Method Article
단백질 - 단백질 상호 작용을 확인
요약
초파리는하지만 깊이있는 생화학 적 분석의 적합성에 대한, 강력한 유전자 조작으로 유명합니다. 여기에서 우리는 파리의 뇌에서 관심의 단백질의 상호 작용 파트너를 식별 할 수있는 TAP 기반의 절차를 제시한다. 이 절차는 잠재적으로 연구의 새로운 길을 초래할 수 있습니다.
초록
초파리 melanogaster의 (초파리)를 사용하여 실시 유전 화면은 생명 과학의 발전에 많은 이정표 발견을 만들었습니다. 그러나, 유전자 분석에서 얻은 지식을 연장 겨냥 생화학 스크린의 사용은 단지 최근 탐구 하였다. 여기에서 우리는 단백질 복합체를 정화 할 수있는 방법을 설명하는 성인 플라이 헤드 관심의 단백질과 동료. 이 방법은 생체 내에서 비행 신경에있는 탠덤 선호도 정화 (TAP) 태그와 융합 미끼 단백질을 발현하는 초파리 GAL4/UAS 시스템을 활용하고 원래 년에 설립 된 것과 유사한 TAP 절차를 사용하여 정화의 두 라운드를 구현 상호 작용하는 단백질 복합체를 정제하는 효모 1. 이 절차의 끝에서, 다중 단백질 복합체의 혼합물을 그 분자 신원 질량 분석법에 의해 결정될 수있다 얻어진다. 후보 단백질의 유효성 검사는 R 도움이됩니다esource과 파리에서 손실의 기능 연구를 수행의 용이성. 유사한 접근법이 다른 플라이 조직에 적용될 수있다. 우리는 비행 모델 시스템에서 유전자 조작이 단백질 체학 접근 방식의 조합은 신경 생물학 분야와 넘어 근본적인 문제를 다루기위한 엄청난 잠재력을 보유하고 있다고 생각합니다.
서문
특정 생물 학적 과정을 중재하는 분자 경로 또는 네트워크를 정의하는 것은 생물 의학 연구의 궁극적 인 목표 중 하나입니다. 비행 유전 학자, 특히 병렬로 함께 작동, 또는 상류 또는 그 유전자의 하류 요인을 식별하는 유전자 화면 (증강 및 회로 화면을 모두) 수정, 앞으로 유전학에 크게 의존했다. 그러나, 앞으로 유전학 화면은 종종 변이 된 경우, 그 손실 함수의 유일한 득점하기 어려운 미묘한 결함의 원인이 기능 중복 및 보상 초기 발달 단계에서 치사, 또는 유전자를 일으키는 원인이되는, 필수 유전자를 확인하기 위해 실패합니다. 이러한 어려움을 극복하는 방법 중 하나는 직접 단백질 - 단백질 상호 작용에 대한 화면이다. 이상 10 년 동안 등 효모 두 하이브리드, 파지 디스플레이, 화학 가교, 공동 IP, 탠덤 선호도 정화 (TAP), 등의 생화학 적 방법의 성장 목록. 단백질을 조사하기 위해 사용되어왔다- 단백질 상호 작용. 각각의 방법은 장점과 민감도와 특이도에 관해서 약점 자체 집합이 있습니다. 그 중에서도, TAP 방식은, 거의 생리적 조건 하에서 물리적 상호 작용의 검출을 허용 특이성 및 일관성이 유지되고 3,4 분석 높은 처리량을 확장 할 수있는 능력을 포함한다.
TAP 방법은 원래 Rigautand 동료 (1)에 의해 효모에 개발되었다. 이 방법에서는, 그 단백질은 TAP 태그로 표현된다. 단백질의 IgG에 결합 도메인과 칼 모듈 린 결합 도메인 : TAP 태그는 두 개의 독립적 인 친 화성 결합 도메인을 항구. 두 도메인은 TEV (담배 식각 바이러스) 절단 부위로 구분됩니다. 선호도 않는 정화의 두 개의 독립적 인 라운드가 충분히 특이 현상이 바인딩을 줄이고 특정 바인딩 1을 풍성하게하는 그런 조합 할 수 있습니다. 이것은 예를 들어, TAP 방식은 매우 강력하다 메 톡시외래 단백질을 과발현하는 것은 일반적으로 그 내생 대응 복잡한하지 않는 단백질과 연결하기가 더 많은 경향이 만들 수 있지만, 특정 단백질의 생체 내 상호 작용을 식별하기 위해 개발. 개발 이후, TAP 방법은 세포 배양 기반 시스템 5,6 및 기타 생체 내 모델 시스템 6-9 포함하여 많은 다른 시스템에 적용되었습니다. 여기에서 우리는 초파리의 TAP 방법의 적응을 설명합니다. 우리는 먼저 그 유전자의 N-또는 C-말단 하나에 TAP 태그의 복제 및 융합을 촉진하기 위해 pUAST-NTAP 및 pUAST-CTAP 벡터를 생성합니다. UAS-TAP-태그 된 트랜스이어서 신경 GAL4 드라이버 (10)의 제어하에 신경계에서 발현된다. 다음으로, 성인 플라이 헤드의 다수의 신경 세포의 높은 함량을 가지고 사이즈 차이에 기초하여 고정한 후 다른 신체 부위로부터 분리하기 쉽고, 이는 모아질 것이다. 성인 머리 균질화 지울 B입니다Y 연속 centrifugations, 상층 액은 아래에 설명 TAP 절차의 적용을받습니다.
프로토콜
1. UAS-TAP-태그 형질 전환 파리를 생성
- pUAST-TAP-태그 DNA 구조를 생성합니다.
- (N-또는 C-말단) 미끼 단백질의 TAP 태그는 단백질의 구조 / 기능을 기반으로 융합되어야하는 가로 결정한다. 자세한 내용은 설명을 참조하십시오.
- 각각 N-또는 C-말단 태그가 UAS-TAP의 도입 유전자를 생성하는 pUAST-NTAP 또는 pUAST-CTAP 벡터의 여러 복제 사이트 (MCS)로 관심의 유전자의 cDNA를 코딩 영역을 서브 클론. 상세한지도와 가능한 제한 사이트 및 독서 프레임의 그림 1을 참조하십시오.
- UAS-TAP-태그 형질 전환 초파리를 생성합니다.
- P 요소 매개 삽입 (11)를 이용하여 표준 프로토콜을 다음과 형질 전환 초파리를 생성합니다. 사출 서비스의 개수는 시판되고있다.
- 각각의 형질 전환 라인에 신경 GAL4 드라이버 (즉 BG380-GAL4)를 건너 단백질 발현 수준을 결정서부 (퍼 옥시 다제 안티 퍼 옥시 다제 항체) 얼룩 및 / 또는 (안티 - TAP 항체) 면역 염색하여 각 라인의. 일반적으로, 내인성 단백질에 가까운 단백질 발현 수준이 유전자 변형 라인은 TAP 절차에 권장됩니다. 자세한 내용은 설명을 참조하십시오.
- 그 유전자의 기능 상실 돌연변이 체를 사용할 수있는 경우 TAP-태그 도입 유전자의 기능을 확인하는 구조 실험을 PerformGAL4/UAS-based. 실질적으로 다음 TAP 실험의 돌연변이 표현형을 구출 할 수있는 유전자를 선택합니다.
2. TAP 절차에 대한 샘플을 준비
- 신경 GAL4 드라이버 (예 : BG380-인 Gal4) 및 비행 샘플의 확장을 용이하게하기 위해 선택 TAP-태그 유전자를 모두 전달하는 비행 주식을 생성합니다. GAL4 드라이버와 위의 조합이 생존과 성장 단점이 발생 드문 경우 UAS - 유전자 십자가의 F1의 자손을 수집합니다.
- 작은 규모의 샘플을 수집하고 TAP - 태그 단백질을 가용화 용해 상태를 최적화 할 수 있습니다.
- 비이 온성 세제 NP-40 (0.1-1 %), NaDOC (0.1-1 %) 및 트리톤 X-100 (0.05-0.5 %)의 조합을 사용하여 용균 버퍼들의 시리즈를 만든다. 자세한 내용은 표 1과 설명을 참조하십시오.
- CO2 패드의 위에, 파리를 표현하는 TAP의 유전자에서 20 성인 머리를 해부하고 각 용해 버퍼 상태를 테스트하기 위해 1.5 ML 튜브에서 그들을 수집 # 5 집게를 사용합니다.
- 튜브에 100 ㎕ 시험 용해 버퍼를 추가하고 또 다른 100 ㎕ 테스트 버퍼를 추가 한 다음, 최대 쓰다듬어에 의해 플라스틱 유 봉 아래로 머리를 균질화.
- 10 분 (4 ℃)를 위해 21,500 XG에서 헤드 해물 스핀, 원심 분리 후 상등액과 펠렛을 분리합니다. 각각 상층 액의 30 UL에 펠릿 10 UL 배 SDS 로딩 버퍼에 25 UL 2X SDS 로딩 버퍼를 추가합니다.
- 5 분 동안 두 개의 샘플을 삶아 나란히 그들에게 분석측 PAP 항체 SDS-PAGE 이후 서양의 얼룩을 사용하여. 펠릿 VS 상청액 TAP-단백질 수준의 비율에 의해 용해도를 결정한다.
- 큰 규모의 샘플을 준비
- 확장 및 성인 파리를 수집합니다.
- 병 neuronal-GAL4/UAS-TAP-transgene 주식을 확장하고 누적 250 병까지 3 일마다이 컬렉션에 사용되는 병을 플립.
- 수집 1~3일 오래된 성인 50 ML 원뿔 튜브에 파리, 즉시 냉동이 파리에 액체 질소에 튜브를 넣어. -80 ° C 냉동고에 파리를 저장합니다. 파리의 부피가 50 ㎖ 튜브의 2 / 3를 초과하지 않아야합니다.
- (분말 드라이 아이스의 상단에이 단계를 수행) 플라이 헤드를 수집합니다.
- prechilled 체 및 -80 ° C 냉동고에서 박격포와 유봉을 가지고 이상적으로 큰 얼음 양동이 안에, 드라이 아이스에 넣어. 일에 제 25 호 두 개의 미국 표준 시험 체 스택전자의 상단과 하단에있는 제 40 호.
- 얼어 붙은 파리를 꺼내 액체 질소에서 그들을 드롭하고 약 10 분 동안 거기에 파리를 유지합니다. 소용돌이 또는 몸에서 머리, 다리, 날개를 깨고 적극적으로 튜브를 흔들.
- 맨 체에 혼합물을 부어 함께 두 체를 누른 상태에서 적극적으로 자체를 흔들. 체질 후, 몸은, 상단 체에 머물 머리를 바닥 체에 유지됩니다 비행, 다리, 날개, 및 다른 파편은 드라이 아이스로 떨어질 것입니다. 두 체를 분리하고 조심스럽게 차가운 박격포에 비행 머리를 전송할 수 있습니다.
- 플라이 헤드를 균질화
- 드라이 아이스 위에, 얼음에 prechilled 된 15 ㎖의 유리 다운스 조직 분쇄기로 가루를 전송 한 후, 분말 입자에 박격포와 유 봉 머리를 갈기.
- 헤드 시료 그것을 붓고 전후 분쇄기의 무게를 측정 한 후 얼마 헤드 SAMP보기 계산할르 무게. 플라이 헤드 6-15그램의 총 단백질의 발현 수준에 따라 조정 TAP 각 실험에 대해 충분할 것이다. 유봉 아래로 이동하는 것이 쉬운 때까지 가루에 얼음처럼 차가운 균질화 버퍼 15 ㎖ (단계 2.2에 최적화 된 용해 버퍼)를 추가 한 다음 큰 간극 유 봉 치기. 항상 얼음에 유리 분쇄기를 유지합니다.
- TAP의 상층 액을 준비
- ~ 50,000 XG (4 ℃)에서 20 분 동안 고속 원심 분리기 튜브와 스핀에 균질를 전송합니다. 새로운 고속 원심 분리 관에 뜨는을 전송하고 원심 분리를 한 번 더 반복합니다.
- 초원 심 분리기 튜브에 뜨는을 전송하고 더 뜨는을 취소 40 분 ~ 25 XG에 스핀을 수행합니다. 상등액을 원심 분리 후 탠덤 친화 정제 과정에 대한 준비가되어 있습니다.
- 확장 및 성인 파리를 수집합니다.
3. TAP 정화
다음 섹션은 Séraphin 실험실 TAP에서 파생 된 protocol 12 (http://web.as.uky.edu/Biology/faculty/rymond/BIO%20510/Bertran%20Seraphin%27s%20TAP%20page.pdf )
- IgG의 구슬 친화력 정화를 수행
- 샘플을 원심 분리하는 동안의 IgG 세 파로스 비드를 준비합니다. 10 ㎖ 차가운 IgG를 세척 버퍼 15 ML 팔콘 튜브에 400 ㎕의 IgG의 구슬 배를 씻으십시오. 각 세척을 위해, 2 분 동안 부드럽게 튜브를 흔들어 다음 다른 2 분 동안 1,000 XG에서 비즈를 스핀 다운. 제 워쉬의 끝에서, 버퍼를 제거하고 튜브 만 비즈를 남긴다.
- 조심스럽게 IgG의 구슬을 포함하는 15 ML 튜브에 삭제 상층 액 (~ 15 ㎖)에 전송합니다. 2 시간 동안 nutator에 4 º C에서 구슬과 뇌 해물 믹스를 품어.
- 냉장실에 약 15 ml의 총 부피와 깨끗하고 빈 마이크로 열을 설정합니다. 꾸준히 열에 믹스를 부어 IgG의 비드 혼합물을로드, 트랩을하지 않도록 노력공기는 열을 내부에 거품. 구슬이 천천히 중력 흐름에 의해 배출 열 버퍼에 정착 할 수 있습니다.
- 뇌 해물 모두가 해결의 IgG 칼럼을 통해 유입 된 후 차가운 IgG의 세척 완충액 10 ㎖로 철저하게 열을 씻으십시오. 세척의 배를 반복합니다. 참고 : 공기 비드를 건조하게하지 마십시오.
- TEV 절단을 수행
- 세 번째 세척 후, 10 ㎖ TEV 절단 버퍼를 사용하여 열을 다시 씻는다. 이 단계는 TEV 절단 용 미끼 복잡한 sequestrates IgG의 구슬을 준비합니다.
- TEV 버퍼의 마지막 한 방울은 밖으로 물방울의 흐름을 차단하는 열의 하단에 모자를 쓰고, 열 TEV 효소의 130 단위를 함유하는 1.3 ml의 TEV 버퍼를 추가 한 다음 안전하게의 상단 캡에 대한되기 직전에 열. 열이 양쪽에 잘 밀봉되어 있는지 확인합니다.
- TEV 효소가 TEV 사이트에서 펩티드를 절단 및 단백질 복잡한 WHI을 해제 할 수 있도록 2 시간 동안 18 º C의 열을 회전르 단백질 뒤에 IgG의 세파 로스 구슬에 결합 도메인 펩타이드를 떠나.
- 칼 모듈 린 구슬 친화력 정화를 수행
- IgG의 구슬이 TEV 효소 배양하는 동안 칼 모듈 린의 구슬을 준비합니다. 버퍼를 바인딩 차가운 칼 모듈 린의 10 ㎖로, 15 ㎖의 팔콘 튜브의 3 배의 각 시간을 200 ㎕의 칼 모듈 린의 구슬을 씻으십시오. 각 세척을 위해, 부드럽게 nutator에 2 분 동안 튜브를 흔들어 다음 2 분 동안 1,000 XG에서 비즈를 스핀 다운. 세 번째 세척의 끝에서, 모든 버퍼를 꺼내 튜브 만 구슬을 떠난다.
- TEV 배양 (단계 3.2.3)의 끝에서 다시 차가운 방에 IgG의 열을 반환하고 똑바로 설정합니다. 구슬이 10 분 동안 정착하자.
- 상단 캡 다음 하단 캡을 제거하고 15 ML 팔콘 튜브에 1.3 ㎖의 TEV 절단 제품을 수집합니다. 버퍼가 완전히 비워집니다. 열 죽은 볼륨을 밀어 열을 추가로 200 ㎕의 TEV 버퍼를 추가, F를 수집같은 튜브 낮은 아웃.
- 상기 수집 된 1.5 ㎖의 TEV 절단 제품에 버퍼와 4.5 ㎕의 1 M 염화칼슘을 결합 칼 모듈 린의 4.5 ML을 추가합니다. 염화칼슘은 TEV 버퍼에 EDTA를 적정하는 역할을한다. 칼 모듈 린의 구슬이 들어있는 튜브에 6 ml의 혼합물을 전송하고 1 시간 동안 nutator에 4 º C에서 튜브를 회전합니다.
- 냉장실에 약 10 ml의 총 부피와 다른 깨끗하고 빈 마이크로 열을 설정합니다. 열에 칼 모듈 린 비드 혼합물을로드하고 중력에 의해 배출 할 수 있습니다.
- 모든 솔루션이 정착 칼 모듈 린의 칼럼을 통해 유입 된 경우, 버퍼를 바인딩 차가운 칼 모듈 린의 10 ㎖로 열 두 번, 각각의 세척. 참고 : 칼 모듈 린의 구슬을 방해 방지하고 세척하는 동안 가능한 한 평면 구슬의 표면을 유지하려고합니다.
- 칼 모듈 린 열에서 미끼 복잡한을 용출.
마우스 오른쪽 단추로 세척 한 후, 200 ㎕의 차가운 Calmodu 다섯 분수와 칼 모듈 린 열을 용출린 용출 버퍼. 각 부분의 경우, 부드럽게 열 용출 버퍼 200 μl를 추가하고 표시 1.5 ㎖의 에펜 도르프 튜브 용출액을 수집합니다. 이 배를 반복합니다. - SDS-PAGE에 의해 단백질 복합체를 분석
- 다섯 분수 (약 30 μL)의 각각에서 작은 나누어지는을 가지고 SDS 로딩 버퍼를 추가합니다. 5 분 동안 샘플을 삶아 구배 (4 % -15 %) SDS-PAGE 젤에있는 단백질 분자 마커와 시료를 나란히로드합니다.
- 샘플이 완전히 겔에서 해결 한 후 전기 영동을 중단하고 13 얼룩 '파란은'같은 G-250 기반의 민감한 콜로이드 쿠마시 염색 절차 젤을 얼룩. 그것은 이후의 질량 분석 분석과 완벽하게 호환되지 않기 때문에 염색은 바람직 선택 사항이지만이 아닙니다. 이러한 정제 된 단백질 복합체의 분자 신원을 폭로하기위한 질량 분석 등의 추가 분석을 위해 -80 ° C의 냉동고에 용출액의 나머지 부분을 저장합니다. SE전자 토론.
결과
여기에서 우리는 즉시 뇌에 Highwire 상호 작용하는 단백질을 식별하는 우리의 노력을 보여줍니다. Highwire (HIW)과 척추 동물과 무척추 동물 상동 신경계 (14)의 개발 및 수리를 조절 거대한 유비퀴틴 리가 제입니다. 그들은 고도의 보존 기능 영역의 번호를 공유 할 수 있습니다. 그러나, 그들의 분자의 행동은 완전히 명확하지 않습니다. 웜에 수행 한 작업은, 비행 및 마우스가 현재 작업 모델에 LED가 E3 리가 같은과를 통해 시간과 세포 유형 특정 신경 세포의 기능을 조절하는 멀티 서브 유닛 유비퀴틴 복합체의 형성을 촉진하기 위하여 비계 단백질로 HIW 기능 다른 보조 인자와의 상호 작용 및 다른 유비퀴틴 기판을 대상으로 조합. HIW 관련 유비퀴틴의 복잡한을 확인하려면, 우리는 먼저 HIW 돌연변이 표현형 (15)를 구조에 완벽하게 작동 N-말단 태그 UAS-TAP-HIW의 유전자를 생성합니다. 성인 플로리다의 약 10g만 TAP 또는 TAP-HIW 유전자 변형 단백질을 표현 Y 헤드를 수집하고 상술 한 바와 같이 옆에 TAP 절차 측을 실시 하였다. 두 않는 정화로부터 최종 용출액을 SDS-PAGE 다음 실버 염색으로 분석 하였다. 질량 분석은 초파리 FSN (DFSN, F-박스 단백질)과 Rae1 (그림 2)를 포함하여, 만 TAP-HIW 샘플에서 단백질의 목록을 확인했다. 이후의 유전 적, 생화학 적 분석은 HIW 및 DFSN 시냅스의 구조와 기능 (16)을 조절하는 SCF 같은 E3 유비퀴틴 리가 단지와 함께 작동 밝혀, 생체 내에서 HIW와 Rae1 동료와 시냅스 전면에 자라 난 17을 억제한다. Rae1의이 기능은 적어도 부분적으로 선택적으로 시냅스 개발 17시 HIW 단백질 풍부을 제어하는 새로운 메커니즘을 밝혀 autophagic 저하에서 HIW 보호를 통해 HIW 단백질의 안정성을 홍보 할 수있는 능력에 의해 달성된다.
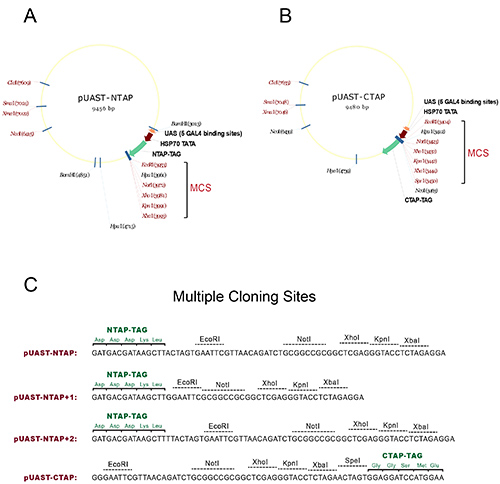
그림 1. TAP 태그가 형질 전환 초파리를 생성하는 벡터. (A) pUAST-NTAP의지도가 구성합니다. (B) pUAST-CTAP의지도가 구성합니다. 두 구조의 여러 복제 사이트 (MCS)는 단일 잘라 제한 사이트는 빨간색으로 표시됩니다 브래킷으로 표시됩니다. (C) TAP 태그의 판독 프레임 TAP 벡터의 다중 클로닝 사이트의 기본 시퀀스를 도시. pUAST-NTAP +1 및 pUAST-NTAP +2 : 서브 클로닝을 용이하게하기 위해 두 개 더 NTAP 구조는 원래 pUAST-NTAP에서 생성됩니다. 함께 세 NTAP는 MCS의 사용을 수용 할 수있는 모든 가능한 세 리딩 프레임을 포함 구성한다. 모든 벡터는 원래 생성 NTAP 또는 CTAP 단편을 사용하여 구성된다Seraphin 연구소 1. 큰 이미지를 보려면 여기를 클릭하십시오.

. TAP 정화에 의해 비행 뇌에서 Highwire 상호 작용하는 단백질의 그림 2 정화 TAP 표현 파리에서 성인 머리. 신경계 (BG380-GAL4,, UAS-TAP) 또는 TAP-HIW (UAS-TAP-HIW BG380-GAL4를) 각각 수집, 균질화 및 TAP 정화를 실시하고 있습니다. 최종 용출액은 실버 염색 한 뒤에 차원 SDS-PAGE 젤에서 분석 하였다. 화살표 머리는 미끼 단백질 HIW를 나타내고 별표는 분열을 TEV에 의한 절단 TAP 단백질을 나타냅니다. TAP-HIW 샘플에서 단백질의 목록은 질량에 의해 식별된다HSC-70, β-튜 블린, Rae1 및 DFSN (화살표로 표시)를 포함하여 분석. 이 수치는 티안 등. 17의 그림 1a에서 수정 된 큰 이미지를 보려면 여기를 클릭하십시오.
| 완충기 | 구성 | 댓글 |
| 용해 완충액 | 50 mM 트리스 - 염산 pH를 7.5 | 주 : 1) DTT와 단백질 분해 효소와 프로 테아 좀 억제제 사용 직전에 추가. |
| 125 mM의 NaCl을 | 2) 여기에서 표시 중 0.5 % NP40 함께 용해 버퍼이다. 비이 온성 세제에 대한 수정에 대한 설명을 참조하십시오. | |
| 5 % 글리세롤 | ||
| 0.5 % NP40 | ||
| 1.5 mM의 MgCl2를 | ||
| 25 mM의 불화 나트륨 | ||
| 0.2 mM의 DTT | ||
| (다음은 단백질 분해 효소와 프로 테아 좀 억제제) | ||
| 1 ㎜ 나 3 VO 4 | ||
| 0.05 ㎜ MG-115 | ||
| 1 ㎜ PMSF | ||
| 프로테아제 억제제 믹스 (시그마 P8340) | ||
| 프로테아제 억제제 칵테일 (로슈 04693159001) | ||
| IgG의 세척 버퍼 | 10 mM 트리스로-C1 pH가 8.0 (0.5 ㎖ M 주식 2) | |
| 150 mM의 염화나트륨 (5 M 주식의 3 ㎖) | ||
| 0.1 % NP40 (10 % 주식의 1.0 ML) | ||
| H 2 0 ~ 100 ㎖의 최종 | ||
| TEV 절단 버퍼 | 10 mM 트리스로-C1 pH가 8.0 (0.5 ㎖ M 주식 2) | 참고 : 사용 직전에 DTT를 추가합니다. |
| 150 mM의 염화나트륨 (5 M 주식의 3 ㎖) | ||
| 0.1 % NP40 (10 % 주식의 1.0 ML) | ||
| 0.5 mM의 EDTA (0.5 M 주식의 100 μL) | ||
| 1 mM의 DTT (1 M 주식의 100 μL) | ||
| H 2 O 100 ㎖의 최종 | ||
| 칼 모듈 린 결합 버퍼 | 10 MM의 β-머 캅토 에탄올 (주식의 69.7 μL) | |
| 10 mM 트리스로-C1 pH가 8.0 (0.5 ㎖ M 주식 2) | ||
| 150 mM의 염화나트륨 (5 M 주식의 3 ㎖) | ||
| 1 밀리미터 밀리그램 - 아세테이트 (1 M 주식의 100 μL) | ||
| 1 mM의 이미 다졸 (1 M 주식의 100 μL) | ||
| 2 mM의 염화칼슘 (1 M 주식의 200 μL) | ||
| 0.1 % NP40 (10 % 주식의 1 ㎖) | ||
| H 2 O 100 ㎖의 최종 | ||
| 칼 모듈 린 용출 버퍼 | 10 MM의 β-머 캅토 에탄올 (주식의 69.7 μL) | |
| 10 mM 트리스로-C1 pH가 8.0 (0.5 ㎖ M 주식 2) | ||
| 150 mM의 염화나트륨 (5 M 주식의 3 ㎖) | ||
| 1 밀리미터 밀리그램 - 아세테이트 (1 M 주식의 100 μL) | ||
| 1 mM의 이미 다졸 (1 M 주식의 100 μL) | ||
| 10 mM의 EGTA (0.5 M 주식의 2 ㎖) | ||
| 0.1 % NP40 (10 % 주식의 1 ㎖) | ||
| H 2 O 100 ㎖의 최종 |
표 1. 버퍼의 조성입니다.
토론
탠덤 선호도 정화 (TAP) 메서드는 두 개의 독립적 인 친 화성 정제 단계를 통해 분리 및 단백질 단지의 농축을 할 수있는 듀얼 정화 프로토콜을 제공합니다. TAP 태그의 디자인이 프로토콜에 제시되어 무엇에 한정되지 않고 버퍼 조건을 적절하게 조정하는 경우, 다른 단백질 결합 도메인 및 모티프도 적용 할 수 있습니다. 다른 TAP 태그의 좋은 예는 GS-TAP 태그, G 단백질의 조합 배양 포유 동물 세포 라인 (18)의 정화 단백질 복합체 목표 줄리오 Superti-Furga의 그룹에 의해 디자인 된 스트렙 타비 딘 결합 모티브입니다. GS-TAP는 나중에 초파리 S2 세포와 배아 19 단백질 - 단백질 상호 작용을 연구하기 위해 적응했다. 베일리 등.의 최근 조브 간행물 GS-TAP 절차를 세포 배양 용 해물 (20)와 수행 방식을 보여 주었다. 여기에서 우리는 (초파리 신경 조직에서 TAP 태그의 사용을 제시 광고대규모 프로테오믹스 검사에 대한 ULT 헤드). 이 프로토콜은 잠재적으로 배아 같은 대규모 샘플 수집을 허용 다른 조직에 적용 할 수있다. 맨 체 (단계 2.3.2.3)에 수집 된 성인의 몸은 매우 어려운 작업이 될 수있는, TAP에 사용될 수있다. 용해 버퍼를 수정하고 많아야 소화관에 존재하고 제 정제 과정이 크게 프로테아제에 단백질의 노출 시간을 감소시키기 위해 줄어드는 대규모 프로테아제를 억제하도록 조정되어야한다. 다른 TAP 태그는 다른 handlings 및 선호도 않는 정화를위한 버퍼 조건을 필요로하지만, TAP에 대한 일반적인 원칙은 동일합니다. 우리는 TAP 결과의 품질에 영향을 미칠 것이다 문제를 논의 이하.
TAP 방식의 성공은 바로 유전자를 생성에 따라 달라집니다. 첫째, TAP 태그 자체는 그것의 기능을 유지하는 것이 중요합니다 미끼 단백질의 전체 형태를 변경하지 않아야합니다생리 학적 결합 파트너와 상호 작용할 수 있습니다. 따라서, 여기서 관심의 유전자에 TAP 태그를 융합하는 방법을 결정하는 데있어 매우 중요합니다. 결정은 단백질의 이전 연구 결과, 그 구조 나 기능 epitode-태그 된 형질 전환 유전자에 대해 특히 정보에 기초하여 이루어질 수있다. 경우 이러한 정보가 병렬 N-또는 C-말단에 미끼 단백질에 태그를 사용할 수없는 권장합니다. 그런 기능성 구조 실험은 사용되어야하는 유전자를 결정하기 위해 수행 될 수있다. 둘째, 유전자 변형 단백질의 발현 수준이 내인성 단백질에 가까운이어야한다. Gal4/UAS 시스템이 정상적으로 가양 증가하거나 발생할 수도 있고 내인성 단백질에 비해 서로 다른 타이밍으로 그리고 훨씬 더 높은 수준의 형질 전환 유전자의 발현을 구동으로서 특히 중요 단백질 상호 작용의 프로파일을 변경할 의외 결과 세포의 네트워크. 예를 들면, 과발현 비계 단백질 caus 수도전자 지배적 인 부정적인 영향과 같은 키나아제 등의 효소 활성을 가지고 과발현 단백질은 종종 차례로 그들과 상호 작용하는 그들의 내생 바인딩 파트너의 능력에 영향을 미칠 수 있습니다 둘 다 이득의 기능 효과를 일으킬 수 있습니다. 따라서, GAL4/UAS 시스템은 또한 유전자의 발현 레벨 및 타이밍은 정상 조건에서 제시 내인성 상호 작용의 보존에 중요 할 때 피해야한다. 대신, TAP-태그 유전자의 발현은 자신의 발기인에 따라 조절되어야한다. 이는, 내인성 프로모터 서열과 UAS 시퀀스를 대체함으로써 또는 그 (21)의 유전자의 전체 궤적을 포함하는 게놈 DNA 단편의 exonal 시퀀스와 프레임 TAP 서열을 융합시킴으로써도 달성 될 수있다. 어떤 경우에는 TAP 실험 INC 대한 내인성 단백질로부터의 경쟁을 감소시키는 그 유전자의 기능 돌연변이 배경의 손실로 수행 될 수있다multiprotein의 단지로 orporating. 이 예를 들어, 단백질 널 (null) 배경은, 사용 가능한 경우, 완전히 내인성 단백질을 제거 할 수있는 이상적인 조건을 제공합니다. 유전자 돌연변이 배경을 사용하여 항상 높은 품질의 결과를 생성하는 기회를 증가시킬 것이다.
미끼 단백질의 용해도는 성공을위한 또 다른 중요한 요소이다. 비이 온성 계면 활성제는 일반적으로 세포막 녹여 생리적 환경에 가까운 상태에 가용성 그대로 단백질 복합체를, 유지하는 용해 버퍼에 사용된다. 그러나 또한 단백질이 막 일체형 또는 - 연관된 단백질인지 아닌지에 따라, 비이 온성 세제의 조성 및 농도는 미끼 단백질을 가용화하는 것이 중요 할 수있다. 0.1 ~ 0.3 % NP40은 세포질 단백질을 용해하는 것이 적합합니다. 막 단백질의 경우, NP40의 조합 (0.1-1 %), NaDOC (0.1-1 %), 트리톤-X 100 (0.05 ~ 0.5 %)을 때때로 가용 화제 필요합니다LIZE 및 TAP 실험을위한 충분한 단백질을 풍부. 엄격한 용해 완충액 약한 단백질 - 단백질 상호 작용을 방해하는 경향이 있기 때문에 그러나, 균형은 동시에 단백질 - 단백질 상호 작용의 대부분이 유지되는 동안 충분히 용해 미끼 단백질 시료에 존재하는 도달 할 필요가있다. 일반적인 원칙은 항상 가장 낮은 농도 세제의 적은 타입을 사용하려고한다는 것입니다.
문제 해결을 용이하게하기 위해, 그것은 매우 두 가지 않는 정화의 각 단계에서 샘플의 작은 나누어지는을 저장하는 것이 좋습니다. 분액에이어서 SDS-PAGE와 단백질 염색 / 웨스턴 분석은 미끼 단백질의 농도 및 특정 단백질 종의 순차 농축 모니터링 할 수있다. 미끼 단백질의 급격한 감소가 TEV 절단 후의 유동 아웃 (단계 3.3.3)의 분취 액에서 검출 된 경우, 예를 들어, 그것은 미끼 단백질의 IgG 비드 세척한다 (단계 3.1.4) 동안 손실 된 것으로 보인다 . 포스호 환 원인은 IgG의 세척 버퍼의 부적절한 세정제 조성물 수 있습니다. IgG의 세척 버퍼에 세제의 조성과 농도에 급락 (0.1 % NP-40 만) 용해 완충액에 비교가있다. 미끼 단백질은 이러한 변화에 민감하고 구슬의 IgG 부분에서 끊을 수 있습니다. 용해 버퍼를 향해 IgG의 세척을 조정하면 문제를 해결하는 데 도움이 될 수 있습니다. 덜하지만 다른 방법으로, TEV 절단 (단계 3.2)의 IgG 구슬에서 미끼 함유 복합을 해제 충분히 작동하지 않았을 수 있습니다. 두 번째 검사의 가치 단계는 TEV 버퍼 (단계 3.2.1)와 효소 활성과 IgG의 비즈의 평형이며, 취급 부주의는 효소를 약하게 할 수 있습니다.
심지어 두 단계의 정화와 함께, 여전히 최종 TAP-정제 단지에 비특이적으로 존재 내려 오게하는 오탐 (false positive)과 단백질이된다는 점을 명심하십시오. 에서 이러한 비특이적 상호 작용을 식별하는 한가지 방법적어도 부분적으로, TAP 정화 실험에서 TAP - 태그 - 유전자와 병렬로 TAP 전용 유전자를 사용하여 컨트롤의 TAP을 포함하는 것입니다. TAP 전용 절차에서 확인 된 단백질은 TAP-유전자 정화에서 확인 된 목록에서 제거해야합니다.
성공적인 TAP는 잠재적으로 생체 내에서 관심의 단백질과 연관된 단백질의 혼합물을 정화합니다. 다음 단계는이 단백질의 분자 식별하고, 질량 분석은 일반적으로이 목적을 위해 사용된다. SDS-PAGE의 결과와 실험의 필요에 따라, 정제 된 단백질 복합체의 분자 신원은 다음의 두 가지 방법으로 결정될 수있다 : 1) 각각의 단백질 밴드는 겔로부터 잘라내어 저가로 실시 할 수있다 복잡성 LC-MS/MS, 또는 2) 피크 단백질 함량 (일반적으로 제 용출)를 포함 용출 분획은 직접 적당한 복잡도 LC-MS/MS를 실시 할 수있다. 이러한 총 총 Proteomic 접근법은 잠재적으로 MS 장비 (22)의 동적 범위에 따라, 복잡한 모든 단백질을 식별하는 것이다.
초파리 - 요약하면, 우리는 유전 모델 생물의 신경 조직에서 단백질 - 단백질 상호 작용을 확인하는 방법을 제시한다. 파리에 TAP 방법을 적용하는 장점이 있습니다 : 1) 초파리는 짧은 라이프 사이클이있다, 그래서 상대적으로 신속하고 형질 전환 초파리를 생성하고 많은 양의 조직을 쉽게 획득 할은, 모두 TAP에 매우 중요한 방법 2) 비행 게놈이 완전히 주석과 인간의 질병을 일으키는 유전자의 70 %가 포함되어 있으며, 3) 가장 중요한 것은 기능의 유효성을 검사하고 파리에서 단백질 상호 작용하는 후보를 특성화하기 쉽습니다. 이러한 연구에 유용한 유전자 기반의 RNAi의 컬렉션으로 특정 유전자의 특성에 대한 비행 연구 커뮤니티에서 사용할 수있는 포괄적 인 리소스가 조직 특정 기능 상실 유전자의 대부분의의 유전자 좌위의 가장뿐만 아니라의 cDNA 클론 및 이득의 기능 연구를위한 유용한 형질 전환 유전자에 대한 돌연변이 및 부족 대립. 우리는 비행 TAP 방법은 비행 실험실에서 사용되는 도구 상자에 귀중한 보탬이 될 것이라고 믿는다. 미래의 관점에서,이 방법은 특정 조건으로 자극에 응답하여 단백질 - 단백질 상호 작용 네트워크의 변화를 가리기 위하여 플라이 행동 패러다임과 인간 질병 모델과 조합 될 수있다.
공개
저자가 공개하는 게 없다.
감사의 말
우리는 우리에게 효모 TAP 발현 플라스미드를 보내는 EUROSARF 감사합니다. 우리는 또한 라이언 Labadens에서 편집의 도움에 감사합니다. 이 작품은 CW에 NIH / NINDS 부여 (R01NS070962)에 의해 지원되었다
자료
| Name | Company | Catalog Number | Comments |
| U.S.A. standard test sieve No. 25 | Fisher Scientific | 04-881-18 | |
| U.S.A. standard test sieve No. 40 | Fisher Scientific | 04-881-21 | |
| Kontes Dounce Tissue Grinders 15 ml | Kimble Chase | 885300-0015 | |
| IgG sepharose beads | Pharmacia | 17-0969-01 | |
| Econo-column 0.7 cm x 20 cm | Bio-Rad | 737-4721 | |
| Econo-column 0.5 cm x 15 cm | Bio-Rad | 737-4716 | |
| Calmodulin beads | Stratagene | 214303 | |
| Coors Mortar and Pestle | CoorsTek | 60311 | |
| AcTEV Protease | Invitrogen | 12575-015 | |
| Protease Inhibitor Cocktail | Roche | 11836153001 | |
| Protease Inhibitor Mix | Sigma | P8340 |
참고문헌
- Rigaut, G., et al. A generic protein purification method for protein complex characterization and proteome exploration. Nat. Biotechnol. 17, 1030-1032 (1999).
- Collins, S. R., et al. Toward a comprehensive atlas of the physical interactome of Saccharomyces cerevisiae. Mol. Cell. Proteomics. 6, 439-450 (1074).
- Gavin, A. C., et al. Proteome survey reveals modularity of the yeast cell machinery. Nature. 440, 631-636 (2006).
- Krogan, N. J., et al. Global landscape of protein complexes in the yeast Saccharomyces cerevisiae. Nature. 440, 637-643 (2006).
- Forler, D., et al. An efficient protein complex purification method for functional proteomics in higher eukaryotes. Nat. Biotechnol. 21, 89-92 (2003).
- Veraksa, A., Bauer, A., Artavanis-Tsakonas, S. Analyzing protein complexes in Drosophila with tandem affinity purification-mass spectrometry. Dev. Dyn. 232, 827-834 (2005).
- Li, Y. The tandem affinity purification technology: an overview. Biotechnol. Lett. 33, 1487-1499 (2011).
- Volkel, P., Le Faou, P., Angrand, P. O. Interaction proteomics: characterization of protein complexes using tandem affinity purification-mass spectrometry. Biochem. Soc. Trans. 38, 883-887 (2010).
- Xu, X., et al. The tandem affinity purification method: an efficient system for protein complex purification and protein interaction identification. Protein Expr. Purif. 72, 149-156 (2010).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118, 401-415 (1993).
- Bachmann, A., Knust, E. The use of P-element transposons to generate transgenic flies. Methods Mol. Biol. 420, 61-77 (2008).
- Puig, O., et al. The tandem affinity purification (TAP) method: a general procedure of protein complex purification. Methods. 24, 218-229 (2001).
- Candiano, G., et al. Blue silver: a very sensitive colloidal Coomassie G-250 staining for proteome analysis. Electrophoresis. 25, 1327-1333 (2004).
- Tian, X., Wu, C. The role of ubiquitin-mediated pathways in regulating synaptic development, axonal degeneration and regeneration: insights from fly and worm. J. Physiol. , (2013).
- Wu, C., Wairkar, Y. P., Collins, C. A., DiAntonio, A. Highwire function at the Drosophila neuromuscular junction: spatial, structural, and temporal requirements. J. Neurosci. 25, 9557-9566 (2005).
- Wu, C., Daniels, R. W., DiAntonio, A. DFsn collaborates with Highwire to down-regulate the Wallenda/DLK kinase and restrain synaptic terminal growth. Neural Dev. 2, 16(2007).
- Tian, X., Li, J., Valakh, V., DiAntonio, A., Wu, C. Drosophila Rae1 controls the abundance of the ubiquitin ligase Highwire in post-mitotic neurons. Nat. Neurosci. 14, 1267-1275 (2011).
- Burckstummer, T., et al. An efficient tandem affinity purification procedure for interaction proteomics in mammalian cells. Nat. Methods. 3, 1013-1019 (2006).
- Kyriakakis, P., Tipping, M., Abed, L., Veraksa, A. Tandem affinity purification in Drosophila: the advantages of the GS-TAP system. Fly. 2, 229-235 (2008).
- Bailey, D., Urena, L., Thorne, L., Goodfellow, I. Identification of protein interacting partners using tandem affinity purification. J. Vis. Exp. (60), e3643(2012).
- Wu, Y., et al. A Drosophila model for Angelman syndrome. Proc. Natl. Acad. Sci. U.S.A. 105, 12399-12404 (2008).
- Liao, L., McClatchy, D. B., Yates, J. R. Shotgun proteomics in neuroscience. Neuron. 63, 12-26 (2009).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유