Method Article
中のタンパク質 - タンパク質相互作用を特定する
要約
ショウジョウバエは、その強力な遺伝子操作のためではなく、詳細な生化学的解析のその適合性のために有名である。ここでは、ハエの脳から、目的の任意のタンパク質の相互作用パートナーを識別するために、TAPベースの手順を提示する。この手順では、潜在的な研究の新たな道につながることができます。
要約
キイロショウジョウバエ (ショウジョウバエ)を用いて行っ遺伝子スクリーニングは、生物科学の前に数々のマイルストーンの発見をした。しかし、遺伝学的解析から得られた知識を広げることを目的とし、生化学的スクリーンの使用は、ごく最近になって調査した。ここでは、成体ハエ頭部から目的の任意のタンパク質と会合したタンパク質複合体を精製する方法を記載している。この方法は、 インビボでのフライニューロンにおけるタンデムアフィニティー精製(TAP)タグと融合ベイトタンパク質を発現するために、ショウジョウバエ GAL4/UASシステムを活用し、その後、本来において確立ものと類似のTAP手順を用いた精製を2回を実装相互作用するタンパク質複合体を精製する酵母1。この手順の最後に、複数のタンパク質複合体の混合物は、その分子のアイデンティティ質量分析によって決定することができるが得られる。候補タンパク質の検証は、Rの恩恵を受けるesourceやハエにおける機能喪失研究を行うのしやすさ。同様のアプローチは他のハエ組織に適用することができる。我々はフライモデル系における遺伝子操作の組み合わせと、このプロテオミクスアプローチは、神経生物学とそれ以降の分野で根本的な問題に取り組むための途方もない可能性を秘めていると信じています。
概要
特定の生物学的プロセスを仲介する分子経路やネットワークを定義することは、生物医学研究の究極の目標の一つである。フライ遺伝学者は、特にと並行して、一緒に作業したり、上流または関心のある遺伝子の下流因子を同定するために、遺伝子スクリーニング(エンハンサーとサプレッサー画面の両方を)修飾子、フォワード遺伝学に大きく依存してきた。しかし、フォワード遺伝学の画面はしばしば、その損失関数の唯一の得点にくい微妙な異常を引き起こす機能的冗長性と補償で不可欠な変異した場合に、初期の発達段階で致死性の原因となる遺伝子、または遺伝子を同定することができない。この困難を克服する1つの方法は、直接的なタンパク質 - タンパク質相互作用をスクリーニングするためのものである。 10年以上のため、 などの酵母ツーハイブリッド、ファージディスプレイ、化学的架橋、共同IP、タンデムアフィニティー精製(TAP)を含む生化学的方法、の成長のリスト。タンパク質を調査するために使用されている- タンパク質相互作用。これらのアプローチはそれぞれ長所と感度と特異性に関しての弱点の独自のセットを持っています。中でも、TAP法は、近生理学的条件下で物理的相互作用の検出を可能にする特異性および整合性を維持し、2 3,4を解析し、高スループットを拡張する能力を含む。
TAP法は、もともとRigautand同僚1によって、酵母で開発されました。この方法では、対象のタンパク質は、TAPタグで表現される。 TAPタグは、2つの独立した親和性結合ドメインを保有する:タンパク質IgGおよびカルモジュリン結合ドメインに結合するドメイン。 2つのドメインはTEV(タバコエッチウイルス)切断部位によって分離されている。アフィニティ精製の 二つの独立したラウンドが十分に非特異的結合を減少させ、特定のバインディング1を豊かにするためのこのような組み合わせが可能です。この例では、TAP法は非常に強力であるメト外因性タンパク質を過剰発現すると、通常、その内因性の相手との複雑なないタンパク質と結合することをより受けやすいことがありますが、与えられたタンパク質の生体内相互作用に識別するためのD。その開発以来、TAP法は、in vivoモデル系6-9 の細胞培養ベースのシステム5,6およびその他を含む多くの他のシステムに適用されている。ここでは、 ショウジョウバエのTAP法の適応を説明します。まず、目的の遺伝子のN末端またはC末端のいずれかに、TAPタグのクローニングとの融合を容易にするためのpUAST-NTAPとのpUAST-CTAPベクトルを生成する。 UAS-TAP-タグ化導入遺伝子は、次いで、ニューロンGAL4ドライバ10の制御下で、神経系で発現される。次に、成体ハエの頭部に多数の神経細胞の高い含有量を有し、サイズの違いに基づいて、凍結後に体の他の部分から分離することが容易である、収集することができる。大人のヘッドは、均質化され、BをクリアYシーケンシャル遠心分離し、上澄み液は、後述のTAPの手順に従うものとします。
プロトコル
1。 UAS-TAPタグトランスジェニックハエを生成
- のpUAST-TAPタグDNA構築物を生成します。
- TAPタグはタンパク質の構造/機能に基づいて、に融合されるべきベイトタンパク質のどちら側(N-またはC-末端)を決める。詳細についての説明を参照してください。
- それぞれ、N-またはC-末端タグ付加UAS-TAPトランスジーンを生成するためのpUAST-又はNTAPのpUAST-CTAPベクターのマルチクローニング部位(MCS)への目的の遺伝子のcDNAコード領域をサブクローニングする。詳細な地図と使用可能な制限部位とリーディングフレームについては、図1を参照してください。
- UAS-TAPタグトランスジェニックハエを生成します。
- Pエレメント媒介挿入11を使用して、標準的なプロトコルに従ってトランスジェニックハエを生成します。注射サービスの数が市販されている。
- それぞれの個々のトランスジェニック系統に神経GAL4ドライバー( すなわち、BG380-GAL4)を渡り、タンパク質の発現レベルを決定する(ペルオキシダーゼ抗ペルオキシダーゼ抗体を用いた)ウエスタンブロットによる各ラインのおよび/または(抗TAP抗体で)免疫染色。一般的には、内因性タンパク質に近いタンパク質発現レベルを有するトランスジェニックラインは、TAPの手続きをお勧めします。詳細についての説明を参照してください。
- 目的の遺伝子の機能喪失変異体が利用可能な場合は、TAPタグ化導入遺伝子の機能性を確認するためのレスキュー実験をPerformGAL4/UAS-based。ほぼ次のTAP実験に変異体の表現型を救出することができ、導入遺伝子を選択してください。
2。 TAP手順のためのサンプルを調製
- フライサンプルの拡大を容易にするために、神経Gal4ドライバー( 例:BG380-GAL4)と選択したTAPタグ導入遺伝子の両方を運ぶハエの株式を生成します。 GAL4ドライバと上記の組み合わせは生存と成長の欠点の原因となるまれにUAS-導入遺伝子のクロスのF1子孫を収集します。
- 小規模のサンプルを収集して、TAPタグ化タンパク質を可溶化するための溶解条件を最適化します。
- 非イオン性界面活性剤NP-40(0.1%)、NaDOC(0.1%)およびTriton X-100(0.05から0.5パーセント)の組み合わせを用いて溶解緩衝液のシリーズを作る。詳細については、表1および説明を参照してください。
- CO2のパッドの上に、ハエを表現TAPトランスジーンから20大人の頭を解剖し、各溶解バッファー条件をテストするために1.5ミリリットルチューブでそれらを収集するために#5鉗子を使用しています。
- チューブに100μlの試験溶解バッファーを追加し、プラスチック乳棒で上下になでるとで頭を均質化し、他の100のULテストバッファを追加します。
- 10分(4℃)のために21,500×gで頭溶解物を回転し、遠心分離後の上清とペレットを分離する。それぞれの上清の30 ULにペレットを10μlの4X SDSローディングバッファに25 ulの2X SDSローディングバッファーを追加します。
- 5分間の2サンプルを沸騰して並べ、それらを分析側PAP抗体でSDS-PAGEおよびその後のウエスタンブロットを用いて。ペレットVS上清中のTAP-タンパク質レベルの比で溶解度を決定する。
- 大規模なサンプルを作成
- 大人のハエを展開し、収集します。
- ボトルにneuronal-GAL4/UAS-TAP-transgeneの株式を展開し、累積250ボトル収集に使用されるまで、3日ごとにボトルを反転させます。
- 収集1-3日齢の成人が50ミリリットルコニカルチューブに飛んで、すぐにDeep Freezeのハエに液体窒素中にチューブを入れる。 -80℃の冷凍庫にハエを格納します。ハエの量は50ミリリットルチューブの2/3を超えてはならないことに注意してください。
- (粉末ドライアイスの上に、この手順を実行する)フライヘッドを収集します。
- 予冷キュラーシーブおよび-80℃の冷凍庫から、乳鉢と乳棒を取り出して、理想的には大規模な氷のバケツの中に、ドライアイス上に置く。日に第25号2米国標準試験ふるいを積み重ねEの上下に40番。
- 凍結したハエを取り出し、液体窒素にドロップし、約10分間そこにハエを保つ。ボルテックスまたは体から頭、脚、翼を破るために積極的にチューブを横に振る。
- トップふるいに混合を注ぎ、その後、一緒に両方のモレキュラーシーブを押しながら積極的にモレキュラーシーブを振る。篩い分けした後、遺体は、トップふるいに滞在ヘッドが下ふるい上に保持されます飛ぶ、と脚、翼、および他の残骸は、ドライアイスに落ちるでしょう。 2モレキュラーシーブを分離し、慎重に冷たい乳鉢にハエの頭を転送します。
- フライヘッドを均質化する
- ドライアイスの上に、氷の上にあらかじめ冷却した15ミリリットルのガラスダウンス組織グラインダーに粉を転送した後、粉末状の粒子に乳鉢と乳棒で頭を挽く。
- ヘッドサンプルがそれに注いだの前後グラインダーの重量を測定してから、どのくらいのヘッドSAMP計算LEは重さがあります。ハエ頭部6-15グラムの総タンパク質の発現レベルに応じて調整する各TAP実験のために十分であろう。乳棒を上下に行くとすることが容易であるまで、粉末に氷冷した均質化緩衝液の15ミリリットル(ステップ2.2に最適化された溶解バッファー)を追加してから、大きなクリアランス乳棒でストローク。すべての回で、氷上でガラス粉砕機を保管してください。
- TAPのために上清を準備
- 〜5万×gで(4℃)で20分間の高速遠心分離管とスピンにホモジネートを転送する。新しい高速遠心チューブに上清を移し、遠心分離をもう一度繰り返します。
- 超遠心チューブに上清を移し、さらに上清をクリアするには40分〜25万XGスピンを行う。上清を超遠心分離後のタンデムアフィニティー精製法の準備ができています。
- 大人のハエを展開し、収集します。
3。 TAP精製
以下のセクションでは、セラフィンラボタップから導出されたprotocol 12 (http://web.as.uky.edu/Biology/faculty/rymond/BIO%20510/Bertran%20Seraphin%27s%20TAP%20page.pdf )
- ビーズのIgGアフィニティー精製を行う
- サンプルは遠心分離されている間のIgGセファロースビーズを準備します。 10ミリリットル冷たいのIgG洗浄緩衝液15ミリリットルファルコンチューブに400μLのIgGビーズ3回洗浄します。各洗浄のために、2分間穏やかチューブを揺するし、別の2分間千×gでビーズをスピンダウン。 3回目の洗浄の最後に、緩衝液を除去し、チューブ内のビーズのみを残す。
- 注意深くのIgGビーズを含有する15mlチューブに透明な上清(〜15ml)に移す。 2時間旋回装置上で4℃でビーズや脳溶解ミックスをインキュベートする。
- 低温室で約15ミリリットルの総容量で、清潔で、空のミクロカラムを設定します。着実に塔にミックスを注ぐことにより、のIgGビーズ混合物をロードし、あらゆるトラップしないようにしよう空気が列の中に泡。ビーズはゆっくりと重力流によって排出する列バッファに定住することができます。
- 脳溶解物のすべてが決着IgGカラムを流れた後に冷えたIgGの洗浄緩衝液10mlで十分にカラムを洗浄。洗浄2Xを繰り返します。注意:空気中のビーズ乾燥させることはありません。
- TEV切断を行う
- 3回目の洗浄後、10ミリリットルTEV切断緩衝液で再びカラムを洗浄。このステップは、TEV切断用の餌複合体をsequestratesのIgGビーズを準備します。
- TEVバッファの最後の一滴が、出ドリップ流れを遮断する列の一番下にキャップを入れて、列にTEV酵素の130単位を含有する1.3ミリリットルTEVバッファーを追加して、安全に上部のキャップをしようとしている直前にコラム。列は両端でよく密封されていることを確認してください。
- TEV酵素はTEV部位でペプチドを切断およびタンパク質複合体WHIのを放出できるようにするために2時間18度Cでカラムを回転させるルタンパク質の背後のIgGセファロースビーズに結合ドメインペプチドを残す。
- カルモジュリンビーズアフィニティー精製を行う
- IgGのビーズをTEV酵素とインキュベートしている間にカルモジュリンビーズを準備します。冷たいカルモジュリン結合バッファー10mlで毎回、15ミリリットルファルコンチューブ3Xに200μlのカルモジュリンビーズを洗浄します。各洗浄のために、ゆっくりと旋回装置上で2分間、チューブを揺らし、その後、2分間千×gでビーズをスピンダウン。 3回目の洗浄の最後に、すべてのバッファーを取り出して試験管内のビーズのみを残す。
- TEVのインキュベーション(ステップ3.2.3)の終了時に、戻って寒い部屋にIgGカラムを返し、まっすぐ上に設定します。ビーズは、10分のために解決しましょう。
- トップキャップを外し、ボトムキャップした後、15ミリリットルファルコンチューブ内の1.3ミリリットルのTEV切断産物を収集します。バッファが完全に排水してみましょう。列のデッドボリュームを押し出す列に追加の200μlのTEVバッファーを追加し、Fを収集同一チューブ内の低アウト。
- 上記の収集された1.5ミリリットルTEV切断製品にバッファし、4.5μlの1 M 塩化カルシウムカルモジュリン結合の4.5ミリリットルを追加します。 塩化カルシウムは、TEVバッファー中のEDTAを滴定するのに役立つ。カルモジュリンビーズを含むチューブに6ミリリットルの混合物を移し、1時間旋回装置上で4℃でチューブを回転させます。
- 低温室で約10ミリリットルの総容量を持つ別の清潔で、空のミクロカラムを設定します。列にカルモジュリンビーズ混合物をロードし、それが重力によって排出させる。
- すべてのソリューションが確定カルモジュリンカラムに流れた場合には、列に冷たいカルモジュリン結合緩衝液10mlでそれぞれ2回洗浄する。注意:カルモジュリンビーズを乱さないよう、洗浄の際に、可能な限りフラットなビーズの表面を維持しようとします。
- カルモジュリン列から餌複合体を溶出させる。
右洗濯後、200μlの冷たいCalmoduの5画分とカルモジュリンカラムを溶出LINの溶出バッファー。各分画のために、ゆっくりとカラムに溶出緩衝液200μlを追加し、マークされた1.5mlのエッペンドルフチューブに溶出液を収集します。この4倍を繰り返します。 - SDS-PAGEによるタンパク質複合体の分析
- 5分(約30μL)のそれぞれから少量をとり、SDSローディングバッファーを追加します。 5分間のサンプルを沸騰させ、勾配(4から15パーセント)のSDS-PAGEゲル中のタンパク質の分子マーカーを有するサンプルを並べてロードします。
- サンプルは完全にゲルで解決した後、電気泳動を停止し、そのような13の染色「ブルーシルバー」などの任意のG-250をベースに敏感コロイド状クマシー染色手順でゲルを染色。それは、その後の質量分析と完全に互換性がないため、銀染色はオプションですが、好ましくない。このような精製されたタンパク質複合体の分子のアイデンティティを発見するための質量分析などのさらなる分析のために-80℃の冷凍庫に溶出液の残りの部分を格納します。 SEEディスカッション。
結果
ここでは、ハエの脳内のHighwire相互作用タンパク質を同定することに我々の努力を示しています。 Highwire(HIW)とその脊椎動物と無脊椎動物の同族体は、神経系14の開発と修復を規制する巨大なユビキチンリガーゼである。彼らは高度に保存された機能的なドメインの数を共有しています。しかし、それらの分子の行動は完全には明らかではありません。ワームで行われた作業、飛ぶとマウスは、E3リガーゼとしての足場タンパク質としてHIW機能がを通じて、時間と細胞種特異的神経細胞の機能を調節マルチサブユニットユビキチン化複合体の形成を促進するため、現在の作業モデルにつながった別の補因子と相互作用し、様々なユビキチン基板をターゲットの組み合わせ。 HIW関連ユビキチン化複合体を同定するために、我々は最初のHIW突然変異表現型15を救出において完全に機能し、N末端 タグを付けたUAS-TAP-HIW導入遺伝子を生成した。大人のFLの約10グラムTAPのみ又はTAP-HIWジェニックタンパク質を発現するyの頭部を回収し、上記のように並べTAP手順側に供した。両方の精製からの最終溶出液をSDS-PAGEし、次いで銀染色によって分析した。質量分析は、 ショウジョウバエ FSN(DFSN、F-ボックスタンパク質)とRAE1( 図2)を含む、唯一のTAP-HIWサンプル中のタンパク質のリストを同定した。その後の遺伝子および生化学的分析は、HIWとDFSNはシナプスの構造と機能16を調節するために、SCFのようなE3ユビキチンリガーゼ複合体として一緒に働くことを明らかにし、 生体内で HIWとRAE1 associatesのシナプスの異常増殖を抑制する17。 RAE1のこの機能は、少なくとも部分的に選択的シナプスの発達中に17 HIWタンパク質存在量を制御する新規な機構を明らかにオートファジー分解から保護HIW介しHIWタンパク質の安定性を促進するその能力によって達成される。
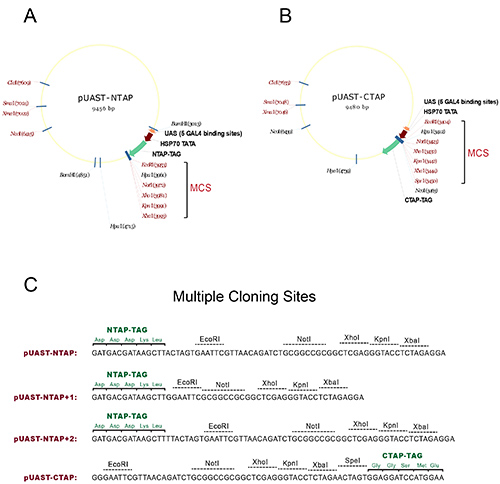
図1。TAP-タグ付きトランスジェニックハエを発生させるためのベクター。(A)のpUAST-NTAPの地図を構築する。 (B)のpUAST-CTAP構造のマップ。両方の構築におけるマルチクローニングサイト(MCS)は、シングルカット制限部位が赤色で示されているブラケット、マークが付いています。 (C)TAPタグのリーディングフレームとTAPベクターの複数のクローニング部位を示す一次配列。のpUAST-NTAP 1とのpUAST-NTAP 2:サブクローニングを容易にするために、さらに2つのNTAP構築物は、元のpUAST-NTAPから生成されています。一緒に3 NTAPは、MCSの使用に対応するために、すべての可能な3つのリーディングフレームをカバーして構築します。全てのベクトルは、もともとで生成NTAP又はCTAP断片を用いて構築されているセラフィン演習1。 拡大画像を表示するにはここをクリックしてください。

神経系での図2のTAP(BG380-GAL4;; UAS-TAP)を発現するハエのTAP精製によりハエの脳からHighwire相互作用タンパク質の精製アダルトヘッドまたはTAP-HIW。(UAS-TAP-HIW BG380-GAL4)をそれぞれ回収し、ホモジナイズし、TAP精製に供される。最終溶出液を銀染色し、一次元SDS-PAGEゲルにより分析した。矢じりは、ベイトタンパク質HIWを示し、アスタリスクは切断をTEVによる切り捨てのTAPタンパク質を示している。 TAP-HIWサンプルでは、タンパク質のリストを質量によって識別されますHSC-70、β-チューブリン、RAE1とDFSN(矢印で示す)を含む分析。 この数字は、天ら 17の図1aから変更されている拡大画像を表示するにはここをクリックしてください。
| バッファ | 合成 | 注釈 |
| 溶解バッファー | 50mMのTris-HCl pH7.5で | 注:1)使用直前にDTTおよびプロテアーゼおよびプロテアソーム阻害剤を添加する。 |
| 125のNaCl | 2)ここで示すことは、0.5%NP40で溶解バッファーである。非イオン性界面活性剤での変更のための説明を参照してください。 | |
| 5%グリセロール | ||
| 0.5%NP40 | ||
| 1.5のMgCl 2 | ||
| 25のNaF | ||
| 0.2のDTT | ||
| (以下は、プロテアーゼおよびプロテアソーム阻害剤である) | ||
| を1mMのNa 3 VO 4 | ||
| 0.05 mMのMG-115 | ||
| 1mMのPMSF | ||
| プロテアーゼ阻害剤混合物(シグマP8340) | ||
| プロテアーゼ阻害剤カクテル(Roche 04693159001) | ||
| IgGの洗浄バッファー | 10mMのトリス-Cl pH8.0の(2 Mのストック0.5ml)を | |
| 150のNaCl(5Mストックの3ミリリットル) | ||
| 0.1%のNP40(10%原液1.0mlの) | ||
| 最終的なH 2 0〜100ミリリットル | ||
| TEV切断バッファー | 10mMのトリス-Cl pH8.0の(2 Mのストック0.5ml)を | 注:使用直前にDTTを追加します。 |
| 150のNaCl(5Mストックの3ミリリットル) | ||
| 0.1%のNP40(10%原液1.0mlの) | ||
| 0.5のEDTA(0.5M株式100μL) | ||
| 1のDTT(1Mストックの100μL) | ||
| 最終的なH 2 Oを100ミリリットル | ||
| カルモジュリン結合バッファー | 10 mMのβ-メルカプトエタノール(株式の69.7μL) | |
| 10mMのトリス-Cl pH8.0の(2 Mのストック0.5ml)を | ||
| 150のNaCl(5Mストックの3ミリリットル) | ||
| 1 mMの酢酸Mg(1Mストックの100μL) | ||
| 1 mMイミダゾール(1Mストックの100μL) | ||
| 2のCaCl 2(1Mストックの200μL) | ||
| 0.1%のNP40(10%ストック1ml)を | ||
| 最終的なH 2 Oを100ミリリットル | ||
| カルモジュリン溶出バッファー | 10 mMのβ-メルカプトエタノール(株式の69.7μL) | |
| 10mMのトリス-Cl pH8.0の(2 Mのストック0.5ml)を | ||
| 150のNaCl(5Mストックの3ミリリットル) | ||
| 1 mMの酢酸Mg(1Mストックの100μL) | ||
| 1 mMイミダゾール(1Mストックの100μL) | ||
| 10のEGTA(0.5Mストックの2ミリリットル) | ||
| 0.1%のNP40(10%ストック1ml)を | ||
| 最終的なH 2 Oを100ミリリットル |
表1。バッファーの成分。
ディスカッション
タンデムアフィニティー精製(TAP)法2の独立したアフィニティー精製工程を経てタンパク質複合体の単離及び濃縮を可能にするデュアル精製プロトコルを提供しています。 TAPタグの設計は、このプロトコルで提示されるものに限定されない緩衝液条件に応じて調整される場合、他のタンパク質の結合ドメインおよびモチーフも適用可能である。他のTAPタグの良い例は、哺乳類の培養細胞株18における精製タンパク質複合体を目的としたジュリオSuperti-Furgaのグループが設計したGS-TAPタグ、Gタンパク質とストレプトアビジン結合モチーフを組み合わせ、である。 GS-TAPは、後に、ショウジョウバエ S2細胞および胚19中のタンパク質-タンパク質相互作用を研究するために適合させた。ベイリーらによる最近の刊行物は、JoveのGS-TAP手順は、細胞培養溶解物20を用いて実施した方法を実証した。ここでは、AD( ショウジョウバエの神経組織におけるTAP-タグの使用を発表大規模なプロテオームスクリーニングのためのULTヘッド)。このプロトコルは、潜在的に、例えば、胚の大規模なサンプル収集を可能にする他の組織に適合させることができる。トップふるい(ステップ2.3.2.3)上で収集された大人の体も非常に困難な作業になる可能性があり、TAP、のために使用することができる。溶解緩衝液は、変性および最大で消化管に存在する第一の精製操作が大幅にプロテアーゼに対するタンパク質の曝露時間を低減するために短くすることが大規模なプロテアーゼを阻害するために調整されなければならない。別のTAPタグはアフィニティー精製に異なるハンドリング及び緩衝液条件を必要とするが、TAPのための一般的な原理は同じである。下は、TAP結果の品質に影響を与える事項について説明します。
TAPアプローチの成功は、右の導入遺伝子の生成に依存します。まず、TAPタグ自体は、その能力を保持することが重要であるベイトタンパク質の全体的なコンホメーションを変更しないでくださいその生理的な結合パートナーと相互に作用する。このように、どこに目的の遺伝子に、TAPタグを融合させるかを決定することが重要です。決定は、タンパク質の以前の研究、その構造または機能的epitodeタグ付きトランスジーンについての特に情報に基づいて行うことができる。場合にこのような情報が並行してNまたはC末端にbaitタンパク質にタグを付ける、利用できないことをお勧めします。次いで、官能レスキュー実験を使用すべきかを決定するために、トランスジーンを行うことができる。第二に、遺伝子組換えタンパク質の発現レベルは、内因性タンパク質のそれに近いものでなければならない。 Gal4/UASシステムは、通常、偽陽性を増加またはタンパク質相互作用のプロフィールを変更、予期しない結果を引き起こすことができるいずれかは、内在性タンパク質と比較して異なるタイミングで、はるかに高いレベルで導入遺伝子の発現を駆動するので、これは特に重要である細胞内のネットワーク。例えば、過剰発現する足場タンパク質は、コーありEドミナントネガティブ効果やそのようなキナーゼのような酵素活性を保有過剰発現するタンパク質は、多くの場合は、順番に、それらと相互作用するそれらの内因性結合パートナーの能力に影響を与える可能性があり、どちらも機能獲得効果を引き起こす。従って、GAL4/UASシステムは、目的の遺伝子の発現のタイミングおよびレベルは、通常の条件下でのみ提示する内因性の相互作用の維持に重要である場合には避けるべきである。代わりに、TAPタグ化導入遺伝子の発現は、それ自身のプロモーターの下で制御されるべきである。これは、内在性プロモーター配列とUAS配列を置換することによって、又は関心対象21の遺伝子の全遺伝子座を含有するゲノムDNAフラグメント中exonal配列とフレーム内のTAP配列を融合させることによってのいずれかを達成することができる。いくつかの場合において、TAP実験株式会社の内因性タンパク質との競合を減少させるために、目的の遺伝子の機能変異体バックグラウンドの損失を行うことができる多タンパク質複合体にorporating。この場合、タンパク質ヌルバックグラウンドのために、可能な場合は、完全に内因性タンパク質を排除するための理想的な条件を提供しています。遺伝的背景の突然変異体を用いて、常に高品質な結果を生成する可能性を高めるであろう。
ベイトタンパク質の溶解度は、成功のためのもう一つの重要な要因である。非イオン性界面活性剤は、通常、原形質膜を溶解し、生理的環境に近い状態に可溶性で無傷のタンパク質複合体を、保持するために溶解緩衝液に使用される。しかし、目的のタンパク質は、膜統合または関連タンパク質であるか否かに応じて、非イオン性界面活性剤の組成および濃度は、ベイトタンパク質を可溶化するために重要であり得る。 0.1から0.3パーセントNP40は、多くの場合、細胞質ゾルのタンパク質を可溶化するのに十分である。膜タンパク質については、NP40(0.1〜1%)、NaDOC(0.1〜1%)、およびTriton X-100(0.05から0.5パーセント)の組合せは、時にはsolubiに必要とされるリゼとTAP実験に十分な蛋白質を豊かにする。ストリンジェントな溶解緩衝液は、弱いタンパク質 - タンパク質相互作用を破壊する傾向があるので、バランスが同時にタンパク質 - タンパク質相互作用の大部分は保存されたまま十分な可溶性ベイトタンパク質がサンプル中に存在する到達する必要がある。一般的な原則は、常に最低濃度の洗剤の最も少ないタイプを使用しようということです。
トラブルシューティングを容易にするために、それは非常に2精製の各ステップからのサンプルの少量を保存することをお勧めします。その後のSDS-PAGEおよびタンパク質染色/ウェスタン分析アリコートにベイトタンパク質および特定のタンパク質種の連続的な富化のレベルをモニターすることを可能にする。ベイトタンパク質の急激な減少は、TEV切断後の流出(ステップ3.3.3)の一定量で検出された場合などには、ベイトタンパク質はIgGのビーズ洗浄する(ステップ3.1.4)の間に失われた可能性が高い。洗濯棒で洗うible原因は、IgG洗浄バッファーの不十分な洗浄剤組成物かもしれません。 IgGの洗浄緩衝液中の界面活性剤の組成および濃度に急激な低下は、溶解緩衝液と比較して(0.1%NP-40のみ)がある。ベイトタンパク質は、これらの変化に敏感で、ビーズ上のIgG部分から切り離すことがあります。溶解バッファーに向けてのIgG洗濯を調整することで、問題の解決に役立つことがあります。可能性が低いもののあるいは、TEV切断(ステップ3.2)のIgGビーズから餌含有複合を解放するために十分に働いていない可能性があります。第2検査の価値の手順は、酵素を和らげることが誤った取り扱い、TEVバッファー(ステップ3.2.1)と、酵素活性を有するIgGビーズの平衡化である。
でも、2段階の精製で、まだ最終的なTAP-精製された複合体中に存在する非特異的にプルダウンされ、誤検出やタンパク質が存在することに留意してください。で、これらの非特異的な相互作用を同定するための一つの方法少なくとも部分的に、TAP精製実験におけるTAP-タグ化導入遺伝子と並列にTAPのみ導入遺伝子を用いて制御TAPを含めることである。 TAP専用の手順で同定されたタンパク質は、TAP-導入遺伝子の浄化で特定され、リストから削除する必要があります。
成功したTAPは、潜在的に生体内で目的のタンパク質に関連しているタンパク質の混合物を浄化します。次のステップは、これらのタンパク質の分子同定され、質量分析法は、一般的にこの目的のために使用される。 SDS-PAGEの結果、実験の必要性に応じて、精製されたタンパク質複合体における分子のアイデンティティは、以下の2つの方法で決定することができる:1)各々の個々のタンパク質バンドをゲルから切り出し、低に供することができる複雑LC-MS/MSまたは2)ピークタンパク質含有量(通常は第二溶出)を含有する溶出画分を直接適度な複雑さのLC-MS/MSに供され得る。このようなショットガンのProteomicアプローチは、潜在的にMSの機器22のダイナミックレンジに応じて、複合体中のすべてのタンパク質を同定します。
ミバエ - 要約すると、我々は、遺伝モデル有機体の神経組織におけるタンパク質 - タンパク質相互作用を同定する方法を提供する。フライにTAP法を適用する多くの利点がある:1)ミバエは、短いライフサイクルを持っているので、比較的迅速かつトランスジェニックハエを発生させると多量の組織を得ることが容易であり、両方がTAPのために重要であるアプローチ2)ハエのゲノムは完全にアノテートおよびヒト疾患原因遺伝子の70%を含んでいる、3)最も重要なのは、それが機能的に検証し、ハエにおいて相互作用タンパク質の候補を特徴付けることは容易である。このような組織特異的機能喪失遺伝子の大多数のを研究するのに有用な遺伝子導入ベースのRNAiコレクションとして所定の遺伝子の特徴づけのためのフライ研究コミュニティで利用できる総合的なリソースがありますの、遺伝子座の大部分、並びにcDNAクローンおよび機能獲得研究のための有用な導入遺伝子のための突然変異及び欠損対立。我々は、フライ、TAP法はフライラボで使用されるツールボックスに貴重な追加になると信じています。将来展望では、この方法は、特定の条件および刺激に応答してタンパク質 - タンパク質相互作用ネットワークの変化をスクリーニングするために飛行行動パラダイムおよびヒト疾患モデルと組み合わせることができる。
開示事項
著者らは、開示することは何もありません。
謝辞
私たちは、私たちに酵母のTAP発現プラスミドを送信するためEUROSARFに感謝します。また、ライアンLabadensから編集助けに感謝しています。この作品は、CWにNIH / NINDS助成金(R01NS070962)によってサポートされていました
資料
| Name | Company | Catalog Number | Comments |
| U.S.A. standard test sieve No. 25 | Fisher Scientific | 04-881-18 | |
| U.S.A. standard test sieve No. 40 | Fisher Scientific | 04-881-21 | |
| Kontes Dounce Tissue Grinders 15 ml | Kimble Chase | 885300-0015 | |
| IgG sepharose beads | Pharmacia | 17-0969-01 | |
| Econo-column 0.7 cm x 20 cm | Bio-Rad | 737-4721 | |
| Econo-column 0.5 cm x 15 cm | Bio-Rad | 737-4716 | |
| Calmodulin beads | Stratagene | 214303 | |
| Coors Mortar and Pestle | CoorsTek | 60311 | |
| AcTEV Protease | Invitrogen | 12575-015 | |
| Protease Inhibitor Cocktail | Roche | 11836153001 | |
| Protease Inhibitor Mix | Sigma | P8340 |
参考文献
- Rigaut, G., et al. A generic protein purification method for protein complex characterization and proteome exploration. Nat. Biotechnol. 17, 1030-1032 (1999).
- Collins, S. R., et al. Toward a comprehensive atlas of the physical interactome of Saccharomyces cerevisiae. Mol. Cell. Proteomics. 6, 439-450 (1074).
- Gavin, A. C., et al. Proteome survey reveals modularity of the yeast cell machinery. Nature. 440, 631-636 (2006).
- Krogan, N. J., et al. Global landscape of protein complexes in the yeast Saccharomyces cerevisiae. Nature. 440, 637-643 (2006).
- Forler, D., et al. An efficient protein complex purification method for functional proteomics in higher eukaryotes. Nat. Biotechnol. 21, 89-92 (2003).
- Veraksa, A., Bauer, A., Artavanis-Tsakonas, S. Analyzing protein complexes in Drosophila with tandem affinity purification-mass spectrometry. Dev. Dyn. 232, 827-834 (2005).
- Li, Y. The tandem affinity purification technology: an overview. Biotechnol. Lett. 33, 1487-1499 (2011).
- Volkel, P., Le Faou, P., Angrand, P. O. Interaction proteomics: characterization of protein complexes using tandem affinity purification-mass spectrometry. Biochem. Soc. Trans. 38, 883-887 (2010).
- Xu, X., et al. The tandem affinity purification method: an efficient system for protein complex purification and protein interaction identification. Protein Expr. Purif. 72, 149-156 (2010).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118, 401-415 (1993).
- Bachmann, A., Knust, E. The use of P-element transposons to generate transgenic flies. Methods Mol. Biol. 420, 61-77 (2008).
- Puig, O., et al. The tandem affinity purification (TAP) method: a general procedure of protein complex purification. Methods. 24, 218-229 (2001).
- Candiano, G., et al. Blue silver: a very sensitive colloidal Coomassie G-250 staining for proteome analysis. Electrophoresis. 25, 1327-1333 (2004).
- Tian, X., Wu, C. The role of ubiquitin-mediated pathways in regulating synaptic development, axonal degeneration and regeneration: insights from fly and worm. J. Physiol. , (2013).
- Wu, C., Wairkar, Y. P., Collins, C. A., DiAntonio, A. Highwire function at the Drosophila neuromuscular junction: spatial, structural, and temporal requirements. J. Neurosci. 25, 9557-9566 (2005).
- Wu, C., Daniels, R. W., DiAntonio, A. DFsn collaborates with Highwire to down-regulate the Wallenda/DLK kinase and restrain synaptic terminal growth. Neural Dev. 2, 16 (2007).
- Tian, X., Li, J., Valakh, V., DiAntonio, A., Wu, C. Drosophila Rae1 controls the abundance of the ubiquitin ligase Highwire in post-mitotic neurons. Nat. Neurosci. 14, 1267-1275 (2011).
- Burckstummer, T., et al. An efficient tandem affinity purification procedure for interaction proteomics in mammalian cells. Nat. Methods. 3, 1013-1019 (2006).
- Kyriakakis, P., Tipping, M., Abed, L., Veraksa, A. Tandem affinity purification in Drosophila: the advantages of the GS-TAP system. Fly. 2, 229-235 (2008).
- Bailey, D., Urena, L., Thorne, L., Goodfellow, I. Identification of protein interacting partners using tandem affinity purification. J. Vis. Exp. (60), e3643 (2012).
- Wu, Y., et al. A Drosophila model for Angelman syndrome. Proc. Natl. Acad. Sci. U.S.A. 105, 12399-12404 (2008).
- Liao, L., McClatchy, D. B., Yates, J. R. Shotgun proteomics in neuroscience. Neuron. 63, 12-26 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved