Method Article
זיהוי אינטראקציה בין חלבונים ב
In This Article
Summary
דרוזופילה מפורסמת המניפולציה הגנטית החזקה שלה, אבל לא להתאמתה של אנליזה ביוכימית לעומק. כאן אנו מציגים הליך מבוסס TAP לזהות שותפים באינטראקציה של כל חלבון של עניין ממוח הזבוב. הליך זה עלול להוביל לאפיקים חדשים של מחקר.
Abstract
מסכי גנטיים שנערכו באמצעות דרוזופילה melanogaster (זבוב פירות) יש תגליות אבן דרך רבות בהתקדמות של מדעים ביולוגיים. עם זאת, השימוש במסכים ביוכימי שמטרתה להרחיב את הידע שנצבר מניתוח גנטי שנחקר רק לאחרונה. כאן אנו מתארים שיטה לטיהור החלבון המורכב שמקורביו עם כל חלבון של עניין מראשי זבוב בוגרים. שיטה זו מנצלת את מערכת דרוזופילה Gal4/UAS לבטא חלבון פיתיון התמזגו עם תג טנדם זיקה הטיהור (TAP) בנוירונים זבוב in vivo, ולאחר מכן מיישמת את שני סבבים של טיהור באמצעות הליך TAP דומה לזה שהוקם במקור בשנת שמרי 1 כדי לטהר את החלבון מורכב אינטראקציה. בסופו של הליך זה, תערובת של קומפלקסי חלבונים מרובים מתקבלת אשר מולקולרי זהויות יכולים להיקבע על ידי ספקטרומטריית מסה. אימות של חלבוני המועמד תיהנה מresource וקלות ביצוע מחקרי אובדן של פונקציה בזבובים. ניתן ליישם גישות דומות לרקמות זבוב אחרות. אנו מאמינים כי השילוב של מניפולציות גנטיות וגישת proteomic זה במערכת מודל זבוב בעל פוטנציאל אדיר להתמודדות עם בעיות יסוד בתחום הנוירוביולוגיה ומעבר.
Introduction
הגדרת מסלולים או רשתות המולקולריים שמתווכים תהליך ביולוגי מסוים היא אחת המטרות האולטימטיבית של מחקר ביו. גנטיקאים טוסו הסתמכו רבים על גנטיקה קדימה, במיוחד מתקנים מסכי גנטיים (שניהם משפר והמסכים המדכאים), כדי לזהות גורמים שפועלים יחד, במקביל, או במעלה הזרם או במורד הזרם של גן של עניין. עם זאת, מסכי גנטיקה קדימה לעתים קרובות פעמים לא מצליחים לזהות את הגנים חיוניים אשר, כאשר מוטציה, לגרום הקטלניות בשלבי התפתחות מוקדמים, או גנים עם יתירות פונקציונלית ופיצוי אובדנה של פונקציה היחידה לגרום למומים עדינים שקשה להבקיע. דרך אחת להתגבר על קושי זה היא מסך עבור אינטראקציות בין חלבונים ישירים. במשך יותר מעשור, רשימה הולכת וגדלה של שיטות ביוכימיות, כולל שמרי שני היברידיות, להציג הפאג, cross-linking הכימי, Co-IP, טנדם זיקה טיהור (TAP), וכו '. היה בשימוש כדי לחקור חלבוןחלבון אינטראקציות. כל אחת מהגישות הללו יש סט של נקודות חוזק וחולשה בכל הקשור לרגישות וסגוליות משלו. ביניהם, את שיטת TAP מאפשרת זיהוי של אינטראקציה פיזית בתנאים כמעט פיסיולוגיים, שומרת על ייחוד ועקביות 2 וכוללת את היכולת להרחיב לתפוקה גבוהה ניתוח 3,4.
שיטת TAP פותחה בשמרים במקור על ידי עמיתי Rigautand 1. בשיטה זו, חלבון של העניין בא לידי ביטוי עם תג TAP. תג TAP מטפח שני תחומים עצמאיים מחייב זיקה: חלבון תחום שנקשר לנוגדנים ומחייב רישום calmodulin. שני תחומים מופרדים על ידי אתר מחשוף TEV (וירוס Etch טבק). שילוב כזה מאפשר לשני סיבובים עצמאיים של purifications זיקה כדי להפחית במידה מספקת איגודים ספציפיים ולהעשיר איגודים ספציפיים 1. למשל זה, שיטת TAP היא metho חזק מאודד לזהות באינטראקציות vivo של חלבון נתון, אם כי ביתר את חלבון אקסוגני יכול לעשות את זה יותר נוטה לקשר עם חלבונים שעושים בדרך כלל אינו מורכב עם עמיתו אנדוגני שלה. מאז הפיתוח שלה, שיטת TAP כבר מיושמת במערכות רבות אחרות, כוללים תאים המבוסס על תרבות מערכות 5,6 ובמערכות מודל vivo אחרות 6-9. כאן אנו מתארים את העיבוד של שיטת TAP בדרוזופילה. אנחנו מייצרים ראשון וקטורי pUAST-NTAP וpUAST-CTAP כדי להקל על שיבוט והיתוך של תג TAP לאו N-או C-המסוף של הגן של עניין. -מתויג TAP כטב"מ transgene לאחר מכן בא לידי ביטוי במערכת העצבים בשליטתו של נהג GAL4 עצבי 10. בשלב הבא, מספר גדול של ראשי זבוב בוגרים ייאסף, שבו יש תכולה גבוהה של תאים עצביים וקלים להיפרד מחלקי גוף אחרים לאחר הקפאה המבוסס על הבדלים בגודל. הראשים הבוגרים ב הומוגני ופינהcentrifugations y הרציף, ואת supernatant כפוף להליך TAP המתואר להלן.
Protocol
1. צור כטב"מ-מתויג TAP זבובים טרנסגניים
- צור pUAST-מתויג TAP בונה DNA.
- להחליט באיזה צד (N-או C-סופית) של חלבון פיתיון תג TAP יש התמזגו, המבוסס על המבנה / התפקוד של החלבון. ראה דיון לפרטים נוספים.
- Subclone אזור קידוד cDNA של הגן של עניין לאתרים המרובים שיבוט (MCS) של וקטורי pUAST-NTAP או pUAST-CTAP ליצור transgenes כטב"מ-TAP N-או C-מסוף מתויג, בהתאמה. ראה איור 1 עבור מפות מפורטות ואתרי הגבלה שמישים ומסגרות קריאה.
- צור כטב"מ-מתויג TAP זבובים מהונדסים.
- צור זבובים מהונדסים הבאים פרוטוקולים סטנדרטיים באמצעות P-תיווך אלמנט ההחדרה 11. מספר שירותי הזרקה הוא זמינים באופן מסחרי.
- לחצות נהג GAL4 עצבי (כלומר BG380-GAL4) לכל שורה מהונדס בודדת ולקבוע את רמות ביטוי החלבוןכל שורה על ידי כתם מערבי (עם נוגדני Anti-Peroxidase Peroxidase) ו / או immunostaining (עם נוגדן אנטי TAP). באופן כללי, קו מהונדס עם רמת ביטוי חלבון שהוא קרוב לחלבון אנדוגני מומלץ לנהלים ברז. ראה דיון לפרטים נוספים.
- PerformGAL4/UAS-based ניסויי הצלה כדי לאשר את הפונקציונליות של transgenes מתויג TAP אם מוטציות פסד של פונקציה של גנים של עניין זמינות. בחר transgene שיכול באופן משמעותי להציל את פנוטיפים מוטציה לניסויי TAP הבאים.
2. הכן דוגמאות לנוהל TAP
- צור מניית זבוב שנושא שני נהג עצבי GAL4 (למשל BG380-Gal4) וtransgene מתויג TAP נבחר על מנת להקל על ההתרחבות של דגימות לטוס. לאסוף progenies F1 של נהג GAL4 וצלב כטב"מ-transgene במקרים נדירים שבם השילוב הנ"ל גורם לחסרון הישרדות וצמיחה.
- לאסוף דגימות בקנה מידה קטנות ולייעל את מצב תמוגה לsolubilizing החלבון מתויג TAP.
- לעשות סדרה של מאגרי תמוגה באמצעות שילוב של חומרי ניקוי nonionic NP-40 (0.1-1%), NaDOC (0.1-1%) וטריטון X-100 (0.05-.5%). ראה טבלת 1 ודיון לקבלת מידע נוסף.
- על גבי משטח CO2, השתמש # 5 מלקחיים לנתח 20 ראשים בוגרים מtransgene TAP להביע זבובים ולאסוף אותם בצינור 1.5 מיליליטר לבדוק כל תנאי מאגר תמוגה.
- הוסף חוצץ תמוגה בדיקות 100 ul לצינור וhomogenize הראשים ידי מלטף את מעלה ומטה עם העלי פלסטיק, ולאחר מכן להוסיף עוד חיץ בדיקות 100 ul.
- ספין lysate הראש ב21,500 XG עבור 10 דקות (4 מעלות צלזיוס), ולהפריד את supernatant וגלולה לאחר צנטריפוגה. הוסף 25 חיץ טעינת ul 2x SDS לגלולה וחיץ טעינה 10 ul 4x SDS ל30 ul של supernatant בהתאמה.
- מרתיחים שתי דגימות למשך 5 דקות ולנתח אותם בצד על ידיבצד באמצעות SDS-PAGE ולאחר מכן כתם מערבי עם נוגדן PAP. לקבוע את המסיסות על ידי היחס בין רמות TAP-החלבון בsupernatant לעומת גלולה.
- הכן את המדגם בקנה מידה גדולה
- להרחיב ולאסוף זבובים בוגרים.
- הרחב את מניית neuronal-GAL4/UAS-TAP-transgene בבקבוקים ולהעיף את הבקבוקים כל 3 ימים עד 250 בקבוקים מצטברים משמשים לאיסוף.
- מבוגר ישן לאסוף 1-3 ימים עף לתוך 50 צינורות חרוטי מיליליטר, לשים את הצינור בחנקן נוזלי באופן מיידי להקפאה עמוקה את הזבובים. אחסן את הזבובים ב-80 ° C במקפיא. שים לב שהנפח של הזבובים לא יעלה על 2/3 מצינור 50 מיליליטר.
- לאסוף ראשים לטוס (לבצע שלב זה על גבי קרח יבש אבקה).
- קח את מסננות prechilled ומכתש ועלי מ-80 ° C במקפיא ולשים אותם על קרח יבש, באופן אידיאלי בתוך דלי קרח גדול. סטאק שתי הנפות מבחן סטנדרטיות בארה"ב עם מס '25 על העליון דואר ומס '40 בתחתית.
- קח את הזבובים הקפואים החוצה ושחרר אותם בחנקן נוזלי ולשמור על הזבובים שביש ל10 דקות בערך. מערבולת או לנער את הצינורות במרץ כדי לשבור את הראש, ברגליים, וכנפיים מהגופות.
- יוצקים את התערובת למסננת העליונה, ולאחר מכן ללחוץ הנפות נמרצות תוך החזקת שני מסננות יחד. לאחר סינון, הגופים יישארו במסננת העליונה, לעוף ראשים יישמרו על המסננת התחתונה, ורגליים, כנפיים, ופסולת אחרת ייפלו על הקרח היבש. להפריד בין שתי הנפות ובזהירות להעביר את הראשים לטוס מרגמה הקרה.
- Homogenize ראשי הזבוב
- על גבי קרח יבש, לטחון את הראשים עם המכתש והעלי לחלקיקי אבק, ולאחר מכן להעביר את האבקה למטחנת רקמת Dounce זכוכית מיליליטר 15 שprechilled על קרח.
- מדוד את המשקל של המטחנה לפני ואחרי דגימת הראש נמזגה לתוכה, ולאחר מכן לחשב כמה samp הראשle שוקל. כולל של 6-15 גרם של ראשי זבוב יהיה מספיק עבור כל ניסוי TAP התאמה בהתאם לרמות הביטוי של החלבון. הוסף 15 מיליליטר של חיץ המגון קר כקרח (מאגר תמוגה מותאם בשלב 2.2) לאבקה ולאחר מכן שבץ עם העלי הסיקול הגדול עד שהוא קל לעלי ללכת למעלה ולמטה. שמור את המטחנה מזכוכית על קרח בכל העת.
- הכן את supernatant לTAP
- מעביר את homogenate לצינור צנטריפוגות במהירות גבוהה וספין ל20 דקות ב ~ 50,000 XG (4 ° C). מעביר את supernatant לצינור צנטריפוגות במהירות גבוהה חדש וחזור צנטריפוגה עוד פעם אחת.
- מעביר את supernatant לצינור ultracentrifuge ולבצע 40 דקות ~ 250,000 ספין XG כדי לנקות את supernatant נוסף. Supernatant מוכן להליכי טיהור זיקת טנדם לאחר ultracentrifugation.
- להרחיב ולאסוף זבובים בוגרים.
3. טיהור TAP
הסעיפים הבאים נגזרו מברז המעבדה Seraphin protocol 12 (http://web.as.uky.edu/Biology/faculty/rymond/BIO%20510/Bertran%20Seraphin%27s%20TAP%20page.pdf )
- לבצע טיהור זיקת חרוז IgG
- הכן את חרוז sepharose IgG תוך הדגימות נמצאים centrifuged. שטוף 400 μl 3x חרוז IgG בצינור פלקון 15 מיליליטר עם 10 מיליליטר חיץ כביסה IgG קר. לכל שטיפה, לטלטל את הצינור בעדינות במשך 2 דקות, ולאחר מכן ספין למטה חרוזים XG ב 1000 לעוד 2 דקות. בסוף לשטוף השלישי, להסיר את החיץ ולהשאיר רק את חרוזים בצינור.
- להעביר בזהירות את supernatant פינה (~ 15 מיליליטר) לתוך צינור 15 מיליליטר המכיל חרוזים IgG. דגירה חרוזים ותמהיל lysate המוח ב4 º C על nutator במשך שעה 2.
- הגדר את עמודת מיקרו נקייה וריקה עם -15 מיליליטר נפח כולל בחדר הקר. טען את תערובת חרוז IgG ידי בהתמדה לשפוך את התערובת לתוך הטור; מנסה לא מלכודת כלבועות אוויר בתוך העמודה. לאפשר חרוזים להתיישב בעמודה והחיץ כדי לנקז באיטיות על ידי זרימת כוח הכבידה.
- לשטוף את העמודה ביסודיות עם 10 מיליליטר של חיץ הכביסה IgG הקר אחרי כל lysate המוח זרם דרך עמודת IgG התיישבה. חזור על 2x לשטוף. שים לב: לא לתת יבש חרוז באוויר.
- בצע מחשוף TEV
- לאחר לשטוף השלישי, לשטוף את העמודה שוב עם 10 חיץ מחשוף מיליליטר TEV. צעד זה מכין את חרוז IgG שsequestrates מורכב פיתיון למחשוף TEV.
- ממש לפני שהטיפה האחרונה של חיץ TEV עומדת לטפטף החוצה, לשים כובע בחלק התחתון של העמודה כדי לחסום את הזרימה, להוסיף 1.3 חיץ מיליליטר TEV מכיל 130 יחידות של אנזים TEV לעמודה, ולאחר מכן באופן מאובטח מכסה את החלק העליון של העמודה. ודא שהעמודה אטומה היטב בשני הקצוות.
- סובב את העמודה ב18 מעלות צלזיוס במשך שעה 2 כדי לאפשר לאנזים TEV לדבוק פפטיד באתר TEV ולשחרר WHI החלבון המורכבle השאיר מאחוריו את החלבון פפטיד תחום חייב חרוזים sepharose IgG.
- לבצע טיהור זיקת חרוז Calmodulin
- הכן את חרוזים Calmodulin תוך חרוזים IgG מודגרת עם אנזים TEV. שטוף 200 חרוזים Calmodulin μl ב15 מיליליטר 3x צינור פלקון, בכל פעם עם 10 מיליליטר של Calmodulin הקר מחייב חיץ. לכל שטיפה, נער בעדינות את הצינור למשך 2 דקות על nutator, ולאחר מכן לסובב את חרוזים ב1,000 XG במשך 2 דקות. בסוף לשטוף השלישי, להוציא את כל החיץ ולהשאיר רק את חרוזים בצינור.
- בסוף הדגירה TEV (צעד 3.2.3), להחזיר את טור IgG חזרה לחדר הקר ולהגדיר ישר אותו. בואו חרוזים להסתפק 10 דקות.
- הסר את המכסה העליון ולאחר מכן את המכסה התחתון, ולאחר מכן לאסוף את מוצר מחשוף מיליליטר TEV 1.3 בצינור פלקון 15 מיליליטר. בואו החיץ לנקז לחלוטין. הוספת חיץ 200 TEV μl נוסף לעמודה לדחוף את הנפח המת של הטור, לאסוף את fנמוך באותו הצינור.
- הוספת 4.5 מיליליטר של Calmodulin מחייב חיץ ו4.5 μl 1 M CaCl 2 למוצר מחשוף 1.5 מיליליטר TEV נאסף לעיל. CaCl 2 משמש כדי לכיל EDTA במאגר TEV. מעביר את תערובת 6 מיליליטר לשפופרת המכילה חרוזים Calmodulin ולסובב את הצינור ב 4 º C על nutator במשך שעה 1.
- להקים עוד עמודת מיקרו נקייה וריקה עם כ -10 מיליליטר נפח כולל בחדר הקר. טען את תערובת חרוז Calmodulin לעמודה ולאפשר לו לרוקן על ידי כוח הכבידה.
- כאשר כל הפתרון זרם דרך עמודת Calmodulin התיישבה, לשטוף את העמודה שתי פעמים, כל אחד עם 10 מיליליטר של Calmodulin הקר מחייב חיץ. שים לב: לא להפריע חרוזים Calmodulin ולנסות לשמור את פני השטח של חרוזים שטוחים ככל האפשר בזמן הכביסה.
- Elute המורכב פיתיון מעמודת Calmodulin.
מייד לאחר כביסה, elute עמודת Calmodulin עם חמישה שברים של 200 μl Calmodu הקרמאגר elution לין. לכל שבר, בעדינות להוסיף 200 μl של חיץ elution לעמודה ולאסוף את eluate עם 1.5 מיליליטר צינור Eppendorf מסומן. חזור על 4x זה. - נתח את החלבון המורכב ידי-SDS
- קח aliquot קטן מכל אחד מחמשת שברים (כ 30 μl) ולהוסיף חיץ טעינת SDS. מרתיחים את הדגימות למשך 5 דקות ולטעון את הדגימות Side-by-צד עם סמנים מולקולריים חלבון בשיפוע (4-15%) ג'ל SDS-PAGE.
- לאחר הדגימות פתרו באופן מלא בג'ל, להפסיק אלקטרופורזה ולהכתים את הג'ל עם כל הליכים המבוססים על ה-G-250 רגישים colloidal Coomassie מכתים כגון 'כסף כחול "מכתים 13. צביעת כסף היא אופציונלית, אך לא עדיפה משום שהיא אינה תואמת באופן מלא עם ניתוח ספקטרומטריית מסה שלאחר מכן. אחסן את שאר eluate במקפיא -80 ° C לניתוח נוסף כגון ספקטרומטריית מסה לחשיפת הזהות המולקולרית של החלבון המורכב המטוהרים. Seדיון בדואר.
תוצאות
כאן אנו מדגימים המאמץ שלנו בזיהוי חלבוני Highwire-אינטראקציה במוח הזבוב. Highwire (hiw) וhomologues החוליות וחסרי חוליות שלה הם ligases היוביקוויטין ענק המווסתים את ההתפתחות ותיקון של מערכת העצבים 14. הם חולקים מספר תחומים פונקציונליים השמורים ביותר. עם זאת, הפעולות מולקולריות שלהם הן לא לגמרי ברורות. עבודה שנעשתה בתולעת, לעוף ועכבר הוביל למודל העבודה הנוכחי שפונקציות hiw כאנזים E3 וכמו חלבון פיגומים כדי להקל על היווצרות מורכבת ubiquitination רב למקטע, המסדיר פונקציות עצביות ספציפי לסוג הזמן ותא דרך שילוב של אינטראקציה עם cofactors שונה ומיקוד מצעי היוביקוויטין שונים. לזהות מורכב ubiquitination קשורים hiw, אנחנו שנוצרנו ראשון transgene כטב"מ-TAP-hiw מתויג N-מסוף כי הוא מתפקד באופן מלא בהצלת פנוטיפ מוטנטי hiw 15. אודות 10 גרם של fl המבוגר ראשי y המבטאים TAP בלבד או חלבונים מהונדסים TAP-hiw נאספו ונתונים לצד נהלי TAP לצד כפי שתוארו לעיל. eluates סופי משני purifications נותח על ידי SDS-PAGE ולאחר מכן צביעת כסף. ספקטרומטריית מסה זיהתה רשימה של חלבונים במדגם TAP-hiw בלבד, כולל דרוזופילה FSN (DFsn, חלבון ה-F-תיבה) וRae1 (איור 2). ניתוחים גנטיים ביוכימיים שלאחר מכן גילו כי hiw וDFsn לעבוד יחד כקומפלקס האנזים דמוי SCF E3 יוביקוויטין להסדיר מבנה ותפקוד 16 הסינפטי, ומקורבי Rae1 עם hiw in vivo ומרסנים את צמיחת יתר הסינפטי 17. פונקציה זו של Rae1 היא לפחות באופן חלקי שהושג על ידי יכולתה כדי לקדם את יציבות חלבון hiw באמצעות הגנת hiw משפלת autophagic, אשר חושפת מנגנון רומן כי סלקטיבי שולט שפע חלבון hiw במהלך פיתוח הסינפטי 17.
gether.within-page = "תמיד"> 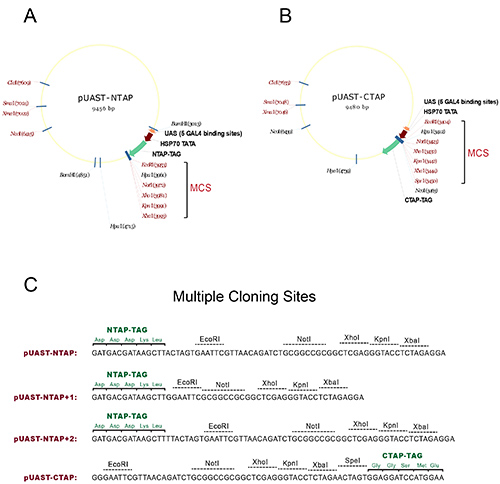
איור 1. וקטורים ליצירת זבובים מהונדסים TAP מתויג. () המפה של pUAST-NTAP לבנות. (ב) המפה של pUAST-CTAP לבנות. אתרי השיבוט המרובים (MCS) בשני המבנים מסומנים בסוגריים, שבו אתרי הגבלת חתך בודד מוצגים באדום. (ג) רצף ראשוני המראה את אתרי שיבוט המרובים של וקטורי TAP עם מסגרת הקריאה של תג TAP. כדי להקל על subcloning, עוד שני מבני NTAP נוצרים מpUAST-NTAP המקורי: pUAST-NTAP +1 וpUAST-NTAP +2. יחד שלושה NTAP בונה מכסה את כל שלוש מסגרות הקריאה אפשריות כדי להתאים את השימוש של MCS. כל הווקטורים נבנים באמצעות NTAP או שברים שנוצר במקור בCTAPSeraphin המעבדה 1. לחץ כאן לצפייה בתמונה גדולה יותר.

. איור 2 טיהור של חלבוני Highwire-אינטראקציה ממוח זבוב על ידי טיהור TAP ראשי מבוגרים מזבובים להביע TAP. (BG380-GAL4; כטב"מ-TAP) או TAP-hiw (BG380-GAL4; כטב"מ-TAP-hiw) במערכת העצבים נאספים, הומוגני, וכפוף לטיהור TAP, בהתאמה. Eluates הסופי נותח על ידי ג'ל SDS-PAGE חד ממדי ואחרי צביעת כסף. ראש החץ מצביע hiw חלבון הפיתיון והכוכבית מציינת חלבון TAP מקוצץ בשל TeV מחשוף. במדגם TAP-hiw, רשימה של חלבונים מזוהים על ידי מסהספקטרומטריית, כולל HSC-70, β-טובולין, Rae1 וDFsn (מסומן בחצים). נתון זה שונה מאיור 1a של טיאן ואח'. 17 לחץ כאן לצפייה בתמונה גדולה יותר.
| חוצץ | הרכב | תגובות |
| מאגר תמוגה | 50 מ"מ טריס-HCl pH 7.5 | הערה: 1) הוסף DTT ומעכבי פרוטאז והפרוטאזום רק לפני השימוש. |
| 125 מ"מ NaCl | 2) מציג כאן הוא מאגר תמוגה עם NP40 0.5%. ראה דיון על שינויים בדטרגנטים nonionic. | |
| גליצרול 5% | ||
| 0.5% NP40 | ||
| 1.5 מ"מ MgCl 2 | ||
| 25 מ"מ NAF | ||
| 0.2 מ"מ DTT | ||
| (להלן מעכבי פרוטאז והפרוטאזום) | ||
| 1 מ"מ Na 3 VO 4 | ||
| 0.05 מ"מ MG-115 | ||
| 1 מ"מ PMSF | ||
| שילוב מעכבי פרוטאז (Sigma P8340) | ||
| מעכבי פרוטאז קוקטייל (Roche 04693159001) | ||
| חיץ הכביסה IgG | 10 מ"מ טריס-Cl pH 8.0 (0.5 מיליליטר של 2 מ 'מניות) | |
| 150 מ"מ NaCl (3 מיליליטר של 5 M מלאי) | ||
| NP40 0.1% (1.0 מיליליטר של מניית 10%) | ||
| 2 0-100 מיליליטר H סופי | ||
| חיץ מחשוף TEV | 10 מ"מ טריס-Cl pH 8.0 (0.5 מיליליטר של 2 מ 'מניות) | הערה: להוסיף DTT רק לפני השימוש. |
| 150 מ"מ NaCl (3 מיליליטר של 5 M מלאי) | ||
| NP40 0.1% (1.0 מיליליטר של מניית 10%) | ||
| 0.5 mM EDTA (של 0.5 M מניית 100 μl) | ||
| 1 מ"מ DTT (מניות 1 M 100 μl) | ||
| 2 O ל 100 מיליליטר H סופי | ||
| חיץ מחייב Calmodulin | 10 β-mercaptoethanol מ"מ (69.7 μl המלאי) | |
| 10 מ"מ טריס-Cl pH 8.0 (0.5 מיליליטר של 2 מ 'מניות) | ||
| 150 מ"מ NaCl (3 מיליליטר של 5 M מלאי) | ||
| 1 מ"מ Mg-אצטט (מניות 1 M 100 μl) | ||
| imidazole מ"מ 1 (של מניית 1 M 100 μl) | ||
| 2 מ"מ CaCl 2 (200 μl של מניית ז 1) | ||
| NP40 0.1% (1 מיליליטר של מניית 10%) | ||
| 2 O ל 100 מיליליטר H סופי | ||
| מאגר elution Calmodulin | 10 β-mercaptoethanol מ"מ (69.7 μl המלאי) | |
| 10 מ"מ טריס-Cl pH 8.0 (0.5 מיליליטר של 2 מ 'מניות) | ||
| 150 מ"מ NaCl (3 מיליליטר של 5 M מלאי) | ||
| 1 מ"מ Mg-אצטט (מניות 1 M 100 μl) | ||
| imidazole מ"מ 1 (של מניית 1 M 100 μl) | ||
| 10 מ"מ EGTA (2 מיליליטר של M 0.5 מלאי) | ||
| NP40 0.1% (1 מיליליטר של מניית 10%) | ||
| 2 O ל 100 מיליליטר H סופי |
טבלת 1. הרכב של מאגרים.
Discussion
שיטת טיהור זיקת טנדם (TAP) מציעה פרוטוקול טיהור כפול המאפשר בידוד והעשרה של קומפלקסי חלבונים באמצעות שני צעדי טיהור זיקה עצמאיים. העיצוב של תג TAP אינו מוגבל למה שמוצג בפרוטוקול זה, תחומים אחרים חלבון מחייב ומוטיבים חלים גם אם תנאי חיץ מותאמים בהתאם. דוגמא טובה לתגי TAP אחרים היא תג GS-TAP, שילוב של חלבון G ומוטיב מחייב streptavidin, שעוצב על ידי קבוצת ג'וליו של Superti-Furga שמטרתה מורכבת חלבון טיהור בשורות תאי יונקים בתרבית 18. GS-TAP מאוחר יותר הותאם לחקור את האינטראקציה בין חלבונים בתאי דרוזופילה S2 ועוברים 19. פרסום יופיטר האחרון על ידי ביילי et al. הוכיח עד כמה הליך GS-TAP בוצע עם lysate תרבית תאי 20. כאן הצגנו את השימוש בTAP התג ברקמות עצביות דרוזופילה (מודעהראשי ult) להקרנת proteomic בקנה מידה גדולה. פרוטוקול זה יכול להיות פוטנציאל מותאם לרקמות אחרות המאפשרות איסוף דגימה בקנה מידה גדולה, כגון עוברים. גם הגופים הבוגרים שנאספו במסננת העליונה (שלב 2.3.2.3) עשויים לשמש לTAP, אשר יכולה להיות משימה מאתגרת מאוד. מאגר תמוגה חייב להיות שונה והתנה לעכב פרוטאזות מסיביות הנמצאות במערכת העיכול וברוב הליך הטיהור הראשון יקוצרו באופן משמעותי על מנת לצמצם את זמן החשיפה של החלבונים לפרוטאזות. למרות תגי TAP שונים דורשים handlings שונה ותנאי חיץ לpurifications זיקה, העקרונות הכלליים לTAP הם אותו הדבר. להלן לדון בעניינים שישפיעו על איכות תוצאות של ברז.
הצלחתה של גישת TAP תלויה ביצירת transgene הנכון. ראשית, תג TAP עצמו אסור לשנות את קונפורמציה הכוללת של חלבון הפיתיון, שהוא קריטי כדי לשמר את יכולתהכדי לקיים אינטראקציה עם השותפים המחייבים הפיסיולוגיים שלו. לכן, זה הכרחי כדי להחליט לאן למזג את תג TAP לגן של עניין. ההחלטה יכולה להתבצע על בסיס מחקרים קודמים של החלבון, במיוחד מידע על המבנה שלה או transgenes מתויג epitode הפונקציונלי. במקרה מידע כזה אינו זמין, תיוג חלבון הפיתיון בN-או C-מסוף במקביל מומלץ. לאחר מכן ניתן לבצע ניסויי הצלה תפקודיים כדי לקבוע אילו transgene אמור לשמש. שנית, רמות הביטוי של החלבון המהונדס צריכה להיות קרובים לזה של חלבון אנדוגני. הדבר חשוב במיוחד, שכן מערכת Gal4/UAS בדרך כלל לנהוג הביטוי של transgene בעיתוי שונה וברמה הרבה יותר גבוהה בהשוואה לחלבונים אנדוגניים, אשר עשוי גם להגדיל את תוצאות חיוביות שגויות או לגרום לתוצאות בלתי צפויות המשנות את הפרופיל של האינטראקציה החלבון רשתות בתאים. לדוגמא, חלבוני פיגומי overexpressing יכולים קאוסדואר השפעות שליליות דומיננטיות וחלבונים ביתר שיש להם פעילות האנזימטית, כגון קינאזות, פעמים רבות לגרום לתופעות לזכות-of-פונקציה, אשר שניהם עשוי בתורו משפיעות על היכולת של השותפים המחייבים אנדוגני שלהם כדי לתקשר איתם. לפיכך, יש להימנע מערכת Gal4/UAS כאשר העיתוי ורמת הביטוי של הגן של עניין היא קריטי לשמירה על אינטראקציות אנדוגני שמציגים רק בתנאים רגילים. במקום זאת, הביטוי של transgene מתויג TAP צריך להיות מבוקר תחת האמרגן שלה. זו יכולה להיות מושגת או על ידי החלפת רצף כטב"מ עם הרצף של פרומוטר אנדוגני, או על ידי פיוזינג רצף TAP במסגרת עם רצף exonal בקטע DNA גנומי המכיל את כל הלוקוסים של הגן של עניין 21. במקרים מסוימים, ניסוי TAP יכול להתבצע באובדן רקע מוטציה פונקציה של הגן של עניין להפחית את התחרות מחלבון אנדוגני לincorporating למתחמי multiprotein. למשל זה, רקע null חלבון, אם הוא זמין, מספק את התנאים אידיאליים כדי לחסל את חלבון אנדוגני לחלוטין. שימוש ברקע המוטציה הגנטי תמיד יגדיל את הסיכוי לייצר תוצאות באיכות גבוהה יותר.
מסיסות של חלבון הפיתיון היא גורם מכריע נוסף להצלחה. חומרי ניקוי Nonionic משמשים בדרך כלל במאגר תמוגה לפזר את קרום הפלזמה ולשמר את החלבון מורכב, מסיס ושלמה, במעמד שהוא קרוב לסביבה הפיזיולוגית. עם זאת, תלוי אם או לא חלבוני עניין הם חלבונים או הקשורים משולב קרום, את ההרכב ואת הריכוז של חומרי ניקוי nonionic יכולים להיות קריטיים לsolubilizing חלבון הפיתיון. .1-0.3% NP40 הוא לעתים קרובות מספיק כדי solubilize חלבוני cytosolic. לחלבונים בממברנה, לעתים נדרש שילוב של NP40 (0.1-1%), NaDOC (0.1-1%), וTriton-X 100 (.05-0.5%) לsolubiליזה ולהעשיר מספיק חלבונים לצורך הניסוי ברז. עם זאת, מאחר שמאגר תמוגה מחמיר נוטה לשבש חלבונים אינטראקציות חלשות, איזון צריך להיות הגיע שבחלבוני פיתיון מספיק מסיסים נמצאים במדגם ובו בזמן שרוב האינטראקציות בין חלבונים נשמרים. עיקרון כללי הוא שתמיד מנסה להשתמש בסוגים הקטן ביותר של חומרי ניקוי עם הריכוז הנמוך ביותר.
כדי להקל על פתרון בעיות, מומלץ מאוד לשמור aliquot קטן של מדגם מכל צעד של שני purifications. הכתמה לאחר SDS-PAGE וחלבון / ניתוח מערבי על aliquots לאפשר הרמות של חלבון הפיתיון וההעשרה הרציף של מיני חלבון מסוימים כדי להיות במעקב. לדוגמא, אם ירידה פתאומית של חלבון הפיתיון זוהתה בaliquot של הזרימה החוצה לאחר מחשוף TEV (הצעד 3.3.3), סביר להניח שחלבון הפיתיון אבדו במהלך הכביסה חרוז IgG (צעד 3.1.4) . Possסיבה נראית עשויה להיות בהרכב חומרי הניקוי הלקוי של חיץ הכביסה IgG. יש ירידה חדה בהרכב ואת הריכוז של חומרי הניקוי בכביסת חיץ IgG (0.1% NP-40 בלבד) בהשוואה למאגר תמוגה. חלבון הפיתיון עשוי להיות רגיש לשינויים אלה ולהתנער ממחצית IgG בחרוזים. התאמת הכביסה IgG כלפי מאגר תמוגה עשויה לעזור לפתור את הבעיה. לחלופין, אם כי פחות סביר, מחשוף TEV (שלב 3.2) אולי לא עבד מספיק כדי לשחרר את הקומפלקס המכיל פיתיון מחרוזי IgG. הצעדים שווים בדיקה שנייה הם האיזון של חרוזים IgG עם חיץ TEV (צעד 3.2.1) ופעילות האנזימים, טיפול שגוי עלול להקהות את האנזים.
זכור כי גם עם טיהור שני שלבים, עדיין יהיו תוצאות חיוביות שגויות וחלבונים, כי הם הורידו את nonspecifically הווה במתחם מטוהר TAP הסופי. דרך אחת לזהות אינטראקציות ספציפיות האלה, בלפחות באופן חלקי, הוא לכלול ברז שליטה באמצעות transgene TAP בלבד במקביל למתויג TAP-transgene בניסויים טיהור TAP. חלבונים שזוהו בהליך-TAP רק צריכים להסיר מהרשימה שזוהתה בטיהור TAP-transgene.
TAP מוצלח יטהר תערובת של חלבונים הקשורים באופן פוטנציאלי עם החלבון של עניין in vivo. השלב הבא הוא זיהוי המולקולרי של החלבונים האלה, וספקטרומטריית המסה משמשת בדרך כלל למטרה זו. בהתאם לתוצאות מ- SDS והצרכים של הניסוי, ניתן לקבוע את זהותם המולקולרית בקומפלקס החלבון מטוהר בשתי הדרכים הבאות: 1) כל להקת חלבון בודדת ניתן לגזור מן הג'ל ונתון נמוך LC-MS/MS מורכבות, או 2) שבריר elute המכיל את תכולת חלבון השיא (בדרך כלל elution השני) יכול להיות חשוף ישירות לLC-MS/MS בינוני מורכב. כגון עמ 'יריית אקדחגישת roteomic פוטנציאלית תהיה לזהות את כל החלבונים במתחם, בהתאם לטווח הדינמי של ציוד MS 22.
לסיכום, אנו מציגים שיטה לזיהוי אינטראקציות בין חלבונים ברקמות עצביות של האורגניזם מודל גנטי - זבוב הפירות. ישנם מספר היתרונות של יישום שיטת TAP לזבוב: 1) יש זבובי פירות מחזור חיים קצרים, כך שזה יחסית קל ומהיר כדי לייצר זבובים מהונדסים ולהשיג רקמות בכמות גדולה; שניהם חיוניים לTAP גישה; 2) הגנום לטוס מבואר באופן מלא ומכיל 70% מהגנים הגורמים למחלות בבני אדם: 3) והכי חשוב, קל לאמת מבחינה תפקודית ולאפיין את מועמד אינטראקציה חלבונים בזבובים. יש משאבים מקיפים זמינים בקהילת מחקר זבוב על האפיון של גן מסוים, כגון איסוף RNAi מבוסס מהונדס שימושי ללמוד רקמות ספציפיות אובדן-of-פונקציה של רוב של הגןים, אללים מוטנטים חסר עבור רוב הלוקוסים גנטיים, כמו גם שיבוטים cDNA וtransgenes שימושי עבור מחקרי רווח של הפונקציה. אנו מאמינים ששיטת TAP הזבוב תהיה תוספת רבת ערך לארגז הכלים המשמש במעבדות לטוס. במבט לעתיד, שיטה זו יכולה להיות משולבת עם פרדיגמות התנהגותי לטוס ומודלים אנושי מחלות למסך השינוי ברשת אינטראקציה בין חלבונים בתגובה לתנאים וגירויים ספציפיים.
Disclosures
יש המחברים אין לחשוף.
Acknowledgements
אנו מודים EUROSARF ששלח לנו פלסמידים ביטוי השמרים TAP. אנו מודים גם למערכת עזרה מLabadens ריאן. עבודה זו נתמכה על ידי מענק NIH / NINDS (R01NS070962) לCW
Materials
| Name | Company | Catalog Number | Comments |
| U.S.A. standard test sieve No. 25 | Fisher Scientific | 04-881-18 | |
| U.S.A. standard test sieve No. 40 | Fisher Scientific | 04-881-21 | |
| Kontes Dounce Tissue Grinders 15 ml | Kimble Chase | 885300-0015 | |
| IgG sepharose beads | Pharmacia | 17-0969-01 | |
| Econo-column 0.7 cm x 20 cm | Bio-Rad | 737-4721 | |
| Econo-column 0.5 cm x 15 cm | Bio-Rad | 737-4716 | |
| Calmodulin beads | Stratagene | 214303 | |
| Coors Mortar and Pestle | CoorsTek | 60311 | |
| AcTEV Protease | Invitrogen | 12575-015 | |
| Protease Inhibitor Cocktail | Roche | 11836153001 | |
| Protease Inhibitor Mix | Sigma | P8340 |
References
- Rigaut, G., et al. A generic protein purification method for protein complex characterization and proteome exploration. Nat. Biotechnol. 17, 1030-1032 (1999).
- Collins, S. R., et al. Toward a comprehensive atlas of the physical interactome of Saccharomyces cerevisiae. Mol. Cell. Proteomics. 6, 439-450 (1074).
- Gavin, A. C., et al. Proteome survey reveals modularity of the yeast cell machinery. Nature. 440, 631-636 (2006).
- Krogan, N. J., et al. Global landscape of protein complexes in the yeast Saccharomyces cerevisiae. Nature. 440, 637-643 (2006).
- Forler, D., et al. An efficient protein complex purification method for functional proteomics in higher eukaryotes. Nat. Biotechnol. 21, 89-92 (2003).
- Veraksa, A., Bauer, A., Artavanis-Tsakonas, S. Analyzing protein complexes in Drosophila with tandem affinity purification-mass spectrometry. Dev. Dyn. 232, 827-834 (2005).
- Li, Y. The tandem affinity purification technology: an overview. Biotechnol. Lett. 33, 1487-1499 (2011).
- Volkel, P., Le Faou, P., Angrand, P. O. Interaction proteomics: characterization of protein complexes using tandem affinity purification-mass spectrometry. Biochem. Soc. Trans. 38, 883-887 (2010).
- Xu, X., et al. The tandem affinity purification method: an efficient system for protein complex purification and protein interaction identification. Protein Expr. Purif. 72, 149-156 (2010).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118, 401-415 (1993).
- Bachmann, A., Knust, E. The use of P-element transposons to generate transgenic flies. Methods Mol. Biol. 420, 61-77 (2008).
- Puig, O., et al. The tandem affinity purification (TAP) method: a general procedure of protein complex purification. Methods. 24, 218-229 (2001).
- Candiano, G., et al. Blue silver: a very sensitive colloidal Coomassie G-250 staining for proteome analysis. Electrophoresis. 25, 1327-1333 (2004).
- Tian, X., Wu, C. The role of ubiquitin-mediated pathways in regulating synaptic development, axonal degeneration and regeneration: insights from fly and worm. J. Physiol. , (2013).
- Wu, C., Wairkar, Y. P., Collins, C. A., DiAntonio, A. Highwire function at the Drosophila neuromuscular junction: spatial, structural, and temporal requirements. J. Neurosci. 25, 9557-9566 (2005).
- Wu, C., Daniels, R. W., DiAntonio, A. DFsn collaborates with Highwire to down-regulate the Wallenda/DLK kinase and restrain synaptic terminal growth. Neural Dev. 2, 16 (2007).
- Tian, X., Li, J., Valakh, V., DiAntonio, A., Wu, C. Drosophila Rae1 controls the abundance of the ubiquitin ligase Highwire in post-mitotic neurons. Nat. Neurosci. 14, 1267-1275 (2011).
- Burckstummer, T., et al. An efficient tandem affinity purification procedure for interaction proteomics in mammalian cells. Nat. Methods. 3, 1013-1019 (2006).
- Kyriakakis, P., Tipping, M., Abed, L., Veraksa, A. Tandem affinity purification in Drosophila: the advantages of the GS-TAP system. Fly. 2, 229-235 (2008).
- Bailey, D., Urena, L., Thorne, L., Goodfellow, I. Identification of protein interacting partners using tandem affinity purification. J. Vis. Exp. (60), e3643 (2012).
- Wu, Y., et al. A Drosophila model for Angelman syndrome. Proc. Natl. Acad. Sci. U.S.A. 105, 12399-12404 (2008).
- Liao, L., McClatchy, D. B., Yates, J. R. Shotgun proteomics in neuroscience. Neuron. 63, 12-26 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved