Administration d'agents expérimentaux I
source : Kay Stewart, RVT, RLATG, CMAR ; Valerie A. Schroeder, RVT, RLATG. Université de Notre Dame, IN
que de nombreux protocoles de recherche exigent qu’une substance être injectées à un animal, l’itinéraire de livraison et la quantité de la substance doit être déterminée avec précision. Il existe plusieurs voies d’administration chez la souris et le rat. Quel itinéraire à utiliser est déterminée par plusieurs facteurs de la substance à doser : le pH de la solution, le volume nécessaire pour le dosage désiré et la viscosité de la solution. Lésions tissulaires graves peuvent se produire si une substance est administrée correctement. Cette vidéo se penche sur les diverses méthodes de retenue et de détails techniques pour les plus couramment utilisés itinéraires injection.
beaucoup les composés d’essai qui sont utilisés en recherche biomédicale sont des substances nouvelles qui ne sont pas disponibles dans le commerce, substance bonne préparation est indispensable. Les préoccupations fondamentales de stérilité, viscosité et compatibilité physiologique de la formulation de la substance d’essai et le medium-véhicule-dans ce qui est dissous/suspendu doit être adressée. Une solution de dosage, donné entérale ou parentérale, doit être physiologiquement tamponnée au pH adéquat pour le composé doit être correctement absorbée et afin d’éviter des lésions tissulaires. La viscosité d’une solution peut être le facteur déterminant de la voie d’injection. Une substance qui est trop épaisse pour traverser l’aiguille de petit calibre requis pour les sites d’injection couramment utilisés dans une souris peut exiger la reformulation pour administration par voie orale. Toutes les solutions qui devront être injectés par voie parentérale doivent être stériles pour empêcher l’introduction d’agents pathogènes dans l’animal. 1
sélection des aiguilles pour les injections s’appuie sur la voie d’administration, la viscosité de la solution et la taille de l’animal. En général, le plus petit calibre possible d’administrer la solution doit être retenue ; Il s’agit habituellement 22-30 jauge chez la souris et le calibre de 20-25 pour le rat. La seringue à choisir est encore le plus petit possible avec les graduations correctes permettant un dosage précis. 2,3,4
il y a plusieurs itinéraires pour les injections par voie parentérale. Dans le but de cette vidéo, les itinéraires plus couramment utilisés (sous-cutanée [SQ], [IP] intrapéritonéale, intraveineuse [IV] et intramusculaire [IM]) sont discutées. Autres techniques d’injection, par exemple intradermique (ID), intracrânienne, intracardiaque, injections de coussinet plantaire, par voie nasale et par voie intraveineuse par l’intermédiaire du plexus rétro-orbitaire sont couverts dans une vidéo différente.
le taux d’absorption des composés varie en fonction de l’itinéraire. La voie IV place la substance directement dans la circulation sanguine, éliminer tout le temps nécessaire pour l’absorption. Une substance qu'injectée IM est rapidement absorbé en raison du nombre abondant des vaisseaux dans les tissus musculaires. Bien qu’une injection Intrapéritonéale est considéré comme l’administration par voie parentérale, le mécanisme d’absorption est effectivement plus semblable à l’administration par voie orale. Le dosage sous-cutané est un moyen pratique de gérer une grande quantité de liquide. Le taux d’absorption est plus lent que les autres routes, fournissant un effet durable. Le choix de l’itinéraire est un élément essentiel du protocole expérimental. 4
administration sous-cutanée met les matériaux entre les couches de la peau et le muscle-dans un espace virtuel créé en soulevant la peau. Ceci donne l’injection sécuritaire de plus gros volumes, car le liquide est absorbé lentement et l’excès de liquide est rapidement excrété par les reins. Cela évite la surcharge hydrique et oedème pulmonaire, qui peut entraîner de gros volumes, être injectés par voie intraveineuse. L’aiguille sélectionnée doit être la plus petite possible de taille qui permettra pour la viscosité de la matière injectée, généralement un 22-30 jauge aiguille pour souris et aiguille pour les rats de calibre 22-25. Volumes d’injection varient de 0,1 ml à 0,5 ml pour les souris et de 0,1 ml à 1,0 ml pour les rats, par site d’injection.
the IP route est couramment utilisé chez les rongeurs, car il peut être utilisé pour l’acheminement de plus gros volumes qu’une voie IV ou IM. Toutefois, l’absorption d’un matériau qui est administré IP est considérablement plus lente qu’un IM ou IV itinéraire. Substances administrées avec cette méthode sont pensés pour être soumis à un métabolisme hépatique avant d’entrer dans la circulation sanguine. 5 Encore une fois, l’aiguille sélectionnée doit être la plus petite possible de taille qui permettra pour la viscosité de la matière injectée, généralement un 22-30 jauge aiguille pour souris et aiguille pour les rats de calibre 22-25. Pour les souris, plage de volumes d’injection de 0,05 ml à 1,0 ml par injection selon la taille de la souris. Pour les rats, la gamme est de 0,1 ml à 1,5 ml par site d’injection.
injections IM, bien que couramment utilisés chez les animaux plus gros, ont des utilisations minimales chez les souris et les rats en raison de leur faible masse musculaire. Incorrecte ou répétée injection dans le muscle peut provoquer des lésions nerveuses entraînant une nécrose musculaire ou de paralysie. L’aiguille sélectionnée doit être la plus petite possible de taille qui permettra pour la viscosité de la matière injectée, généralement de calibre de 27-30. Pour les souris, gamme de volumes injection de 0,01 ml à un maximum de 0,05 ml par site d’injection pour le muscle fessier. Volumes d’injection pour le gastrocnémien disposent d’un maximum de 0,05 ml. En revanche, rat injection volumes entre 0,01 ml et un maximum de 0,3 ml par site d’injection pour le muscle fessier. Volumes d’injection pour le gastrocnémien disposent d’un maximum de 0,1 ml.
injection IV est le moyen le plus efficace de l’administration de la substance, tel qu’il est présenté immédiatement dans le système circulatoire. Cependant, avec les vaisseaux sous-dimensionné disponibles pour le IV dosage chez la souris, son utilité est limitée. Si répété l’administration intraveineuse est nécessaire, l’utilisation de ports d’accès vasculaire ou autres équipements spécialisés de dosage doit envisager pour le bien-être des animaux. L’aiguille sélectionnée doit être la plus petite possible de taille qui permettra pour la viscosité de la matière injectée, généralement de calibre de 27-30. Gamme de volumes injection de 0,05 ml à un maximum de 0,5 ml par injection, selon la taille de la souris.
| route | souris | Rat | |||
| aiguille de calibre (g) | Volume d’injection (mL) | aiguille de calibre (g) | levolume d’Injection (mL) | ||
| SC | 22 – 30 | 0,1 – 1.5 | 22 – 25 | 0,1 – 3.0 | |
| IP | 22 – 30 | 0,05 – 1.0 | 20 – 25 | 0,1 – 1.5 | |
| IM | 27 – 30 | 0,01 – 0,05 (fessiers/gastrocnémien) | 25 – 27 | 0,01-0,3 (fessier) 0,01 à 0,1 (gastrocnémien) | |
| IV | 27 – 30 | 0 .05 – 0,5 | 22 – 25 | 0.05 – 4.0 | |
tableau 1. L’aiguille appropriée jauge et injection plage de volume pour souris et rats selon le circuit.
1. injection sous-cutanée
- manuellement restrain la souris via le dispositif de retenue une main tenir. Une fois saisi, laisser la souris pour se reposer sur une table ou toute autre surface sécurisée. Veillez à ne pas faire pression sur le corps de la souris.
- Reposer le talon de la main sur la table pour éviter trop de poids sur la souris qui peut compromettre la respiration. Souris peuvent également être maintenues dans un appareil commercial. Pour les rats, il est préférable d’utiliser un dispositif de retenue commerciale.
- Saisir la peau et tirer vers le haut pour créer une tente de peau. Si vous utilisez un dispositif de retenue, les pinces peuvent devoir saisir la peau à travers la fente sur le dessus.
- Insérer l’aiguille parallèle à la colonne vertébrale, dirigée à l’opposé de la tête à la base du pli de la peau de la tente. Diriger l’aiguille loin de la tête pour éviter les risques de crevaisons sur le crâne, comme l’OS crânien de la souris est très mince. Les rats ont la tendance à l’arrière de leur tête, ce qui pourrait causer l’injection doit être déposé dans les muscles du cou.
- Insérer le biseau de l’aiguille vers le haut pour permettre une douce glisse dans la peau. Notez que l’aiguille est insérée sous les doigts de préhension de la peau. Pour améliorer la sécurité lors de l’injection d’articles biologiques, la peau est saisie avec une pince, éliminant ainsi la possibilité de blessures par piqûre d’aiguille.
- Tirer le piston pour vérifier l’emplacement approprié. Si l’air est aspiré dans la seringue, il indique que la pointe de l’aiguille n’est pas placée sous la peau et devront être retirés et repositionné. S’il y a une pression quand le piston est tiré vers l’arrière, elle indique le positionnement correct de l’aiguille, et que procéder à l’injection.
- Injecter lentement la substance avec un mouvement constant. Pour éviter la perte de l’article de l’injection, pause après l’injection, légèrement tourner l’aiguille sous la peau et pincer la peau au point d’injection tout en retirant l’aiguille.
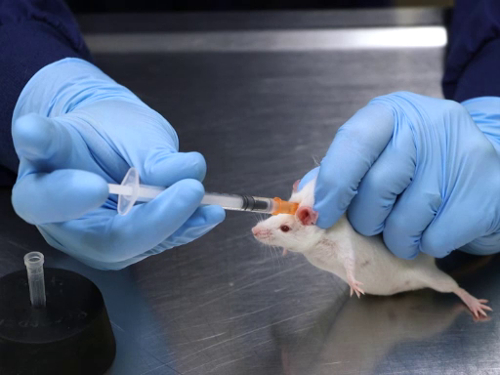
figure 1. Injection sous-cutanée chez les souris.
2. injection intrapéritonéale
- la méthode retenue manuelle avec une seule main est utilisée pour cette technique d’injection chez les souris. Ajuster la main, c’est elle placée assez haut sur le cou pour empêcher la souris de tourner.
- Saisir la peau lâche au niveau de la nuque entre le pouce et l’index.
- Stabiliser la croupe en l’épinglant la peau lâche le long du dos entre les deuxième, troisième et quatrième doigts et à la base du pouce, ou en plaçant la queue entre les troisième et quatrième doigts.
- IP injection chez le rat nécessite deux personnes, l’un visant à empêcher le rat et l’autre pour effectuer l’injection.
- Saisir le rat sur les épaules à l’aide de l’index et le majeur de chaque côté du cou et de la paume sur le dos. Le pouce et les troisième et quatrième doigts doivent encercler la poitrine pour éviter tout mouvement vers l’avant ou vers l’arrière. La position des doigts sur chaque côté du cou empêchera le rat de tourner sa tête.
- Lever le rat et tournez-la pour exposer l’abdomen ventral.
- Stabiliser la croupe en saisissant les pieds et la queue en toute sécurité et en étendant loin du corps.
- Position de la souris ou le rat pour exposer l’abdomen, en veillant à ce qu’il doit faire face vers le haut.
- Tilt l’animal avec la tête vers le bas à un angle de 30°, afin de permettre les intestins à tomber vers l’avant.
- Sites d’injection sont les suivants :
- la zone à injecter est parotidien bordée par une ligne imaginaire qui s’étend horizontalement à travers le corps en haut de la hanche (de flanc à flanc).
- La ligne médiane est la frontière médiale, reconnue comme étant l’intersection de poils qui poussent dans des directions opposées. Chez les animaux sans poil, la ligne médiane s’étend en ligne droite de la xiphoïde jusqu'à l’anus.
- Le bord latéral est une ligne du dessus de la hanche au prépuce chez l’homme et du haut de la hanche et à la suite les mamelles chez la femelle.
- Cela fournit une zone triangulaire pour la sécurité des injections.
- Injection d’un article dans les monuments
- Insérer une aiguille perpendiculairement à la colonne vertébrale, de la ligne médiane, dans le triangle comme décrit ci-dessus. Placer l’aiguille à un angle de 90° sur le plan du corps permet d’injection sécuritaire utilisant les deux côtés de l’abdomen. Ceci est particulièrement important pour les injections multiples, car elle minimise le traumatisme tissulaire en permettant l’alternance des sites d’injection.
- Lorsque l’aiguille est placée à un angle de 90°, il sera " pop " dans l’abdomen, ce qui permet une détermination plus facile de la profondeur. C’est aussi un repère visuel et tactile que l’aiguille est correctement positionné.
- Aspirer la seringue afin d’assurer la mise en place dans la cavité péritonéale et non dans la vessie, intestin ou les structures vasculaires.
- Éviter l’injection direction caudale chez la souris mâle afin d’éviter d’administrer l’article dans le sac scrotal. Éviter d’injecter dans la tétine de la femelle afin d’éviter les traumatismes.

figure 2. Les points de repère pour une injection intrapéritonéale chez les souris.
3. injection intramusculaire
- retenue pour cette technique pour souris et rats nécessite deux personnes ou l’utilisation d’un tube de retenue. Décrite ici est une méthode d’une personne utilisant un dispositif de retenue.
- Placer l’animal dans le dispositif de retenue.
- Une fois que l’animal est dans le tube, saisir la queue afin de positionner l’animal avec les pattes arrière hors du tube.
- Saisir la peau du flanc à la partie crâniale du fémur pour allonger la jambe et empêcher la flexion de l’articulation fémoro.
- Le dispositif de retenue du poste alors qu’il se tienne sur la table avec l’animal ' s la tête dirigée vers le bas, ou posé sur la table pointé vers le corps du technicien pour permettre la stabilisation de l’appareil tandis que l’injection est effectuée.
- Sites d’injection est les suivantes : patte de la souris et le rat sont petites et les muscles fessiers (les muscles de la cuisse caudale) comprenant la plus grande masse musculaire dans le membre postérieur ; la deuxième plus grande masse musculaire dans le membre postérieur est le muscle gastrocnémien (le muscle du mollet). L’injection est faite sous l’angle caudal de la jambe.
- Localiser le fessier muscles masse postérieure sur le fémur. L’OS peuvent être palpé et le muscle grand est facilement ressenti.
- Noter que la ligne médiane de la jambe de la face postérieure relie le point de la pointe du jarret à la queue. Les cheveux souvent ont une crête où il s’agit ensemble, car il pousse dans des directions opposées des surfaces latérales et internes.
- Injections sont faites vers la face latérale de la cuisse de la ligne médiane. Cela réduit la probabilité d’endommager les nerfs et les vaisseaux sanguins situés sur la surface médiale de la jambe
- Injections faites dans le gastrocnémien sont font de la face postérieure et avec un examen attentif de l’emplacement de la veine saphène latérale.
- Injection d’un article dans les monuments
- Insérez l’aiguille perpendiculairement sur le fémur de la ligne médiane comme décrit ci-dessus, à une profondeur maximale de 5 mm pour le muscle fessier et un maximum de 3 mm pour le gastrocnémien.
- Pour éviter les traumatismes du muscle, des mouvement de l’aiguille dans le tissu doit être évitée. La seringue se tienne d’une façon qui ne nécessite pas de repositionnement de la main pour effectuer l’injection.
- Aspirer la seringue afin d’assurer le placement dans les muscles et pas dans un vaisseau sanguin.
- Injecter le matériau dans un mouvement continu et fluid. Ne pas injecter rapidement pour permettre une expansion lente du muscle. Injection rapide causera traumatisme tissulaire.
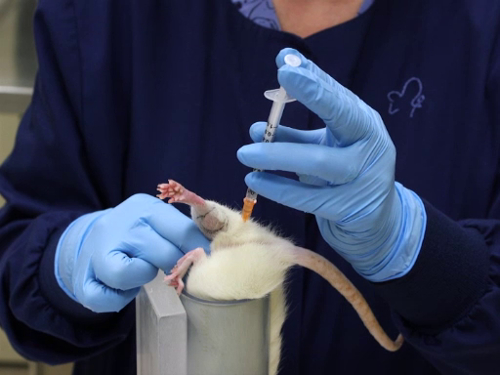
Figure 3. Injection intramusculaire dans le muscle fessier chez le rat.
4. injection intraveineuse utilisant la veine caudale
- retenue de l’animal est dépendant de la question de savoir si l’animal est anesthésié éveillé ou endormi.
Animaux
- utiliser un tube cylindrique de retenue pour conscientes souris ou de rats, à l’exception de la glabres ou nue. En raison du caractère gras des animaux sans poils, il est difficile repositionner et retirer les dynamiques de l’acryliques, car leur peau a tendance à adhérer au plastique rigide. Ainsi, un cône en plastique souple sert.
- Autres dispositifs d’injection incluent plates-formes éclairées et chauffées plates-formes des cônes en plastique rigides lorsque la souris est conservée dans le cône strictement avec la tension sur la queue.
- Souris Anesthetized ne peut-être pas besoin de retenue.
- Chauffer le corps tout entier ou juste la queue pour s’assurer de la vasodilatation des vaisseaux queue.
- Chauffer l’ensemble du corps avec un tampon de chauffage électrique défini sur moyen ou une couverture d’eau circulante.
- Placer l’animal dans le dispositif de retenue, enveloppé dans la source de chaleur.
- Observer l’animal de près et retirer du feu dès que les vaisseaux sanguins se dilatent. Réchauffement du corps entier peut également être réalisé avec l’utilisation d’une lampe chauffante réalisée dans une cage. Lorsque vous utilisez une lampe de chaleur les animaux doivent être étroitement respectées, comme il est facile de les surchauffer.
- Lorsque le réchauffement du corps entier n’est pas réalisable, la queue seule de chauffage peut être réalisé à l’aide de compresses chaudes, d’une porte-serviette chauffant, bouillotte, ou plonger la queue dans l’eau tiède. Mise en garde doit être employé pour éviter de brûler la queue parce que les bouteilles d’eau chaude, serviettes chauffés et eau chaude n’ont pas de contrôle de la température. Il est fréquent pour les sources de chaleur être chauffés au départ. Ces sources de chaleur aussi refroidissent rapidement.
- L’utilisation d’huile de tissu est une autre façon d’améliorer la visualisation des vaisseaux.
- Tremper un coton-tige dans l’huile de tissu et appliquez le puits de pétrole de la portion de la queue qui est saisie pour la stabilisation. L’huile de tissus provoque les vaisseaux à apparaître plus clairement défini.
- Il est des huiles non toxiques disponibles dans le commerce qui contiennent un produit chimique dans la formulation qui crée le réchauffement de la peau et la vasodilatation à l’évaporation. Ces huiles sont appliquées, et après quelques instants, quand les vaisseaux sont visibles, l’huile en excès est essuyé avec un tampon d’ouate.
- Toutes les huiles peuvent faire la queue plus difficile à tenir.
- Lorsque vous utilisez des huiles, l’injection doit avoir lieu immédiatement après la visualisation des vaisseaux.
- Sites d’injection sont les suivants :
- les nervures latérales arrière sont situés sur les côtés de la queue. Il y a aussi des bateaux qui longent les médianes dorsales et ventrales de la queue qui ne conviennent pas à des fins d’injection.
- L’animal dans la drisse peut être tourné pour que les vaisseaux latéraux sont vers le haut pour faciliter l’injection. Par ailleurs, la queue peut être tournée pour amener les vaisseaux à la position plus acceptable pour l’injection.
- Les vaisseaux sont très superficielles. Ils deviennent plus superficielles qu’ils atteignent la base de la queue.
- Injection d’un article dans la veine caudale requiert des compétences. Pour éviter les traumatismes au vaisseau sanguin, des mouvement de l’aiguille doit être évitée. La seringue est organisée d’une manière qui ne nécessite pas de repositionnement de la main pour effectuer l’injection.
- Positionner la queue pour que le navire soit visible et être maintenu sous tension. Ne pas appliquer une tension excessive sur la queue, ou le navire peut être étiré et le flux sanguin diminué.
- Placer l’aiguille directement sur le navire jusqu'à son extrémité distale possible.
- , Appliquer une légère pression et glisser l’aiguille dans le parallèle de la queue et les vertèbres. Éviter la pêche à la ligne de l’aiguille vers le bas, comme l’aiguille sera transect le navire. L’aiguille doit être visible dans le navire, tel qu’il est avancé au moins 2 mm dans la lumière.
- Injecter le matériau dans un mouvement lent, fluid pour éviter la rupture du récipient.
- Une attention particulière à la queue pendant l’injection. Si correctement insérées dans le navire, le matériel d’injection qui se jettent dans le navire se fait sentir aucune résistance. Le vaisseau sanguin doit blanchir comme le sang est poussé par le matériel d’injection.
- Si l’aiguille n’est pas dans le navire, il y aura forte résistance lors de l’injection. Si l’injection avec force, le matériau se remplira l’espace sous-cutané et la queue se gonfler. Arrêter immédiatement, comme matériau conçu pour être injecté par voie intraveineuse peut être corrosif pour les tissus environnants. Retirer l’aiguille et essayez une autre injection plus proche sur la queue.
- Après l’injection réussie, retirer l’aiguille et appliquez une pression sur le site d’injection afin d’assurer la bonne hémostase avant de regagner la cage de l’animal.
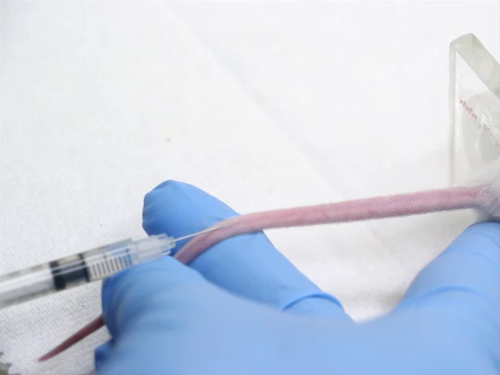
figure 4. Injection dans la veine chez des souris de queue.
administration de la substance est un composant commun des protocoles expérimentaux qui utilisent des animaux. Lors du choix d’un itinéraire de livraison, de nombreux facteurs doivent être délibérés, y compris les compétences techniques des personnes responsables pour le dosage des animaux, la taille de l’animal, la viscosité du fluide et la quantité à administrer. Un examen attentif de ces facteurs amélioreront le bien-être de l’animal et le résultat global de l’expérimentation.
- Turner, P.V., Pekow, C., Vasbinder, M. A. and Brabb, T. 2011. Administration of substances to laboratory animals: equipment and considerations, vehicle selection, and solution preparation. JAALAS. 50:5. 614-627.
- Shimizu, S. 2004. Routes of Administration in The Laboratory Mouse. Elsevier.
- Machholz, E., Mulder, G., Ruiz, C., Corning, B. F., Pritchett-Corning, K. R. 2012. Manual Restraint and Common Compound Administration Routes in Mice and Rats. J. Vis. Exp. (67), e2771, doi:10.3791/2771
- Turner, P. V., Brabb, T., Pekow, C., Vasbinder, M. A. 2011. Administration of substances to laboratory animals: routes of administration and factors to consider. JAALAS. 50, 600-613
Passer à...
Vidéos de cette collection:

Now Playing
Administration d'agents expérimentaux I
Lab Animal Research
99.9K Vues

Techniques de manipulation et de contention des rongeurs
Lab Animal Research
173.2K Vues

Soins de base
Lab Animal Research
27.6K Vues

Principes fondamentaux de l'élevage et du sevrage
Lab Animal Research
35.5K Vues

Techniques d'identification des rongeurs I
Lab Animal Research
54.4K Vues

Techniques d'identification des rongeurs II
Lab Animal Research
25.5K Vues

Administration d'agents expérimentaux II
Lab Animal Research
34.6K Vues

Administration d'agents expérimentaux III
Lab Animal Research
31.2K Vues

Administration d'agents expérimentaux IV
Lab Animal Research
51.2K Vues

Prélèvement d'échantillons de sang I
Lab Animal Research
170.7K Vues

Prélèvement d'échantillons de sang II
Lab Animal Research
72.7K Vues

Induction et maintien de l’anesthésie
Lab Animal Research
50.0K Vues

Recommandations pour la chirurgie des rongeurs
Lab Animal Research
22.3K Vues

Autopsie et prélèvement des tissus
Lab Animal Research
57.8K Vues

Prélèvement de tissus en conditions stériles
Lab Animal Research
34.7K Vues