ניהול מורכב I
Overview
מקור: קיי סטיוארט, RVT, RLATG, CMAR; ואלרי א. שרודר, אר.די.ג'י, אר-אל-ג'י. אוניברסיטת נוטרדאם, IN
כפי שפרוטוקולי מחקר רבים דורשים כי חומר יוזרק לתוך בעל חיים, יש לקבוע במדויק את מסלול הלידה ואת כמות החומר. ישנם מספר נתיבי ניהול זמינים בעכבר וחולדה. איזה מסלול להשתמש נקבע על ידי מספר גורמים של החומר להיות מוזרק: ה- pH של הפתרון, הנפח הנדרש עבור המינון הרצוי, ואת הצמיגות של הפתרון. נזק חמור לרקמות יכול להתרחש אם חומר מנוהל באופן שגוי. וידאו זה בוחן את שיטות האיפוק השונות ואת הפרטים הטכניים עבור נתיבי הזרקה הנפוצים ביותר.
Principles
כמו רבים של תרכובות הבדיקה המשמשים במחקר ביו-רפואי הם חומרים חדשניים שאינם זמינים מסחרית, הכנת חומר נכונה היא חיונית. יש לטפל בדאגות בסיסיות של סטריליות, צמיגות ותאימות פיזיולוגית של ניסוח תרכובת הבדיקה והבינונית או הרכב שבה היא מומסת/מושעית. פתרון מנונים, בין אם ניתן בכניסה או parenterally, חייב להיות חוצץ פיזיולוגית ל- pH הנכון כדי שהתרכובת תיספג כראוי ולמנוע פגיעה ברקמות. הצמיגות של פתרון עשויה להיות הגורם הקובע של מסלול ההזרקה. חומר עבה מדי כדי לעבור דרך מחט מד קטן הנדרש עבור אתרי הזרקה נפוץ בעכבר עשוי לדרוש רפורמה עבור ניהול אוראלי. כל הפתרונות שיש להזריק parenterally חייב להיות סטרילי כדי למנוע החדרת פתוגנים לתוך החיה. 1
בחירת מחט עבור זריקות מבוססת על מסלול הממשל, הצמיגות של הפתרון, ואת גודל החיה. באופן כללי, יש לבחור את המד הקטן ביותר שניתן לנהל את הפתרון; זה בדרך כלל 22-30 מד בעכבר ו 20-25 מד עבור החולדה. המזרק שייבחר הוא שוב הקטן ביותר האפשרי עם טקסי הסיום הנכונים הדרושים למינום מדויק. 2,3,4
ישנם מספר מסלולים עבור זריקות parenteral. לצורך וידאו זה, נדונים המסלולים הנפוצים ביותר (תת עורית [SQ], תוך-פריטיזונלי [IP], תוך ורידי [IV] ו- intramuscular [IM]). טכניקות הזרקה אחרות, כגון מקלעת תוך-עורית (ID), תוך גולגולתי, תוך-לב, זריקות משטח כף הרגל, תוך-גולגולתי, תוך ורידי באמצעות מקלעת רטרו-מסלולית מכוסים בסרטון אחר.
קצב הקליטה של תרכובות משתנה בהתאם לתוואי. מסלול העירוי ממקם את החומר ישירות לתוך זרם הדם, ומבטל את כל הזמן הדרוש לספיגה. חומר מוזרק IM נספג במהירות בשל מספר שופע של כלי בתוך רקמת השריר. למרות הזרקת IP נחשב ניהול parenteral, מנגנון הקליטה הוא למעשה דומה יותר מינון אוראלי. מנונים תת עוריים היא דרך נוחה לנהל נפח גדול של נוזלים. קצב הקליטה איטי יותר ממסלולים אחרים, ומספק אפקט מתמשך. בחירת המסלול היא מרכיב חיוני בפרוטוקול הניסויי. 4
ניהול תת עורי מציב את החומרים בין שכבות העור לבין השריר לתוך מרחב וירטואלי שנוצר על ידי הרמת העור. זה מאפשר הזרקה בטוחה של כרכים גדולים יותר, כמו הנוזל נספג לאט ואת הנוזל העודף מופרש במהירות דרך הכליות. זה מונע עומס יתר נוזלים בצקת ריאות, אשר יכול לנבוע כמויות גדולות להיות מוזרק תוך ורידי. המחט שנבחרה צריכה להיות בגודל הקטן ביותר האפשרי שיאפשר את הצמיגות של החומר המוזרק, בדרך כלל מחט 22-30 מד לעכברים ומחט 22-25 מד לחולדות. נפחי הזרקה נעים בין 0.1 מ"ל ל 0.5 מ"ל עבור עכברים, ו 0.1 מ"ל עד 1.0 מ"ל עבור חולדות, לכל אתר הזרקה.
נתיב ה- IP נמצא בשימוש נפוץ במכרסמים מכיוון שניתן להשתמש בו למסירה של אמצעי אחסון גדולים יותר מנתיב IV או IM. עם זאת, ספיגת החומר המנוהל IP היא איטית משמעותית כי מסלול IM או IV. חומרים מנוהלים בשיטה זו נחשבים להיות נתון חילוף החומרים בכבד לפני הכניסה למחזור הדם. 5 שוב, המחט שנבחרה צריכה להיות בגודל הקטן ביותר האפשרי שיאפשר את צמיגות החומר המוזרק, בדרך כלל מחט 22-30 מד לעכברים ומחט 22-25 מד לחולדות. עבור עכברים, נפחי הזרקה נעים בין 0.05 מ"ל ל 1.0 מיליליטר לכל הזרקה בהתבסס על גודל העכבר. עבור חולדות, הטווח הוא 0.1 מ"ל עד 1.5 מ"ל לכל אתר הזרקה.
זריקות IM, אם כי נפוץ בבעלי חיים גדולים יותר, יש שימושים מינימליים בעכברים וחולדות בשל מסת השריר הקטנה שלהם. הזרקה לא נכונה או חוזרת ונשנית בשריר עלולה לגרום לנזק עצבי וכתוצאה מכך לשיתוק או לנמק שרירים. המחט שנבחרה צריכה להיות בגודל הקטן ביותר האפשרי שיאפשר את הצמיגות של החומר המוזרק, בדרך כלל 27-30 מד. עבור עכברים, נפחי הזרקה נעים בין 0.01 מ"ל למקסימום של 0.05 מ"ל לכל אתר הזרקה עבור שריר gluteal. נפחי הזרקה עבור gastrocnemius יש מקסימום של 0.05 מ"ל. לעומת זאת, נפחי הזרקת חולדה נעים בין 0.01 מ"ל למקסימום של 0.3 מ"ל לכל אתר הזרקה עבור שריר gluteal. נפחי הזרקה עבור gastrocnemius יש מקסימום של 0.1 מיליליטר.
הזרקת IV היא המסלול היעיל ביותר של מתן חומר, כפי שהוא הציג מיד לתוך מערכת הדם. עם זאת, עם כלי בגודל undersized זמין עבור מנונים IV בעכבר, התועלת שלה מוגבלת. אם נדרש ניהול תוך ורידי חוזר ונשנית, יש לשקול את השימוש בנמלי גישה לכלי דם או בציוד מנונים מיוחד אחר לרווחת בעלי החיים. המחט שנבחרה צריכה להיות בגודל הקטן ביותר האפשרי שיאפשר את הצמיגות של החומר המוזרק, בדרך כלל 27-30 מד. נפחי הזרקה נעים בין 0.05 מ"ל למקסימום של 0.5 מ"ל לכל הזרקה, בהתבסס על גודל העכבר.
| מסלול | עכבר | חולדה | |||
| מד מחט (גרם) | נפח הזרקה (מ"ל) | מד מחט (גרם) | נפח הזרקה (מ"ל) | ||
| SC | 22–30 | 0.1–1.5 | 22–25 | 0.1–3.0 | |
| IP | 22–30 | 0.05–1.0 | 20–25 | 0.1–1.5 | |
| הודעות מיידיות | 27–30 | 0.01–0.05 (גלוטל/גסטרוקנמיוס) | 25–27 | 0.01-0.3 (גלוטל)
0.01-0.1 (גסטרוקנמיוס) |
|
| הרביעי | 27–30 | 0.05–0.5 | 22–25 | 0.05–4.0 | |
טבלה 1. מד מחט וטווח נפח הזרקה מתאים לעכברים וחולדות בהתאם למסלול.
Procedure
1. הזרקה תת עורית
- לרסן את העכבר באופן ידני באמצעות אחיזת האיפוק ביד אחת. לאחר אחיזה, אפשר לעכבר לנוח על שולחן או על משטח מאובטח אחר. הקפד להימנע מהפעלת לחץ על גוף העכבר.
- הנח את עקב היד על השולחן כדי למנוע משקל מופרז על העכבר שיכול לסכן נשימה. עכברים יכולים להיות מרוסנים גם במכשיר מסחרי. עבור חולדות, עדיף להשתמש במכשיר איפוק מסחרי.
- לתפוס את העור, ולמשוך כלפי מעלה כדי ליצור אוהל של עור. אם אתם משתמשים במכשיר ריסון, ייתכן שיידרשו מלקחיים כדי לתפוס את העור דרך החריץ בחלק העליון.
- הכנס את המחט במקביל לעמוד השדרה, מכוון מהראש בבסיס קיפול העור של האוהל. כוון את המחט מהראש כדי למנוע את האפשרות של נקבים לגולגולת, כמו עצם הגולגולת של העכבר הוא דק מאוד. לחולדות יש נטייה להרים את ראשן, מה שעלול לגרום להזרקה להיות ממוקמת בשרירי הצוואר.
- הכנס את משופע המחט כדי לאפשר גלישה עדינה לתוך העור. שים לב כי המחט מוכנסת מתחת לאצבעות אוחזות בעור. כדי לשפר את הבטיחות בעת הזרקת מאמרים biohazardous, העור נתפס עם מלקחיים, ובכך מבטל את האפשרות של פציעות מקל מחט.
- משוך את הבוכנה כדי לבדוק מיקום נכון. אם האוויר נמשך לתוך המזרק, הוא מציין כי קצה המחט אינו ממוקם מתחת לעור ויהיה צורך לסגת ולמקם אותו מחדש. אם יש לחץ גב כאשר הבוכנה נמשכה לאחור, זה מצביע על מיקום נכון של המחט, וכי ההזרקה יכולה להמשיך.
- הזריקו את החומר לאט בתנועה קבועה. כדי למנוע אובדן של מאמר ההזרקה, להשהות לאחר הזרקה, לסובב מעט את המחט מתחת לעור, ולצבוט את העור באתר ההזרקה תוך משיכת המחט.
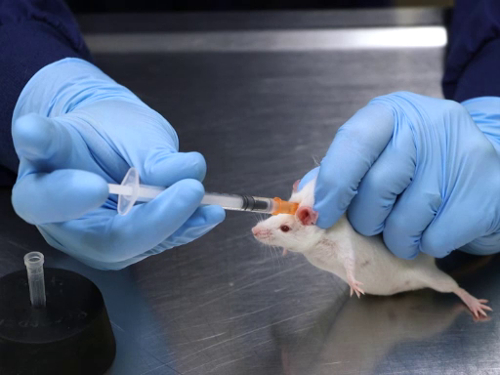
איור 1. הזרקה תת עורית בעכברים.
2. הזרקה תוך-איפריטונית
- שיטת הריסון הידנית ביד אחת משמשת לטכניקת הזרקה זו בעכברים. התאם את היד כך שהיא ממוקמת גבוה מספיק על הצוואר כדי למנוע מהעכבר להסתובב.
- תפוס את העור הרופף בעורף הצוואר בין האגודל לאצבע המורה.
- לייצב את הרבעים האחוריים על ידי הצמדת העור הרופף לאורך הגב בין האצבע השנייה, השלישית והרביעית ובסיס האגודל, או על ידי הצבת הזנב בין האצבע השלישית והרביעית.
- הזרקת ה- IP בחולדה דורשת שני אנשים, אחד לרסן את החולדה והשני לבצע את הזריקה.
- תפסו את החולדה מעבר לכתפיים באמצעות האינדקס והאצבעות האמצעיות בכל צד של הצוואר וכף היד על הגב. האגודל והאצבע השלישית והרביעית צריכים להקיף את החזה כדי למנוע תנועה קדימה או אחורה. מיקום האצבעות בכל צד של הצוואר מונע מהעכברוש לסובב את ראשו.
- הרם את החולדה וסובב אותו כדי לחשוף את הבטן הגחית.
- לייצב את הרבעים האחוריים על ידי אחיזת הרגליים והזנב בבטחה והרחבתם הרחק מהגוף.
- מקם את העכבר או החולדה כדי לחשוף את הבטן, להבטיח כי הוא פונה כלפי מעלה.
- הטה את החיה כשהראש מצביע כלפי מטה בזווית של כ-30 מעלות, כדי לאפשר למעיים ליפול קדימה.
- ציוני דרך הזרקה הם כדלקמן:
- האזור שיש להזריק גובל באופן cranially על ידי קו דמיוני המשתרע אופקית על פני הגוף בחלק העליון של הירך (מאגף לאגף).
- קו האמצע הוא הגבול הממצעי, המוכר כהיכן שהשיער צומח בכיוונים מנוגדים נפגש. בבעלי חיים חסרי שיער, קו האמצע משתרע בקו ישר מן xiphoid לפי הטבעת.
- הגבול לרוחב הוא קו מראש הירך אל ההקדמה בזכר, ומחלק העליון של הירך ולעקוב אחר הפטמות בנקבה.
- זה מספק אזור משולש להזרקה בטוחה.
- הזרקת מאמר בתוך ציוני הדרך
- הכנס מחט בניצב לעמוד השדרה, מחוץ לקו האמצע, במשולש כמתואר לעיל. הצבת המחט בזווית של 90 מעלות למישור הגוף מאפשרת הזרקה בטוחה המשתמשת בשני צידי הבטן. זה חשוב במיוחד עם זריקות מרובות, כפי שהוא ממזער טראומה רקמה על ידי מתן אפשרות לסירוגין של אתרי הזרקה.
- כאשר המחט ממוקמת בזווית של 90 מעלות, היא "תקפוץ" לתוך הבטן, ותאפשר קביעת עומק קלה יותר. זהו גם סימן חזותי ומישוש כי המחט ממוקמת כראוי.
- שאפו את המזרק כדי להבטיח מיקום בתוך חלל הצפק ולא בתוך שלפוחית השתן, המעי או מבני כלי הדם.
- הימנע הזרקת caudally בעכבר הגברי כדי למנוע מתן המאמר לתוך שק האשכים. הימנע הזרקה לתוך פטם של הנקבה כדי למנוע טראומה.

איור 2. ציוני הדרך להזרקה תוך-איפריטונית בעכברים.
3. הזרקה תוך שרירית
- איפוק לטכניקה זו עבור עכברים וחולדות דורש שני אנשים או שימוש בצינור ריסון. מתואר כאן היא שיטה של אדם אחד באמצעות מכשיר מרסן.
- הנח את החיה במכשיר האיפוק.
- ברגע שהחיה נמצאת בצינור, לתפוס את הזנב כדי למקם את החיה עם הרגליים האחוריות מתוך הצינור.
- לתפוס את העור של האגף בחלק הגולגולתי של עצם הירך כדי להאריך את הרגל ולמנוע את המחניק מכופף.
- מקם את מכשיר האיפוק כך שהוא עומד על השולחן כשראש החיה מכוון כלפי מטה, או שוכב על השולחן הצביע לכיוון גופו של הטכנאי כדי לאפשר ייצוב של המכשיר בזמן ביצוע ההזרקה.
- ציוני דרך הזרקה הם כדלקמן: הן העכבר והן רגל החולדה הם קטנים עם שרירי gluteal (שרירי הירך caudal) המרכיבים את מסת השריר הגדולה ביותר בגפה האחורית; מסת השריר השנייה בגודלה בגפיים האחוריות היא הגסטרוקנמיוס (שריר השוק). הזריקה עשויה מההיבט התקתק של הרגל.
- אתר את מסת שריר gluteal אחורית עד עצם הירך. העצם יכולה להיות מישוש ואת השריר הגדול מורגש בקלות.
- שים לב כי קו האמצע של הרגל מן ההיבט האחורי פועל מנקודת למשכן לזנב. לשיער יש לעתים קרובות רכס שבו הוא מתחבר, כפי שהוא גדל בכיוונים מנוגדים מן המשטחים לרוחב והפנימה.
- זריקות נעשות לכיוון ההיבט לרוחב של הירך מקו האמצע. זה מקטין את הסבירות לפגיעה בעצבים ובכלי הדם הממוקמים על פני השטח המתיווכים של הרגל.
- זריקות שנעשו לתוך gastrocnemius נעשים מן ההיבט האחורי עם התחשבות זהירה של המיקום של הווריד saphenous לרוחב.
- הזרקת מאמר בתוך ציוני הדרך
- הכנס את המחט בניצב עצם הירך את קו האמצע כמתואר לעיל, לעומק מרבי של 5 מ"מ עבור שריר gluteal מקסימום של 3 מ"מ עבור gastrocnemius.
- כדי למנוע טראומה לשריר, יש למנוע תנועה צפונית של המחט ברקמה. המזרק צריך להיות מוחזק באופן שאינו דורש מיקום מחדש של היד כדי לבצע את הזריקה.
- שאפו את המזרק כדי להבטיח מיקום בתוך השריר ולא בכלי דם.
- הזריקו את החומר בתנועה יציבה וזורמת. אין להזריק במהירות כדי לאפשר התרחבות איטית של השריר. הזרקה מהירה תגרום לטראומה ברקמות.
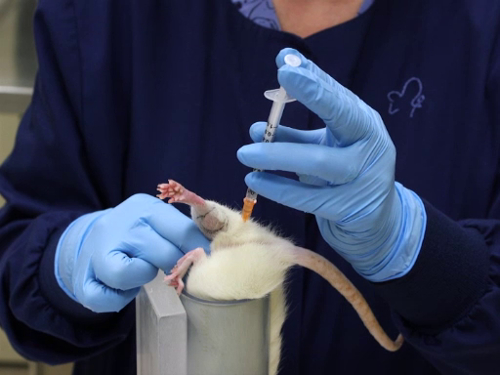
איור 3. הזרקה תוך שרירית לתוך שריר העכוז בחולדות.
4. הזרקה תוך ורידי ניצול וריד הזנב
- איפוק החיה תלוי בשאלה אם החיה היא מרדים או ער.
- השתמש צינור ריסון גלילי עבור עכברים מודעים או חולדות, למעט בעלי חיים חסרי שיער או עירום. בשל האופי השמנוני של בעלי החיים חסרי השיער, קשה למקם מחדש ולהסיר אותם מן מרסן אקריליק, כמו העור שלהם נוטה לדבוק פלסטיק נוקשה. לכן, חרוט פלסטיק גמיש משמש.
- התקני הזרקה אחרים כוללים פלטפורמות מוארות, פלטפורמות מחוממות וקונוסים מפלסטיק נוקשים שבהם העכבר נשמר בקונוס אך ורק עם מתח על הזנב.
- עכברים מרדים אולי לא יזדקקו לאיפוק.
- לחמם את כל הגוף או רק את הזנב כדי להבטיח vasodilation של כלי הזנב.
- מחממים את כל הגוף עם כרית חימום חשמלית על שמיכת מים בינונית או במחזור.
- מניחים את החיה במכשיר האיפוק, עטוף במקור החום.
- התבונן בחיה מקרוב, והסר אותה ממקור החום ברגע שכלי הדם מתרחבים. התחממות גוף שלם יכולה להיות מושגת גם עם שימוש במנורת חום המופנית לכלוב. בעת שימוש מנורת חום יש נצפים מקרוב, שכן קל לחמם אותם יתר על המידה.
- כאשר התחממות הגוף כולה אינה ריאלית, חימום הזנב לבדו יכול להיות מושגת באמצעות קומפרסים חמים ממגבות מחוממות, בקבוק מים חמים, או שקוע הזנב לתוך מים חמים. יש לנקוט משנה זהירות כדי להימנע משריפת הזנב מכיוון שלבקבוקי מים חמים, מגבות מחוממות ומים חמים אין בקרת טמפרטורה. זה נפוץ עבור מקורות החום להיות מחומם יתר על המידה בתחילה. מקורות חום אלה גם להתקרר במהירות.
- השימוש בשמן רקמות הוא דרך נוספת לשפר את ההדמיה של כלי הדם.
- טובלים אפליקטור עם קצה כותנה בשמן הרקמות, ומחילים את השמן הרחק מחלק הזנב הנאחז לייצוב. שמן הרקמה גורם לכלים להיראות מוגדרים בצורה ברורה יותר.
- ישנם שמנים לא רעילים זמינים מסחרית המכילים כימיקל בפורמולה היוצרת התחממות של העור ו vasodilation עם אידוי. שמנים אלה מוחלים, ולאחר כמה רגעים, כאשר כלי הדם נראים, השמן עודף נמחק עם כדור כותנה.
- כל השמנים יכולים להקשות על אחיזת הזנב.
- בעת שימוש בשמנים, ההזרקה חייבת להתבצע מיד עם הדמיה של כלי הדם.
- ציוני דרך הזרקה הם כדלקמן:
- ורידי הזנב הצדדיים ממוקמים בצדי הזנב. ישנם גם כלי הפועלים לאורך קו האמצע האחורי והיצוחני של הזנב שאינם מתאימים למטרות הזרקה.
- ניתן לסובב את החיה במרסן כך שהכלים לרוחב פונים למעלה להקל על הזרקה. לחלופין, הזנב יכול להיות הפוך כדי להביא את כלי למצב מקובל יותר עבור הזרקה.
- הכלים מאוד שטחיים. הם נעשים שטחיים יותר כשהם מגיעים לבסיס הזנב.
- הזרקת מאמר לתוך הווריד הזנב דורש מיומנות. כדי למנוע טראומה לכלי הדם, יש למנוע תנועה חוץ של המחט. המזרק מוחזק באופן שאינו דורש מיקום מחדש של היד כדי לבצע את הזריקה.
- מקם את הזנב כך שהכלי נראה ומוחזק תחת מתח. אין למרוח מתח מוגזם על הזנב, או שניתן למתוח את כלי הדם וזרימת הדם פוחתת.
- מניחים את המחט ישירות מעל הכלי ככל האפשר.
- הפעל לחץ קל ולהחליק את המחט לתוך הזנב במקביל לחוליות. הימנעו מלהעביר את המחט כלפי מטה, שכן המחט תקיף את כלי הדם. המחט צריכה להיות גלויה בכלי כפי שהוא מתקדם לפחות 2 מ"מ לתוך לומן.
- הזריקו את החומר בתנועה איטית וזורמת כדי למנוע קרע בכלי הדם.
- שים לב במיוחד לזנב במהלך ההזרקה. אם מוכנס כראוי לכלי, חומר ההזרקה הזורם לתוך כלי השיט מורגש ללא התנגדות. כלי הדם צריך לקשקש כמו הדם נדחף החוצה על ידי חומר ההזרקה.
- אם המחט אינה בכלי, תהיה התנגדות חזקה בעת הזרקה. אם מזריקים כוח, החומר ימלא את החלל התת עורי והזנב יתנפח. עצור מיד, כמו חומר שנועד להיות מוזרק תוך ורידי עשוי להיות קאוסטית לרקמות שמסביב. משוך את המחט, ולנסות זריקה נוספת יותר cranially על הזנב.
- לאחר הזרקה מוצלחת, למשוך את המחט ולהפעיל לחץ על אתר ההזרקה כדי להבטיח hemostasis טוב לפני החזרת החיה לכלוב.
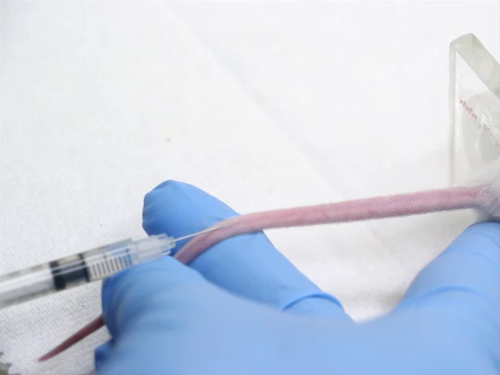
איור 4. הזרקת וריד זנב בעכברים.
Application and Summary
מתן חומרים הוא מרכיב נפוץ בפרוטוקולים ניסיוניים המשתמשים בבעלי חיים. בעת בחירת מסלול של משלוח, גורמים רבים חייבים להיות דנו, כולל מיומנות טכנית של אותם אנשים האחראים על מנונים את בעלי החיים, את גודל החיה, את הצמיגות של הנוזל, ואת הסכום שיש לנהל. התחשבות זהירה בגורמים אלה תשפר את רווחת החיה ואת התוצאה הכוללת של הניסוי.
Tags
Skip to...
Videos from this collection:

Now Playing
ניהול מורכב I
Lab Animal Research
101.4K Views

טכניקות טיפול וריסון מכרסמים
Lab Animal Research
176.1K Views

נהלי טיפול בסיסיים
Lab Animal Research
28.2K Views

יסודות הרבייה והנגייה
Lab Animal Research
35.9K Views

זיהוי מכרסמים I
Lab Animal Research
55.1K Views

זיהוי מכרסמים II
Lab Animal Research
25.8K Views

ניהול מתחם II
Lab Animal Research
35.2K Views

ניהול מתחם III
Lab Animal Research
31.7K Views

ניהול מורכב 4
Lab Animal Research
52.2K Views

נסיגת דם I
Lab Animal Research
172.9K Views

נסיגת דם II
Lab Animal Research
74.0K Views

אינדוקציה ותחזוקה של הרדמה
Lab Animal Research
51.1K Views

שיקולים לניתוח מכרסמים
Lab Animal Research
22.6K Views

אבחון נקרופסיה וקציר רקמות
Lab Animal Research
58.5K Views

קציר רקמות סטריליות
Lab Animal Research
35.0K Views
Copyright © 2025 MyJoVE Corporation. All rights reserved