Administração de Composto I
Fonte: Kay Stewart, RVT, RLATG, CMAR; Valerie A. Schroeder, RVT, RLATG. Universidade de Notre Dame, IN
Como muitos protocolos de pesquisa exigem que uma substância seja injetada em um animal, a rota de entrega e a quantidade da substância devem ser apuradas com precisão. Existem várias rotas de administração disponíveis no mouse e rato. Qual rota de uso é determinada por vários fatores da substância a ser injetada: o pH da solução, o volume necessário para a dosagem desejada e a viscosidade da solução. Danos graves nos tecidos podem ocorrer se uma substância for administrada incorretamente. Este vídeo analisa os vários métodos de contenção e detalhes técnicos para as rotas de injeção mais usadas.
Como muitos dos compostos de teste que são utilizados em pesquisas biomédicas são substâncias novas que não estão disponíveis comercialmente, a preparação adequada da substância é vital. Devem ser abordadas preocupações fundamentais de esterilidade, viscosidade e compatibilidade fisiológica da formulação do composto de teste e do veículo médio ou veicular em que está dissolvido/suspenso. Uma solução de dosagem, seja dada enterralmente ou parentalmente, deve ser fisiologicamente tamponada ao pH adequado para que o composto seja devidamente absorvido e para evitar lesões teciduais. A viscosidade de uma solução pode ser o fator determinante da rota da injeção. Uma substância muito grossa para passar pela agulha de bitola pequena necessária para os locais de injeção comumente usados em um rato pode exigir reformulação para administração oral. Todas as soluções que devem ser injetadas parentalmente devem ser estéreis para evitar a introdução de patógenos no animal. 1
A seleção de agulhas para injeções baseia-se na rota da administração, na viscosidade da solução e no tamanho do animal. Em geral, deve-se escolher o menor medidor viável para administrar a solução; este é geralmente 22-30 medidor no mouse e 20-25 medidor para o rato. A seringa a ser selecionada é novamente a menor possível com as graduações corretas necessárias para uma dosagem precisa. 2,3,4
Existem várias rotas para injeções parenterais. Para efeitos deste vídeo, são discutidas as rotas mais utilizadas (subcutâneo [SQ], intraperitoneal [IP], intravenosa [IV]e intramuscular [IM]). Outras técnicas de injeção, como intradérmico (ID), intracraniano, intracardiac, injeções de footpad, intranasal e intravenosa através do plexo retro-orbital são cobertas em um vídeo diferente.
A taxa de absorção dos compostos varia de acordo com a rota. A rota IV coloca a substância diretamente na corrente sanguínea, eliminando o tempo necessário para absorção. Uma substância injetada IM é rapidamente absorvida devido ao número abundante de vasos dentro do tecido muscular. Embora uma injeção de IP seja considerada administração parenteral, o mecanismo de absorção é, na verdade, mais semelhante à dosagem oral. A dosagem subcutânea é uma maneira conveniente de administrar um grande volume de fluido. A taxa de absorção é mais lenta do que outras rotas, proporcionando um efeito sustentado. A escolha da rota é um componente essencial do protocolo experimental. 4
A administração subcutânea coloca os materiais entre as camadas da pele e o músculo-em um espaço virtual criado pelo levantamento da pele. Isso permite a injeção segura de volumes maiores, pois o fluido é absorvido lentamente e o excesso de fluido é rapidamente excretado através dos rins. Isso evita sobrecarga de fluidos e edema pulmonar, o que pode resultar de grandes volumes sendo injetados por via intravenosa. A agulha selecionada deve ser o menor tamanho possível que permitirá a viscosidade do material injetado, geralmente uma agulha de calibre 22-30 para camundongos e uma agulha de calibre 22-25 para ratos. Os volumes de injeção variam de 0,1 ml a 0,5 ml para camundongos, e de 0,1 ml a 1,0 ml para ratos, por local de injeção.
A rota IP é comumente usada em roedores porque pode ser usada para a entrega de volumes maiores do que uma rota IV ou IM. No entanto, a absorção de material administrado IP é significativamente mais lenta que uma rota IM ou IV. Acredita-se que as substâncias administradas com este método sejam submetidas ao metabolismo hepático antes de entrar na corrente sanguínea. 5 Novamente, a agulha selecionada deve ser o menor tamanho possível que permitirá a viscosidade do material injetado, geralmente uma agulha de calibre 22-30 para camundongos e uma agulha de calibre 22-25 para ratos. Para camundongos, os volumes de injeção variam de 0,05 ml a 1,0 ml por injeção com base no tamanho do mouse. Para ratos, a faixa é de 0,1 ml a 1,5 ml por local de injeção.
As injeções de IM, embora comumente usadas em animais maiores, têm usos mínimos em camundongos e ratos devido à sua pequena massa muscular. A injeção imprópria ou repetida no músculo pode causar danos nos nervos, resultando em paralisia ou necrose muscular. A agulha selecionada deve ser o menor tamanho possível que permitirá a viscosidade do material injetado, geralmente calibre 27-30. Para camundongos, os volumes de injeção variam de 0,01 ml a um máximo de 0,05 ml por local de injeção para o músculo glúteo. Os volumes de injeção para o gastrocnemius têm um máximo de 0,05 ml. Em contraste, os volumes de injeção de rato variam de 0,01 ml a um máximo de 0,3 ml por local de injeção para o músculo glúteo. Os volumes de injeção para o gastrocnemius têm no máximo 0,1 ml.
A injeção intravenosa é a via mais eficaz da administração de substâncias, pois é introduzida imediatamente no sistema circulatório. No entanto, com os vasos subdimensionados disponíveis para dosagem intravenosa no mouse, sua utilidade é limitada. Se for necessária uma administração intravenosa repetida, o uso de portas de acesso vascular ou outros equipamentos especializados de dosagem deve ser considerado para o bem-estar dos animais. A agulha selecionada deve ser o menor tamanho possível que permitirá a viscosidade do material injetado, geralmente calibre 27-30. Os volumes de injeção variam de 0,05 ml a um máximo de 0,5 ml por injeção, com base no tamanho do mouse.
| Rota | Rato | Rato | |||
| Medidor de agulha (g) | Volume de injeção (mL) | Medidor de agulha (g) | Volume de injeção (mL) | ||
| SC | 22–30 | 0.1–1.5 | 22–25 | 0.1–3.0 | |
| IP | 22–30 | 0.05–1.0 | 20–25 | 0.1–1.5 | |
| IM | 27–30 | 0.01-0.05 (glúteo/gastrocnemius) | 25–27 | 0.01-0.3 (glúteo)
0.01-0.1 (gastrocnemius) |
|
| IV | 27–30 | 0.05–0.5 | 22–25 | 0.05–4.0 | |
Mesa 1. Medidor de agulha apropriado e faixa de volume de injeção para ratos e ratos, dependendo da rota.
1. Injeção subcutânea
- Contenha manualmente o mouse através do porão de contenção com uma mão. Uma vez apreendido, deixe o mouse descansar sobre uma mesa ou outra superfície segura. Certifique-se de evitar colocar pressão no corpo do mouse.
- Coloque o calcanhar da mão sobre a mesa para evitar um peso indevido no mouse que pode comprometer as respirações. Os ratos também podem ser contidos em um dispositivo comercial. Para ratos, é melhor usar um dispositivo de contenção comercial.
- Segure a pele, e puxe para cima para criar uma tenda de pele. Se usar um dispositivo de contenção, podem ser necessários fórceps para agarrar a pele através do slot na parte superior.
- Insira a agulha paralela à coluna vertebral, direcionada para longe da cabeça na base da dobra da pele da tenda. Direcione a agulha para longe da cabeça para evitar a possibilidade de perfurações no crânio, já que o osso do crânio do rato é muito fino. Os ratos têm a tendência de levantar a cabeça, o que pode fazer com que a injeção seja colocada nos músculos do pescoço.
- Insira a agulha para cima para permitir um deslizamento suave na pele. Note que a agulha está inserida abaixo dos dedos segurando a pele. Para melhorar a segurança ao injetar artigos de risco biológico, a pele é agarrada com fórceps, eliminando assim a possibilidade de lesões de agulha.
- Puxe o êmbolo para verificar se há uma colocação adequada. Se o ar for puxado para dentro da seringa, indica que a ponta da agulha não está posicionada sob a pele e precisará ser retirada e reposicionada. Se houver pressão traseira quando o êmbolo é puxado para trás, indica a colocação adequada da agulha, e que a injeção pode prosseguir.
- Injete a substância lentamente com um movimento constante. Para evitar a perda do artigo de injeção, faça uma pausa após a injeção, gire ligeiramente a agulha sob a pele e belisque a pele no local da injeção enquanto retira a agulha.
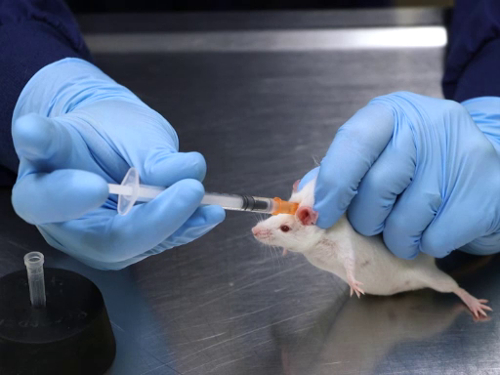
Figura 1. Injeção subcutânea em camundongos.
2. Injeção intraperitoneal
- O método de contenção manual com uma mão é usado para esta técnica de injeção em camundongos. Ajuste a mão de modo que esteja posicionada alta o suficiente no pescoço para evitar que o mouse vire.
- Segure a pele solta na nuca entre o polegar e o dedo indicador.
- Estabilize os quartos traseiros fixando a pele solta ao longo da parte de trás entre o segundo, terceiro e quarto dedos e a base do polegar, ou colocando a cauda entre o terceiro e o quarto dedos.
- A injeção ip no rato requer duas pessoas, uma para conter o rato e outra para realizar a injeção.
- Segure o rato sobre os ombros usando o índice e os dedos médios em cada lado do pescoço e a palma nas costas. O polegar e o terceiro e quarto dedos devem cercar o peito para evitar movimentos para frente ou para trás. A posição dos dedos em cada lado do pescoço impede que o rato erou a cabeça.
- Levante o rato e gire-o para expor o abdômen ventral.
- Estabilize os quartos traseiros agarrando os pés e a cauda com segurança e estendendo-os para longe do corpo.
- Posicione o rato ou o rato para expor o abdômen, garantindo que ele se desesse para cima.
- Incline o animal com a cabeça apontando para baixo em cerca de um ângulo de 30°, para permitir que os intestinos caiam para a frente.
- Os marcos de injeção são os seguintes:
- A área a ser injetada é cercada cranialmente por uma linha imaginária que se estende horizontalmente através do corpo no topo do quadril (do flanco ao flanco).
- A linha média é a fronteira medial, reconhecida como onde o cabelo crescendo em direções opostas se encontra. Em animais sem pelos, a linha média se estende em linha reta do xiphoide ao ânus.
- A borda lateral é uma linha do topo do quadril para o prepuce no masculino, e do topo do quadril e seguindo as no feminino.
- Isso fornece uma área triangular para injeção segura.
- Injeção de um artigo dentro dos marcos
- Insira uma agulha perpendicular à coluna vertebral, fora da linha média, no triângulo como descrito acima. Colocar a agulha em um ângulo de 90° no plano do corpo permite uma injeção segura utilizando ambos os lados do abdômen. Isso é especialmente importante com múltiplas injeções, pois minimiza o trauma tecidual, permitindo a alternância de locais de injeção.
- Quando a agulha é colocada em um ângulo de 90°, ela "estalou" no abdômen, permitindo uma determinação mais fácil da profundidade. Este também é um sinal visual e tátil de que a agulha está devidamente posicionada.
- Aspire a seringa para garantir a colocação dentro da cavidade peritoneal e não dentro da bexiga urinária, intestino ou estruturas vasculares.
- Evite injetar caudally no rato macho para evitar a administração do artigo no saco escrotal. Evite injetar na da fêmea para evitar traumas.

Figura 2. Os marcos para injeção intraperitoneal em camundongos.
3. Injeção intramuscular
- A contenção para esta técnica para ratos e ratos requer duas pessoas ou o uso de um tubo de contenção. Descrito aqui é um método de uma pessoa utilizando um dispositivo de contenção.
- Coloque o animal no dispositivo de contenção.
- Uma vez que o animal esteja no tubo, segure a cauda para posicionar o animal com as patas traseiras para fora do tubo.
- Segure a pele do flanco na porção craniana do fêmur para estender a perna e evitar que o sufocamento dobre.
- Posicione o dispositivo de contenção para que ele fique sobre a mesa com a cabeça do animal apontada para baixo, ou deitada sobre a mesa apontada para o corpo do técnico para permitir a estabilização do dispositivo enquanto a injeção é realizada.
- Os marcos de injeção são os seguintes: tanto o rato quanto a perna de rato são pequenos com os músculos glúteos (os músculos caudais da coxa) compreendendo a maior massa muscular no membro posterior; a segunda maior massa muscular no membro traseiro é o gastrocnemius (o músculo da panturrilha). A injeção é feita do aspecto caudal da perna.
- Localize a massa muscular glútea posterior ao fêmur. O osso pode ser palpated e o músculo grande é facilmente sentido.
- Note que a linha média da perna do aspecto posterior vai do ponto do hock até a cauda. O cabelo muitas vezes tem um cume onde se junta, pois cresce em direções opostas das superfícies lateral e interna.
- As injeções são feitas em direção ao aspecto lateral da coxa fora da linha média. Isso reduz a probabilidade de danificar os nervos e vasos sanguíneos localizados na superfície medial da perna.
- As injeções feitas no gastrocnemius são feitas a partir do aspecto posterior e com cuidadosa consideração da localização da veia lateral safena.
- Injeção de um artigo dentro dos marcos
- Insira a agulha perpendicularmente ao fêmur da linha média como descrito acima, a uma profundidade máxima de 5 mm para o músculo glúteo e um máximo de 3 mm para o gastrocnemius.
- Para evitar traumas no músculo, deve-se prevenir o movimento ímio da agulha no tecido. A seringa deve ser mantida de forma que não exija reposicionamento da mão para realizar a injeção.
- Aspire a seringa para garantir a colocação dentro do músculo e não em um vaso sanguíneo.
- Injete o material em um movimento constante e fluido. Não injete rapidamente quanto a permitir uma expansão lenta do músculo. Injeção rápida causará trauma tecidual.
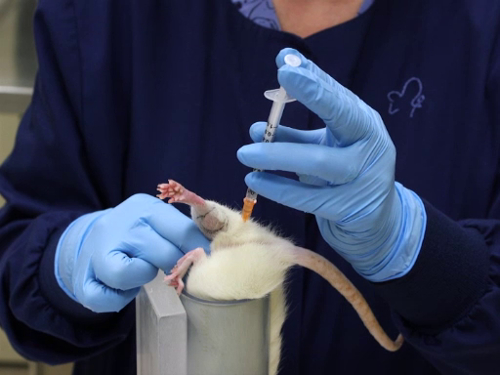
Figura 3. Injeção intramuscular no músculo glúteo em ratos.
4. Injeção intravenosa utilizando a veia traseira
- A contenção do animal depende se o animal está anestesiado ou acordado.
- Use um tubo de contenção cilíndrica para ratos ou ratos conscientes, exceto para os animais sem pelos ou nus. Devido à natureza oleosa dos animais sem pelos, é difícil reposicioná-los e removê-los dos contidores acrílicos, pois sua pele tende a aderir ao plástico rígido. Assim, é utilizado um cone plástico flexível.
- Outros dispositivos de injeção incluem plataformas iluminadas, plataformas aquecidas e cones plásticos rígidos onde o mouse é mantido no cone estritamente com tensão na cauda.
- Ratos anestesiados podem não precisar de contenção.
- Aqueça todo o corpo ou apenas a cauda para garantir a vasodilatação dos vasos da cauda.
- Aqueça todo o corpo com uma almofada de aquecimento elétrica fixada em meio ou uma manta de água circulante.
- Coloque o animal no dispositivo de contenção, envolto na fonte de calor.
- Observe o animal de perto e remova-o da fonte de calor assim que os vasos sanguíneos se dilatam. O aquecimento corporal inteiro também pode ser alcançado com o uso de uma lâmpada de calor direcionada para uma gaiola. Ao usar uma lâmpada de calor, os animais devem ser observados de perto, pois é fácil superaquecê-los.
- Quando o aquecimento do corpo inteiro não é viável, o aquecimento da cauda sozinho pode ser alcançado usando compressas quentes de uma toalha aquecida, garrafa de água quente ou submergindo a cauda em água morna. É preciso ter cuidado para evitar queimar a cauda porque garrafas de água quente, toalhas aquecidas e água morna não têm controles de temperatura. É comum que as fontes de calor sejam superaquecidas inicialmente. Essas fontes de calor também esfriam rapidamente.
- O uso de óleo de tecido é outra forma de melhorar a visualização dos vasos.
- Mergulhe um aplicador de ponta de algodão no óleo de tecido, e aplique o óleo bem longe da porção da cauda que é agarrada para estabilização. O óleo de tecido faz com que os vasos pareçam mais claramente definidos.
- Existem óleos não motores disponíveis comercialmente que contêm um produto químico na formulação que cria aquecimento da pele e vasodilatação com evaporação. Esses óleos são aplicados, e depois de alguns momentos, quando os navios são visíveis, o excesso de óleo é limpo com uma bola de algodão.
- Todos os óleos podem tornar a cauda mais difícil de segurar.
- Ao usar óleos, a injeção deve ser feita imediatamente após a visualização dos navios.
- Os marcos de injeção são os seguintes:
- As veias traseiras laterais estão localizadas nas laterais da cauda. Há também vasos que correm ao longo das linhas médias dorsal e ventral da cauda que não são adequados para fins de injeção.
- O animal no contenção pode ser girado para que os vasos laterais estejam de frente para a facilidade de injeção. Alternativamente, a cauda pode ser virada para trazer os vasos para uma posição mais aceitável para injeção.
- As naves são muito superficiais. Eles se tornam mais superficiais à medida que chegam à base da cauda.
- A injeção de um artigo na veia da cauda requer habilidade. Para evitar traumas no vaso sanguíneo, deve-se prevenir o movimento ím lonu da agulha. A seringa é mantida de forma que não exija reposicionamento da mão para realizar a injeção.
- Posicione a cauda para que o vaso seja visível e mantido sob tensão. Não aplique tensão excessiva na cauda, ou o vaso pode ser esticado e o fluxo sanguíneo diminuído.
- Coloque a agulha diretamente sobre o vaso o mais longe possível.
- Aplique uma leve pressão e deslize a agulha para dentro da cauda paralela às vértebras. Evite acionar a agulha para baixo, pois a agulha vai transectar o vaso. A agulha deve ser visível no vaso, pois é avançada pelo menos 2 mm no lúmen.
- Injete o material em um movimento lento e fluido para evitar a ruptura do vaso.
- Preste atenção especial à cauda durante a injeção. Se devidamente inserido no vaso, o material de injeção que flui para dentro do vaso é sentido sem resistência. O vaso sanguíneo deve branquear enquanto o sangue é empurrado para fora pelo material de injeção.
- Se a agulha não estiver no vaso, haverá forte resistência ao injetar. Se injetar com força, o material preencherá o espaço subcutâneo e a cauda irá balão. Pare imediatamente, pois o material projetado para ser injetado por via intravenosa pode ser cáustico para os tecidos circundantes. Retire a agulha e tente outra injeção mais cranialmente na cauda.
- Após a injeção bem sucedida, retire a agulha e aplique pressão no local da injeção para garantir uma boa hemostasia antes de devolver o animal à gaiola.
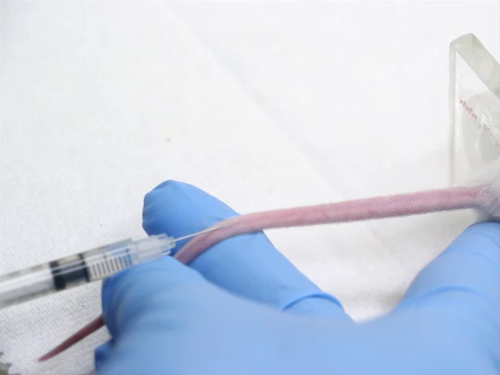
Figura 4. Injeção de veia traseira em camundongos.
A administração de substâncias é um componente comum de protocolos experimentais que utilizam animais. Ao escolher uma rota de parto, muitos fatores devem ser deliberados, incluindo a proficiência técnica dos indivíduos responsáveis pela dosagem dos animais, o tamanho do animal, a viscosidade do fluido e a quantidade a ser administrada. Uma cuidadosa consideração desses fatores aumentará o bem-estar do animal e o resultado geral do experimento.
- Turner, P.V., Pekow, C., Vasbinder, M. A. and Brabb, T. 2011. Administration of substances to laboratory animals: equipment and considerations, vehicle selection, and solution preparation. JAALAS. 50:5. 614-627.
- Shimizu, S. 2004. Routes of Administration in The Laboratory Mouse. Elsevier.
- Machholz, E., Mulder, G., Ruiz, C., Corning, B. F., Pritchett-Corning, K. R. 2012. Manual Restraint and Common Compound Administration Routes in Mice and Rats. J. Vis. Exp. (67), e2771, doi:10.3791/2771
- Turner, P. V., Brabb, T., Pekow, C., Vasbinder, M. A. 2011. Administration of substances to laboratory animals: routes of administration and factors to consider. JAALAS. 50, 600-613
Pular para...
Vídeos desta coleção:

Now Playing
Administração de Composto I
Lab Animal Research
99.9K Visualizações

Técnicas de manuseio e contenção de roedores
Lab Animal Research
173.2K Visualizações

Procedimentos de Cuidados Básicos
Lab Animal Research
27.6K Visualizações

Fundamentos da Reprodução e Desmame
Lab Animal Research
35.5K Visualizações

Identificação de roedores I
Lab Animal Research
54.4K Visualizações

Identificação de Roedores II
Lab Animal Research
25.5K Visualizações

Administração de Composto II
Lab Animal Research
34.6K Visualizações

Administração de Composto III
Lab Animal Research
31.2K Visualizações

Administração de Composto IV
Lab Animal Research
51.2K Visualizações

Retirada de Sangue I
Lab Animal Research
170.7K Visualizações

Retirada de Sangue II
Lab Animal Research
72.7K Visualizações

Indução e Manutenção da Anestesia
Lab Animal Research
50.0K Visualizações

Considerações para cirurgia de roedores
Lab Animal Research
22.3K Visualizações

Necropsia diagnóstica e coleta de tecidos
Lab Animal Research
57.8K Visualizações

Coleta de Tecido Estéril
Lab Animal Research
34.7K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados