Administración de compuestos I
Visión general
Fuente: Kay Stewart, RVT, RLATG, CMAR; Valerie A. Schroeder, RVT, RLATG. Universidad de Notre Dame, en
como muchos protocolos de investigación requieren que una sustancia se inyecta en un animal, debe determinarse con precisión la ruta de entrega y la cantidad de la sustancia. Hay varias vías de administración disponibles en el ratón y la rata. Que ruta usar está determinada por varios factores de la sustancia que se inyecta: el pH de la solución, el volumen requerido para la dosis deseada y la viscosidad de la solución. Daño tisular severa puede ocurrir si una sustancia se administra incorrectamente. Este video se ve en los diversos métodos de sujeción y detalles técnicos para los más de uso general rutas inyección.
Principios
como muchos de los compuestos de prueba que se utilizan en la investigación biomédica son sustancias nuevas que no están comercialmente disponibles, preparación de la sustancia apropiada es vital. Preocupaciones fundamentales de esterilidad, viscosidad y compatibilidad fisiológica de la formulación de la sustancia de ensayo y el medio- o vehículo en que se disolvió/suspendido deben abordarse. Una solución de dosificación, si por vía enteral o parenteral, debe ser fisiológicamente tamponada para el pH correcto para el compuesto para ser correctamente absorbida y para prevenir la lesión del tejido. La viscosidad de una solución puede ser el factor determinante de la ruta de la inyección. Una sustancia que es demasiado gruesa para pasar a través de la aguja de calibre pequeño para los sitios de inyección utilizadas en un ratón puede requerir la reformulación para administración oral. Todas las soluciones a inyectar por vía parenteral deben ser estériles para prevenir la introducción de patógenos en el animal. 1
selección de agujas para las inyecciones se basa en la vía de administración, la viscosidad de la solución y el tamaño del animal. En general, el calibre más pequeño posible para administrar la solución debe ser elegido; Esto es generalmente calibre 22-30 en el ratón y calibre de 20-25 para la rata. La jeringa para ser seleccionado es otra vez el más pequeño posible con las graduaciones correcta necesaria para la dosificación exacta. 2,3,4
hay varias rutas para las inyecciones parenterales. Con el propósito de este video, se discuten las rutas más utilizadas (subcutáneo [SQ], intraperitoneal [IP], intravenosa [IV] y intramuscular [IM]). Otras técnicas de inyección, como la intradérmica (ID), intracraneal, intracardiaco, las inyecciones de bandolero, intranasales o intravenosas vía el plexo retro orbital están cubiertas en un video diferente.
la velocidad de absorción de compuestos varía según la ruta. La ruta IV coloca la sustancia directamente en el torrente sanguíneo, eliminando cualquier tiempo necesario para la absorción. Una sustancia que inyectada IM se absorbe rápidamente debido a la abundante cantidad de vasos dentro del tejido muscular. Aunque una inyección del IP se considera la administración parenteral, el mecanismo de absorción es más similar con la dosis oral. Dosis subcutánea es una forma conveniente de administrar un gran volumen de líquido. La velocidad de absorción es más lenta que otras rutas, proporcionando un efecto sostenido. La elección de la ruta es un componente esencial del protocolo experimental. 4
subcutánea coloca los materiales entre las capas de la piel y el músculo en un espacio virtual creado por elevación de la piel. Esto permite la inyección segura de grandes volúmenes, ya que el líquido se absorbe lentamente y el exceso de líquido se excreta rápidamente por los riñones. Esto evita la sobrecarga de líquidos y edema pulmonar, que puede ser resultado de grandes volúmenes se inyecta por vía intravenosa. La aguja seleccionada debe ser la posible más pequeño de tamaño que permita la viscosidad del material inyectado, generalmente un 22-30 medidor de aguja para los ratones y un 22-25 calibre aguja para las ratas. Volúmenes de inyección oscilan 0,1 ml a 0,5 ml para los ratones y 0,1 ml a 1,0 ml para las ratas, por sitio de inyección.
ruta de IP es muy frecuente en roedores ya que puede utilizarse para la entrega de volúmenes más grandes que una vía IV o IM. Sin embargo, la absorción del material administrado IP es significativamente más lento que un IM o IV de la ruta. Sustancias administradas con este método se piensan para ser sometido a metabolismo hepático antes de entrar en el torrente sanguíneo. 5 Una vez más, la aguja seleccionada debe ser la posible más pequeño de tamaño que permita la viscosidad del material inyectado, generalmente un 22-30 medidor de aguja para los ratones y un 22-25 calibre aguja para las ratas. Para los ratones, gama de volúmenes de inyección de 0,05 ml a 1,0 ml por inyección en función del tamaño del ratón. Para las ratas, el rango es de 0,1 ml a 1,5 ml por sitio de inyección.
las inyecciones IM, aunque usados comúnmente en animales más grandes, tienen usos mínima en ratones y ratas debido a su pequeña masa muscular. Inyección incorrecta o repetida en el músculo puede causar daño del nervio dando por resultado parálisis o músculo necrosis. La aguja seleccionada debe ser la posible más pequeño de tamaño que permita la viscosidad del material inyectado, generalmente de calibre 27-30. Para los ratones, gama de volúmenes de inyección de 0.01 ml hasta un máximo de 0,05 ml por sitio de inyección para el músculo glúteo. Los volúmenes de inyección para el gastrocnemio tienen un máximo de 0,05 ml. En cambio, la rata gama de volúmenes de inyección de 0.01 ml hasta un máximo de 0,3 ml por sitio de inyección para el músculo glúteo. Los volúmenes de inyección para el gastrocnemio tienen un máximo de 0,1 ml.
inyección IV es la vía más eficaz de administración de la sustancia, ya que se introduce inmediatamente en el sistema circulatorio. Sin embargo, con los vasos de menor tamaño disponibles IV dosis en el ratón, su utilidad es limitada. Si se requiere la administración intravenosa, se debe considerar el uso de puertos de acceso vascular o de otros equipos dosificadores especializada para el bienestar de los animales. La aguja seleccionada debe ser la posible más pequeño de tamaño que permita la viscosidad del material inyectado, generalmente de calibre 27-30. Gama de volúmenes de inyección de 0,05 ml para un máximo de 0,5 ml por inyección, en función del tamaño del ratón.
| ruta | ratón | rata | |||
| aguja calibre (g) | Volumen de inyección (mL) | aguja calibre (g) | volumen de inyección (mL) | ||
| SC | 22 – 30 | 0.1 – 1.5 | 22 – 25 | 0.1 – 3.0 | |
| IP | 22 – 30 | 0.05 – 1.0 | 20 – 25 | 0.1 – 1.5 | |
| IM | 27 – 30 | 0.01 – 0.05 (glútea/gastrocnemio) | 25 – 27 | 0,01-0,3 (glúteos) 0.01-0.1 (gastrocnemio) | |
| IV | 27 – 30 | 0 .05 – 0.5 | 22 – 25 | 0.05 – 4.0 | |
tabla 1. Apropiada de la aguja calibre inyección volumen gama y para ratones y ratas dependiendo de la ruta.
Procedimiento
1. inyección subcutánea
- refrena el ratón mediante la sujeción con una mano sostenga manualmente. Una vez entendido, permite el ratón para descansar sobre una mesa u otra superficie segura. Asegúrese de evitar la presión sobre el cuerpo del ratón.
- Descansar el talón de la mano sobre la mesa para evitar excesiva peso en el ratón que puede dificultar la respiración. Ratones pueden también ser asegurados en un dispositivo comercial. Para las ratas, es mejor usar un dispositivo de restricción comercial.
- Agarrar la piel y tire hacia arriba para crear una tienda de la piel. Si utiliza un dispositivo de sujeción, pinzas se requiera captar la piel a través de la ranura en la parte superior.
- Insertar la aguja paralela a la columna vertebral, dirigida a la cabeza en la base de la doblez de la piel de la tienda. Dirigir la aguja de la cabeza para evitar la posibilidad de pinchazos en el cráneo, como el hueso del cráneo del ratón es muy delgado. Las ratas tienen la tendencia a la parte trasera de su cabeza, que podría causar la inyección para colocarse en los músculos del cuello.
- Coloque el bisel de la aguja hacia arriba para permitir un deslizamiento suave en la piel. Tenga en cuenta que se inserta la aguja por debajo de los dedos sujetando la piel. Para mejorar la seguridad cuando fuesen artículos de inyección, la piel está agarrada con pinzas, eliminando así la posibilidad de lesiones accidentales de aguja.
- Tire hacia atrás el émbolo para verificar la colocación correcta. Si el aire es aspirado en la jeringa, indica que la punta de la aguja no se coloca debajo de la piel y tendrá que ser retirado y colocado de nuevo. Si hay presión cuando el émbolo se jala hacia atrás, indica la colocación correcta de la aguja y la inyección puede proceder.
- Inyectar la sustancia lentamente con un movimiento constante. Para evitar la pérdida del artículo inyección, hacer una pausa después de la inyección, gire ligeramente la aguja bajo la piel y pellizcar la piel en el sitio de la inyección mientras retira la aguja.
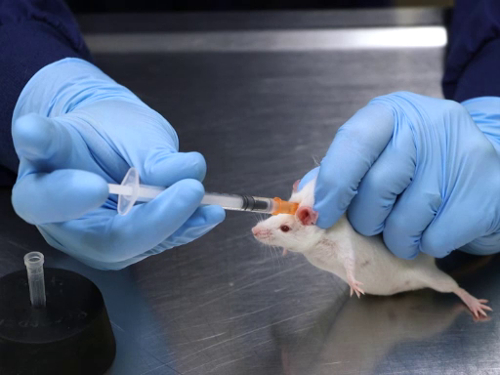
figura 1. La inyección subcutánea en los ratones.
2. inyección intraperitoneal
- el método de sujeción manual con una sola mano se utiliza para esta técnica de inyección en ratones. Ajustar la mano que quede colocado lo suficientemente alta en el cuello para evitar que gire el ratón.
- Agarre la piel floja en la nuca del cuello entre el pulgar y el dedo índice.
- Estabilizar los cuartos traseros, ya sea fijando la piel a lo largo de la parte posterior entre el segundo, tercero y cuarto dedos y la base del pulgar, o colocando la cola entre los dedos terceros y cuarto. Inyección de
- IP en la rata requiere dos personas, uno para sujetar la rata y el otro para realizar la inyección.
- Alcance la rata sobre los hombros usando el dedo índice y medio a cada lado del cuello y la palma en la parte posterior. El pulgar y los dedos terceros y cuarto deben rodear el pecho para evitar el movimiento hacia adelante o hacia atrás. La posición de los dedos a cada lado del cuello evita que la rata de girar su cabeza.
- La rata de levantar y girar para dejar expuesto el abdomen ventral.
- Estabilizar los cuartos traseros sujetando los pies y la cola bien y extiende lejos del cuerpo.
- Coloque el ratón o rata para exponer el abdomen, asegurando que se enfrenta a hacia arriba.
- El animal de la inclinación con la cabeza hacia abajo en un ángulo 30°, para permitir que los intestinos a caer hacia adelante.
- Lugares de inyección son los siguientes:
- el área a inyectar cranially está rodeado de una línea imaginaria que se extiende horizontalmente por todo el cuerpo en la parte superior de la cadera (de flanco a flanco).
- La línea media es la frontera intermedia, reconocida como donde se encuentra con pelo que crece en direcciones opuestas. En los animales sin pelo, la línea media se extiende en línea recta desde el xifoides hasta el ano.
- La frontera lateral es una línea desde la parte superior de la cadera para el prepucio en el varón y desde la parte superior de la cadera y los pezones en la mujer.
- Esto proporciona un área triangular de inyección segura.
- La inyección de un artículo dentro de los hitos
- insertar una aguja perpendicular a la columna vertebral, de la línea media, en el triángulo como se describió anteriormente. Colocar la aguja en un ángulo de 90° respecto al plano del cuerpo permite inyecciones seguras utilizando ambos lados del abdomen. Esto es especialmente importante con múltiples inyecciones, ya que minimiza el trauma tisular permitiendo la alternancia de sitios de inyección.
- Cuando la aguja se coloca en un ángulo de 90°, lo hará " pop " en el abdomen, lo que permite más fácil determinación de la profundidad. Esto también es una referencia visual y táctil que la aguja esté bien colocada.
- Aspirar la jeringa para asegurar la colocación dentro de la cavidad peritoneal y no dentro de la vejiga urinaria, intestino o estructuras vasculares.
- Evitar inyectar caudalmente en el ratón macho para evitar administrar el artículo en el saco escrotal. Evitar inyectar en la teta de la hembra para evitar trauma.

figura 2. Los lugares para inyección intraperitoneal en ratones.
3. inyección intramuscular
- restricción de esta técnica para ratones y ratas requiere dos personas o el uso de un tubo de sujeción. Se describe aquí es un método de una sola persona utilizando un dispositivo de restricción.
- Coloque el animal en el dispositivo de seguridad.
- Una vez que el animal está en el tubo, sujete la cola para colocar el animal con las patas traseras del tubo.
- Agarre la piel del flanco en la porción craneal del fémur para extender la pierna y evitar que la rodilla flexión.
- Colocar el dispositivo de sujeción para que está parado sobre la mesa con el animal ' cabeza apuntando hacia abajo, o acostado sobre la mesa apuntando hacia el cuerpo del técnico para permitir la estabilización del dispositivo mientras se realiza la inyección.
- Lugares de inyección es las siguientes: pierna el ratón y la rata son pequeños con los músculos glúteos (los músculos caudales del muslo) que comprende la mayor masa muscular en las extremidades, la segunda mayor masa muscular en las extremidades es el gastrocnemio (músculo del becerro). La inyección se realiza desde el aspecto caudal de la pierna.
- Localizar el glúteo músculo masa posterior en el fémur. Puede ser palpated el hueso y el músculo grande se siente fácilmente.
- Nota que la línea media de la pierna de la cara posterior del punto del corvejón a la cola. El pelo tiene a menudo una cresta donde viene junto, como crece en direcciones opuestas de las superficies lateral e interiores. Las inyecciones de
- se hacen hacia el aspecto lateral del muslo de la línea media. Esto reduce la probabilidad de dañar los nervios y los vasos sanguíneos situados en la superficie medial de la Leg
- Las inyecciones en el gastrocnemio se realizan desde la cara posterior y con la consideración cuidadosa de la localización de la vena safena lateral.
- La inyección de un artículo dentro de los hitos
- Insertar la aguja perpendicular al fémur fuera de la línea media, como se describe anteriormente, a una profundidad máxima de 5 mm para el músculo glúteo y un máximo de 3 mm para el gastrocnemio.
- Para evitar traumatismo en el músculo, el extraño movimiento de la aguja en el tejido debe ser prevenido. La jeringa debe celebrarse de una manera que no es necesario cambiar la posición de la mano para realizar la inyección.
- Aspirar la jeringa para asegurar la colocación dentro del músculo y no en un vaso sanguíneo.
- Inyectar el material en un movimiento fluido y constante. No se inyecte rápidamente tal que permita la expansión lenta del músculo. Inyección rápida puede causar trauma de tejido.
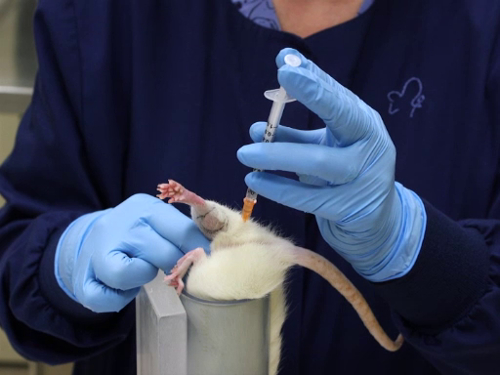
figura 3. La inyección intramuscular en el músculo glúteo en ratas.
4. inyección intravenosa utilizando la vena de la cola
- sujeción del animal es dependiente sobre si el animal está anestesiado o despierto.
Animales
- uso un tubo de sujeción cilíndrico para conscientes ratones o ratas, excepto sin pelo o desnudo. Debido a la naturaleza grasa de los animales sin pelo, es difícil de colocar y quitar de las restrainers acrílico, ya que su piel tiende a adherirse al plástico rígido. Por lo tanto, se utiliza un cono de plástico flexible.
- Otros dispositivos de inyección incluyen plataformas iluminadas, climatizadas plataformas y conos de plástico rígidos donde el ratón se mantiene en el cono estrictamente con la tensión en la cola.
- Anesthetized ratones pueden no necesitar seguridad.
- Caliente el cuerpo entero o sólo la cola para la vasodilatación de los vasos de la cola.
- Caliente todo el cuerpo con una almohadilla de calefacción eléctrica en media o una manta de agua circulante con.
- Colocar el animal en el dispositivo de sujeción, envuelto en la fuente de calor.
- Observar de cerca el animal y retire de la fuente de calor tan pronto como se dilatan los vasos sanguíneos. Calentamiento de cuerpo entero también puede lograrse con el uso de una lámpara de calor dirigido en una jaula. Cuando se utiliza una lámpara de calor los animales estrechamente respete, ya que es fácil sobrecalentarlos.
- Al calentamiento de cuerpo entero no es factible, la cola solo la calefacción se logra utilizando compresas calientes de un calentador de toallas, botella de agua caliente, o sumergir la cola en agua caliente. PRECAUCIÓN debe ser empleada para evitar que se queme la cola porque el agua caliente, caliente toallas y bolsas de agua caliente no tienen controles de temperatura. Es común que las fuentes de calor que se sobrecalienta inicialmente. Estas fuentes de calor también enfríen rápidamente.
- El uso de aceite de tejido es otra forma de mejorar la visualización de los vasos.
- Sumergir un aplicador con punta de algodón en el aceite del tejido y el pozo de petróleo de la porción de la cola que se apoderó de estabilización se aplica. El aceite del tejido hace que los vasos que aparecen más claramente definidos.
- Allí es aceites no tóxicos comercialmente disponibles que contienen un producto químico en la formulación que genera calentamiento de la piel y vasodilatación con la evaporación. Estos aceites se aplican, y después de unos momentos, cuando los vasos son accesibles, el exceso de aceite es enjugado con una bola de algodón.
- Todos los aceites pueden dificultar la cola hacer.
- Uso de aceites, la inyección debe hacerse inmediatamente en la visualización de los vasos.
- Lugares de inyección son los siguientes:
- las venas laterales de la cola se encuentran en los lados de la cola. También hay barcos que recorren nuestra dorsal y ventral de la cola que no es adecuado para propósitos de la inyección.
- El animal en el limitador puede girarse para que las naves laterales son hacia arriba para facilitar la inyección. Por otra parte, la cola puede dar vuelta para traer los vasos en una posición más aceptable para la inyección.
- Los vasos son muy superficiales. Llegan a ser más superficiales que llegan a la base de la cola.
- Inyección de un artículo en la vena de la cola requiere habilidad. Para evitar traumatismos a los vasos sanguíneos, el extraño movimiento de la aguja debe evitarse. La jeringa se celebra de una manera que no es necesario cambiar la posición de la mano para realizar la inyección.
- Posición de la cola para que la nave es visible y sostenido bajo tensión. No aplique una tensión excesiva en la cola, o se puede estirar el vaso y el flujo de sangre disminuido.
- Colocar la aguja directamente sobre el recipiente hasta distal como sea posible.
- Aplique una ligera presión y deslice la aguja en el paralelo de cola a las vértebras. Evitar la pesca de la aguja hacia abajo, como la aguja transecto del buque. La aguja debe ser visible en el vaso como se es avanzado por lo menos 2 mm en el lumen.
- Inyectar el material en un movimiento lento y fluido para evitar la ruptura de la vasija.
- Prestar especial atención a la cola durante la inyección. Si correctamente en el recipiente, el material de la inyección que fluye en el recipiente se siente con ninguna resistencia. El vaso sanguíneo debe blanquear como la sangre es empujada hacia fuera por el material de inyección.
- Si la aguja no está en el recipiente, habrá fuerte resistencia al inyectar. Si inyectar con fuerza, el material llenará el espacio subcutáneo y la cola se globo. Parar inmediatamente, como un material diseñado para ser inyectado por vía intravenosa puede ser cáustico para los tejidos circundantes. Retire la aguja y trate de otra inyección más cranially en la cola.
- Después de la inyección acertada, retire la aguja y aplique presión en el sitio de la inyección para asegurar buena hemostasia antes de regresar el animal a la jaula.
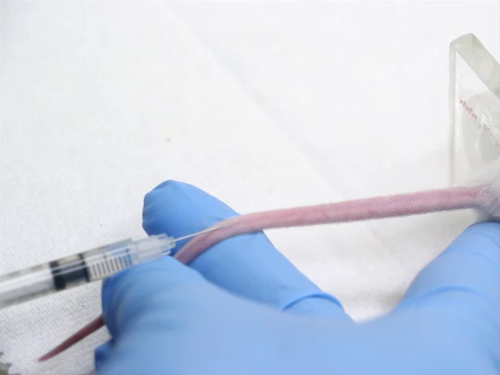
figura 4. Inyección en la vena en los ratones de cola.
Aplicación y resumen
Administración de la sustancia es un componente común de protocolos experimentales que utilizan animales. Al elegir una ruta de entrega, deben deliberaron muchos factores, incluyendo la competencia técnica de los individuos responsables de los animales, el tamaño del animal, la viscosidad del fluido y la cantidad de dosificación a administrar. Una cuidadosa consideración de estos factores aumentará el bienestar de los animales y el resultado total del experimento.
Tags
Saltar a...
Vídeos de esta colección:

Now Playing
Administración de compuestos I
Lab Animal Research
101.4K Vistas

Técnicas de manipulación y sujeción de roedores
Lab Animal Research
176.0K Vistas

Procedimientos de atención básica
Lab Animal Research
28.2K Vistas

Fundamentos de la crianza y destete
Lab Animal Research
35.9K Vistas

Identificación de roedores I
Lab Animal Research
55.1K Vistas

Identificación de roedores II
Lab Animal Research
25.8K Vistas

Administración de compuestos II
Lab Animal Research
35.2K Vistas

Administración de compuestos III
Lab Animal Research
31.7K Vistas

Administración de compuestos IV
Lab Animal Research
52.1K Vistas

Extracción de sangre I
Lab Animal Research
172.9K Vistas

Extracción de sangre II
Lab Animal Research
74.0K Vistas

Mantenimiento e inducción de la anestesia
Lab Animal Research
51.1K Vistas

Consideraciones para la cirugía de roedores
Lab Animal Research
22.6K Vistas

Necropsia diagnóstica y recolección de tejidos
Lab Animal Research
58.5K Vistas

Recolección de tejidos estériles
Lab Animal Research
35.0K Vistas
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados