Coltura e conta di batteri da campioni di suolo
Panoramica
Fonte: Laboratori del Dr. Ian Pepper e del Dr. Charles Gerba - Università dell'Arizona
Autori dimostrativi: Bradley Schmitz e Luisa Ikner
I terreni superficiali sono una miscela eterogenea di particelle inorganiche e organiche che si combinano insieme per formare aggregati secondari. All'interno e tra gli aggregati ci sono vuoti o pori che contengono visivamente sia aria che acqua. Queste condizioni creano un ecosistema ideale per i batteri, quindi tutti i terreni contengono vaste popolazioni di batteri, di solito oltre 1 milione per grammo di suolo.
I batteri sono il più semplice dei microrganismi, noti come procarioti. All'interno di questo gruppo procariotico, ci sono i microbi filamentosi noti come actinomiceti. Gli actinomiceti sono in realtà batteri, ma sono spesso considerati un gruppo unico all'interno della classificazione dei batteri a causa della loro struttura filamentosa, che consiste in più cellule infilate insieme per formare ife. Questo esperimento utilizza i mezzi del glicerolo che selezionano le colonie di actinomiceti, durante la diluizione e la placcatura. Tipicamente, gli actinomiceti sono circa il 10% della popolazione batterica totale. Batteri e actinomiceti si trovano in ogni ambiente sulla Terra, ma l'abbondanza e la diversità di questi microbi nel suolo non ha eguali. Questi microbi sono anche essenziali per la vita umana e influenzano ciò che le persone mangiano, bevono, respirano o toccano. Inoltre, ci sono specie batteriche che possono infettare le persone e causare malattie, e ci sono batteri che possono produrre prodotti naturali in grado di guarire le persone. Gli actinomiceti sono particolarmente importanti per la produzione di antibiotici, come la streptomicina. I batteri sono fondamentali per il ciclo dei nutrienti, la crescita delle piante e la degradazione dei contaminanti organici.
I batteri sono molto diversi in termini di numero di specie che si possono trovare nel suolo, in parte perché sono fisiologicamente e metabolicamente diversi. I batteri possono essere eterotrofici, il che significa che utilizzano composti organici, come il glucosio, per il cibo e l'energia, o autotrofici, il che significa che utilizzano composti inorganici, come lo zolfo elementare, per il cibo e l'energia. Possono anche essere aerobici, utilizzando ossigeno per la respirazione, o anaerobici, utilizzando forme combinate di ossigeno, come nitrato o solfato, per respirare. Alcuni batteri possono utilizzare ossigeno o forme combinate di ossigeno e sono noti come anaerobi facoltativi.
Principi
Un modo per enumerare il numero di batteri presenti in un campione di terreno è utilizzare la metodologia di diluizione e placcatura. Questa metodologia utilizza l'agar come mezzo per la crescita batterica, un processo definito "tecnologia coltivabile". A causa del gran numero di batteri presenti all'interno dei terreni, un piccolo campione di terreno viene diluito in serie in acqua, prima di essere placcato su agar all'interno di una piastra di Petri. Tipicamente, una piccola quantità di terreno contenuta entro 0,1 a 1 mL della sospensione del suolo diluito viene "distribuita" sulla superficie della piastra di agar. Le piastre contengono agar, che è fuso quando è caldo, ma solido quando è freddo. Oltre all'agar, i nutrienti, come il lievito peptone o un prodotto disponibile in commercio come R2A, vengono aggiunti al mezzo per consentire la crescita di batteri eterotrofi.
La diluizione e la placcatura sono una tecnologia economica e relativamente semplice per l'enumerazione dei batteri del suolo. Tuttavia, ci sono diversi inconvenienti alla tecnica. Alcuni errori e ipotesi comuni associati ai saggi di diluizione e placcatura sono i seguenti: si presume che ogni singolo batterio del suolo dia origine a una colonia, ma in realtà una colonia può derivare da un grumo di cellule, con conseguente sottovalutazione del vero conteggio coltivabile. Durante la diluizione seriale del terreno, le particelle di terreno possono depositarsi (cadere sul fondo), quindi la vera aliquota del suolo non viene trasmessa nella diluizione successiva. Molti microbi del suolo sono vitali ma non coltivabili. I batteri a crescita lenta potrebbero non provocare colonie visibili entro un lasso di tempo ragionevole (1-2 settimane).
Inoltre, i batteri anaerobici non crescono in condizioni aerobiche e i batteri che crescono sono selezionati dai nutrienti aggiunti al mezzo. Così R2A seleziona per i batteri eterotrofi, mentre lo zolfo elementare seleziona per gli ossidanti autotrofici dello zolfo. Nel complesso, si stima che solo lo 0,1-1% di tutti i batteri del suolo possa essere coltivato. Pertanto, la diluizione e la placcatura dei batteri del suolo rappresentano solo i batteri coltivabili e sottovalutano la vera popolazione vitale del suolo di uno o due ordini di grandezza. Un esempio di colonie batteriche eterotrofiche risultanti dalla diluizione e dalla placcatura del suolo è mostrato nella Figura 1. Si noti che circa 1 milione di cellule batteriche sono necessarie affinché una colonia sia visibile ad occhio nudo.
Questo esperimento dimostra la metodologia di diluizione e diffusione della placcatura utilizzata per enumerare il numero di batteri all'interno di un campione di terreno. In particolare, vengono utilizzati due mezzi: uno progettato per tutti i batteri e l'altro che seleziona per gli actinomiceti. Una volta che le colonie batteriche sono cresciute sulle piastre di agar, isolare le colture pure di colonie selezionate utilizzando una tecnica a piastra striata. Tali culture pure possono quindi essere ulteriormente analizzate e caratterizzate per tratti e funzioni specifici.
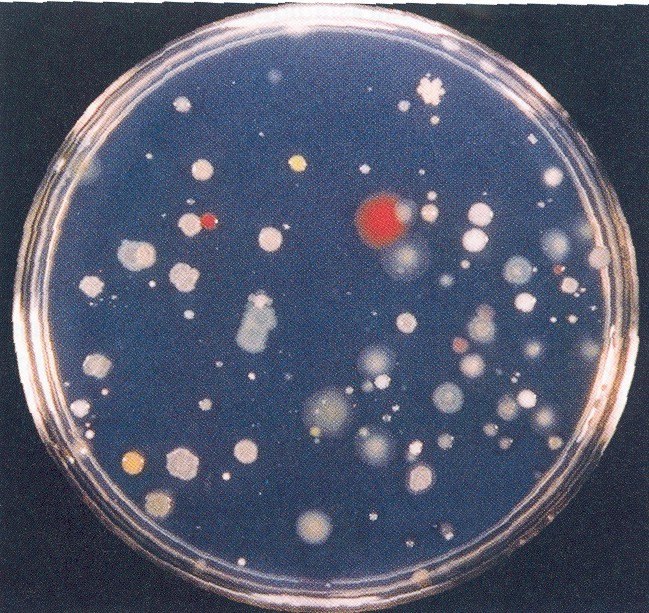
Figura 1. Colonie eterotrofiche su una piastra di agar R2A. Un certo numero di colonie discrete con morfologia diversa sorgono dopo la diluizione e la placcatura dal suolo. Autorizzazione all'uso concessa da Academic Press.
Procedura
1. Preparazione delle diluizioni del suolo
- Per iniziare la procedura, pesare 10 g di campione di terreno e aggiungere a 95 ml di acqua deionizzata. Agitare bene la sospensione ed etichettare come "A".
- Prima che il terreno si depositi, rimuovere 1 mL della sospensione con una pipetta sterile e trasferirla in un bianco d'acqua deionizzata da 9 mL. Vortice completo, ed etichetta come "B".
- Ripetere questa fase di diluizione tre volte, ogni volta con 1 mL della sospensione precedente e uno spazio vuoto d'acqua deionizzato da 9 mL. Etichettali in sequenza come tubi C, D ed E. Ciò si traduce in diluizioni seriali da 10-1 a 10-5 grammi di terreno per mL
2. Realizzazione di piastre diffuse per la coltura batterica
- Per far crescere le colonie batteriche, prendere tre piastre di agar peptone-lievito pre-preparate ed etichettarle come C, D ed E. Campioni di vortice C, D ed E e pipetta 0,1 ml su ciascun piatto. Questo aumenta ulteriormente il valore di diluizione, di un fattore dieci (C = 10-3, D = 10-4, E = 10-5).
- Quindi, immergere uno spandi bicchiere nell'etanolo. Mettere lo spargitore in una fiamma per alcuni secondi per accendere e bruciare l'etanolo. Questo sterilizzerà lo spargitore.
- Tenere lo spargitore sopra la prima piastra fino a quando la fiamma non si spegne. Aprire rapidamente la piastra, tenendo il coperchio vicino. Toccare lo spargitore all'agar lontano dall'inoculo (Inoculum = cellule utilizzate per iniziare una coltura) per raffreddare, quindi diffondere la goccia di inoculo intorno alla superficie dell'agar fino a quando le tracce di liquido libero scompaiono. Sostituire il coperchio della piastra.
- Riafirgire lo spargitore e ripetere il processo con la piastra successiva, lavorando rapidamente in modo da non contaminare l'agar con organismi presenti nell'aria
- Incubare le piastre batteriche a temperatura ambiente per 1 settimana. Assicurarsi che le piastre siano invertite durante l'incubazione per evitare che gocce di umidità dovute alla condensa cadano sulla superficie dell'agar.
3. Fare piastre di diffusione per Actinomiceti
- Per coltivare actinomiceti, prendere tre piastre di glicerolo-caseina pre-preparate ed etichettarle come B, C e D. Usando le tecniche mostrate in precedenza, distribuire la piastra 0,1 ml dalle sospensioni B, C e D. Le diluizioni inferiori sono utilizzate perché gli actinomiceti sono tipicamente presenti come 1/10 ° della popolazione batterica (B = 10-2, C = 10-3, D = 10-4).
- Incubare le piastre di actinomicete (invertite) a temperatura ambiente per 2 settimane.
4. Conteggi batterici e actinomiceti
- Dopo l'incubazione, esaminare attentamente tutte le piastre batteriche e notare le differenze nelle dimensioni e nella forma della colonia. Quando vengono coltivati su agar, i batteri producono colonie viscide che vanno dall'incolore all'arancione brillante, al giallo o al rosa. Al contrario, le colonie di actinomiceti sono gessose, sode, coriacee e si rompono sotto pressione, dove altre colonie batteriche si spalmano. Ciò consente alle colonie di essere distinte dal tocco con un anello sterile.
- Contare e registrare il numero di colonie batteriche, compresi eventuali actinomiceti. Conta solo le piastre con 30-200 colonie per piatto.
5. Isolamento delle culture pure
- Selezionare le singole colonie batteriche da una qualsiasi delle piastre. Più colonie possono essere selezionate se c'è particolare interesse per il suolo. Utilizzare una piastra ad alta diluizione, in quanto tende ad avere colonie pure che sono ben separate. Scegli solo colonie che sono ben separate dalle colonie vicine e sembrano morfologicamente distinte l'una dall'altra.
- Sterilizzare il cappio immergendolo nell'alcool e infiammandolo. Apri rapidamente la capsula di Petri di interesse e tocca il cappio in un punto nudo nell'agar per raffreddarlo. Quindi, rimuovi una piccola quantità di una colonia di interesse sul loop.
- Prendendo un piatto di lievito peptone fresco, fai una striscia lunga pochi centimetri su un lato. Sterilizzare e raffreddare di nuovo, quindi fare una striscia che attraversa la striscia iniziale solo al primo passaggio. Ripeti questo processo altre due volte nello stesso modo. Questa "diluizione" striata fa in modo che le cellule sul loop vengano separate l'una dall'altra. Posizionare la piastra in una zona buia per incubare a temperatura ambiente per due settimane.
Risultati
Un campione di terreno di 10 g con un contenuto di umidità del 20% su base di peso secco viene analizzato per batteri coltivabili vitali tramite tecniche di diluizione e placcatura. Le diluizioni sono state effettuate come indicato nella Tabella 1. 1 mL di soluzione E viene versato su un mezzo appropriato e si traduce in 200 colonie batteriche.

Ma, per 10 g di terreno umido,
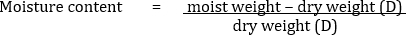
Pertanto

| Passo | Diluizione | |
| 10 g di terreno (peso/volume) | 95 mL di soluzione salina (soluzione A) | 10-1 |
| 1 mL di soluzione A (volume/volume) | 9 mL di soluzione salina (soluzione B) | 10-2 |
| 1 mL di soluzione B (volume/volume) | 9 mL di soluzione salina (soluzione C) | 10-3 |
| 1 mL di soluzione C (volume/volume) | 9 mL di soluzione salina (soluzione D) | 10-4 |
| 1 mL di soluzione D (volume/volume) | 9 mL di soluzione salina (soluzione E) | 10-5 |
Tabella 1: Diluizione e placcatura dei campioni.
Applicazione e Riepilogo
Ci sono due applicazioni fondamentali di diluizione e placcatura dei batteri del suolo. La prima applicazione è l'enumerazione dei batteri coltivabili all'interno di un particolare terreno. La quantificazione del numero di batteri del suolo fornisce un'indicazione della salute del suolo. Ad esempio, se ci sono da 106 a 108 batteri coltivabili presenti per grammo di terreno, questo sarebbe considerato un numero sano. Un numero inferiore a 106 per grammo indica una salute del suolo più povera, che può essere dovuta alla mancanza di sostanze nutritive come si trova nei terreni a bassa materia organica; stress abiotico imposto da valori estremi di pH del suolo (pH < 5 o > 8); o tossicità imposta da contaminanti antropogenici organici o inorganici.
La seconda applicazione principale è la visualizzazione e l'isolamento di colture pure di batteri. Le colture pure possono successivamente essere caratterizzate e valutate per caratteristiche specifiche che possono essere utili in applicazioni mediche o ambientali. Gli esempi includono: produzione di antibiotici; biodegradazione di sostanze organiche tossiche; o rizobia specifica utile per la fissazione dell'azoto da parte di leguminose, come piselli o fagioli.
Tags
Vai a...
Video da questa raccolta:

Now Playing
Coltura e conta di batteri da campioni di suolo
Environmental Microbiology
184.3K Visualizzazioni

Determinazione del contenuto di umidità del suolo
Environmental Microbiology
359.3K Visualizzazioni

Tecnica asettica nelle scienze ambientali
Environmental Microbiology
126.4K Visualizzazioni

Colorazione di Gram dei batteri provenienti da fonti ambientali
Environmental Microbiology
100.2K Visualizzazioni

Visualizzazione dei microrganismi del suolo tramite il test su vetrino a contatto e microscopia
Environmental Microbiology
42.2K Visualizzazioni

Funghi filamentosi
Environmental Microbiology
57.3K Visualizzazioni

Estrazione del DNA di comunità da colonie batteriche
Environmental Microbiology
28.8K Visualizzazioni

Rilevamento dei microrganismi ambientali tramite PCR ed elettroforesi su gel
Environmental Microbiology
44.6K Visualizzazioni

Analisi dell'RNA di campioni ambientali mediante RT-PCR
Environmental Microbiology
40.4K Visualizzazioni

Quantificazione di microrganismi e virus ambientali mediante qPCR
Environmental Microbiology
47.8K Visualizzazioni

Analisi della qualità dell'acqua tramite organismi indicatori
Environmental Microbiology
29.5K Visualizzazioni

Isolamento di batteri fecali da campioni d'acqua mediante filtrazione
Environmental Microbiology
39.3K Visualizzazioni

Rilevamento di batteriofagi in campioni di matrici ambientali
Environmental Microbiology
40.7K Visualizzazioni

Analisi della curva di crescita batterica e sue applicazioni ambientali
Environmental Microbiology
295.9K Visualizzazioni

Enumerazione delle alghe tramite metodo di coltivazione
Environmental Microbiology
13.8K Visualizzazioni