Tecnica asettica nelle scienze ambientali
Panoramica
Fonte: Laboratori del Dr. Ian Pepper e del Dr. Charles Gerba - Università dell'Arizona
Autore dimostrativo: Luisa Ikner
La tecnica asettica è un'abilità fondamentale ampiamente praticata nel campo della microbiologia ambientale che richiede un equilibrio tra consapevolezza e pratica in laboratorio. L'uso corretto di questa tecnica riduce la probabilità di contaminazione batterica o fungina di reagenti, mezzi di coltura e campioni ambientali. La tecnica asettica è anche vitale per garantire l'integrità dei dati e mantenere la purezza delle librerie di cultura che possono essere composte da isolati molto rari e difficili da colturare. Le fonti di contaminazione nell'ambiente di laboratorio includono microrganismi presenti nell'aria (compresi quelli che aderiscono a particelle di polvere e lanugine), microbi presenti sullo spazio di lavoro del banco di laboratorio o su vetreria o apparecchiature non sterilizzate e microbi trasferiti dal corpo e dai capelli del ricercatore. L'uso della tecnica asettica è anche una misura di sicurezza che riduce il potenziale di trasmissione di microrganismi ai ricercatori, il che è particolarmente importante quando si lavora con agenti patogeni.
Principi
L'obiettivo dell'utilizzo di tecniche asettiche è quello di creare e mantenere un ambiente di lavoro sterile, attrezzature e reagenti, in modo da ridurre al minimo la contaminazione dei campioni biologici. Per fare questo, lo spazio di lavoro e alcuni strumenti possono essere disinfettati con sostanze chimiche come il 70% di etanolo e candeggina diluita. È anche importante che il ricercatore indossi dispositivi di protezione individuale (DPI) come un camice da laboratorio, guanti e occhiali di sicurezza.
I mezzi e i reagenti possono essere sterilizzati utilizzando apparecchi di sterilizzazione con filtro che impiegano filtri da 0,22 μm, che rimuovono efficacemente la maggior parte dei microrganismi come i batteri. In alternativa, molti reagenti e attrezzature possono anche essere sterilizzati a calore elevato. Ad esempio, i microbi su o in strumenti, vetreria e mezzi liquidi possono essere uccisi termicamente in un'autoclave, che è una camera che sterilizza il contenuto attraverso l'esposizione a vapore pressurizzato ad alta temperatura. Inoltre, alcuni strumenti possono essere sterilizzati termicamente utilizzando una fonte di fiamma, come un bruciatore Bunsen.
L'uso di una sorgente di fiamma è anche uno dei modi più comuni per stabilire un ambiente di lavoro asettico. Il calore della fiamma provoca la convezione dell'aria, generando un updraft che solleva eventuali contaminanti presenti nell'aria lontano dalle vicinanze del bruciatore e creando un "campo sterile" in cui condurre un lavoro sperimentale asettico.
Procedura
1. Preparazione per il lavoro asettico
- Ottenere e applicare i seguenti DPI: camici da laboratorio, guanti in lattice o nitrile (privi di strappi o buchi) e occhiali di sicurezza (Figura 1). Per sicurezza in caso di utilizzo di una fiamma libera, legare i capelli lunghi.

Figura 1: DPI: un camice da laboratorio, guanti in lattice e occhiali di sicurezza. - Un secondo aspetto importante della tecnica asettica è la corretta sterilizzazione e conservazione dei mezzi/reagenti da utilizzare in laboratorio. Preparare il brodo liquido medio(ad esempio,brodo di soia tripttico) e il mezzo a base diagar (ad esempio,R2A) pesando la giusta quantità di polvere di base essiccata, che viene aggiunta alla quantità appropriata di acqua deionabilizzata.
- Per il mezzo di brodo, sciogliere la polvere su una piastra calda a fuoco basso applicato ed erogare il liquido in volumi da 100 ml in palloni di vetro a vite o in volumi da 10 ml in provette a vite di vetro. Utilizzando una barra magnetica, mescolare il mezzo di agarose sull'agitatore a piastra calda fino a quando la polvere non è completamente sciolta.
- Applicare il nastro adesivo per autoclave sui contenitori e autoclave il supporto secondo le istruzioni del produttore (ad esempio,20 min a 121 °C) (Figure 2 e 3). Si noti che il colore delle strisce sul nastro autoclave dovrebbe cambiare da bianco (pre-autoclave) a nero (post-autoclave). Sebbene il cambiamento di colore indichi generalmente che la sterilizzazione ha avuto successo, i controlli di sterilità utilizzando kit di strisce di spore possono essere condotti per verificare il processo di autoclave.

Figura 2: Nastro adesivo applicato al materiale.
Figura 3: Notare il cambiamento di colore delle strisce sul nastro autoclave dal bianco (pre-autoclave) al nero (post-autoclave). - Raffreddare i brodi liquidi a temperatura ambiente, quindi conservare a temperatura ambiente o refrigerati a 4 °C.
- Raffreddare il mezzo di agarose mettendo il contenitore in un bagno d'acqua impostato a ~ 50 °C. Una volta raffreddato, il supporto può essere versato in piastre di Petri sterili. Lasciare raffreddare e solidificare il supporto, quindi consolidare per la conservazione alle temperature specificate dal produttore.
- Esistono diverse varietà di terreni di coltura che non possono essere autoclavati poiché le alte temperature degradano gli ingredienti critici. La sterilizzazione di questi richiede la sterilizzazione del filtro utilizzando un sistema di filtrazione sotto vuoto che impiega un filtro da 0,22 μm, seguito dalla conservazione alla temperatura appropriata.
- Prima di eseguire il lavoro sul banco, disinfettare la superficie utilizzando una soluzione appropriata(ad esempio,candeggina da 500 ppm). Ciò riduce il rischio di trasferire contaminanti dalla superficie di lavoro a colture e mezzi sterili.
- Per stabilire un campo sterile, accendere un bruciatore Bunsen. Il tipo di fiamma più adatto per sterilizzare i circuiti di inoculazione del metallo è una fiamma blu intenso, con un cono blu definitivo osservato nel mezzo (Figura 4).

Figura 4: Un trasferimento di batteri da una piastra di Petri che mostra la crescita di un isolato coltivato a un'altra piastra di Petri non inoculata contenente un mezzo di crescita a base di agar. - Passare lentamente il ciclo di inoculazione attraverso la parte più calda della fiamma (punta del cono blu). Il loop dovrebbe diventare rovente ai fini della sterilizzazione.
2. Trasferimenti batterici: dalla piastra di Petri alla piastra di Petri
- Uno scenario di trasferimento di batteri è da una piastra di Petri che mostra la crescita di un isolato coltivato a un'altra piastra di Petri sterile contenente un terreno di crescita a base di agar.
- Per iniziare, aprire leggermente la piastra di Petri contenente la coltura batterica pura e picchiettare delicatamente il cappio inoculante caldo e sterilizzato sulla superficie dell'agar.
- Recupera una colonia isolata dalla superficie della piastra usando l'anello di inoculazione raffreddato e chiudi la piastra di Petri.
- Eseguire una striscia per l'isolamento utilizzando una piastra di Petri fresca contenente terreno di coltura, con il coperchio leggermente socchiuso.
- Per ogni porzione della striscia di isolamento (3 totali per piastra), sterilizzare a fiamma il ciclo di inoculazione appena prima dell'uso. Inoltre, sterilizzare a fiamma il loop subito dopo l'esecuzione della striscia finale al fine di prevenire la contaminazione della superficie del banco e come considerazione per gli altri in laboratorio che potrebbero successivamente utilizzare o entrare in contatto con i loop di inoculazione.
- Posizionare le piastre striate in un'incubatrice per la crescita durante la notte.
3. Trasferimenti batterici: dalla coltura del brodo alla piastra di Petri
- Un secondo scenario di trasferimento di batteri è da una coltura di brodo che mostra crescita, come generalmente osservato dalla torbidità, a una piastra di Petri sterile contenente terreno di crescita.
- Rimuovere il tappo dalla provetta (o pallone) contenente la coltura batterica pura e passare l'apertura del contenitore 2-3 volte attraverso la parte più calda della fiamma. Per evitare contaminazioni, non appoggiare il tappo sul piano di lavoro.
- Abbassare con attenzione l'anello di inoculazione sterilizzato nel tubo/pallone e premere delicatamente contro il lato del contenitore per raffreddare appena prima dell'inserimento nella coltura del brodo.
- Rimuovere un ciclo di coltura di brodo (Figura 5 )e sostituire immediatamente il tappo.

Figura 5: Un ciclo di cultura del brodo. - Eseguire una striscia per l'isolamento utilizzando una piastra di Petri fresca contenente terreno di coltura, con il coperchio leggermente socchiuso.
- Per ogni porzione della striscia (3 totali per piastra), sterilizzare a fiamma il ciclo di inoculazione appena prima dell'uso. Inoltre, sterilizzare a fiamma il loop subito dopo l'esecuzione della striscia finale al fine di prevenire la contaminazione della superficie del banco e come considerazione per gli altri in laboratorio che potrebbero successivamente utilizzare i loop di inoculazione.
- Posizionare le piastre striate per l'isolamento in un'incubatrice per la crescita durante la notte.
4. Trasferimenti batterici: dalla piastra di Petri con crescita al mezzo liquido sterile
- Un terzo scenario di trasferimento di batteri è da una piastra di Petri contenente una striscia di coltura isolata a un tubo / pallone contenente un mezzo di crescita liquido sterile.
- Aprire leggermente la piastra di Petri contenente la coltura batterica pura e raffreddare il ciclo di inoculazione caldo picchiettandolo delicatamente sulla superficie dell'agar.
- Recupera una colonia isolata dalla superficie della piastra usando l'anello di inoculazione raffreddato e chiudi la piastra di Petri.
- Rimuovere il tappo dalla provetta (o pallone) contenente il mezzo di coltura liquido sterile e passare l'apertura del contenitore 2 o 3 volte attraverso la parte più calda della fiamma. Per evitare contaminazioni, non appoggiare il tappo sul piano dilavoro.
- Abbassare con attenzione la colonia estratta nel mezzo di brodo liquido e agitare delicatamente il cappio per rilasciare i batteri. Sostituire immediatamente il tappo.
- Sterilizzare a fiamma il circuito di inoculazione al fine di prevenire la contaminazione della superficie del banco e come considerazione per gli altri in laboratorio che potrebbero successivamente utilizzare i loop di inoculazione.
- Metti il pallone in un'incubatrice per la crescita durante la notte.
- Rimuovere il pallone dall'incubazione il giorno successivo. Eseguire una serie di diluizione per enumerare la lingua.
- Placcare le diluizioni della serie su mezzi di coltura di agarose e incubare le piastre durante la notte.
- Rimuovere le piastre il giorno successivo e osservare eventuali contaminazioni.
5. Trasferimenti batterici: dalla coltura del brodo al mezzo di crescita liquido sterile
- Un quarto scenario di trasferimento di batteri è da una coltura di brodo che mostra crescita a un tubo / pallone contenente un mezzo di crescita liquido sterile.
- Rimuovere il tappo dalla provetta (o pallone) contenente la coltura batterica pura e passare due volte l'apertura del contenitore attraverso la parte più calda della fiamma. Per evitare contaminazioni, non appoggiare il tappo sul piano di lavoro.
- Abbassare con attenzione l'anello di inoculazione nel tubo/pallone e premere delicatamente contro il lato del contenitore per raffreddare appena prima dell'inserimento nella coltura del brodo.
- Rimuovere un ciclo di coltura di brodo e sostituire immediatamente il cappuccio.
- Rimuovere il tappo dalla provetta (o pallone) contenente il mezzo di coltura liquido sterile e passare due volte l'apertura del contenitore attraverso la parte più calda della fiamma. Per evitare contaminazioni, non appoggiare il tappo sul piano di lavoro.
- Abbassare con attenzione il loopful estratto nel mezzo di brodo liquido sterile e agitare delicatamente il loop per rilasciare i batteri. Sostituire immediatamente il tappo.
- Sterilizzare a fiamma il circuito di inoculazione (Figura 6) al fine di prevenire la contaminazione della superficie del banco e come considerazione per gli altri in laboratorio che possono successivamente utilizzare i circuiti di inoculazione.

Figura 6: Ciclo di inoculazione che diventa rovente durante la sterilizzazione con un bruciatore Bunsen. - Metti il pallone in un'incubatrice per la crescita durante la notte.
- Rimuovere il pallone dall'incubazione il giorno successivo. Eseguire una serie di diluizione per enumerare la lingua.
- Placcare le diluizioni della serie su mezzi di coltura di agarose e incubare le piastre durante la notte.
- Rimuovere le piastre il giorno successivo e osservare eventuali contaminazioni.
Risultati
L'esito della procedura dimostra una corretta tecnica asettica e una scarsa tecnica asettica. La Figura 7 illustra la contaminazione che può derivare da una scarsa tecnica asettica quando si versano piastre di agarose (piastra superiore: mezzo sterile; piastre inferiori: mezzi contaminati).
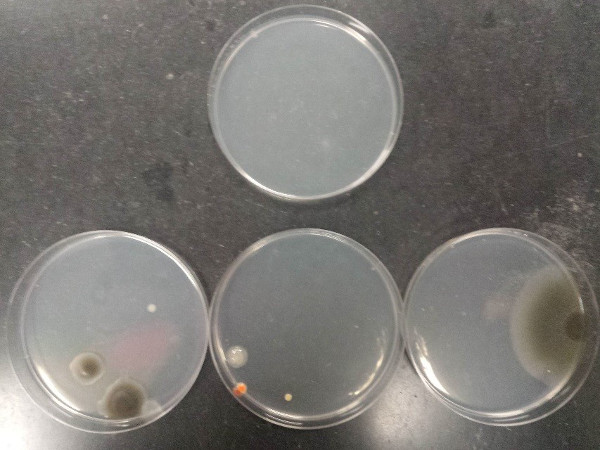
Figura 7: Contaminazione che può derivare da una scarsa tecnica asettica quando si versano piastre di agarose. Piastra superiore: mezzo sterile; piastre inferiori: mezzi contaminati.
Applicazione e Riepilogo
Oltre all'utilizzo dei bruciatori Bunsen, gli ambienti di lavoro asettici possono anche essere mantenuti in postazioni di lavoro specializzate note come cappe a flusso laminare, che utilizzano un flusso d'aria diretto e filtri per mantenere la sterilità.
L'uso corretto della tecnica asettica è vitale per i microbiologi ambientali durante il campionamento sul campo e in laboratorio quando si lavora con mezzi, reagenti e isolati coltivati. Una scarsa tecnica asettica sul campo può comportare il trasferimento di microrganismi dal tecnico a campioni ambientali critici, nonché la contaminazione incrociata di microbi da un campione all'altro. Tali eventi sono importanti, ad esempio, negli studi di ecologia microbica che cercano di identificare e confrontare popolazioni batteriche e fungine che possono essere presenti in un dato bioma. La contaminazione di tali campioni può comportare una perdita di integrità dei dati. La tecnica asettica è anche fondamentale per il mantenimento di isolati di colture di laboratorio provenienti da campionamenti sul campo o da archivi di colture microbiche e cellulari ben consolidati. Il tempo, la manodopera e i costi finanziari che sarebbero richiesti a un laboratorio nel tentativo di "ripulire" o sostituire le colture contaminate, in particolare gli isolati rari provenienti da ambienti unici, potrebbero essere molto alti e proibitivi, poiché alcuni isolati potrebbero essere insostituibili.
Vai a...
Video da questa raccolta:

Now Playing
Tecnica asettica nelle scienze ambientali
Environmental Microbiology
126.4K Visualizzazioni

Determinazione del contenuto di umidità del suolo
Environmental Microbiology
359.4K Visualizzazioni

Colorazione di Gram dei batteri provenienti da fonti ambientali
Environmental Microbiology
100.2K Visualizzazioni

Visualizzazione dei microrganismi del suolo tramite il test su vetrino a contatto e microscopia
Environmental Microbiology
42.2K Visualizzazioni

Funghi filamentosi
Environmental Microbiology
57.3K Visualizzazioni

Estrazione del DNA di comunità da colonie batteriche
Environmental Microbiology
28.8K Visualizzazioni

Rilevamento dei microrganismi ambientali tramite PCR ed elettroforesi su gel
Environmental Microbiology
44.6K Visualizzazioni

Analisi dell'RNA di campioni ambientali mediante RT-PCR
Environmental Microbiology
40.4K Visualizzazioni

Quantificazione di microrganismi e virus ambientali mediante qPCR
Environmental Microbiology
47.8K Visualizzazioni

Analisi della qualità dell'acqua tramite organismi indicatori
Environmental Microbiology
29.5K Visualizzazioni

Isolamento di batteri fecali da campioni d'acqua mediante filtrazione
Environmental Microbiology
39.3K Visualizzazioni

Rilevamento di batteriofagi in campioni di matrici ambientali
Environmental Microbiology
40.7K Visualizzazioni

Coltura e conta di batteri da campioni di suolo
Environmental Microbiology
184.3K Visualizzazioni

Analisi della curva di crescita batterica e sue applicazioni ambientali
Environmental Microbiology
296.0K Visualizzazioni

Enumerazione delle alghe tramite metodo di coltivazione
Environmental Microbiology
13.8K Visualizzazioni