Enumerazione delle alghe tramite metodo di coltivazione
Panoramica
Fonte: Laboratori del Dr. Ian Pepper e del Dr. Charles Gerba - Università dell'Arizona
Autore dimostrativo: Bradley Schmitz
Le alghe sono un gruppo altamente eterogeneo di microrganismi che hanno un tratto comune, vale a dire il possesso di pigmenti fotosintetici. Nell'ambiente, le alghe possono causare problemi ai proprietari di piscine crescendo nell'acqua. Le alghe possono anche causare problemi nelle acque superficiali, come laghi e bacini idrici, a causa delle fioriture algali che rilasciano tossine. Più recentemente, le alghe vengono valutate come nuove fonti di energia attraverso i biocarburanti algali. Le alghe blu-verdi sono in realtà batteri classificati come cianobatteri. I cianobatteri non solo fotosintetizzano, ma hanno anche la capacità di fissare il gas di azoto dall'atmosfera. Altre alghe sono eucariotiche, che vanno da organismi unicellulari a organismi multicellulari complessi, come le alghe. Questi includono le alghe verdi, gli euglenoidi, i dinoflagellati, le alghe brune dorate, le diatomee, le alghe brune e le alghe rosse. Nei suoli, le popolazioni algali sono spesso 106 per grammo. Questi numeri sono inferiori ai numeri corrispondenti per batteri, actinomiceti e funghi, soprattutto perché la luce solare richiesta per la fotosintesi non può penetrare molto al di sotto della superficie del suolo.
Poiché le alghe sono fototrofiche, ottenendo energia dalla fotosintesi e carbonio per la biomassa dall'anidride carbonica, possono essere coltivate in mezzi di crescita costituiti interamente da nutrienti inorganici e senza un substrato di carbonio organico. La mancanza di substrato organico preclude la crescita di batteri eterotrofi. Utilizzando un mezzo di crescita inorganico, le alghe originariamente presenti nel suolo o nell'acqua possono essere quantificate con il metodo del numero più probabile (MPN). Il metodo MPN si basa sulla successiva diluizione di un campione, in modo tale che le alghe stesse siano diluite fino all'estinzione. La presenza di alghe in qualsiasi diluizione è determinata da un segno positivo di crescita nel mezzo, che è tipicamente una melma verde di alghe che deriva dalla fotosintesi. L'uso di tubi replicati ad ogni diluizione e una valutazione statistica del numero di tubi positivi per la crescita in una data diluizione consente di calcolare il numero di alghe presenti nel campione originale. Le tabelle MPN sono state sviluppate e pubblicate specifiche per un particolare progetto MPN, incluso il numero di repliche utilizzate ad ogni diluizione.
Procedura
- Pesare un campione di 10 g di terreno che è stato raccolto umido dal campo o che ha aggiunto acqua in modo che rimanga umido per 2-3 giorni. Si noti che il terreno dovrebbe essere umido ma non saturo.
- Preparare una serie di diluizione 10 volte aggiungendo i 10 g di terreno in 95 ml di soluzione di Bristol modificata (Figura 1). Per creare la soluzione di Bristol modificata, sciogliere quanto segue in 1.000 ml di acqua: 0,25 g NaNO3, 0,025 g CaCl2, 0,075 g MgSO-4 · 7H2O, 0,075 g K2HPO4, 0,018 g KH2PO4, 0,025 g NaCl e 0,5 mg FeCl3.
- Continua la serie di diluizioni con l'aggiunta di 1 mL di Sospensione A a 9 mL della Soluzione bristol e ulteriori diluizioni sequenziali.
- Inoculare 5 tubi replicati contenenti ciascuno 9 mL di Soluzione di Bristol Modificata con 1 mL ciascuna delle diluizioni da 10-2 a 10-6 (Tabella 1).
- Incubare i tubi tappati per un massimo di 4 settimane in un'area esposta alla luce solare.
- Osservare i tubi per la crescita algale una volta ogni 7 giorni. I tubi con crescita algale appaiono verdi.

Figura 1. Come realizzare una serie di diluizione 10 volte.
| Tubo | Diluizione |
| B | 10-2 |
| C | 10-3 |
| D | 10-4 |
| E | 10-5 |
| F | 10-6 |
Tabella 1. Tubi e diluizioni.
Risultati
La Figura 2 è un esempio di risultati rappresentativi.
p1 è scelto per essere il numero di tubi replicati della più alta diluizione (meno concentrati nel terreno) che ha il maggior numero di tubi positivi. Qui, le repliche del tubo B non contano, perché quelle del tubo C provengono da una diluizione più elevata. Al contrario, il numero di tubi del tubo D che mostrano un segno positivo di crescita è inferiore a quelli del tubo C. Quindi, p1 = 5.
p2 e p3 sono scelti per essere il numero di tubi nelle prossime due diluizioni più elevate che mostrano un segno positivo di crescita. Quindi, p2 = 3 e p3 = 1.
Il valore per p1 può essere trovato guardando verso il basso la prima colonna nella Tabella 2. Lo stesso viene fatto nella colonna p2. Quindi, il valore di p3 (attraverso la parte superiore) interseca i due definiti dai valori di p1 e p2. In questo esempio, il valore è 1,1 organismi per ml.
Dividete questo valore per la concentrazione di terreno nella diluizione a cui avete assegnato p2. In questo esempio, questo è tube D.

Quindi, in questo esempio, c'erano 1,1 x 104 cellule di alghe per g di terreno. Questo valore è abbastanza tipico del numero di alghe presenti nel suolo.
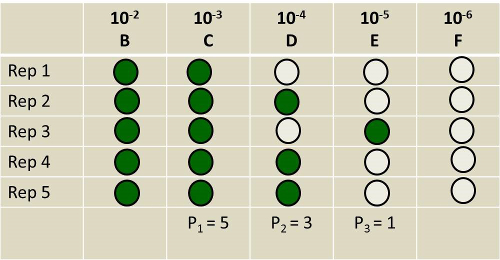
Figura 2. Risultato ipotetico di un esperimento di enumerazione delle alghe. I tubi ombreggiati indicano la presenza di alghe. I tubi non ombreggiati rappresentano l'assenza di alghe.
| Numero più probabile per i valori indicati di p3 | |||||||
| p1 | p2 | 0 | 1 | 2 | 3 | 4 | 5 |
| 0 0 0 0 0 0 |
0 1 2 3 4 5 |
-- 0.018 0.037 0.056 0.075 0.094 |
0.018 0.036 0.055 0.074 0.094 0.11 |
0.036 0.055 0.074 0.093 0.11 0.13 |
0.054 0.073 0.092 0.11 0.13 0.15 |
0.072 0.091 0.11 0.13 0.15 0.17 |
0.090 0.11 0.13 0.15 0.17 0.19 |
| 1 1 1 1 1 1 |
0 1 2 3 4 5 |
0.020 0.040 0.061 0.083 0.11 0.13 |
0.040 0.061 0.082 0.1 0.13 0.16 |
0.060 0.081 0.10 0.13 0.15 0.17 |
0.080 0.10 0.12 0.15 0.17 0.19 |
0.10 0.12 0.15 0.17 0.19 0.22 |
0.12 0.14 0.17 0.19 0.22 0.24 |
| 2 2 2 2 2 2 |
0 1 2 3 4 5 |
0.045 0.068 0.093 0.12 0.15 0.17 |
0.068 0.092 0.12 0.14 0.17 0.20 |
0.091 0.12 0.14 0.17 0.20 0.23 |
0.12 0.14 0.17 0.20 0.23 0.26 |
0.14 0.17 0.19 0.22 0.25 0.29 |
0.16 0.19 0.22 0.25 0.28 0.32 |
| 3 3 3 3 3 3 |
0 1 2 3 4 5 |
0.078 0.11 0.14 0.17 0.21 0.25 |
0.11 0.14 0.17 0.21 0.24 0.29 |
0.13 0.17 0.20 0.24 0.28 0.32 |
0.16 0.20 0.24 0.28 0.32 0.37 |
0.20 0.23 0.27 0.31 0.36 0.41 |
0.23 0.27 0.31 0.35 0.40 0.45 |
| 4 4 4 4 4 4 |
0 1 2 3 4 5 |
0.13 0.17 0.22 0.34 0.41 |
0.17 0.21 0.26 0.33 0.40 0.48 |
0.21 0.26 0.32 0.39 0.47 0.56 |
0.25 0.31 0.38 0.45 0.54 0.64 |
0.30 0.36 0.44 0.52 0.62 0.72 |
0.36 0.42 0.5 0.59 0.69 0.81 |
| 5 5 5 5 5 5 |
0 1 2 3 4 5 |
0.23 0.33 0.49 0.79 1.3 2.4 |
0.31 0.46 0.7 1.1 1.7 3.5 |
0.43 0.64 0.95 1.4 2.2 5.4 |
0.58 0.84 1.2 1.8 2.8 9.2 |
0.76 1.1 1.5 2.1 3.5 16 |
0.95 1.3 1.8 2.5 4.3 -- |
Tabella 2. Numeri più probabili da utilizzare con il disegno sperimentale in questo esercizio.
Applicazione e Riepilogo
La metodologia MPN è utile, perché consente la stima di una popolazione funzionale basata su un'attribuzione correlata al processo. Nell'esempio, il processo funzionale era la fotosintesi intrapresa dalle alghe, che consentiva la crescita in assenza di carbonio organico. Ciò ha permesso di enumerare le popolazioni algali totali nel suolo.
MPN viene anche utilizzato per stimare il numero di un particolare tipo di agenti patogeni microbici nell'acqua, come la Salmonella, utilizzando la resistenza della Salmonella al verde malachite.
Un'ulteriore applicazione è la stima dei funghi micorrizici inoculando le diluizioni del suolo su un ospite vegetale e cercando la colonizzazione delle radici da parte dei funghi.
Tags
Vai a...
Video da questa raccolta:

Now Playing
Enumerazione delle alghe tramite metodo di coltivazione
Environmental Microbiology
13.8K Visualizzazioni

Determinazione del contenuto di umidità del suolo
Environmental Microbiology
359.3K Visualizzazioni

Tecnica asettica nelle scienze ambientali
Environmental Microbiology
126.4K Visualizzazioni

Colorazione di Gram dei batteri provenienti da fonti ambientali
Environmental Microbiology
100.2K Visualizzazioni

Visualizzazione dei microrganismi del suolo tramite il test su vetrino a contatto e microscopia
Environmental Microbiology
42.2K Visualizzazioni

Funghi filamentosi
Environmental Microbiology
57.3K Visualizzazioni

Estrazione del DNA di comunità da colonie batteriche
Environmental Microbiology
28.8K Visualizzazioni

Rilevamento dei microrganismi ambientali tramite PCR ed elettroforesi su gel
Environmental Microbiology
44.6K Visualizzazioni

Analisi dell'RNA di campioni ambientali mediante RT-PCR
Environmental Microbiology
40.4K Visualizzazioni

Quantificazione di microrganismi e virus ambientali mediante qPCR
Environmental Microbiology
47.8K Visualizzazioni

Analisi della qualità dell'acqua tramite organismi indicatori
Environmental Microbiology
29.5K Visualizzazioni

Isolamento di batteri fecali da campioni d'acqua mediante filtrazione
Environmental Microbiology
39.3K Visualizzazioni

Rilevamento di batteriofagi in campioni di matrici ambientali
Environmental Microbiology
40.7K Visualizzazioni

Coltura e conta di batteri da campioni di suolo
Environmental Microbiology
184.3K Visualizzazioni

Analisi della curva di crescita batterica e sue applicazioni ambientali
Environmental Microbiology
295.9K Visualizzazioni