Method Article
La myotomie robotique de Heller pour les progrès dans la prise en charge chirurgicale de l’achalasie
Dans cet article
Résumé
Le protocole présente une approche robotique de la myotomie de Heller pour le traitement de l’achalasie.
Résumé
L’achalasie est un trouble de la motilité de l’œsophage. Cela se produit en raison de la destruction des nerfs dans le sphincter inférieur de l’œsophage (SOI), ce qui entraîne l’incapacité du LES à se détendre. Les patients se plaignent généralement de dysphagie, de douleurs thoraciques et de régurgitations. Ils signalent souvent qu’ils boivent des liquides contenant des solides pour aider à propulser les bolus alimentaires dans l’estomac. Le diagnostic d’achalasie est généralement confirmé par un œsophagogramme et une étude de motilité (manométrie œsophagienne). Un œsophagogramme montre classiquement le signe du bec de l’oiseau avec un rétrécissement dans l’œsophage distal. Le traitement de l’achalasie comprend des options chirurgicales et non chirurgicales. Le traitement chirurgical est associé à un taux plus faible de récidives, à un taux de réussite clinique élevé et à la durabilité du soulagement des symptômes. L’étalon-or actuel de la technique chirurgicale est la myotomie, ou la division des fibres musculaires de l’œsophage distal. La myotomie chirurgicale peut être réalisée via une technique laparoscopique ou robotique ; La myotomie endoscopique per-orale est une nouvelle intervention alternative. En raison du risque théorique de reflux gastro-œsophagien suite à une myotomie, une procédure anti-reflux est parfois pratiquée. Nous avons examiné l’approche d’une myotomie de Heller robotique pour le traitement de l’achalasie.
Introduction
L’achalasie est un trouble de la motilité de l’œsophage. La cause la plus fréquente d’achalasie est idiopathique, caractérisée par une altération des couches musculaires circulaires et longitudinales de l’œsophage en raison de la destruction des nerfs myentériques dans le sphincter inférieur de l’œsophage (LES)1. Cela conduit à l’incapacité des ERP à se détendre. L’achalasie est également associée à un risque accru de carcinome épidermoïde de l’œsophage. L’étalon-or pour diagnostiquer l’achalasie est la manométrie 2,3. Cependant, une endoscopie doit être effectuée pour exclure d’autres causes de rétrécissement, telles que la malignité de la jonction gastro-œsophagienne (JEG) et d’autres sténoces.
Le traitement de l’achalasie est divisé en options chirurgicales et non chirurgicales. Les traitements non chirurgicaux comprennent l’utilisation de médicaments tels que les inhibiteurs calciques et les nitrates, ainsi que les traitements endoscopiques comme la dilatation ou l’injection de toxine botulique. Les traitements non chirurgicaux ont des taux de récidive élevés 4,5. Le traitement chirurgical, en particulier la myotomie laparoscopique ou robotique, décrite à l’origine comme la myotomie de Heller, peut être effectué avec ou sans procédure anti-reflux. Le traitement chirurgical offre le meilleur traitement à long terme et soulage les symptômes de l’achalasie par dissection des muscles de la partie affectée de l’œsophage autour du LES6.
La décision de réaliser une fundoplicature à la suite d’une myotomie de Heller reste controversée. En théorie, les procédures anti-reflux, telles que les procédures Dor ou Toupet, réduisent le risque de reflux gastro-œsophagien (RGO) après une myotomie. La myotomie endoscopique perorale (POEM) a été développée comme une option dans le traitement de l’achalasie. À travers un tunnel sous-muqueux proximal, la couche musculaire de l’œsophage affecté est divisée distalement au niveau du LES et du cardia7. Nous effectuons la myotomie Heller en utilisant une approche robotique. La plate-forme robotique offre une visualisation haute définition améliorée de l’anatomie distale de l’œsophage et de l’hiatale, une amplitude de mouvement avancée et une diminution des taux de complications par rapport à l’approche laparoscopique8. Malgré tous les avantages de l’approche robotique, la méthode et l’approche du traitement chirurgical de l’achalasie reposent en fin de compte sur le chirurgien et dépendent des ressources disponibles, du niveau de confort et de l’expérience des techniques disponibles. L’objectif de ce protocole est de servir de guide et de ressource précieuse pour la formation des nouveaux chirurgiens de l’intestin antérieur, ainsi que des résidents, en rendant les étapes de la chirurgie claires et compréhensibles.
Protocole
Ce protocole suit les lignes directrices du comité d’éthique de la recherche sur l’être humain de notre établissement. Un consentement éclairé écrit a été obtenu à partir des cas des patients examinés pour le protocole. Critères d’inclusion - patients de tous âges qui ont été diagnostiqués avec une achalasie sur la base des manifestations cliniques, des critères manométriques et des études radiographiques. Critère d’exclusion - symptômes d’achalasie dus à une malignité gastro-œsophagienne.
1. Préparation préopératoire
- Placez les patients sur un régime liquide pendant 3 jours avant l’opération dans le but de débarrasser l’œsophage des aliments touchés.
- Placez le patient en position couchée et administrez une anesthésie endotrachéale générale (GETA) via une induction à séquence rapide (RSI) tout en maintenant la pression cricothyroïdienne pour réduire le risque d’aspiration pendant l’intubation. Pour fournir une pression cricothyroïdienne, appliquez une pression manuelle sur le cartilage cricoïde pour occlure l’œsophage.
REMARQUE : La technique RSI est réalisée par l’administration d’agents anesthésiques appropriés et d’agents bloquants neuromusculaires selon le protocole de l’anesthésiste. - Après une intubation endotrachéale réussie, effectuez une œsophagogastroduodénoscopie (EGD) pour évaluer le niveau de gravité de l’achalasie et déloger tout aliment solide coincé dans l’œsophage, si nécessaire (Figure 1A).
- Assurez-vous que l’endoscope est propre et correctement connecté au moniteur vidéo et à la source lumineuse. Confirmez que les canaux d’eau et d’air fonctionnent correctement, lubrifiez l’extrémité distale de l’endoscope pour faciliter l’insertion, puis insérez doucement l’endoscope dans l’œsophage par la bouche du patient sous visualisation directe.
REMARQUE : Habituellement, il y a une pression lorsque l’endoscope passe à travers la jonction gastro-œsophagienne avec pression.
- Assurez-vous que l’endoscope est propre et correctement connecté au moniteur vidéo et à la source lumineuse. Confirmez que les canaux d’eau et d’air fonctionnent correctement, lubrifiez l’extrémité distale de l’endoscope pour faciliter l’insertion, puis insérez doucement l’endoscope dans l’œsophage par la bouche du patient sous visualisation directe.
- Laissez l’endoscope dans l’estomac pour qu’il fonctionne comme une bougie et fournissez une contre-pression dans l’œsophage pendant la procédure de myotomie.
2 Placement des ports et amarrage robotique
REMARQUE : Un total de quatre ports robotiques de 8 mm sont nécessaires pour la chirurgie, et il est possible d’ajouter un cinquième port pour servir de trocart assistant.
- Après la stérilisation et la préparation de la peau à l’aide d’une solution antiseptique, effectuer une petite incision cutanée d’environ 1 cm à l’aide d’une lame à chaque site d’insertion prévu du trocart afin d’insérer le trocart dans la cavité abdominale.
- Placez le premier site portuaire à 15 cm sous l’apophyse xiphoïde, à 1-2 cm à gauche de la ligne médiane abdominale, à l’aide d’un laparoscope de 0° 5 mm et d’une technique de visualisation du trocart d’accès optique. Utilisez une aiguille à versets pour gonfler l’abdomen si nécessaire.
- Fixez l’insufflation de dioxyde de carbone et gonflez l’abdomen à 15 mmHg. Réinsérez la lunette à 0° et inspectez l’abdomen à la recherche d’un site de blessure potentielle au trocart. Changez le laparoscope à 30° pour faciliter le placement supplémentaire du trocart.
- En vision directe, placez trois trocarts robotiques de 8 mm en ligne transversale au niveau du premier port avec 4 à 8 cm entre chaque port (essayez de laisser 8 cm entre chaque port pour réduire les collisions à l’intérieur des bras robotiques). Les emplacements des ports robotiques (de gauche à droite du patient) se trouvent approximativement sur la ligne axillaire antérieure gauche, la ligne médio-claviculaire gauche et la ligne médio-claviculaire droite (Figure 2).
- Placez un trocart assistant supplémentaire dans le flanc droit au niveau de la ligne axillaire antérieure droite, juste au-dessus du niveau de l’ombilic.
- Placez un écarteur de foie Nathanson dans la région xiphoïde pour élever le lobe latéral gauche du foie et exposer le hiatus. Cela exposera tout le quadrant supérieur gauche, assurant une excellente exposition pour l’opération.
- Ancrez le robot. Préparez les instruments, qui comprennent un dispositif d’énergie bipolaire avancé, une pince à cardia, un bipolaire fenêtré et un cautérisation à crochet.
3 Division du ligament phren-œsophagien
- Divisez le ligament gastro-hépatique à l’aide du dispositif d’énergie bipolaire pour exposer le crus droit et la membrane phréno-œsophagienne (Figure 3).
- Identifiez la membrane phréno-œsophagienne et divisez-la à l’aide du dispositif d’énergie bipolaire pour exposer les fibres musculaires longitudinales de l’œsophage. Étendre et disséquer le plan avasculaire entre l’œsophage et le médiastin du crus droit au crus gauche après avoir divisé le ligament phren-œsophagien. Cette dissection devrait exposer la surface antérieure de l’œsophage.
- Identifier et préserver le nerf vague antérieur. Élevez et disséquez le nerf vague antérieur de l’œsophage pour faciliter la préservation du nerf et assurer une myotomie complète sous le nerf.
4 Myotomie œsophagienne
- Disséquer le coussinet adipeux gastro-œsophagien sur la surface antérieure à l’aide d’un crochet d’électrocautérisation à partir du niveau de l’estomac pour exposer le GEJ ; Commencez la dissection au niveau du coussinet adipeux distal.
- Étendez la dissection vers la partie proximale de la partie gauche à l’aide d’un crochet d’électrocautérisation, puis disséquez médialement vers la partie droite en prenant soin de préserver et de protéger le vague antérieur, qui traverse souvent la face médiale du coussinet adipeux.
- Avant d’effectuer la myotomie, exposez complètement la partie distale de l’œsophage et la partie antérieure de l’estomac proximal pour permettre la durée appropriée de la myotomie.
REMARQUE : L’objectif de longueur de la myotomie doit être d’au moins 6 cm dans l’œsophage distal et de 2 cm dans l’estomac proximal. - Commencer la myotomie juste à proximité du GEJ sur le côté de l’œsophage, à environ 1 cm proximal. Cette approche aidera le chirurgien à éviter les fibres de l’écharpe de l’estomac, qui peuvent parfois causer de la confusion lors de la dissection.
- Remplacez l’instrument bipolaire robotique avancé par le crochet robotique. Avec beaucoup de précautions, commencez la myotomie à 1 cm de la jonction GE par une brève application de l’énergie de la cautérisation avec le crochet robotique. En utilisant la traction du crochet robotique vers la paroi abdominale antérieure, divisez soigneusement les fibres musculaires de l’œsophage jusqu’à ce que la muqueuse de l’œsophage soit visualisée.
- Une fois la muqueuse visualisée, répétez le mouvement de traction du crochet (avec une utilisation minimale de cautérisation) pour déchirer les fibres musculaires de l’œsophage en proximal de l’œsophage. Poursuivez la dissection jusqu’à ce que la vue soit obstruée ou que la dissection ait atteint un point où la réparation d’une blessure serait difficile. Assurez-vous qu’il mesure au moins 6 cm de long (Figure 4 et Figure 5).
- Une fois la myotomie proximale terminée, continuez la dissection sur le côté de l’estomac.
REMARQUE : Une considération technique pendant la myotomie est de donner la priorité à la déchirure des fibres musculaires plutôt qu’à l’utilisation de la cautérisation. Cela permet de minimiser le risque de blessure thermique. Cependant, si la cautérisation est utilisée, il est recommandé de retirer les fibres circulaires de l’œsophage avant d’appliquer la cautérisation. (Graphique 4)
5 Post-myotomie œsophago-gastro-duodénoscopie
- Effectuer un EGD pour évaluer le GEJ. Assurez-vous que l’endoscope passe facilement sur le cardia et effectuez une inspection visuelle pour vous assurer qu’il n’y a pas de blessure thermique (Figure 1B).
- Effectuez un test d’étanchéité en gonflant l’œsophage et l’estomac avec de l’air tout en les immergeant dans l’eau. Évaluez la présence de bulles de gaz, ce qui pourrait indiquer une fuite.
- Après avoir terminé la myotomie, procédez à une fundoplicature de Dor à Toupet si indiqué.
REMARQUE : Si une fundoplicature de Toupet est réalisée, une dissection postérieure du hiatus est nécessaire. Cependant, si une fundoplicature de Dor doit être réalisée, il n’est pas nécessaire de perturber les attaches postérieures de l’œsophage. - Une fois l’intervention terminée, retirez l’endoscope ainsi que l’écarteur hépatique et les ports.
6 Soins postopératoires
- Dans la période postopératoire, administrer un régime multimodal de traitement de la douleur avec des médicaments anti-inflammatoires et opioïdes. Commencez les patients avec un régime liquide clair le jour de la chirurgie. Le 1er jour postopératoire, effectuez une évaluation radiographique avec une série gastro-intestinale supérieure pour évaluer les fuites (Figure 6B). La plupart des patients reçoivent leur congé le jour 1 postopératoire avec des instructions de suivre un régime liquide complet jusqu’à l’évaluation postopératoire à la clinique chirurgicale dans les 2 semaines.
Résultats
Dans notre centre universitaire de soins tertiaires, les complications peropératoires et postopératoires de la myotomie de Heller sont extrêmement rares. Entre 2020 et août 2023, le taux de perforation de la myotomie post-Heller était de 0 % en utilisant l’approche robotique. Au cours de cette période, nous avons effectué 105 myotomies robotiques de Heller. La perte de sang est généralement inférieure à 20 ml, et nous n’avons transfusé de sang pour aucun patient ; La durée du séjour à l’hôpital dépasse rarement le jour 1 postopératoire, et les patients peuvent boire immédiatement après l’opération, ce qui soulage leurs symptômes d’achalasie. Après la myotomie, nous effectuons régulièrement une œsophagogastroduodénoscopie peropératoire (EGD) pour évaluer la jonction gastro-œsophagienne (GE). Lors de cet examen, nous nous assurons que l’endoscope peut facilement traverser le cardia (Figure 1B), et nous pouvons exclure toute blessure à l’aide d’un test d’étanchéité. Ces dernières années, nous avons commencé à utiliser des sondes d’imagerie à lumière fonctionnelle endoluminale pendant l’opération. Notre patient a été choisi au hasard. Elle est âgée de 67 ans et a des antécédents de rhumatisme psoriasique et d’achalasie de type II. Elle souffrait de dysphagie progressive, même après une tentative précédente de la traiter avec du Botox et de la dilatation. La procédure (myotomie de Heller) a été réalisée avec succès sans aucune complication, et aucune transfusion sanguine n’a été nécessaire. Elle a pu boire immédiatement après l’intervention et a ressenti un soulagement évident de la dysphagie. Après l’opération, elle est rentrée chez elle le jour 1 postopératoire. Ces résultats suite à la chirurgie nous permettent d’être confiant quant à une myotomie sûre et complète (Tableau 1). L’évaluation radiographique de la série gastro-intestinale supérieure réalisée avant l’opération et le jour 1 postopératoire, montrant l’ablation des sténoses et l’absence de fuites, est illustrée à la figure 6.
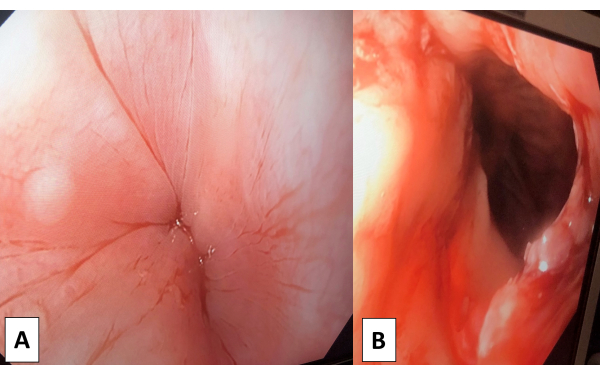
Figure 1 : Œsophagogastroduodénoscopie. (A) L’œsophagogastroduodénoscopie préopératoire (EGD) a été utilisée pour visualiser la gravité de l’achalasie et exclure d’autres signes (GEJ, malignité et autres sténoces). (B) L’œsophagogastroduodénoscopie post-myotomie (EGD) a pu faire passer l’endoscope à travers le cardia facilement, et aucune lésion thermique n’a été trouvée. Veuillez cliquer ici pour voir une version agrandie de cette figure.
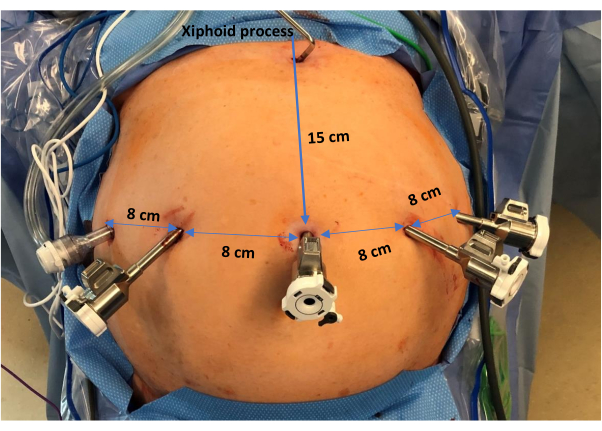
Figure 2 : Placement des trocarts. De gauche à droite du patient, l’image représente la disposition de 4 trocarts robotiques espacés d’environ 8 cm. De plus, il y a un trocart assistant positionné au niveau de la ligne axillaire antérieure droite. De plus, un écarteur hépatique de Nathanson est visible dans la région xiphoïde. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Division du ligament gastrohépatique. Division du ligament gastro-hépatique, exposant la cruse droite et la membrane phren-œsophagienne, à l’aide du dispositif d’énergie bipolaire. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Myotomie œsophagienne. L’image montre l’application d’une traction à l’aide d’un crochet robotique vers la paroi abdominale antérieure tout en séparant soigneusement les fibres musculaires de l’œsophage jusqu’à ce que la muqueuse œsophagienne devienne visible. Veuillez cliquer ici pour voir une version agrandie de cette figure.
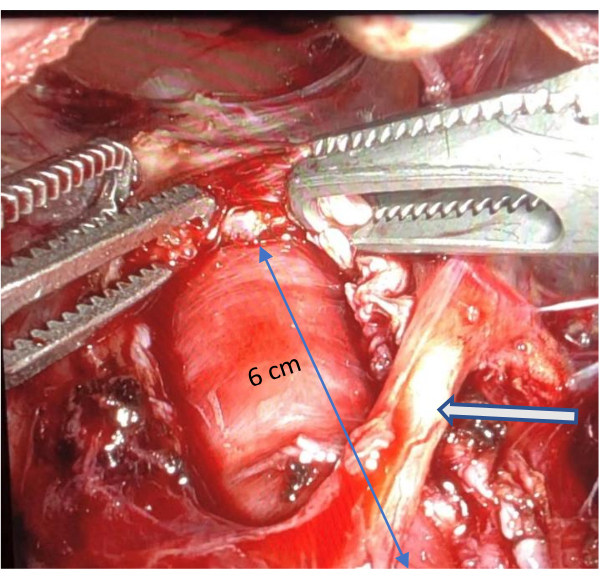
Figure 5 : Myotomie œsophagienne complète. L’image illustre une myotomie œsophagienne complète d’au moins 6 cm, mettant en évidence la préservation de la branche nerveuse vague antérieure indiquée par une flèche. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 6 : Série GI supérieure. (A) Cette image montre un œsophage dilaté et une sténose de l’EGJ après l’ingestion de baryum au cours d’une série gastro-intestinale. (B) Suite à la myotomie de Heller, on peut observer un soulagement significatif de la dilatation de l’œsophage et une amélioration significative de la sténose GEJ avec le passage du baryum. De plus, aucune preuve de fuite ou d’air libre n’a été trouvée. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Âge | 67 ans |
| Genre | Femelle |
| Course | Blanc ou caucasien |
| IMC | 40 |
| Peropératoire | |
| Temps opératoire, min | Durée : 160 minutes |
| Perte de sang peropératoire, mL | 20 mL |
| Postopératoire | |
| Complications postopératoires | Aucun |
| Durée du séjour à l’hôpital, jours | 2 |
| Sortie, jour postopératoire (POD) | POD 1 |
Tableau 1 : Données démographiques et paramètres opérationnels du patient.
Discussion
La myotomie de Heller laparoscopique et robotique est maintenant la procédure de choix avec ou sans fundoplicature6. Les principales questions litigieuses tournent autour de la nécessité de la fundoplicature après la myotomie de Heller, ainsi que du type de fundoplicature (Toupet, Dor, Nissen) pour minimiser le RGO. La myotomie endoscopique perorale (POEM) est une autre option pour le traitement de l’achalasie ; Cependant, cette option ne prévoit pas de procédure de fundoplicature8. Par conséquent, les chirurgiens doivent prendre des décisions concernant les procédures à effectuer en fonction de leur propre expérience et de leurs préférences. Le point critique de la myotomie est d’obtenir une longueur de myotomie suffisante du côté de l’œsophage et de l’estomac. La myotomie gastrique est parfois plus difficile que la myotomie œsophagienne, car il y a maintenant une couche séreuse de la paroi de l’estomac et les fibres de l’écharpe gastrique sont également présentes. Au cours de cette dissection, il est également fréquent de rencontrer de grandes veines sous-muqueuses alimentant le système veineux gastrique gauche. En cas de saignement, il est recommandé d’utiliser une pression et un agent thrombotique pour arrêter le saignement. De plus, des précautions doivent être prises lors de l’utilisation de la cautérisation à crochet pour éviter de blesser la muqueuse œsophagienne et pour prévenir la perforation9. S’il y a des problèmes d’exposition du médiastin pendant la myotomie œsophagienne, la partie antérieure du hiatus diaphragmatique peut être divisée pour augmenter l’exposition. Cependant, si cela est fait, celui-ci doit être fermé avec un point permanent à la fin de l’affaire.
Les avantages de la chirurgie robotique par rapport aux autres sont une dextérité accrue et une plus grande précision grâce à une meilleure visualisation avec la vue tridimensionnelle. De plus, il donne au chirurgien la possibilité d’opérer même dans des espaces restreints, d’où son utilisation en chirurgie pelvienne. Une méta-analyse a montré un taux de perforation peropératoire plus faible avec la myotomie robotique de Heller par rapport à la chirurgie laparoscopique (0 % contre 11 %, respectivement)10. L’inconvénient de l’approche robotique est signalé coût plus élevé11. Les limites de l’approche laparoscopique comprennent une faible amplitude de mouvement et une vision et une stabilité visuelle limitées par rapport à la robotique.
En conclusion, entre les mains de chirurgiens expérimentés, la chirurgie robotique est plus sûre et donne des résultats exceptionnels en raison de sa visualisation améliorée, de la stabilité de la plate-forme et de l’articulation accrue des instruments.
Déclarations de divulgation
Le Dr DuCoin travaille pour Intuitive Surgical, Medtronic et Johnson & Johnson. Les autres auteurs ne déclarent aucun intérêt concurrent.
Remerciements
Je tiens à exprimer ma sincère gratitude au Dr DuCoin pour l’opportunité d’étudier la chirurgie robotique de l’intestin antérieur. En tant que chercheur israélien, je suis reconnaissant d’avoir l’occasion de partager cette approche robotique de la myotomie de Heller utilisée dans notre centre. Les auteurs n’ont reçu aucun financement pour ce travail.
matériels
| Name | Company | Catalog Number | Comments |
| 8 mm assistance port | Da Vinci | ||
| Air Seal insuflation system | CONMED | Ias8-120LP | |
| Force bipolar grasper | |||
| Forceps | |||
| Four 8-mm robotic ports | Da Vinci | ||
| Hook cautery. | COVIDIEN | E3773-36C | |
| Nathanson liver retractor | Mediflex | 69704-3 | |
| Needle driver | COVIDIEN | 172015 | |
| Robotic 30° endoscope | Da Vinci | 470057 | |
| Robotic advanced bipolar device (Vessel Sealer) | INTUITIVE SURGICAL | 480422 | |
| Two laparoscopic graspers | Stortv |
Références
- Boeckxstaens, G. E., Zaninotto, G., Richter, J. E. Achalasia. Lancet. 383, 83-93 (2014).
- Goyal, R. K., Chaudhury, A. Pathogenesis of achalasia: lessons from mutant mice. Gastroenterology. 39 (4), 1086-1090 (2010).
- Leeuwenburgh, I., et al. Long-term esophageal cancer risk in patients with primary achalasia: a prospective study. Am J Gastroenterol. 105 (10), 2144-2149 (2010).
- Campos, G. M., et al. Endoscopic and surgical treatments for achalasia: a systematic review and meta-analysis. Ann Surg. 249 (1), 45-57 (2009).
- Lopushinsky, S. R., Urbach, D. R. Pneumatic dilatation and surgical myotomy for achalasia. JAMA. 296 (18), 2227-2233 (2006).
- Yaghoobi, M., et al. Laparoscopic Heller's myotomy versus pneumatic dilation in the treatment of idiopathic achalasia: a meta-analysis of randomized, controlled trials. Gastrointest Endosc. 78 (3), 468-475 (2013).
- Boeckxstaens, G. E., et al. Pneumatic dilation versus laparoscopic Heller's myotomy for idiopathic achalasia. N Engl J Med. 364 (19), 1807-1816 (2011).
- Patti, M. G., Schlottmann, F., Herbella, F. A. M. Laparoscopic Heller myotomy and robotic Heller myotomy: when is it indicated. Mini-invasive. Surgery. 6, 38(2022).
- Campos, G. M., et al. Endoscopic and surgical treatments for achalasia: a systematic review and meta-analysis. Ann Surg. 249 (1), 45-57 (2009).
- Maeso, S., et al. Efficacy of the Da Vinci surgical system in abdominal surgery compared with that of laparoscopy: a systematic review and meta-analysis. Ann Surg. 252 (2), 254-262 (2010).
- Huffmanm, L. C., et al. Robotic Heller myotomy: a safe operation with higher postoperative quality-of-life indices. Surgery. 142 (4), 613-618 (2007).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon