Method Article
Miotomía robótica de Heller para avances en el tratamiento quirúrgico de la acalasia
En este artículo
Resumen
El protocolo presenta un enfoque robótico de la miotomía de Heller para el tratamiento de la acalasia.
Resumen
La acalasia es un trastorno de la motilidad esofágica. Se produce debido a la destrucción de los nervios en el esfínter esofágico inferior (EEI), lo que conduce a la incapacidad de la relajación del EEI. Los pacientes suelen quejarse de disfagia, dolor torácico y regurgitación. A menudo informan que beben líquidos con ingesta de sólidos para ayudar a impulsar los bolos alimenticios hacia el estómago. El diagnóstico de acalasia generalmente se confirma con un esofagograma y un estudio de motilidad (manometría esofágica). Un esofagograma muestra clásicamente el signo del pico del ave con estrechamiento en el esófago distal. El tratamiento para la acalasia incluye opciones quirúrgicas y no quirúrgicas. El tratamiento quirúrgico se asocia con una tasa más baja de recurrencias, una alta tasa de éxito clínico y la durabilidad del alivio de los síntomas. El estándar de oro actual de la técnica quirúrgica es la miotomía, o la división de las fibras musculares del esófago distal. La miotomía quirúrgica se puede realizar mediante una técnica laparoscópica o robótica; La miotomía endoscópica peroral es una nueva alternativa de intervención. Debido al riesgo teórico de reflujo gastroesofágico después de una miotomía, a veces se realiza un procedimiento antirreflujo. Se revisó el abordaje de una miotomía robótica de Heller para el tratamiento de la acalasia.
Introducción
La acalasia es un trastorno de la motilidad esofágica. La causa más común de acalasia es la idiopática, caracterizada por el deterioro de las capas musculares circulares y longitudinales del esófago debido a la destrucción de los nervios mientéricos en el esfínter esofágico inferior (EEI)1. Esto conduce a la incapacidad del EEI para relajarse. La acalasia también se asocia con un mayor riesgo de carcinoma de células escamosas de esófago. El estándar de oro para el diagnóstico de la acalasia es la manometría 2,3. Sin embargo, se debe realizar una endoscopia para descartar otras causas de estrechamiento, como la neoplasia maligna de la unión gastroesofágica (GEJ) y otras estenosis.
El tratamiento de la acalasia se divide en opciones quirúrgicas y no quirúrgicas. Los tratamientos no quirúrgicos incluyen el uso de fármacos como bloqueadores de los canales de calcio y nitratos, así como tratamientos endoscópicos como la dilatación o la inyección de toxina botulínica. Los tratamientos no quirúrgicos tienen altas tasas de recurrencia 4,5. El tratamiento quirúrgico, específicamente la miotomía laparoscópica o robótica, originalmente descrita como miotomía de Heller, se puede realizar con o sin un procedimiento antirreflexivo. El tratamiento quirúrgico proporciona el mejor tratamiento a largo plazo y alivia los síntomas de la acalasia mediante la disección de los músculos de la parte afectada del esófago alrededor del EEI6.
La decisión de realizar una funduplicatura después de la miotomía de Heller sigue siendo controvertida. En teoría, los procedimientos antirrefluos, como los procedimientos Dor o Toupet, reducen el riesgo de enfermedad por reflujo gastroesofágico (ERGE) después de la miotomía. La miotomía endoscópica peroral (POEM) se ha desarrollado como una opción en el tratamiento de la acalasia. A través de un túnel submucoso proximal, la capa muscular del esófago afectado se divide distalmente a nivel del EEI y del cardias7. Realizamos la miotomía de Heller utilizando un enfoque robótico. La plataforma robótica ofrece una visualización mejorada de alta definición de la anatomía esofágica y de hiato distal, un rango de movimiento avanzado y tasas de complicaciones disminuidas en comparación con el abordaje laparoscópico8. A pesar de todas las ventajas del enfoque robótico, el método y el enfoque para el tratamiento quirúrgico de la acalasia la decisión recae en última instancia en el cirujano y depende de los recursos disponibles, el nivel de comodidad y la experiencia con las técnicas disponibles. El objetivo de este protocolo es servir como una guía y un recurso valioso para capacitar a los nuevos cirujanos del intestino anterior, así como a los residentes, haciendo que los pasos de la cirugía sean claros y comprensibles.
Protocolo
Este protocolo sigue los lineamientos del comité de ética en investigación humana de nuestra institución. Se obtuvo el consentimiento informado por escrito de los casos de los pacientes revisados para el protocolo. Criterios de inclusión: pacientes de todas las edades con diagnóstico de acalasia basados en manifestaciones clínicas, criterios manométricos y estudios radiográficos. Criterios de exclusión: síntomas de acalasia por neoplasia maligna gastroesofágica.
1. Preparación preoperatoria
- Coloque a los pacientes en una dieta líquida durante 3 días antes de la operación en un intento de limpiar el esófago de los alimentos afectados.
- Coloque al paciente en posición supina y administre anestesia endotraqueal general (GETA) a través de una inducción de secuencia rápida (RSI) mientras mantiene la presión cricotiroidea para reducir el riesgo de aspiración durante la intubación. Para proporcionar presión cricotiroidea, aplique presión manual sobre el cartílago cricoides para ocluir el esófago.
NOTA: La técnica RSI se lleva a cabo mediante la administración de agentes anestésicos apropiados y agentes bloqueantes neuromusculares según el protocolo del anestesiólogo. - Después de una intubación endotraqueal exitosa, realizar una esofagogastroduodenoscopia (EGD) para evaluar el nivel de gravedad de la acalasia y desalojar cualquier alimento sólido atascado en el esófago, si es necesario (Figura 1A).
- Asegúrese de que el endoscopio esté limpio y conectado correctamente al monitor de vídeo y a la fuente de luz. Confirme que los canales de agua y aire funcionan correctamente, lubrique el extremo distal del endoscopio para facilitar la inserción y, a continuación, inserte suavemente el endoscopio a través de la boca del paciente en el esófago bajo visualización directa.
NOTA: Por lo general, hay un estallido de presión a medida que el endoscopio pasa a través de la unión gastroesofágica con presión.
- Asegúrese de que el endoscopio esté limpio y conectado correctamente al monitor de vídeo y a la fuente de luz. Confirme que los canales de agua y aire funcionan correctamente, lubrique el extremo distal del endoscopio para facilitar la inserción y, a continuación, inserte suavemente el endoscopio a través de la boca del paciente en el esófago bajo visualización directa.
- Deje que el endoscopio en el estómago funcione como un flotador y proporcione contrapresión dentro del esófago durante el procedimiento de miotomía.
2 Colocación de puertos y acoplamiento robótico
NOTA: Se requieren un total de cuatro puertos robóticos de 8 mm para la cirugía, y existe la opción de agregar un quinto puerto para que sirva como trocar asistente.
- Después de la esterilización y preparación de la piel con una solución antiséptica, realice una pequeña incisión en la piel de aproximadamente 1 cm con una cuchilla en cada sitio de inserción del trócar planificado para insertar el trócar en la cavidad abdominal.
- Colocar el primer sitio del puerto a 15 cm por debajo de la apófisis xifoides, a 1-2 cm a la izquierda de la línea media abdominal, utilizando un laparoscopio de 0° 5 mm y una técnica de visualización de trocar de acceso óptico. Use una aguja para inflar el abdomen cuando sea necesario.
- Conecte la insuflación de gas de dióxido de carbono e infle el abdomen a 15 mmHg. Vuelva a insertar el endoscopio de 0° e inspeccione el abdomen en busca de cualquier sitio de posible lesión del trócar. Cambie el laparoscopio a 30° para facilitar la colocación adicional del trócar.
- Bajo visión directa, coloque tres trócares robóticos de 8 mm en línea transversal al nivel del primer puerto con 4-8 cm entre cada puerto (intente dejar 8 cm entre cada puerto para reducir las colisiones dentro de los brazos robóticos). Las ubicaciones de los puertos robóticos (de izquierda a derecha del paciente) se encuentran aproximadamente en la línea axilar anterior izquierda, la línea medioclavicular izquierda y la línea media clavicular derecha (Figura 2).
- Coloque un trócar auxiliar adicional en el flanco derecho a la altura de la línea axilar anterior derecha, justo por encima del nivel del ombligo.
- Coloque un retractor hepático Nathanson en la región xifoides para elevar el lóbulo lateral izquierdo del hígado y exponer el hiato. Esto expondrá todo el cuadrante superior izquierdo, lo que garantiza una excelente exposición para la operación.
- Acopla el robot. Prepare los instrumentos, que incluyen un dispositivo avanzado de energía bipolar, una pinza de cardias, una cámara bipolar fenestrada y una cauterio con gancho.
3 División del ligamento frén-esofágico
- Divida el ligamento gastrohepático utilizando el dispositivo de energía bipolar para exponer el crus derecho y la membrana frén-esofágica (Figura 3).
- Identificar la membrana freno-esofágica y dividirla utilizando el dispositivo de energía bipolar para exponer las fibras musculares longitudinales del esófago. Extender y diseccionar el plano avascular entre el esófago y el mediastino desde el esófago derecho hasta el izquierdo después de dividir el ligamento frén-esofágico. Esta disección debe exponer la superficie anterior del esófago.
- Identificar y preservar el nervio vago anterior. Elevar y diseccionar el nervio vago anterior del esófago para facilitar la preservación del nervio y asegurar una miotomía completa debajo del nervio.
4 Miotomía esofágica
- Diseccionar la almohadilla de grasa gastroesofágica en la superficie anterior utilizando un gancho de electrocauterización desde el nivel del estómago para exponer la GEJ; Comience la disección en la almohadilla de grasa distal.
- Extienda la disección proximalmente al crus izquierdo con un gancho de electrocauterización, y luego diseccione medialmente hacia el crus derecho con cuidado para preservar y proteger el vago anterior, que a menudo atraviesa el aspecto medial de la almohadilla de grasa.
- Antes de realizar la miotomía, exponga completamente la porción distal del esófago y la porción anterior del estómago proximal para permitir la longitud adecuada de la miotomía.
NOTA: El objetivo de longitud de la miotomía debe ser de un mínimo de 6 cm en el esófago distal y de 2 cm en el estómago proximal. - Comenzar la miotomía justo proximal a la UGE en el lado del esófago, aproximadamente 1 cm proximal. Este enfoque ayudará al cirujano a evitar las fibras del cabestrillo del estómago, que ocasionalmente pueden causar confusión durante la disección.
- Cambie el instrumento bipolar avanzado robótico por el gancho robótico. Con mucho cuidado, inicie la miotomía 1 cm proximal a la unión GE con una breve aplicación de energía de cauterización con el gancho robótico. Usando la tracción del gancho robótico hacia la pared abdominal anterior, divida cuidadosamente las fibras musculares esofágicas hasta que se visualice la mucosa esofágica.
- Después de visualizar la mucosa, repita el movimiento de tracción del gancho (con un uso mínimo de cauterización) para desgarrar las fibras musculares esofágicas proximalmente sobre el esófago. Continúe la disección hasta que la vista se obstruya o la disección haya llegado a un punto en el que la reparación de una lesión sea un desafío. Asegúrese de que tenga al menos 6 cm de largo (Figura 4 y Figura 5).
- Después de completar la miotomía proximal, continúe la disección hacia el costado del estómago.
NOTA: Una consideración técnica durante la miotomía es priorizar el desgarro de las fibras musculares en lugar de usar cauterización. Esto ayuda a minimizar el riesgo de lesiones térmicas. Sin embargo, si se utiliza cauterización, se recomienda separar las fibras circulares del esófago antes de aplicar la cauterización. (Figura 4)
5 Esófago-gastro-duodenoscopia post-miotomía
- Realizar un EGD para evaluar el GEJ. Asegúrese de que el endoscopio pase fácilmente a través del cardias y utilice la inspección visual para asegurarse de que no haya lesión térmica (Figura 1B).
- Realice una prueba de fugas inflando el esófago y el estómago con aire mientras los sumerge en agua. Evalúe la presencia de burbujas de gas, lo que podría indicar una fuga.
- Después de completar la miotomía, proceda con una funduplicatura de Dor a Toupet si está indicado.
NOTA: Si se realiza una funduplicatura de Toupet, es necesaria la disección posterior del hiato. Sin embargo, si se va a realizar una funduplicatura de Dor, no es necesario alterar las inserciones posteriores del esófago. - Al finalizar el procedimiento, retire el endoscopio junto con el retractor hepático y los puertos.
6 Cuidados postoperatorios
- En el postoperatorio, administrar un régimen de dolor multimodal con medicamentos antiinflamatorios y opioides. Comience a los pacientes con una dieta de líquidos claros el día de la cirugía. En el día 1 postoperatorio, realizar una evaluación radiográfica con una serie GI superior para evaluar si hay fugas (Figura 6B). La mayoría de los pacientes son dados de alta el día 1 postoperatorio con instrucciones de seguir una dieta líquida completa hasta la evaluación postoperatoria en la clínica quirúrgica dentro de las 2 semanas.
Resultados
En nuestro centro académico de atención terciaria, las complicaciones intraoperatorias y postoperatorias de la miotomía de Heller son extremadamente raras. Entre 2020 y agosto de 2023, la tasa de perforación de miotomía posterior a Heller fue del 0% utilizando el enfoque robótico. Durante este período, se realizaron 105 miotomías robóticas de Heller. La pérdida de sangre es generalmente inferior a 20 mL, y no transfundimos sangre a ningún paciente; La duración de la estancia hospitalaria rara vez supera el día 1 postoperatorio, y los pacientes pueden beber inmediatamente después de la cirugía, experimentando un alivio de sus síntomas de acalasia. Después de la miotomía, realizamos de forma rutinaria una esofagogastroduodenoscopia intraoperatoria (EGD) para evaluar la unión gastroesofágica (GE). Durante este examen, nos aseguramos de que el endoscopio pueda atravesar fácilmente el cardias (Figura 1B) y podemos descartar cualquier lesión mediante una prueba de fugas. En los últimos años, hemos comenzado a utilizar sondas de imagen de lúmenes funcionales endoluminales durante la operación. Nuestro paciente fue elegido al azar. Es una mujer de 67 años con antecedentes de artritis psoriásica y acalasia tipo II. Había estado sufriendo de disfagia progresiva, incluso después de un intento previo de tratarla con Botox y dilatación. El procedimiento (miotomía de Heller) se realizó con éxito, sin complicaciones, y no se necesitaron transfusiones de sangre. Pudo beber inmediatamente después del procedimiento y sintió un alivio evidente de la disfagia. Después de la cirugía, fue dada de alta en el día 1 del postoperatorio. Estos resultados tras la cirugía nos permiten estar seguros de una miotomía segura y completa (Tabla 1). En la Figura 6 se muestra la evaluación radiográfica de la serie GI superior realizada antes de la operación y en el día postoperatorio 1, que muestra la eliminación de las estenosis y la ausencia de fugas.
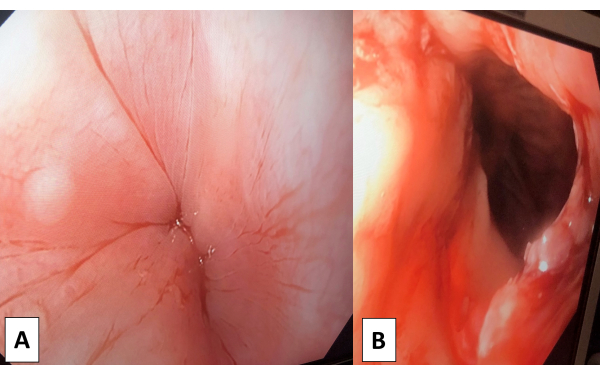
Figura 1: Esofagogastroduodenoscopia. (A) Se utilizó la esofagogastroduodenoscopia preoperatoria (EGD) para visualizar la gravedad de la acalasia y descartar otros hallazgos (neoplasia maligna de GEJ y otras estenosis). (B) La esofagogastroduodenoscopia (EGD) posterior a la miotomía pudo pasar el endoscopio a través del cardias fácilmente y no se encontró lesión térmica. Haga clic aquí para ver una versión más grande de esta figura.
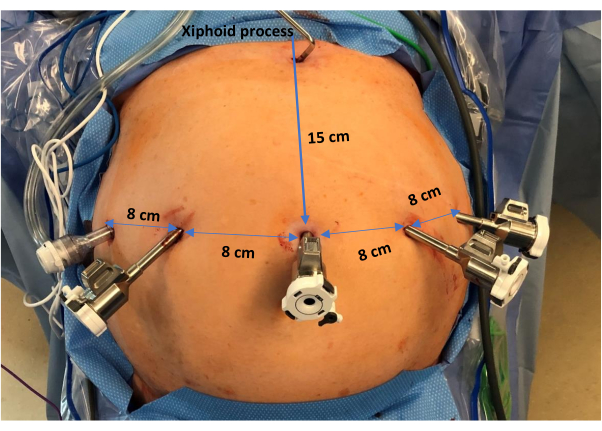
Figura 2: Colocación de los trócares. De izquierda a derecha del paciente, la imagen muestra la disposición de 4 trócares robóticos espaciados aproximadamente a 8 cm de distancia. Además, hay un trocar auxiliar situado a nivel de la línea axilar anterior derecha. Además, un retractor hepático de Nathanson es visible en la región xifoides. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: División del ligamento gastrohepático. División del ligamento gastorrepático, exponiendo la vasija derecha y la membrana frenesofágica, mediante el dispositivo de energía bipolar. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Miotomía esofágica. La imagen muestra la aplicación de tracción mediante un gancho robótico hacia la pared abdominal anterior mientras se separan cuidadosamente las fibras musculares del esófago hasta que la mucosa esofágica se hace visible. Haga clic aquí para ver una versión más grande de esta figura.
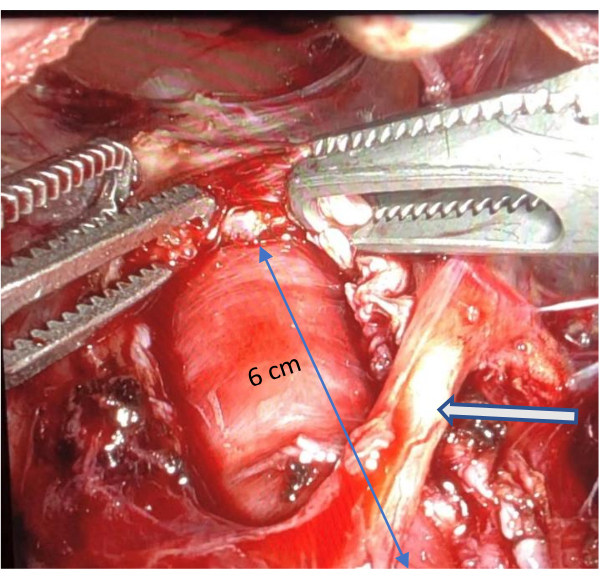
Figura 5: Miotomía esofágica completa. La imagen ilustra una miotomía esofágica completa de al menos 6 cm, destacando la preservación de la rama anterior del nervio vago indicada por una flecha. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Serie GI superior. (A) Esta imagen muestra un esófago dilatado y una estenosis de EGJ después de ingerir bario durante una serie GI. (B) Después de la miotomía de Heller, podemos observar un alivio significativo en la dilatación esofágica y una mejora significativa de la estenosis de la UGE con el paso del bario. Además, no se encontró evidencia de una fuga o aire libre. Haga clic aquí para ver una versión más grande de esta figura.
| Edad | 67 años |
| Género | Hembra |
| Raza | Blanco o caucásico |
| IMC | 40 |
| Intraoperatorio | |
| Tiempo de operación, min | 160 minutos |
| Pérdida de sangre intraoperatoria, mL | 20 mL |
| Postoperatorio | |
| Complicaciones postoperatorias | Ninguno |
| Duración de la estancia hospitalaria, días | 2 |
| Alta postoperatoria (POD) | POD 1 |
Tabla 1: Demografía del paciente y parámetros de operación.
Discusión
La miotomía de Heller laparoscópica y robótica es ahora el procedimiento de elección con o sin funduplicatura6. Los principales temas polémicos giran en torno a la necesidad de funduplicatura después de la miotomía de Heller, así como el tipo de funduplicatura (Toupet, Dor, Nissen) para minimizar la ERGE. La miotomía endoscópica peroral (POEM) es otra opción para el tratamiento de la acalasia; Sin embargo, esta opción carece de un procedimiento de funduplicatura8. Por lo tanto, los cirujanos deben tomar decisiones sobre qué procedimientos realizar en función de su propia experiencia y preferencias. El punto crítico en la miotomía es obtener una longitud suficiente de miotomía tanto en el lado esofágico como en el gástrico. La miotomía del lado gástrico es, a veces, más desafiante que la miotomía esofágica, ya que ahora hay una capa serosa de la pared del estómago y las fibras del cabestrillo gástrico también están presentes. Durante esta disección, también es común encontrar grandes venas submucosas que alimentan el sistema venoso gástrico izquierdo. Si se encuentra sangrado, se recomienda usar presión y un agente trombótico para detener el sangrado. Además, se debe tener precaución al utilizar la cauterización con gancho para evitar lesiones en la mucosa esofágica y prevenir la perforación9. Si hay problemas con la exposición del mediastino durante la miotomía esofágica, la porción anterior del hiato diafragmático se puede dividir para aumentar la exposición. Sin embargo, si se hace esto, este debe cerrarse con una puntada permanente al finalizar el caso.
Las ventajas de la cirugía robótica en comparación con otras son una mayor destreza y una mayor precisión debido a una mejor visualización con la vista tridimensional. Además, le da al cirujano la capacidad de operar incluso en espacios reducidos, de ahí su utilización en la cirugía pélvica. Un estudio de metaanálisis mostró una menor tasa de perforación intraoperatoria con la miotomía robótica de Heller en comparación con la cirugía laparoscópica (0% vs. 11%, respectivamente)10. La desventaja del enfoque robótico es que se ha reportado un mayor costo11. Las limitaciones del enfoque laparoscópico incluyen un rango de movimiento deficiente y una estabilidad visual y visual limitadas en comparación con la robótica.
En conclusión, en manos de cirujanos experimentados, la cirugía robótica es más segura y produce resultados excepcionales debido a su mejor visualización, estabilidad de la plataforma y mayor articulación de los instrumentos.
Divulgaciones
El Dr. DuCoin trabaja para Intuitive Surgical, Medtronic y Johnson & Johnson. Los demás autores declaran no tener intereses contrapuestos.
Agradecimientos
Me gustaría expresar mi más sincero agradecimiento al Dr. DuCoin por la oportunidad de estudiar la cirugía robótica del intestino anterior. Como becario de investigación de Israel, estoy agradecido por la oportunidad de compartir este enfoque robótico de la miotomía Heller utilizado en nuestro centro. Los autores no recibieron financiación para este trabajo.
Materiales
| Name | Company | Catalog Number | Comments |
| 8 mm assistance port | Da Vinci | ||
| Air Seal insuflation system | CONMED | Ias8-120LP | |
| Force bipolar grasper | |||
| Forceps | |||
| Four 8-mm robotic ports | Da Vinci | ||
| Hook cautery. | COVIDIEN | E3773-36C | |
| Nathanson liver retractor | Mediflex | 69704-3 | |
| Needle driver | COVIDIEN | 172015 | |
| Robotic 30° endoscope | Da Vinci | 470057 | |
| Robotic advanced bipolar device (Vessel Sealer) | INTUITIVE SURGICAL | 480422 | |
| Two laparoscopic graspers | Stortv |
Referencias
- Boeckxstaens, G. E., Zaninotto, G., Richter, J. E. Achalasia. Lancet. 383, 83-93 (2014).
- Goyal, R. K., Chaudhury, A. Pathogenesis of achalasia: lessons from mutant mice. Gastroenterology. 39 (4), 1086-1090 (2010).
- Leeuwenburgh, I., et al. Long-term esophageal cancer risk in patients with primary achalasia: a prospective study. Am J Gastroenterol. 105 (10), 2144-2149 (2010).
- Campos, G. M., et al. Endoscopic and surgical treatments for achalasia: a systematic review and meta-analysis. Ann Surg. 249 (1), 45-57 (2009).
- Lopushinsky, S. R., Urbach, D. R. Pneumatic dilatation and surgical myotomy for achalasia. JAMA. 296 (18), 2227-2233 (2006).
- Yaghoobi, M., et al. Laparoscopic Heller's myotomy versus pneumatic dilation in the treatment of idiopathic achalasia: a meta-analysis of randomized, controlled trials. Gastrointest Endosc. 78 (3), 468-475 (2013).
- Boeckxstaens, G. E., et al. Pneumatic dilation versus laparoscopic Heller's myotomy for idiopathic achalasia. N Engl J Med. 364 (19), 1807-1816 (2011).
- Patti, M. G., Schlottmann, F., Herbella, F. A. M. Laparoscopic Heller myotomy and robotic Heller myotomy: when is it indicated. Mini-invasive. Surgery. 6, 38(2022).
- Campos, G. M., et al. Endoscopic and surgical treatments for achalasia: a systematic review and meta-analysis. Ann Surg. 249 (1), 45-57 (2009).
- Maeso, S., et al. Efficacy of the Da Vinci surgical system in abdominal surgery compared with that of laparoscopy: a systematic review and meta-analysis. Ann Surg. 252 (2), 254-262 (2010).
- Huffmanm, L. C., et al. Robotic Heller myotomy: a safe operation with higher postoperative quality-of-life indices. Surgery. 142 (4), 613-618 (2007).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados