Preparación de equipos y reactivos anhidros
Visión general
Fuente: Laboratorio del Dr. Dana Lashley - College of William and Mary
Demostrada por: Cuba de tintura de Timoteo y Lucas Arney
Muchas reacciones en química orgánica son sensibles a la humedad y deben llevarse a cabo bajo cuidadosa exclusión de agua. En estos casos los reactivos tienen una alta afinidad para reaccionar con el agua de la atmósfera y si la izquierda expuesta la reacción deseada no tienen lugar ni dar rendimientos pobres, porque químicamente se alteran los reactantes.
Para evitar reacciones indeseadas con H2O estas reacciones tienen que llevarse a cabo bajo una atmósfera inerte. Se genera una atmósfera inerte mediante la ejecución de la reacción bajo nitrógeno gaseoso, o en casos más delicados, en un gas como el argón.
Todos los componentes de dicha reacción deben ser totalmente anhidro, o libre de agua. Esto incluye todos los reactivos y disolventes utilizan, así como todo cristalería y equipo que entrará en contacto con los reactivos. Reacciones extremadamente sensibles al agua deben ser realizadas dentro de una guantera que proporciona un sellado totalmente de ambiente anhidro para trabajar bajo por un par de guantes que sobresale hacia fuera a uno de los lados de la cámara.
Principios
Drying of Glassware
Glassware must be completely dry when running reactions with water-sensitive molecules. Glass, which consists of silicon dioxide (SiO2), has microscopic traces of water adsorbed to its surface, even when it looks dry to the eye. The Si-O bonds attract water and as a result a film of water molecules start coating the surface of glass and accumulate over time. In order to free glassware from water it can be dried over-night in an oven or alternatively flame-dried directly before conducting the reaction. Avoid washing glassware the same day as running a reaction inside of it. Note: for reactions that are not very water-sensitive it is possible to rinse the glassware out with acetone directly before use. This drying method is absolutely insufficient for reactions such as the Grignard reaction.
Advantages and disadvantages of the different methods:
Drying glassware in an oven is time-consuming but is also very convenient and works well for all types of glassware. Flame-drying glassware is much quicker but requires the set-up of a Bunsen burner (which is always an additional safety concern) and may not be used with conical vials. Due to the thickness of the base compared to the rest of the conical vial the tension created during heating can cause cracks in the glass. While drying glassware with acetone is a very quick fix for reactions that are not overly sensitive, one should always keep in mind the generated solvent waste and the cost and environmental burden associated with that.
Drying of Solvents
Many different techniques exist for the drying of solvents with varying degrees of effectiveness. Some laboratories use commercially available systems for the drying of solvents. These systems employ so called drying trains and can dry several different types of solvents simultaneously. This method is very safe and convenient yet rather expensive and not available in most laboratories. Residual water content values of 1-10 ppm can be achieved this way.
Another method of drying solvents is by use of highly reactive metals such as sodium in so-called solvent stills. This method poses several safety concerns due to the risk of fires and explosions and is not usually performed by students in undergraduate teaching labs. It is however frequently used in research labs by more advanced students and professionals. Solvent stills will deliver fairly dry solvents and should be employed for extensive drying of ethers (THF, diethylether, etc) or hydrocarbons. Note: this method should never be used for drying of chlorinated solvents because an explosive reaction may occur. When drying with sodium metal an indicator called benzophenone is used to monitor the drying progress. In the presence of water the solution will be clear or yellow, but when the solvent is dry the solution will be blue or purple. Benzophenone is a ketone and reacts with metallic sodium (Na0) into a ketyl radical, which has a blue/purple color. In the presence of water the radical is protonated to give a colorless product. Residual water content achieved by this method is typically around 10 ppm.
Water may also be removed from liquid reagents or solvents by the use of desiccants, or drying agents. These are highly hygroscopic solids, meaning that they readily absorb and thereby remove water from an organic liquid. In recent years a very effective method has been developed using molecular sieves for the drying of various solvents. This method is much more convenient than the use of active metal solvent stills and bypasses the safety concerns of that method. Molecular sieves are commonly used, and probably the most effective desiccant currently available. They are a microporous material made of sodium and calcium aluminosilicates. The pore-sizes of molecular sieves can vary typically between 2–5 Å (0.2–0.5 nm) and are used to trap or absorb small molecules while larger molecules do not fit inside the pores. The molecular sieves are available in powder or bead form and can be used to trap water (a small molecule) thereby removing it from another liquid with a larger molecular size. Molecular sieves are also common components of everyday life products, for example cat-litter. Molecular sieves are activated in an oven at temperatures above 300 °C at atmospheric pressure for a minimum of 3 h but better overnight. In a vacuum oven a temperature of around 200 °C will suffice. This activation process removes all water with which the pores are saturated even in a freshly purchased and freshly opened bottle of molecular sieves. After activation the molecular sieves should be stored in a conventional drying oven at temperatures above 120 °C or in a desiccator for several weeks before requiring reactivation. Note: whether molecular sieves are still active can easily be determined by placing a small amount of beads in a gloved-hand followed by two volume equivalents of water to the beads. If the sieves are still active they will become very hot to the touch.
Solvents are dried by removing the beads from the oven or desiccator and cooled to room temperature before adding them to a solvent of choice. The solvent is dried over the beads for at least 12 h-5 days before the solvent is considered anhydrous and can be used in a reaction.
The length of the storage time depends on the solvent as does the amount of molecular sieves required. This is typically reported as the % mass/ volume (m/v) loading and describes the amount of molecular sieves used per volume of solvent. For example a 5% m/v means that 5 g of molecular sieves are added per 100 mL of solvent.
For common solvents such as dichloromethane (DCM), acetonitrile, or toluene a storage time of 24 h over 3-Å molecular sieves with 10% m/v is sufficient to reach very low ppm values for residual water content (0.1–0.9 ppm). Tetrahydrofuran (THF) on the other hand should be dried for a duration of 3 days using 20% m/v of 3-Å molecular sieves to reach low residual amounts of water of about 4 ppm. Lower-mass alcohols such as methanol or ethanol should even be stored about 5 days over 3-Å molecular sieves and 20% m/v, which will yield residual water content of 8–10 ppm. Higher molecular weight alcohols should be dried using powdered 3-Å sieves rather than beads. Powdered molecular sieves adsorb at a much faster rate than beads. This results in a non selective adsorption of solvent molecules which are small enough in size to compete with water for entry into the sieve pore (e.g. small alcohol molecules, such as methanol). For large molecular weight alcohols it is safe to use the more active powdered form of the sieves because they are too large to compete with water for the pores.1Note: alcohols are typically very hygroscopic and very low residual water amounts cannot be reached. Table 1 summarizes the findings for the common solvents described above.
Note that slightly larger 4-Å beads are used for drying of amines, dimethylformamide (DMF), and hexamethylphosphoramide (HMPA) by storing them over the beads using 5% w/v for at least 24 h. Molecular sieves should not be used for drying acetone, because they are basic and induce an aldol reaction in acetone.
Another great advantage of molecular sieves is that they can be recycled by rinsing them thoroughly with a volatile organic solvent, followed by drying them at 100 °C for a few hours first (or alternatively air-drying) before reactivating them as usual at temperatures above 300 °C for at least 3 h. Acetone may auto-ignite at high temperatures of > 400 °C. So one must be sure that it has fully evaporated before moving the beads to the high temperature oven. Note: in undergraduate laboratories solvents are sometimes dried using the drying agents listed in Table 2 in the section below. This method is sufficient for reactions that are not very water sensitive but will not render sufficiently dry solvents to run sensitive reactions such as a Grignard reaction.
| Solvent | % m/v | Time of storing solvent over 3 Å molecular sieves | Residual water content (ppm) |
| DCM | 10% | 24 h | ~0.1 |
| Acetonitrile | 10% | 24 h | ~0.5 |
| Toluene | 10% | 24 h | ~0.9 |
| THF | 20% | 3 days | ~4.1 |
| Methanol | 20% | 5 days | ~10.5 |
| Ethanol | 20% | 5 days | ~8.2 |
Table 1. Desiccant amount, drying time and residual water content for various solvent dried over 3 Å molecular sieves.2
Drying of Reagents
Reagents in a chemical reaction can be solid or liquid (and in very rare cases gases). Different methods are employed to dry solids than are used to dry liquids.
Liquid reagents can generally be made anhydrous by similar methods as for solvents described above. Reagents that are freshly purchased are often sufficiently anhydrous. Reagents need to be dried if they are not fresh or if they were synthesized as part of a multi-step synthesis. In a multi-step synthesis the product of one reaction step is the reagent for the next step. The product formation of many reactions requires a quenching step, which means contact with a large quantity of water. Afterward the product, whether it is solid or liquid, should be dried in order to ensure anhydrous conditions for the following step. This is afforded first by extraction, a method by which the aqueous phase is separated from the organic phase thereby removing macroscopic amounts of water. After extraction the organic phase, which contains the product dissolved in an organic solvent, will still have microscopic traces of water present. Following extraction the organic phase must be dried over a highly hygroscopic drying agent that is usually an inorganic salt. There are many different drying agents, and some of the most common ones are listed in Table 2.
For drying purposes, the drying agent is added to the organic phase until freshly added drying agent no longer clumps together but rolls around freely and the solution is clear and not cloudy. The organic phase should be covered and stored over the drying agent for a short period of time (usually an hour) to ensure drying. Afterward the drying agent is filtered off and the solvent is removed under reduced pressure in a rotary evaporator.
For a product that is a liquid, further drying can be achieved by storing it over a drying agent and freshly distilling it before use. For a product that is solid, drying is achieved preferably by storage in a vacuum oven at a temperature below its melting point (mp). For example, if the solid's mp is below 100 °C the oven must be set to a temperature around 15–20 °C below its mp. Water will still evaporate over time and applied vacuum will accelerate the process. Alternatively the solid may be dried by storage inside a vacuum desiccator over an appropriate drying agent (typically P2O5). This may be indicated for cases where the solid's mp is extremely low (below ~50 °C) or when a vacuum oven is not available. After drying, the anhydrous reagent should be stored in a bottle under inert atmosphere (N2or Ar) and the bottle's lid should be tightly sealed with Parafilm. The bottle should be kept inside a desiccator until the reagent is needed. Note: some solid reagents, such as the magnesium metal for a Grignard reaction may be dried inside the apparatus during the flame-drying process.
Liquid reagents can alternatively be dried by molecular sieves as described in the previous section for solvents. This is indicated when large amounts of a reagent need to be dried. Typically reagents in small-scale syntheses are used in small amounts (a few mL or less). Drying of such small amounts with molecular sieves is impractical and drying with the above methods should suffice.
| Drying Agent | Capacity | Speed | Suitability |
| Na2SO4 | high | low | Generally useful |
| MgSO4 | high | high | Generally useful |
| CaCl2 | high | medium | Useful for hydrocarbons* |
| CaSO4 | low | high | Generally useful |
| * Organic liquids that are not hydrocarbons, such as alcohols, amines, and different carbonyl-containing compounds are also absorbed by CaCl2. It can’t be used to dry these liquids but it can help remove these types of impurities from a hydrocarbon. | |||
Table 2. The most commonly used drying agents in organic laboratories.
Procedimiento
Reacciones químicas que son sensibles a la humedad deben realizarse en un ambiente anhidro o agua libre.
Reactivos y reactantes a veces pueden reaccionar con o absorben el agua de la atmósfera. Si esto sucede, pueden cambiar las propiedades químicas o físicas de los reactivos y la reacción deseada no tendrá lugar o llevar a un rendimiento pobre.
Para evitar reacciones indeseadas con agua de sensible que ocurren las reacciones se llevan a cabo bajo una atmósfera inerte, como nitrógeno o argón, uso de equipo y reactivos anhidros. Reacciones extremadamente sensibles al agua deben llevarse a cabo dentro de una guantera que puede mantener un ambiente anhidro. Este vídeo demuestra cómo secar correctamente cristalería, disolventes y reactivos para ejecutar una reacción anhidra.
La composición química del vidrio hace que una película de agua para cubrir la superficie que debe quitarse antes de preparar una reacción anhidra. Calor o la acetona se utiliza a menudo para eliminar esta capa de material de vidrio limpio antes de usarlo.
Muchos solventes también absorben agua del ambiente y deben secarse antes de usar. Alambiques de solvente o desecantes se utilizan a menudo para eliminar el agua antes de la creación de una reacción.
Alambiques de solvente usan metales alcalinos como el sodio al reaccionar con el agua y dejar un contenido de agua residual de alrededor de 10 partes por millón.
Absorbentes de humedad son sólidos altamente higroscópicos, lo que significa que absorben fácilmente el agua. Algunos desecantes, como el sulfato de sodio, se utilizan para eliminar el agua de pequeñas cantidades de un solvente orgánico y deben ser filtradas antes de su uso posterior.
Tamices moleculares son las más comúnmente utilizan desecante y se utilizan para secar grandes volúmenes de disolventes. Se fabrican de un material microporoso compuesto por aluminosilicatos de sodio y calcio.
Tamices moleculares funcionan por agua de captura dentro de los granos con eficacia quitando del solvente. Una vez usado se puede regenerar en un horno.
Por último, hay varias formas para secar sólidos reactivos. Uno ocupa por guardarlo en el horno 15-20 ° C por debajo de su punto de fusión. El calor conduce agua de reactivo dejando seco compuesto.
Si el sólido no se calienta o tiene muy baja de un punto de fusión puede ser secado en un desecador de vacío. Una vez seco, el reactivo anhidro puede almacenarse en una botella bajo una atmósfera inerte dentro del desecador.
Ahora que has visto los conceptos de secado el equipo y reactivos para las reacciones anhidros, ¡echa un vistazo y ver como se hace en el laboratorio.
Para secar el vidrio en un horno, en primer lugar se reúnen todos los componentes necesarios para el aparato de la reacción. Retire todas las piezas no sean de cristal como la llave de paso de un matraz Schlenk.
Colocar el vidrio en un horno de secado a 125 ° C y hornear durante al menos 24 h antes de su uso.
Después de 24 h, colóquese guantes de protección térmica y sacar el vidrio del horno. Montar el aparato mientras que el vidrio está aún caliente.
Cuando el vidrio está completamente ensamblado y fresco, limpie el aparato con un gas inerte como el nitrógeno. Por último, Añadir nuevamente los trozos que se retiraron antes del secado. La cristalería está lista para la reacción anhidra.
Una opción más rápida que el horno de secado de cristalería es utilizar un mechero de Bunsen. Algunos cristalería no llama seca, así que asegúrese de que la configuración es segura llama seco antes de comenzar. Para comenzar, configurar el aparato completo y quitar todos los componentes que no son de vidrio.
Póngase guantes resistentes al calor, y luego encender la hornilla de Bunsen. Comenzar llama secar la cristalería calentando la parte inferior del aparato. Conducir el agua de la instalación mediante el movimiento de la llama hacia arriba. Continúe este proceso hasta que se empaña y cocer al vapor se detiene.
Espere que el aparato se enfríe hasta unos 60 ° C, luego use guantes resistentes al calor y agregar el resto de los aparatos que se quitaron antes del secado de la llama.
Para secar solventes usando tamices moleculares, primero agregar en un recipiente de vidrio termo-estable.
Los tamices deben primero ser tan secos para su correcto funcionamiento, coloque el recipiente en un horno ° C y hornear durante 3 – 3 h ½ de 300 a 350.
Cuando los granos están secos, use guantes resistentes al calor alto para Retire el recipiente y guárdelo en un horno de secado a temperaturas superiores a 120 ° C. Después del secado, los tamices moleculares se pueden almacenar por semanas antes de su uso.
Cuando son necesarios, saque los granos secado horno o desecador. Trabajar rápido y cubrir el recipiente partir de este momento para minimizar el contacto de los granos con agua atmosférica.
Si quitar los granos de un horno permitir que enfríe a temperatura de ambiente aproximadamente.
Pesar la cantidad necesaria de granos activos a escala. Por ejemplo, para alcanzar un 10% masa volumen de granos en una botella de 500 mL de disolvente, 50 g de granos se requiere.
Añadir los granos al disolvente. Para un disolvente volátil, como el diclorometano, dejar la tapa encima de la botella pero espere unos minutos antes de atornillarlo completamente la tapa para evitar la acumulación de presión.
Sellar el área alrededor de la tapa envolviendo con Parafilm para evitar humedad. Almacenar el solvente con los granos para al menos 24 horas después, el disolvente anhidro se puede utilizar en una reacción.
Como alternativa, solvente alambiques con benzofenona y metal de sodio se pueden utilizar para secar solventes.
Reactivos sólidos a menudo se disuelven en solventes orgánicos. Antes de retirar el líquido y recuperar el reactivo sólido exceso de agua debe extraerse la solución.
Obtener un envase seco y añadir la solución. A continuación añadir a un deshidratante para el recipiente con una espátula. El agente de secado inicialmente agruparse, pero seguir añadiendo hasta recién agregado secado agente ya no produce y se mueve libremente.
Cubrir el recipiente con un tapón o papel de aluminio y dejar la solución durante al menos 1 h.
Para quitar al exceso deshidratante, montar un aparato de filtración de vacío con un frasco de Büchner embudo y brazo lateral. Añadir el papel de filtro en el embudo de Büchner, luego encienda el vacío.
Lentamente decantar la fase orgánica en el embudo de Büchner. Evitar la transferencia del deshidratante, como puede obstruir el filtro. Cuando se ha transferido la mayor parte del líquido en el embudo y en el matraz a continuación, añade el resto con el agente de secado y dejarlo reposar unos minutos.
Apague la aspiradora y transfiera la solución filtrada en un seco redondo matraz de fondo. Conectar el matraz de fondo redondo para un evaporador rotatorio y quite todo disolvente a presión reducida. El sólido o líquido que queda ahora debe estar seco.
Un lugar ya sólido reactivo compuesto en un recipiente abierto seco y determinar su peso. Luego colóquelo en un horno de secado a una temperatura por debajo del punto de fusión del sólido. Permitir que el reactivo secar por varias horas dentro del horno.
Retire el recipiente del horno y colóquelo en un desecador. Entonces, permita que la muestra se enfríe a temperatura ambiente. Repesar y asegurarse de que la masa es menos que antes seca en el horno. Repita los pasos de secado hasta que el peso no cambie. Cuando esto sucede el reactivo es suficientemente seco.
Si el reactivo no es necesario utilizar inmediatamente, lave el contenedor con un gas inerte como el nitrógeno y envolver la tapa con Parafilm. Coloque el recipiente en un desecador y almacenar hasta que el reactivo es necesario.
Reacciones anhidras se utilizan en una variedad de síntesis química orgánica importante.
Un ejemplo clásico de una reacción que se debe hacer bajo condiciones anhidras es la reacción de Grignard. En el primer paso de la reacción es imprescindible que ni el menor rastro de agua esté presente. En presencia de agua el reactivo de Grignard preferencial actuará como una base, dando por resultado la pérdida de los subproductos indeseables actividad y forma nucleófila.
Muchas Síntesis orgánicas se deben realizar en condiciones extremadamente secas, como con este ejemplo de síntesis orgánica de imán. El material precursor en este caso, metal de sodio, es pirofórico, lo que significa que es extremadamente sensible de la humedad y pueden ser inflamables o explosivos incluso en contacto con humedad en el aire.
Las baterías de iones de litio son también extremadamente sensible de la humedad y deben ser montadas en una caja de guante o habitación seca. El electrodo negativo consiste en un compuesto de litio mientras que el electrolito contiene una sal de litio halogenados. Puesto que el litio sea humedad sensible cualquier agua del rastro introducido en la célula de la batería sí mismo disminuiría capacidad.
Sólo ha visto introducción de Zeus para preparar anhidro reactivos y equipos. Ahora debería entender cómo preparar material de vidrio, solventes y reactivos que son todo anhidros para su uso en reacciones químicas.
¡Gracias por ver!
Resultados
Un ejemplo clásico de una reacción que se debe hacer bajo condiciones anhidras es la reacción de Grignard. (Ecuación 1)
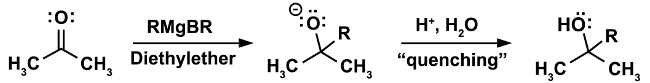
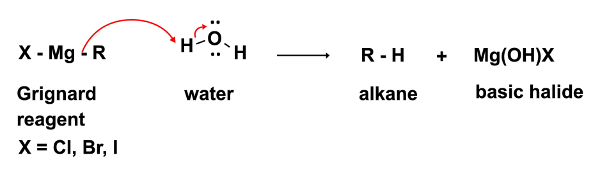
En el primer paso de la reacción, el ataque nucleofílico del reactivo de Grignard RMgX ocurre en un electrófilo (en este caso una cetona). En este paso es imprescindible que ni el menor rastro de agua esté presente. El reactivo de Grignard, mientras un nucleófilo fuerte, es una base aún más fuerte. En presencia de agua preferentemente actuará como una base y deprotonate agua, resultando en la pérdida de lo reactivo de Grignard nucleofílica y en la formación de un alcano, un subproducto indeseable. (Ecuación 2)
Referencias
- Burfield, D. R. and Smithers, R. H. Desiccant efficiency in solvent and reagent drying. 7. Alcohols. J. Org. Chem. 48 (14), 2420-2422 (1983).
- Williams, D. B. G. and Lawton, M. Drying of Organic Solvents: Quantitative Evaluation of the Efficiency of Several Desiccants. J. Org. Chem. 75 (24), 8351-8354 (2010).
Saltar a...
Vídeos de esta colección:

Now Playing
Preparación de equipos y reactivos anhidros
Organic Chemistry
79.2K Vistas

Introducción a la catálisis
Organic Chemistry
34.2K Vistas

Montaje de un sistema de reflujo para reacciones químicas calientes
Organic Chemistry
166.9K Vistas

Realizar reacciones por debajo de la temperatura ambiente
Organic Chemistry
70.4K Vistas

Líneas de Schlenk para transferencia de disolventes
Organic Chemistry
41.5K Vistas

Desgasificación de líquidos con ciclos de congelación-bomba-descongelación
Organic Chemistry
56.0K Vistas

Purificación de compuestos por recristalización
Organic Chemistry
706.6K Vistas

Separación de mezclas por precipitación
Organic Chemistry
157.4K Vistas

Extracción sólido-líquida
Organic Chemistry
237.5K Vistas

Evaporación rotatoria para eliminar solventes
Organic Chemistry
212.6K Vistas

Destilación fraccionada
Organic Chemistry
333.6K Vistas

Crecimiento de cristales para el análisis de difracción de rayos x
Organic Chemistry
32.3K Vistas

Performing 1D Thin Layer Chromatography
Organic Chemistry
288.9K Vistas

Cromatografía en columna
Organic Chemistry
359.2K Vistas

Espectroscopia de resonancia magnética nuclear (RMN)
Organic Chemistry
247.2K Vistas
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados