Vorbereiten von wasserfreien Reagenzien und Geräten
Überblick
Quelle: Labor von Dr. Dana Lashley - College of William and Mary
Von: Timothy Beck und Lucas Arney
Viele Reaktionen in der organischen Chemie sind feuchteempfindlicher und müssen unter sorgfältiger Ausschluss von Wasser durchgeführt werden. In diesen Fällen werden die Reagenzien haben eine hohe Affinität zu Wasser aus der Atmosphäre zu reagieren und wenn links die gewünschte Reaktion ausgesetzt nicht stattfinden oder schlechte Erträge geben, weil der Edukte chemisch verändert werden.
Diese Reaktionen müssen zur Vermeidung von unerwünschten Reaktionen mit H2O unter inerter Atmosphäre durchgeführt werden. Inerter Atmosphäre entsteht durch die Reaktion unter Stickstoffgas oder in mehr Fällen unter einem Edelgas wie Argon ausgeführt.
Jede Komponente in einer solchen Reaktion muss völlig wasserfrei oder wasserfrei sein. Hierunter fallen alle Reagenzien und Lösungsmitteln verwendet sowie alle Glaswaren und Geräte, die in Kontakt mit den Reagenzien kommen wird. Extrem Wasser-empfindlichen Reaktionen erfolgen innerhalb einer Glovebox bietet eine komplett geschlossene aus wasserfreien Umgebung unter über ein paar Handschuhe zu arbeiten, die auf einer der Seiten der Kammer heraus ragt.
Grundsätze
Drying of Glassware
Glassware must be completely dry when running reactions with water-sensitive molecules. Glass, which consists of silicon dioxide (SiO2), has microscopic traces of water adsorbed to its surface, even when it looks dry to the eye. The Si-O bonds attract water and as a result a film of water molecules start coating the surface of glass and accumulate over time. In order to free glassware from water it can be dried over-night in an oven or alternatively flame-dried directly before conducting the reaction. Avoid washing glassware the same day as running a reaction inside of it. Note: for reactions that are not very water-sensitive it is possible to rinse the glassware out with acetone directly before use. This drying method is absolutely insufficient for reactions such as the Grignard reaction.
Advantages and disadvantages of the different methods:
Drying glassware in an oven is time-consuming but is also very convenient and works well for all types of glassware. Flame-drying glassware is much quicker but requires the set-up of a Bunsen burner (which is always an additional safety concern) and may not be used with conical vials. Due to the thickness of the base compared to the rest of the conical vial the tension created during heating can cause cracks in the glass. While drying glassware with acetone is a very quick fix for reactions that are not overly sensitive, one should always keep in mind the generated solvent waste and the cost and environmental burden associated with that.
Drying of Solvents
Many different techniques exist for the drying of solvents with varying degrees of effectiveness. Some laboratories use commercially available systems for the drying of solvents. These systems employ so called drying trains and can dry several different types of solvents simultaneously. This method is very safe and convenient yet rather expensive and not available in most laboratories. Residual water content values of 1-10 ppm can be achieved this way.
Another method of drying solvents is by use of highly reactive metals such as sodium in so-called solvent stills. This method poses several safety concerns due to the risk of fires and explosions and is not usually performed by students in undergraduate teaching labs. It is however frequently used in research labs by more advanced students and professionals. Solvent stills will deliver fairly dry solvents and should be employed for extensive drying of ethers (THF, diethylether, etc) or hydrocarbons. Note: this method should never be used for drying of chlorinated solvents because an explosive reaction may occur. When drying with sodium metal an indicator called benzophenone is used to monitor the drying progress. In the presence of water the solution will be clear or yellow, but when the solvent is dry the solution will be blue or purple. Benzophenone is a ketone and reacts with metallic sodium (Na0) into a ketyl radical, which has a blue/purple color. In the presence of water the radical is protonated to give a colorless product. Residual water content achieved by this method is typically around 10 ppm.
Water may also be removed from liquid reagents or solvents by the use of desiccants, or drying agents. These are highly hygroscopic solids, meaning that they readily absorb and thereby remove water from an organic liquid. In recent years a very effective method has been developed using molecular sieves for the drying of various solvents. This method is much more convenient than the use of active metal solvent stills and bypasses the safety concerns of that method. Molecular sieves are commonly used, and probably the most effective desiccant currently available. They are a microporous material made of sodium and calcium aluminosilicates. The pore-sizes of molecular sieves can vary typically between 2–5 Å (0.2–0.5 nm) and are used to trap or absorb small molecules while larger molecules do not fit inside the pores. The molecular sieves are available in powder or bead form and can be used to trap water (a small molecule) thereby removing it from another liquid with a larger molecular size. Molecular sieves are also common components of everyday life products, for example cat-litter. Molecular sieves are activated in an oven at temperatures above 300 °C at atmospheric pressure for a minimum of 3 h but better overnight. In a vacuum oven a temperature of around 200 °C will suffice. This activation process removes all water with which the pores are saturated even in a freshly purchased and freshly opened bottle of molecular sieves. After activation the molecular sieves should be stored in a conventional drying oven at temperatures above 120 °C or in a desiccator for several weeks before requiring reactivation. Note: whether molecular sieves are still active can easily be determined by placing a small amount of beads in a gloved-hand followed by two volume equivalents of water to the beads. If the sieves are still active they will become very hot to the touch.
Solvents are dried by removing the beads from the oven or desiccator and cooled to room temperature before adding them to a solvent of choice. The solvent is dried over the beads for at least 12 h-5 days before the solvent is considered anhydrous and can be used in a reaction.
The length of the storage time depends on the solvent as does the amount of molecular sieves required. This is typically reported as the % mass/ volume (m/v) loading and describes the amount of molecular sieves used per volume of solvent. For example a 5% m/v means that 5 g of molecular sieves are added per 100 mL of solvent.
For common solvents such as dichloromethane (DCM), acetonitrile, or toluene a storage time of 24 h over 3-Å molecular sieves with 10% m/v is sufficient to reach very low ppm values for residual water content (0.1–0.9 ppm). Tetrahydrofuran (THF) on the other hand should be dried for a duration of 3 days using 20% m/v of 3-Å molecular sieves to reach low residual amounts of water of about 4 ppm. Lower-mass alcohols such as methanol or ethanol should even be stored about 5 days over 3-Å molecular sieves and 20% m/v, which will yield residual water content of 8–10 ppm. Higher molecular weight alcohols should be dried using powdered 3-Å sieves rather than beads. Powdered molecular sieves adsorb at a much faster rate than beads. This results in a non selective adsorption of solvent molecules which are small enough in size to compete with water for entry into the sieve pore (e.g. small alcohol molecules, such as methanol). For large molecular weight alcohols it is safe to use the more active powdered form of the sieves because they are too large to compete with water for the pores.1Note: alcohols are typically very hygroscopic and very low residual water amounts cannot be reached. Table 1 summarizes the findings for the common solvents described above.
Note that slightly larger 4-Å beads are used for drying of amines, dimethylformamide (DMF), and hexamethylphosphoramide (HMPA) by storing them over the beads using 5% w/v for at least 24 h. Molecular sieves should not be used for drying acetone, because they are basic and induce an aldol reaction in acetone.
Another great advantage of molecular sieves is that they can be recycled by rinsing them thoroughly with a volatile organic solvent, followed by drying them at 100 °C for a few hours first (or alternatively air-drying) before reactivating them as usual at temperatures above 300 °C for at least 3 h. Acetone may auto-ignite at high temperatures of > 400 °C. So one must be sure that it has fully evaporated before moving the beads to the high temperature oven. Note: in undergraduate laboratories solvents are sometimes dried using the drying agents listed in Table 2 in the section below. This method is sufficient for reactions that are not very water sensitive but will not render sufficiently dry solvents to run sensitive reactions such as a Grignard reaction.
| Solvent | % m/v | Time of storing solvent over 3 Å molecular sieves | Residual water content (ppm) |
| DCM | 10% | 24 h | ~0.1 |
| Acetonitrile | 10% | 24 h | ~0.5 |
| Toluene | 10% | 24 h | ~0.9 |
| THF | 20% | 3 days | ~4.1 |
| Methanol | 20% | 5 days | ~10.5 |
| Ethanol | 20% | 5 days | ~8.2 |
Table 1. Desiccant amount, drying time and residual water content for various solvent dried over 3 Å molecular sieves.2
Drying of Reagents
Reagents in a chemical reaction can be solid or liquid (and in very rare cases gases). Different methods are employed to dry solids than are used to dry liquids.
Liquid reagents can generally be made anhydrous by similar methods as for solvents described above. Reagents that are freshly purchased are often sufficiently anhydrous. Reagents need to be dried if they are not fresh or if they were synthesized as part of a multi-step synthesis. In a multi-step synthesis the product of one reaction step is the reagent for the next step. The product formation of many reactions requires a quenching step, which means contact with a large quantity of water. Afterward the product, whether it is solid or liquid, should be dried in order to ensure anhydrous conditions for the following step. This is afforded first by extraction, a method by which the aqueous phase is separated from the organic phase thereby removing macroscopic amounts of water. After extraction the organic phase, which contains the product dissolved in an organic solvent, will still have microscopic traces of water present. Following extraction the organic phase must be dried over a highly hygroscopic drying agent that is usually an inorganic salt. There are many different drying agents, and some of the most common ones are listed in Table 2.
For drying purposes, the drying agent is added to the organic phase until freshly added drying agent no longer clumps together but rolls around freely and the solution is clear and not cloudy. The organic phase should be covered and stored over the drying agent for a short period of time (usually an hour) to ensure drying. Afterward the drying agent is filtered off and the solvent is removed under reduced pressure in a rotary evaporator.
For a product that is a liquid, further drying can be achieved by storing it over a drying agent and freshly distilling it before use. For a product that is solid, drying is achieved preferably by storage in a vacuum oven at a temperature below its melting point (mp). For example, if the solid's mp is below 100 °C the oven must be set to a temperature around 15–20 °C below its mp. Water will still evaporate over time and applied vacuum will accelerate the process. Alternatively the solid may be dried by storage inside a vacuum desiccator over an appropriate drying agent (typically P2O5). This may be indicated for cases where the solid's mp is extremely low (below ~50 °C) or when a vacuum oven is not available. After drying, the anhydrous reagent should be stored in a bottle under inert atmosphere (N2or Ar) and the bottle's lid should be tightly sealed with Parafilm. The bottle should be kept inside a desiccator until the reagent is needed. Note: some solid reagents, such as the magnesium metal for a Grignard reaction may be dried inside the apparatus during the flame-drying process.
Liquid reagents can alternatively be dried by molecular sieves as described in the previous section for solvents. This is indicated when large amounts of a reagent need to be dried. Typically reagents in small-scale syntheses are used in small amounts (a few mL or less). Drying of such small amounts with molecular sieves is impractical and drying with the above methods should suffice.
| Drying Agent | Capacity | Speed | Suitability |
| Na2SO4 | high | low | Generally useful |
| MgSO4 | high | high | Generally useful |
| CaCl2 | high | medium | Useful for hydrocarbons* |
| CaSO4 | low | high | Generally useful |
| * Organic liquids that are not hydrocarbons, such as alcohols, amines, and different carbonyl-containing compounds are also absorbed by CaCl2. It can’t be used to dry these liquids but it can help remove these types of impurities from a hydrocarbon. | |||
Table 2. The most commonly used drying agents in organic laboratories.
Verfahren
Chemische Reaktionen, die feuchteempfindlicher müssen in einem wasserfreien oder wasserfrei, Umfeld durchgeführt werden.
Reagenzien und Reaktionspartner können manchmal mit reagieren oder Wasser aus der Atmosphäre aufnehmen. Wenn dies geschieht, der chemischen oder physikalischen Eigenschaften der Reagenzien ändern können und die gewünschte Reaktion nicht dauert platzieren oder führen zu einer schlechten Ausbeute.
Um zu verhindern, dass unerwünschte Reaktionen mit Wasser vorkommenden empfindlich sind Reaktionen unter inerter Atmosphäre, wie Stickstoff oder Argon, mit wasserfreiem Reagenzien und Geräten durchgeführt. Extrem Wasser-empfindlichen Reaktionen müssen innerhalb einer Glovebox durchgeführt werden, die eine wasserfreie Umgebung beibehalten kann. Dieses Video zeigen wie man richtig Glaswaren, Lösungsmittel und Reagenzien zu trocknen, um eine wasserfreie Reaktion führen.
Die chemische Zusammensetzung des Glases bewirkt, dass ein Wasserfilm auf die Oberfläche zu beschichten, die entfernt werden müssen, bevor eine wasserfreie Reaktion vorbereitet. Wärme oder Aceton ist oft verwendet, um diese Schicht aus sauberen Gläser vor dem Gebrauch zu entfernen.
Viele Lösungsmittel auch Wasser aus der Umgebung aufnehmen und müssen vor Gebrauch getrocknet werden. Solvent Stills oder Trockenmittel sind oft verwendet, um Wasser vor der Einrichtung einer Reaktion zu entfernen.
Solvent Standbilder verwenden Alkalimetalle wie Natrium reagiert mit Wasser und lassen ein Restwassergehalt von rund 10 Teile pro million.
Trockenmittel sind stark hygroskopisch Feststoffe, was bedeutet, dass sie ohne weiteres Wasser aufnehmen. Bestimmte Trockenmittel, wie Natriumsulfat, werden verwendet, um kleine Mengen von einem organischen Lösungsmittel Wasser entziehen und müssen vor der weiteren Verwendung herausgefiltert werden.
Molekularsiebe sind die am häufigsten verwendeten Trockenmittel und werden verwendet, um größere Mengen an Lösungsmitteln zu trocknen. Sie bestehen aus einem mikroporöse Material bestehend aus Natrium und Kalzium Silicate.
Molekularsieben arbeiten durch Überfüllung Wasser in die Perlen, die effektiv vom Lösungsmittel zu entfernen. Einmal verwendet, sie können in einem Ofen regeneriert werden.
Schließlich gibt es mehrere Möglichkeiten, um solide Reagenzien trocken. Einer wird durch Speicherung in einem Ofen 15-20 ° C unter dem Schmelzpunkt festgelegt. Die Hitze treibt Wasser aus das Reagenz hinterlässt eine chemische Verbindung.
Wenn der Feststoff kann nicht beheizt werden oder zu niedrigen Schmelzpunkt kann es in einem Vakuum Exsikkator getrocknet werden. Nach dem Trocknen kann das wasserfreie Reagenz in einer Flasche unter inerter Atmosphäre in den Exsikkator gespeichert.
Nun, da Sie die Konzepte hinter trocknen die Geräte und Reagenzien für wasserfreie Reaktionen gesehen haben, werfen wir einen genaueren Blick und sehen wie es im Labor gemacht wird.
Glas in einem Ofen trocknen, sammeln Sie zunächst alle erforderlichen Komponenten für die Reaktionsvorrichtung. Entfernen Sie alle Stücke, die nicht aus Glas wie der Hahn von einem Schlenk-Kolben.
Legen Sie das Glas in einem trocknen Backofen auf 125 ° C und Backen Sie für mindestens 24 Stunden vor Gebrauch gesetzt.
Nach 24 Stunden Wärme Schutzhandschuhe anziehen und die Gläser aus dem Ofen nehmen. Montieren Sie das Gerät, während das Glas noch heiß ist.
Wenn das Glas komplett montiert und cool ist, spülen Sie das Gerät mit einem inerten Gas wie Stickstoff. Zu guter Letzt wieder fügen Sie keine Stücke hinzu, die vor dem Trocknen entfernt wurden. Das Glas ist nun bereit für die wasserfreie Reaktion.
Eine schnellere Variante als Ofen trocknen Glaswaren soll einen Bunsenbrenner verwenden. Bestimmte Gläser sollten nicht Flamme getrocknet werden, so stellen Sie sicher, dass das Setup sicher trocken vor Beginn der Flamme. Um zu beginnen, richten Sie das vollständige Gerät und entfernen Sie alle Komponenten, die nicht aus Glas gefertigt sind.
Hitzebeständige Handschuhe ziehen Sie an, dann leuchten Sie die Bunsenbrenner. Beginnen Sie Flamme trocknen der Gläser durch Erhitzen der Unterseite des Geräts. Fahren Sie das Wasser aus dem Setup durch die Flamme nach oben verschieben. Fortfahren Sie, bis beschlagen und Haltestellen zu dämpfen.
Warten auf das Gerät, bis auf etwa 60 ° Cabkühlen lassen, dann verwenden Sie hitzebeständige Handschuhe und fügen Sie den Rest des Apparates, die vor der Flamme Trocknung entfernt wurde.
Zum Trocknen von Lösungsmitteln mit Molekularsieben zuerst fügen Sie sie in einem Thermo-stabile Glasbehälter.
Die Siebe muss zuerst getrocknet für den ordnungsgemäßen Betrieb, so stellen Sie den Behälter in eine 300 bis 350 ° C Backofen und backen für 3 – 3 ½ h.
Wenn die Kugeln trocken sind, verwenden Sie hoch hitzebeständige Handschuhe, um den Behälter entfernen und speichern Sie es in einem Trockenschrank bei Temperaturen über 120 ° C. Nach dem Trocknen können die Molekularsiebe wochenlang vor Gebrauch gespeichert werden.
Wenn sie benötigt werden, entfernen Sie die Perlen aus dem Trocknen Backofen oder Exsikkator. Arbeiten Sie schnell und decken Sie den Container ab diesem Zeitpunkt Kontakt der Perlen mit atmosphärischem Wasser zu minimieren.
Wenn die Perlen aus Backofen entfernen lassen Sie etwa Raumtemperatur abkühlen lassen.
Wiegen Sie die notwendige Menge an aktiven Perlen auf einer Skala. Zum Beispiel um 10 % zu erreichen Masse Volumen der Perlen in einer 500 mL Flasche des Lösungsmittels, 50 g Perlen sind erforderlich.
Das Lösungsmittel die Perlen hinzufügen. Für eine flüchtige Lösungsmittel, wie z. B. Dichlormethan, lassen Sie den Deckel auf die Flasche aber warten Sie wenige Minuten vor voll Schrauben den Deckel zu vermeiden Druckaufbau.
Versiegeln Sie die Gegend um den Deckel durch Umwickeln es mit Parafilm, Feuchtigkeit fernhalten. Das Lösungsmittel mit Perlen für mindestens 24 h danach speichern, wasserfreie Lösungsmittel eingesetzt werden, in einer Reaktion.
Alternativ können Lösungsmittel Standbilder mit Natrium-Metall und Benzophenon trocknen Lösungsmittel verwendet werden.
Solide Reagenzien werden häufig in organischen Lösungsmitteln aufgelöst. Vor dem Entfernen der Flüssigkeit und Wiederherstellung der festere Reagenz muss überschüssiges Wasser aus der Lösung entfernt werden.
Besorgen Sie ein trockenes Gefäß und fügen Sie die Lösung. Fügen Sie ein Trockenmittel in den Container mit einem Spatel. Das Trockenmittel wird zunächst verklumpen, sondern fügen hinzu, bis frisch hinzugefügt Trockenmittel nicht mehr Klumpen und bewegt sich frei.
Decken Sie den Container mit einem Stopfen oder Alu-Folie und lassen Sie die Lösung für mindestens 1 h sitzen.
Entfernen Sie die überschüssige Trockenmittel montieren Sie ein Vakuum-Filtration-Apparat mit einem Büchner Trichter und Seitenarm Kolben. Hinzufügen des Büchner-Trichters, Filterpapier, dann schalten Sie das Vakuum.
Dekantieren Sie langsam die organische Phase in den Büchner-Trichter. Vermeiden Sie übertragen das Trockenmittel wie die Filter verstopfen kann. Wenn die meisten der Flüssigkeit auf den Trichter übertragen und in die Flasche unten abgelassen wurde, den Rest mit Trockenmittel und lassen Sie ihn für ein paar Minuten sitzen.
Schalten Sie das Vakuum und übertragen Sie die gefilterte Lösung in eine trockene Runde untere Kolben. Schließen Sie Rundboden-Flasche an einen Drehverdampfer an und entfernen Sie alle Lösungsmittel unter vermindertem Druck. Die festen oder flüssigen, dass bleibt jetzt trocken sein sollte.
Einen bereits solide Reagenz Ort der Verbindung in einem offenen Behälter trocknen und sein Gewicht zu bestimmen. Dann legen Sie es in einen Trockenofen auf eine Temperatur unterhalb des Schmelzpunktes des Volumenkörpers festgelegt. Lassen Sie das Reagenz für mehrere Stunden im Ofen trocknen.
Nehmen Sie den Behälter aus dem Ofen und in den Exsikkator gestellt. Führen Sie die Probe auf Raumtemperatur abkühlen lassen. Vakuumtrockenschrank und stellen Sie sicher, dass die Masse weniger als vorher Backofen trocknen. Wiederholen Sie die Trocknung Schritte, bis das Gewicht nicht mehr ändert. In diesem Fall ist das Reagenz ausreichend trocken.
Wenn das Reagens nicht sofort verwendet werden muss, spülen Sie den Behälter mit einem inerten Gas wie Stickstoff und den Deckel umwickeln Sie Parafilm. Stellen Sie den Behälter in den Exsikkator gestellt und speichern Sie, bis das Reagenz benötigt wird.
Wasserfreie Reaktionen werden in einer Vielzahl von wichtig organische Chemie-Synthesen verwendet.
Ein klassisches Beispiel für eine Reaktion, die unter wasserfreien Bedingungen getan werden muss ist die Grignard-Reaktion. Im ersten Schritt der Reaktion ist es unerlässlich, dass nicht einmal die kleinste Spuren von Wasser vorhanden sein. In Gegenwart von Wasser wird das Grignard-Reagenz bevorzugt als Basis, die zum Verlust der nukleophilen Aktivität und Form unerwünschter Nebenprodukte handeln.
Viele organische Synthesen müssen in extrem trockenen Bedingungen, wie bei diesem Beispiel der Synthese von organischen Magnet durchgeführt werden. Das Vorläufer-Material in diesem Fall Natrium-Metall ist pyrophor, d.h. es ist extrem Feuchtigkeit empfindlich und kann leicht entzündliche oder sogar explosive beim Kontakt mit Feuchtigkeit in der Luft.
Lithium-Ionen-Batterien sind auch extrem Feuchtigkeit empfindlich und müssen in einem Handschuh-Box oder Trockenraum zusammengebaut werden. Die negative Elektrode besteht aus einem zusammengesetzten, Lithium während das Elektrolyt eine halogenierte Lithiumsalz enthält. Da Lithium Feuchtigkeit empfindlich ist würde jede Spur Wasser in die Batteriezelle selbst eingeführt Kapazität verringern.
Sie sah nur Jupiters Einführung in wasserfreien Reagenzien Vorbereitung und Ausrüstung. Sie sollten jetzt verstehen, wie vorbereiten, Glaswaren, Lösungsmittel und Reagenzien, die alle für den Einsatz in chemischen Reaktionen wasserfrei sind.
Danke fürs Zuschauen!
Ergebnisse
Ein klassisches Beispiel für eine Reaktion, die unter wasserfreien Bedingungen getan werden muss ist die Grignard-Reaktion. (Gleichung 1)
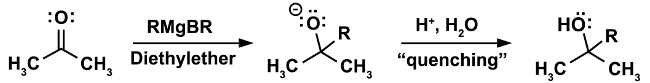
Im ersten Schritt der Reaktion tritt der nukleophilen Angriff des Grignard-Reagenz RMgX auf einem Elektrophil (in diesem Fall ein Keton). In diesem Schritt ist es unerlässlich, dass nicht einmal die kleinste Spuren von Wasser vorhanden sein. Das Grignard-Reagenz, während ein starkes nucleophil ist eine noch stärkere Basis. In Gegenwart von Wasser fungiert sie bevorzugt als Basis und Deprotonate Wasser, was zum Verlust der nukleophilen Grignard-Reagenz und bei der Bildung von einem Alkan ein unerwünschtes Nebenprodukt. (Gleichung 2)
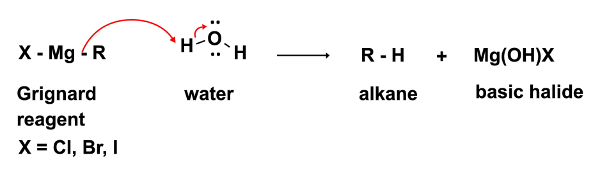
pringen zu...
Videos aus dieser Sammlung:

Now Playing
Vorbereiten von wasserfreien Reagenzien und Geräten
Organic Chemistry
79.5K Ansichten

Einführung in die Katalyse
Organic Chemistry
34.7K Ansichten

Montage eines Reflux-Systems für beheizte chemische Reaktionen
Organic Chemistry
168.6K Ansichten

Durchführung von Reaktionen unterhalb der Raumtemperatur
Organic Chemistry
70.8K Ansichten

Übertragen von Lösungmitteln mit der Schlenk-Technik
Organic Chemistry
41.7K Ansichten

Entgasung von Flüssigkeiten mittels Freeze-Pump-Thaw Cycling
Organic Chemistry
56.4K Ansichten

Reinigen von Verbindungen durch Umkristallisation
Organic Chemistry
711.0K Ansichten

Trennen von Gemischen durch Ausfällung
Organic Chemistry
158.2K Ansichten

Fest-Flüssig-Extraktion
Organic Chemistry
238.4K Ansichten

Entfernung von Lösungsmitteln mit dem Rotationsverdampfer
Organic Chemistry
213.1K Ansichten

Fraktionierte Destillation
Organic Chemistry
335.1K Ansichten

Züchten von Kristallen für die Röntgenbeugungsanalyse
Organic Chemistry
32.9K Ansichten

Performing 1D Thin Layer Chromatography
Organic Chemistry
290.3K Ansichten

Säulenchromatographie
Organic Chemistry
361.6K Ansichten

Kernspinresonanzspektroskopie (NMR-Spektroskopie)
Organic Chemistry
249.2K Ansichten
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten