無水試薬と機器の準備
概要
博士ダナ ラシュリー - 大学のウィリアムとメアリーのソース: 研究室
実証: ティモシー ベックとルーカス アーニー
有機化学に多くの反応は、水分に敏感な水の慎重な排除の下で遂行されなければなりません。これらのケースで左が望ましい反作用を公開されるかどうかと試薬の大気中の水と反応する高親和性ないや反応は化学的に変更されるため、低収率を与えます。
H2O の望ましくない反応を防ぐためにこれらの反応は不活性雰囲気下で実施される必要があります。不活性雰囲気が窒素ガス下でまたはより敏感な場合、アルゴンなどの希ガスの下での反応を実行することによって生成されます。
このような反応のすべてのコンポーネントは、完全に無水または水の無料でなければなりません。これはすべての試薬が含まれています、溶剤の使用だけでなく、すべてのガラス製品、機器、試薬との接触に来る。非常に水に敏感な反応を完全にシールを提供するグローブ ボックス内遂行されなければならない無水環境チャンバーの側面の 1 つに突出する組の手袋を介しての下で動作するようにオフ。
原則
Drying of Glassware
Glassware must be completely dry when running reactions with water-sensitive molecules. Glass, which consists of silicon dioxide (SiO2), has microscopic traces of water adsorbed to its surface, even when it looks dry to the eye. The Si-O bonds attract water and as a result a film of water molecules start coating the surface of glass and accumulate over time. In order to free glassware from water it can be dried over-night in an oven or alternatively flame-dried directly before conducting the reaction. Avoid washing glassware the same day as running a reaction inside of it. Note: for reactions that are not very water-sensitive it is possible to rinse the glassware out with acetone directly before use. This drying method is absolutely insufficient for reactions such as the Grignard reaction.
Advantages and disadvantages of the different methods:
Drying glassware in an oven is time-consuming but is also very convenient and works well for all types of glassware. Flame-drying glassware is much quicker but requires the set-up of a Bunsen burner (which is always an additional safety concern) and may not be used with conical vials. Due to the thickness of the base compared to the rest of the conical vial the tension created during heating can cause cracks in the glass. While drying glassware with acetone is a very quick fix for reactions that are not overly sensitive, one should always keep in mind the generated solvent waste and the cost and environmental burden associated with that.
Drying of Solvents
Many different techniques exist for the drying of solvents with varying degrees of effectiveness. Some laboratories use commercially available systems for the drying of solvents. These systems employ so called drying trains and can dry several different types of solvents simultaneously. This method is very safe and convenient yet rather expensive and not available in most laboratories. Residual water content values of 1-10 ppm can be achieved this way.
Another method of drying solvents is by use of highly reactive metals such as sodium in so-called solvent stills. This method poses several safety concerns due to the risk of fires and explosions and is not usually performed by students in undergraduate teaching labs. It is however frequently used in research labs by more advanced students and professionals. Solvent stills will deliver fairly dry solvents and should be employed for extensive drying of ethers (THF, diethylether, etc) or hydrocarbons. Note: this method should never be used for drying of chlorinated solvents because an explosive reaction may occur. When drying with sodium metal an indicator called benzophenone is used to monitor the drying progress. In the presence of water the solution will be clear or yellow, but when the solvent is dry the solution will be blue or purple. Benzophenone is a ketone and reacts with metallic sodium (Na0) into a ketyl radical, which has a blue/purple color. In the presence of water the radical is protonated to give a colorless product. Residual water content achieved by this method is typically around 10 ppm.
Water may also be removed from liquid reagents or solvents by the use of desiccants, or drying agents. These are highly hygroscopic solids, meaning that they readily absorb and thereby remove water from an organic liquid. In recent years a very effective method has been developed using molecular sieves for the drying of various solvents. This method is much more convenient than the use of active metal solvent stills and bypasses the safety concerns of that method. Molecular sieves are commonly used, and probably the most effective desiccant currently available. They are a microporous material made of sodium and calcium aluminosilicates. The pore-sizes of molecular sieves can vary typically between 2–5 Å (0.2–0.5 nm) and are used to trap or absorb small molecules while larger molecules do not fit inside the pores. The molecular sieves are available in powder or bead form and can be used to trap water (a small molecule) thereby removing it from another liquid with a larger molecular size. Molecular sieves are also common components of everyday life products, for example cat-litter. Molecular sieves are activated in an oven at temperatures above 300 °C at atmospheric pressure for a minimum of 3 h but better overnight. In a vacuum oven a temperature of around 200 °C will suffice. This activation process removes all water with which the pores are saturated even in a freshly purchased and freshly opened bottle of molecular sieves. After activation the molecular sieves should be stored in a conventional drying oven at temperatures above 120 °C or in a desiccator for several weeks before requiring reactivation. Note: whether molecular sieves are still active can easily be determined by placing a small amount of beads in a gloved-hand followed by two volume equivalents of water to the beads. If the sieves are still active they will become very hot to the touch.
Solvents are dried by removing the beads from the oven or desiccator and cooled to room temperature before adding them to a solvent of choice. The solvent is dried over the beads for at least 12 h-5 days before the solvent is considered anhydrous and can be used in a reaction.
The length of the storage time depends on the solvent as does the amount of molecular sieves required. This is typically reported as the % mass/ volume (m/v) loading and describes the amount of molecular sieves used per volume of solvent. For example a 5% m/v means that 5 g of molecular sieves are added per 100 mL of solvent.
For common solvents such as dichloromethane (DCM), acetonitrile, or toluene a storage time of 24 h over 3-Å molecular sieves with 10% m/v is sufficient to reach very low ppm values for residual water content (0.1–0.9 ppm). Tetrahydrofuran (THF) on the other hand should be dried for a duration of 3 days using 20% m/v of 3-Å molecular sieves to reach low residual amounts of water of about 4 ppm. Lower-mass alcohols such as methanol or ethanol should even be stored about 5 days over 3-Å molecular sieves and 20% m/v, which will yield residual water content of 8–10 ppm. Higher molecular weight alcohols should be dried using powdered 3-Å sieves rather than beads. Powdered molecular sieves adsorb at a much faster rate than beads. This results in a non selective adsorption of solvent molecules which are small enough in size to compete with water for entry into the sieve pore (e.g. small alcohol molecules, such as methanol). For large molecular weight alcohols it is safe to use the more active powdered form of the sieves because they are too large to compete with water for the pores.1Note: alcohols are typically very hygroscopic and very low residual water amounts cannot be reached. Table 1 summarizes the findings for the common solvents described above.
Note that slightly larger 4-Å beads are used for drying of amines, dimethylformamide (DMF), and hexamethylphosphoramide (HMPA) by storing them over the beads using 5% w/v for at least 24 h. Molecular sieves should not be used for drying acetone, because they are basic and induce an aldol reaction in acetone.
Another great advantage of molecular sieves is that they can be recycled by rinsing them thoroughly with a volatile organic solvent, followed by drying them at 100 °C for a few hours first (or alternatively air-drying) before reactivating them as usual at temperatures above 300 °C for at least 3 h. Acetone may auto-ignite at high temperatures of > 400 °C. So one must be sure that it has fully evaporated before moving the beads to the high temperature oven. Note: in undergraduate laboratories solvents are sometimes dried using the drying agents listed in Table 2 in the section below. This method is sufficient for reactions that are not very water sensitive but will not render sufficiently dry solvents to run sensitive reactions such as a Grignard reaction.
| Solvent | % m/v | Time of storing solvent over 3 Å molecular sieves | Residual water content (ppm) |
| DCM | 10% | 24 h | ~0.1 |
| Acetonitrile | 10% | 24 h | ~0.5 |
| Toluene | 10% | 24 h | ~0.9 |
| THF | 20% | 3 days | ~4.1 |
| Methanol | 20% | 5 days | ~10.5 |
| Ethanol | 20% | 5 days | ~8.2 |
Table 1. Desiccant amount, drying time and residual water content for various solvent dried over 3 Å molecular sieves.2
Drying of Reagents
Reagents in a chemical reaction can be solid or liquid (and in very rare cases gases). Different methods are employed to dry solids than are used to dry liquids.
Liquid reagents can generally be made anhydrous by similar methods as for solvents described above. Reagents that are freshly purchased are often sufficiently anhydrous. Reagents need to be dried if they are not fresh or if they were synthesized as part of a multi-step synthesis. In a multi-step synthesis the product of one reaction step is the reagent for the next step. The product formation of many reactions requires a quenching step, which means contact with a large quantity of water. Afterward the product, whether it is solid or liquid, should be dried in order to ensure anhydrous conditions for the following step. This is afforded first by extraction, a method by which the aqueous phase is separated from the organic phase thereby removing macroscopic amounts of water. After extraction the organic phase, which contains the product dissolved in an organic solvent, will still have microscopic traces of water present. Following extraction the organic phase must be dried over a highly hygroscopic drying agent that is usually an inorganic salt. There are many different drying agents, and some of the most common ones are listed in Table 2.
For drying purposes, the drying agent is added to the organic phase until freshly added drying agent no longer clumps together but rolls around freely and the solution is clear and not cloudy. The organic phase should be covered and stored over the drying agent for a short period of time (usually an hour) to ensure drying. Afterward the drying agent is filtered off and the solvent is removed under reduced pressure in a rotary evaporator.
For a product that is a liquid, further drying can be achieved by storing it over a drying agent and freshly distilling it before use. For a product that is solid, drying is achieved preferably by storage in a vacuum oven at a temperature below its melting point (mp). For example, if the solid's mp is below 100 °C the oven must be set to a temperature around 15–20 °C below its mp. Water will still evaporate over time and applied vacuum will accelerate the process. Alternatively the solid may be dried by storage inside a vacuum desiccator over an appropriate drying agent (typically P2O5). This may be indicated for cases where the solid's mp is extremely low (below ~50 °C) or when a vacuum oven is not available. After drying, the anhydrous reagent should be stored in a bottle under inert atmosphere (N2or Ar) and the bottle's lid should be tightly sealed with Parafilm. The bottle should be kept inside a desiccator until the reagent is needed. Note: some solid reagents, such as the magnesium metal for a Grignard reaction may be dried inside the apparatus during the flame-drying process.
Liquid reagents can alternatively be dried by molecular sieves as described in the previous section for solvents. This is indicated when large amounts of a reagent need to be dried. Typically reagents in small-scale syntheses are used in small amounts (a few mL or less). Drying of such small amounts with molecular sieves is impractical and drying with the above methods should suffice.
| Drying Agent | Capacity | Speed | Suitability |
| Na2SO4 | high | low | Generally useful |
| MgSO4 | high | high | Generally useful |
| CaCl2 | high | medium | Useful for hydrocarbons* |
| CaSO4 | low | high | Generally useful |
| * Organic liquids that are not hydrocarbons, such as alcohols, amines, and different carbonyl-containing compounds are also absorbed by CaCl2. It can’t be used to dry these liquids but it can help remove these types of impurities from a hydrocarbon. | |||
Table 2. The most commonly used drying agents in organic laboratories.
手順
湿気敏感な化学反応は、無水、または無料、フリー、水環境で遂行されなければなりません。
試薬と反応時と反応したり、大気中から水を吸収します。この問題が発生、試薬の化学的又は物理的特性を変更することができます、目的の反応は、配置や貧しい収量に 。
水で発生する依存からの望ましくない反応を防ぐために反応が窒素または無水試薬と装置を用いたアルゴンなどの不活性雰囲気下で実行されます。非常に水に敏感な反応は無水環境を保持できるグローブ ボックス内に遂行されなければなりません。このビデオは、無水の反応を実行するために、ガラス製品、溶剤、試薬を正しく乾燥する方法を実演します。
ガラスの化学組成は、コートに無水反応を準備する前に削除する必要があります表面の水の膜を発生します。熱やアセトンはこのレイヤーを使用する前にきれいなガラス製品から削除によく使用されます。
多くの溶剤も環境からの水を吸収して、使用する前に乾燥する必要があります。静止画の溶剤や乾燥剤は反応を設定する前に水分を除去するよく使用されます。
溶剤静止画約 10 の残留水分を残すし、水反応するナトリウムなどのアルカリ金属を使用して百万。
乾燥剤は、吸湿性の高い固体、彼らは容易に水を吸収する意味です。硫酸ナトリウムのような特定の乾燥剤は、少量の有機溶剤から水を除去する使用され、さらに使用する前に除外する必要があります。
モレキュラーシーブは、一般的に乾燥剤を使用され、大量の溶剤の乾燥に使用されます。ナトリウムとカルシウムのアルミノケイ酸塩から成る多孔性材料から作られています。
モレキュラーシーブは溶媒からの削除が効率的にビーズの中のトラップの水で動作します。一度使用された彼らをオーブンで再生成することができます。
最後に、固体試薬を乾燥する複数の方法があります。1 つはオーブンでそれを格納することによって 15-20 ° Cの融点以下を設定するされています。熱乾燥の化合物を残して試薬から水をドライブします。
固体加熱することはできませんまたは、あまりにもそれは真空デシケータで乾燥できますのする融点の低い。一度乾燥し、無水試薬は、デシケータ内不活性雰囲気下でボトルに格納できます。
乾燥装置と無水の反応のための試薬の背後にある概念を見てきた、今では、近い見てみましょうとそれが実験室で行われる方法を参照してください。
オーブンでガラスを乾燥するには、最初反応装置に必要なすべてのコンポーネントを収集します。Schlenk フラスコの活栓などガラスで作られていないすべての部分を削除します。
乾燥-オーブンで使用する前に、少なくとも 24 時間焼くと 125 ° Cに設定されてガラスを配置します。
24 h 後熱保護手袋を入れてからオーブンからガラスを取り出してください。ガラスがまだ熱い間、装置を組み立てます。
ガラスが完全に組み立てられた、クールな窒素などの不活性ガスを装置をフラッシュします。最後に、戻って乾燥する前に削除された部分を追加します。ガラスは、無水の反応の準備が整いました。
ガラスの乾燥オーブンよりも高速化オプションは、ブンゼン バーナーを使用することです。特定のガラスは炎乾燥、のでセットアップは炎の開始する前に乾燥しても安全確認べきではないです。開始、完全装置のセットアップ、ガラスの作られているすべてのコンポーネントを削除します。
耐熱手袋を入れて、ブンゼン バーナーを点灯します。炎が器具の底を熱することによってガラスを乾燥を開始します。炎を上方に移動することにより、セットアップから水を駆動します。曇りと湯気を立てて停止までこのプロセスを続行します。
耐熱手袋を使用して約 60 ° Cまで冷却装置から炎が乾燥する前に削除された装置の残りの部分を追加します。
分子ふるいを使用して溶剤を乾燥するには、最初熱安定したガラスの容器にそれらを追加します。
モレキュラーシーブはする必要があります最初、300 に 350 ° Cのオーブンで焼く 3-3 1/2 h のために容器を置きますので適切な操作の乾燥します。
ビーズが乾燥しているとき、高耐熱手袋を使用してコンテナーを削除し、120 ° C以上の温度で乾燥炉に保管します。乾燥後、分子ふるいを使用する前に週間保存されるかもしれない。
彼らが必要な場合は、乾燥オーブンまたはデシケータからビーズを削除します。高速動作し、大気中の水とビーズの接触を最小限に抑えるためこの点からコンテナーをカバーします。
オーブンからビーズを取り外す場合大体室温に冷却するように。
規模でアクティブなビーズの必要量を重量を量る。たとえば、10% を達成するために溶媒、500 mL ペットボトルでビーズの量を質量 50 g のビーズが必要です。
溶媒にビーズを追加します。揮発性溶剤、ジクロロ メタンなどボトルの上に蓋を残すが、完全にふたをねじ込む前に、数分待って、圧力上昇を避けてください。
シール蓋周辺の水分が入らないようにパラフィルムでそれをラップすることによって。その後少なくとも 24 時間のビーズと溶剤を格納、無水溶媒を反応に使用できます。
また、金属ナトリウムとベンゾフェノンを用いた溶剤の静止画は、溶剤を乾燥する使用できます。
固体試薬は、しばしば有機溶剤に溶解しました。液体の取り外しおよび固体試薬を回復する前に余分な水分は、ソリューションから削除する必要があります。
ドライ コンテナーを取得し、ソリューションに追加します。次に、乾燥剤をへらを使用してコンテナーに追加します。乾燥剤は最初一緒に群生しますが、たて乾燥剤不要になった塊し、自由に動きを追加までの追加を続けます。
ストッパーやアルミ箔容器をカバーし、少なくとも 1 時間座っているソリューションを許可します。
過剰な乾燥剤を削除するには、を Büchner 漏斗とサイドアーム フラスコ真空ろ過装置を組み立てます。Büchner 漏斗、ろ紙を追加し、真空をオンにします。
ゆっくりと有機相を Büchner 漏斗にデカントします。フィルターを詰まらせる可能性があります転送する乾燥剤を避けてください。ほとんどの液体が目標到達プロセスに転送されているとき、下のフラスコに排水、乾燥剤の残りの部分を追加し、数分間座ってできるように。
真空を切り、丸底フラスコ ドライ フィルタ リング ソリューションに転送します。丸底フラスコを回転蒸発器に接続し、減圧下で溶媒をすべてを削除します。固体または液体のまま今乾燥する必要があります。
既に固体試薬場所開いた容器の化合物を乾燥し、その重量を決定します。乾燥炉固体の溶融点以下の温度に設定に格納します。オーブンの中数時間乾燥する試薬を許可します。
コンテナーをオーブンから除去し、デシケータに配置。サンプルは室温に冷却し、許可します。Reweigh し、質量が以前より少ないことを確認オーブン乾燥します。重量が変化しなくなるまでは、乾燥の手順を繰り返します。これが起こるとき、本試薬は十分に乾燥です。
すぐに使用に試薬がない場合は、窒素などの不活性ガスでコンテナーをフラッシュし、蓋の周りにパラフィルムをラップします。乾燥器内のコンテナーを配置し、試薬を必要になるまでを格納します。
無水の反応は、さまざまな重要な有機化学合成に使用されます。
無水条件下で行う必要があります反応の古典的な例は、グリニャール反応です。反応の最初のステップでは、水の最小の痕跡もないが存在することが不可欠です。水の存在下でグリニャール試薬は優先的に求核性フォーム望ましくない副産物の損失の結果、基盤として機能します。
多くの有機合成は有機磁石の合成のこの例でのような非常に乾燥条件で実行する必要があります。この場合、前駆体材料金属ナトリウムは自然発火性、可燃性、空気中の水分との接触でも爆発することができますは非常に機密性の高い水分と。
リチウム イオン電池も非常に敏感な水分、グローブ ボックスや乾燥した部屋で組み立てする必要があります。ハロゲン化リチウム塩電解質の含まれていますが、負極は、リチウム化合物で構成されます。リチウムは湿気敏感な電池セル自体に導入された任意の微量水分が容量を減少しました。
無水試薬の準備や機器のゼウスの概要を見てきただけ。今すべて無水化学反応で使用するための試薬、溶剤、ガラス製品を準備する方法を理解する必要があります。
見てくれてありがとう!
結果
無水条件下で行う必要があります反応の古典的な例は、グリニャール反応です。(関係式 1)
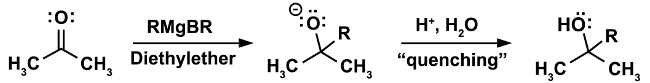
反応の最初のステップ、RMgX グリニャール試薬の求核攻撃は (この場合ケトン) に求電子剤で発生します。この手順では、水の最小の痕跡もないが存在することが不可欠です。強い求核剤中のグリニャール試薬は、さらに強力な拠点です。水の存在下でベースと脱プロトン化水、グリニャール試薬の求核の損失とアルカン、望ましくない副産物の形成を結果として優先的に動作します。(式 2)
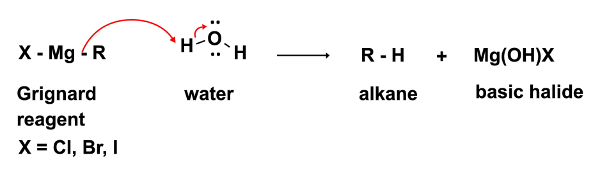
スキップ先...
このコレクションのビデオ:

Now Playing
無水試薬と機器の準備
Organic Chemistry
79.5K 閲覧数

触媒入門
Organic Chemistry
34.7K 閲覧数

温水の化学反応のための還流システムの組み立て
Organic Chemistry
168.6K 閲覧数

室温以下の反応を実施
Organic Chemistry
70.8K 閲覧数

Schlenk ライン溶剤伝
Organic Chemistry
41.7K 閲覧数

凍害ポンプ サイクリングで液体の脱気
Organic Chemistry
56.4K 閲覧数

再結晶により物質を浄化
Organic Chemistry
710.9K 閲覧数

沈殿物によって混合物の分離
Organic Chemistry
158.2K 閲覧数

固液抽出
Organic Chemistry
238.4K 閲覧数

溶媒を除去する回転蒸発
Organic Chemistry
213.0K 閲覧数

分別蒸留
Organic Chemistry
335.1K 閲覧数

X 線回折用結晶を成長
Organic Chemistry
32.9K 閲覧数

Performing 1D Thin Layer Chromatography
Organic Chemistry
290.3K 閲覧数

カラム ・ クロマトグラフィ
Organic Chemistry
361.5K 閲覧数

核磁気共鳴 (NMR) 分光法
Organic Chemistry
249.2K 閲覧数
Copyright © 2023 MyJoVE Corporation. All rights reserved