Introducción a la catálisis
Fuente: Laboratorio del Dr. Ryan Richards, Colorado School of Mines
Catálisis es uno de los campos más importantes de tecnología moderna y actualmente representa aproximadamente el 35% del producto interno bruto (PIB) y el sustento de aproximadamente el 33% de la población mundial a través de fertilizantes producidos mediante el proceso de Haber. 1 los catalizadores son sistemas que facilitan las reacciones química bajando la energía de activación y que influyen en la selectividad. Catálisis es una tecnología central para hacer frente a la energía y los retos ambientales de los tiempos modernos.
Catalizadores heterogéneos consisten en típicamente una entidad catalítica de nanoescala (normalmente un metal) dispersada en un material de apoyo (normalmente óxido de carbono o metal), que aumenta el área superficial y a menudo imparte cierta estabilidad contra la agregación de las nanopartículas. Las nanopartículas del catalizador tiene sitios activos en su superficie, donde ocurre la reacción. Dependiendo de la reacción, estos sitios activos pueden ser caras planas o bordes de cristal en la superficie de la partícula. Normalmente, las nanopartículas más pequeñas tienen una mayor actividad catalítica, debido a la mayor cantidad de superficie átomos por mol de catalizador. 2
La reacción en la superficie del catalizador comienza con la adsorción de los reactivos en el sitio activo, seguido por la reacción en la superficie. La reacción superficial puede ocurrir entre una especie adsorbida y a granel, llamado el mecanismo de Eley-Rideal, o entre dos especies adsorbidas, llamadas el mecanismo de Langmuir-Hinshelwood. La especie reaccionada desorbs entonces de la superficie en la mayor parte. 2
Las partículas de paladio soportados nanoescala han mostrado actividad en muchos importantes reacciones catalíticas y representan un sistema modelo para la demostración de un catalizador heterogéneo. Paladio en base a investigación de catalizador son amplios y van desde aumento de biomasa de la descomposición de los tintes químicos en corrientes de aguas residuales. El uso de catalizadores de paladio como representante para catalizadores heterogéneos es deseable ya que permite la fácil separación del catalizador de los productos. 2
Aquí, el catalizador heterogéneo consiste en nanoescala paladio partículas dispersadas en un soporte de carbono de elevada área superficial. En la actualidad, varios catalizadores de paladio soportados están comercialmente disponibles. En este artículo la educación, dos disponibles comercialmente apoyado paladio se utilizan materiales, 1% paladio soportado sobre carbón activo y 0.5% paladio soportado en carbón granular. Otro material, carbón activo, se utiliza como un experimento de control. La reducción del 4-nitrofenol es elegida para la reacción catalítica porque es fácil de trabajar y los resultados son visibles a través de un cambio de color. Este protocolo experimental proporciona una demostración visual muy clara de una típica reacción catalítica.
1. preparación de solución de 4-nitrofenol mezclado con borohidruro de sodio
- Pesar de 14 mg de 4-nitrofenol y disolver en 10 mL de agua desionizada en un frasco de vidrio.
- Pesar de 57 mg de borohidruro de sodio y disolver en 15 mL de agua desionizada.
- Mezclar las dos soluciones y agitación magnética durante 30 min a temperatura ambiente una solución uniforme. Bata de laboratorio, gafas de seguridad y guantes son necesarios como protección del protocolo estándar.
2. preparación de solución de catalizador
- Pesar 10 mg de paladio sobre carbón activo y paladio sobre carbón granular respectivamente. Pesar 10 mg de carbón activo como grupo de control.
- Transferencia pesó catalizadores a un frasco y añadir 100 mL de agua desionizada a cada frasco.
- Someter a ultrasonidos los frascos con una potencia de 135 W durante 10 minutos hasta que los catalizadores están bien distribuidos en el agua.
3. catalítica reducción del 4-nitrofenol
- Miden 1,15 mL de solución de borohidruro de 4-nitrofenol y sodio preparada, transferir a un frasco de vidrio de 5 mL.
- Registrar el color de la solución en el frasco, esperar 10 minutos y registro si hay algún cambio en el color de la solución.
- Añadir 1 mL de paladio preparado en solución de catalizador de carbón activo al frasco, agitar el vial con la mano para 20 s. observar reacción por 20 min, grabar cuando el color de la solución comienza a cambiar y cuando el color de la solución se desvanece completamente a transparente.
- Repita el mismo procedimiento con el paladio en la solución de catalizador de carbón granular.
- Repita el mismo procedimiento con la solución de catalizador de carbón activo.
- Comparar el cambio de color entre tres catalizadores después de 0, 5, 10, 15 y 20 minutos de tiempo de reacción. Para cuantificar este cambio, medir espectros UV-Vis de la muestra durante el intervalo de reacción de 20 minutos.
La reducción del 4-nitrofenol con un catalizador es una reacción de referencia en la literatura de evaluación del rendimiento del catalizador y medición cinética. Antes de la adición del catalizador, el color de la solución es la luz amarilla, que corresponde al ion del 4-nitrofenol en condiciones alcalinas. Sin la adición de un catalizador, el color amarillo no se descolora lejos, esto indica que el sistema de mezcla de 4-nitrofenol y Sodio borohidruro es estable.
Después de la incorporación de paladio sobre carbón activo y palladium en soluciones de catalizador de carbón granular, color amarillo de la solución de 4-nitrofenol se desvanece poco a poco. En una escala de tiempo de aproximadamente 20 min, la solución llega a ser descolorida, sugiriendo una reducción completa del 4-nitrofenol por el catalizador.
Después de la adición de la solución de carbón activo, con sin catalizador, el color amarillo de 4-nitrofenol permanece inalterado dentro de la ventana de reacción de 20 minutos. Carbón actúa solamente como un material de apoyo para el paladio, para que carbono por sí mismo no demuestra ningún efecto catalítico en la reacción. El grupo control muestra que nanoescala partículas de paladio soportadas en carbón es un catalizador activo, mientras que el carbón sí mismo no es un catalizador. Este experimento de control también muestra que el 4-nitrofenol es no simplemente absorbido por el carbón extraído de la solución.
Observación de los espectros de absorción UV-Vis indica una disminución gradual en alrededor de 400 nm mientras que aumenta en alrededor de 300 nm. Este cambio es indicativo de la reducción del 4-nitrofenol durante el proceso. La concentración relativa del 4-nitrofenol es representada por la intensidad relativa de la absorción a 400 nm. Una trama ln (t/A0) vs tiempo, muestra el procedimiento de reacción de manera cuantificada. Una parcela representativa se muestra en la figura 1.
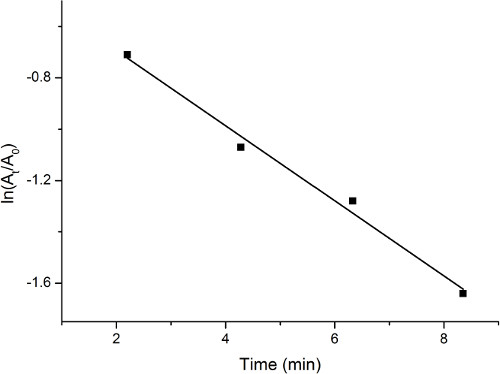
Figura 1. Parcela de absorción vs tiempo, durante la reducción del 4-nitrofenol por el catalizador de paladio sobre carbón activo.
Para ambos catalizadores de paladio utilizados, no hay ninguna diferencia entre su comportamiento de cambio de color y sus espectros. Este resultado indica que el paladio es activo en la reducción catalítica del 4-nitrofenol independientemente de si está soportado sobre carbón activo o carbón granular.
Como reacción de referencia, la aplicación catalítica de nanoescala partículas de paladio puede ampliarse a otros campos. Similar a la reducción del 4-nitrofenol, que es un colorometric (la reacción se observa como un cambio de color), la hidrogenación de tintes químicos puede realizarse con el mismo protocolo. Procesos de hidrogenación química son muy importantes para muchas reacciones industriales así como la eliminación de desechos. Los investigadores han encontrado aplicaciones de catalizadores en reacciones de hidrogenación en campos tales como productos petroquímicos. En los Estados Unidos, benceno la producción alcanzó 415144 millones de galones durante el cuarto trimestre de 2010, donde el proceso de hidrogenación desempeñó un papel importante.
En presencia de un catalizador de paladio y un ambiente básico, reacciones de acoplamiento C-C se producen entre los alkenes y los halides aryl/vinilo. 3,4 esta reacción se conoce como la reacción de Heck. Las reacciones de acoplamiento C-C son de vital importancia para resolver los retos energéticos que hoy enfrenta la sociedad. La implicación es tan importante que el Premio Nobel en química 2010 obtuvo por trabajo en Paladio catalizado Cruz reacción de acoplamiento. Catalizadores también se utilizan en la síntesis de nanopartículas de polímero. En esta aplicación, ramas de polímero se mezclan con un catalizador con el fin de inducir la formación de partículas de estrellas. 5 finalmente, catalizadores se encuentran ampliamente en la naturaleza y las reacciones biológicas en coche. Aquí, naturalmente existen como las enzimas específicas de la forma. 6
- Armor, J. What is catalysis? North American Catalysis Society. (2008).
- Thomas, J.M., Thomas, W.J. Principles and Practice of Heterogeneous Catalysis. Wiley-VCH. Germany (2015).
- Heck, R.F., Nolley, J.P. Palladium-catalyzed v Vinylic Hydrogen Substitution Reactions with Aryl, Benzyl and Styryl Halides. J. Org. Chem. 37 (14), (1972).
- Oberholzer, M., Frech, C. M. Mizoroki-Heck Cross-coupling Reactions Catalyzed by Dichloro{bis[1,1',1''-(phosphinetriyl)tripiperidine]}palladium Under Mild Reaction Conditions. J. Vis. Exp. (85), e51444, (2014).
- Liu, J., Gao, A. X., Johnson, J. A. Particles without a Box: Brush-first Synthesis of Photodegradable PEG Star Polymers under Ambient Conditions. J. Vis. Exp. (80), e50874, (2013).
- Fowler, M. L., Ingram-Smith, C. J., Smith, K. S. Direct Detection of the Acetate-forming Activity of the Enzyme Acetate Kinase. J. Vis. Exp. (58), e3474, (2011).
Saltar a...
Vídeos de esta colección:

Now Playing
Introducción a la catálisis
Organic Chemistry
34.1K Vistas

Montaje de un sistema de reflujo para reacciones químicas calientes
Organic Chemistry
166.3K Vistas

Realizar reacciones por debajo de la temperatura ambiente
Organic Chemistry
70.3K Vistas

Líneas de Schlenk para transferencia de disolventes
Organic Chemistry
41.5K Vistas

Desgasificación de líquidos con ciclos de congelación-bomba-descongelación
Organic Chemistry
55.9K Vistas

Preparación de equipos y reactivos anhidros
Organic Chemistry
79.1K Vistas

Purificación de compuestos por recristalización
Organic Chemistry
705.3K Vistas

Separación de mezclas por precipitación
Organic Chemistry
157.2K Vistas

Extracción sólido-líquida
Organic Chemistry
237.1K Vistas

Evaporación rotatoria para eliminar solventes
Organic Chemistry
212.3K Vistas

Destilación fraccionada
Organic Chemistry
332.8K Vistas

Crecimiento de cristales para el análisis de difracción de rayos x
Organic Chemistry
32.3K Vistas

Performing 1D Thin Layer Chromatography
Organic Chemistry
288.4K Vistas

Cromatografía en columna
Organic Chemistry
358.4K Vistas

Espectroscopia de resonancia magnética nuclear (RMN)
Organic Chemistry
246.7K Vistas
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados