Wirkstoffverabreichung I
Überblick
Quelle: Kay Stewart, RVT, RLATG, Anus; Valerie A. Schroeder, RVT, RLATG. University of Notre Dame, IN
Wie viele Forschungsprotokolle verlangen, dass ein Tier eine Substanz injiziert werden, muss die Route und die Menge des Stoffes genau bestimmt werden. Gibt es mehrere Darreichungsformen in der Maus und Ratte. Welche Route zu verwenden, richtet sich nach mehreren Faktoren der Substanz injiziert werden: der pH-Wert der Lösung, die Lautstärke für die gewünschte Dosierung und die Viskosität der Lösung erforderlich. Schwere Gewebeschäden kann auftreten, wenn eine Substanz nicht richtig verwaltet wird. Dieses Video befasst sich mit den verschiedenen Methoden der Zurückhaltung und technischen Details für die meisten gängigen Injektion Routen.
Grundsätze
Wie viele von den Testverbindungen, die in der biomedizinischen Forschung genutzt werden neuartige Stoffe, die nicht im Handel erhältlich sind, ist richtige Substanz Vorbereitung unerlässlich. Grundsätzliche Bedenken der Sterilität, Viskosität und physiologische Verträglichkeit der Formulierung die Testverbindung und dem Medium- oder Fahrzeug-in denen es aufgelöst/suspendiert ist angegangen werden muss. Eine Dosierung Lösung muss ob enteral oder parenteral, physiologisch, der richtige pH-Wert für die Verbindung richtig absorbiert werden und Gewebeverletzungen zu verhindern, gepuffert werden. Die Viskosität einer Lösung möglicherweise der bestimmende Faktor für die Route der Injektion. Eine Substanz, die zu dick durchlaufen die kleinen Gauge-Nadel für die gängigen Injektionsstellen in eine Maus erforderlich ist erfordern Neuformulierung zur oralen Verabreichung. Alle Lösungen, die parenteral injiziert werden muss steril zu verhindern, dass Krankheitserreger in das Tier eingeführt. 1
Nadelauswahl für Injektionszwecke basiert auf die Art der Verabreichung, die Viskosität der Lösung und die Größe des Tieres. Im Allgemeinen sollte die kleinste Spurweite möglich, die Lösung verwalten gewählt werden; Dies ist in der Regel 22-30 Gauge in der Maus und 20-25 Gauge für die Ratte. Die Spritze ausgewählt werden ist wieder das kleinste mögliche mit die richtige Abstufungen für die genaue Dosierung erforderlich. 2,3,4
Es gibt mehrere Routen für parenterale Injektionen. Für die Zwecke dieses Video sind die am häufigsten verwendeten Routen (subkutane [SQ], intraperitoneal [IP] intravenös [IV] und intramuskuläre [IM]) diskutiert. Andere Injektionstechniken, z. B. intradermale (ID), intrakranielle, intrakardialen, Straßenräuber Injektionen, intranasale und intravenöse über den Retro-Orbital-Plexus fallen in ein anderes Video.
Die Absorptionsrate von Verbindungen variiert je nach Route. Die IV-Route stellt die Substanz direkt in die Blutbahn, Beseitigung jeder Zeit brauchte für die Absorption. Eine Substanz, die injizierten IM aufgrund der reichlich vorhandenen Anzahl von Schiffen innerhalb des Muskelgewebes schnell absorbiert wird. Obwohl eine IP-Injektion parenteraler Verabreichung gilt, ist der Absorption Mechanismus tatsächlich mehr Ähnlichkeit mit oralen Dosierung. Subkutane Dosierung ist eine bequeme Möglichkeit, eine große Menge an Flüssigkeit zu verabreichen. Die Absorptionsrate ist langsamer als andere Routen, die eine nachhaltige Wirkung. Die Wahl des Weges ist ein wesentlicher Bestandteil des experimentellen Protokolls. 4
Subkutane Verabreichung stellt die Materialien zwischen den Hautschichten und die Muskeln in einem virtuellen Raum, geschaffen durch Anheben der Haut. Dies ermöglicht die sichere Injektion von größere Mengen wie die Flüssigkeit langsam absorbiert wird und die überschüssige Flüssigkeit wird schnell über die Nieren ausgeschieden. Dies vermeidet Fluid Überlast und Lungenödem, die sich aus großen Mengen intravenös injiziert werden kann. Die Nadel ausgewählt sollte die kleinstmögliche Größe, die für die Viskosität des Materials injiziert erlauben, in der Regel eine 22-30 gauge Nadel für Mäuse und eine 22-25 gauge Nadel für Ratten. Injektionsvolumina reichen von 0,1 ml bis 0,5 ml für Mäuse, und 0,1 ml bis 1,0 ml für Ratten pro Injektionsstelle.
Die IP-Route wird häufig bei Nagern verwendet, da es für die Lieferung von größeren Mengen als ein IV oder IM Route verwendet werden kann. Jedoch die Aufnahme von Material, das verwaltet IP ist deutlich langsamer, dass eine Sofortnachricht oder IV route. Substanzen, die mit dieser Methode verabreicht werden gedacht, um hepatischen Metabolismus vor dem Eintritt in die Blutbahn unterzogen werden. 5 Wieder, die Nadel ausgewählt sollte die kleinstmögliche Größe, die für die Viskosität des Materials injiziert erlauben, in der Regel eine 22-30 gauge Nadel für Mäuse und eine 22-25 gauge Nadel für Ratten. Bei Mäusen, Injektion Bände reichen von 0,05 ml bis 1,0 ml pro Injektion anhand der Größe der Maus. Für Ratten ist der Bereich 0,1 ml bis 1,5 ml pro Injektionsstelle.
IM Injektionen, obgleich in größeren Tieren verbreitet haben minimalen Gebrauch bei Mäusen und Ratten aufgrund ihrer geringen Muskelmasse. Unsachgemäße oder wiederholte Injektion in den Muskel kann Nervenschäden, was zu Lähmungen oder Muskel Nekrose verursachen. Die Nadel ausgewählt sollte die kleinstmögliche Größe sein, die für die Viskosität des Materials injiziert, in der Regel 27-30 Messen ermöglichen. Bei Mäusen, Injektion Bände reichen von 0,01 ml bis maximal 0,05 ml pro Injektionsstelle für den Gesäßmuskel. Injektionsvolumina für die Gastrocnemius haben maximal 0,05 ml. Im Gegensatz dazu Ratte Injektion Bände reichen von 0,01 ml bis maximal 0,3 ml pro Injektionsstelle für den Gesäßmuskel. Injektionsvolumina für die Gastrocnemius haben maximal 0,1 ml.
IV-Injektion ist die effektivste Art der Verabreichung der Substanz, wie es unmittelbar in das Herz-Kreislauf-System eingeführt ist. Jedoch beschränkt sich mit der untermaßige Schiffe zur IV Dosierung in der Maus, seine Nützlichkeit. Wenn wiederholte intravenöse Verabreichung erforderlich ist, sollte die Verwendung von Gefäßzugang Häfen oder andere Dosierung Spezialgeräte für das Wohlergehen der Tiere betrachtet werden. Die Nadel ausgewählt sollte die kleinstmögliche Größe sein, die für die Viskosität des Materials injiziert, in der Regel 27-30 Messen ermöglichen. Injektion Bände reichen von 0,05 ml bis maximal 0,5 ml pro Injektion, basierend auf der Größe der Maus.
| Route | Maus | Ratte | |||
| Nadelstärke (g) | Injektionsvolumen (mL) | Nadelstärke (g) | Injektionsvolumen (mL) | ||
| SC | 22 – 30 | 0,1-1,5 | 22 – 25 | 0,1 – 3,0 | |
| IP | 22 – 30 | 0,05-1,0 | 20 – 25 | 0,1-1,5 | |
| IM | 27 – 30 | 0,01-0,05 (gluteal/Gastrocnemius) | 25 – 27 | 0.01-0.3 (Gesäßmuskel)
0,01-0,1 (Gastrocnemius) |
|
| IV | 27 – 30 | 0,05 – 0,5 | 22 – 25 | 0,05-4,0 | |
Tabelle 1. Geeignete Nadel Gauge und Injektion Volumenbereich für Mäuse und Ratten je nach Route.
Verfahren
(1) die subkutane Injektion
- Manuell zurückhalten der Maus über die einhändige Zurückhaltung halten. Einmal erfasst, ermöglichen Sie die Maus, um auf einen Tisch oder eine andere sichere Oberfläche aufliegen. Achten Sie darauf, zu vermeiden, dass Druck auf den Körper der Maus.
- Ruhen der Ferse der Hand auf den Tisch zu vermeiden unnötige Gewicht des Mausrads die Atmungen gefährden können. Mäuse können auch in einem kommerziellen Gerät zurückgehalten werden. Für Ratten empfiehlt es sich, eine kommerzielle Rückhalteeinrichtung verwendet.
- Verständnis der Haut und ziehen Sie nach oben ein Zelt der Haut zu schaffen. Wenn eine Rückhalteeinrichtung verwendet, eventuell Zange, die Haut durch den Schlitz auf der Oberseite zu erfassen.
- Stechen Sie die Nadel parallel zur Wirbelsäule, geleitet vom Kopf an der Basis der Hautfalte des Zeltes. Lenken Sie die Nadel vom Kopf auf die Möglichkeit der Einstiche an den Schädel zu vermeiden, wie die Schädelknochen der Maus sehr dünn ist. Ratten haben die Tendenz, ihren Kopf nach hinten, die die Injektion in die Nackenmuskulatur platziert werden könnte.
- Setzen Sie die Nadel Abschrägung ermöglicht ein sanftes Gleiten in die Haut ein. Beachten Sie, dass die Nadel unter die Finger greifen die Haut eingeführt wird. Zur Verbesserung der Sicherheit beim Einspritzen biogefährlichen Artikel wird die Haut mit der Pinzette, wodurch die Möglichkeit einer Nadel Stick Verletzungen ergriffen.
- Ziehen Sie den Kolben, um für die richtige Platzierung zu überprüfen. Wenn Luft in die Spritze gezogen wird, bedeutet dies, dass die Spitze der Nadel sich nicht unter der Haut befindet und muss zurückgezogen und neu positioniert werden. Wenn es Gegendruck gibt bei der Kolben zurück gezogen wird, bedeutet dies die richtige Platzierung der Nadel, und dass die Injektion durchgeführt werden kann.
- Die Substanz mit einer stetigen Bewegung langsam zu injizieren. Zur Vermeidung von Verlust des Artikels Injektion anhalten nach der Injektion, leicht drehen Sie die Nadel unter die Haut und drücken Sie die Haut an der Injektionsstelle beim Zurückziehen der Nadelöhrs.
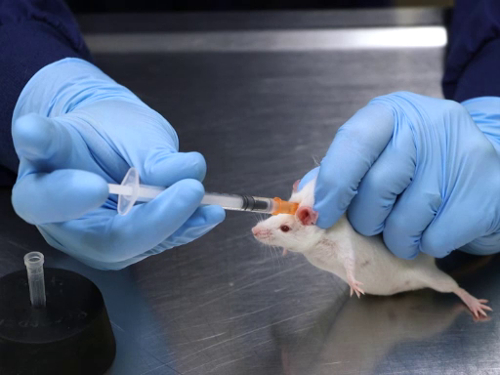
Abbildung 1. Subkutane Injektion in den Mäusen.
(2) intraperitoneale Injektion
- Die One-Handed manuelle Zurückhaltung-Methode dient dieser Injektionstechnik bei Mäusen. Passen Sie die Hand, damit ist, dass es an den Hals, um die Maus verhindern hoch genug positioniert.
- Fassen Sie die lose Haut am Nacken des Ansatzes zwischen Daumen und Zeigefinger.
- Stabilisierung der Hinterhand durch entweder fixieren die lose Haut entlang des Rückens zwischen der zweiten, dritten und vierten Finger und die Basis des Daumens, oder indem man die Rute zwischen dem dritten und vierten Finger.
- Die IP-Injektion bei der Ratte erfordert zwei Personen, eine Ratte und andererseits die Injektion durchführen zurückzuhalten.
- Fassen Sie die Ratte über die Schultern mit den zeige- und Mittelfinger auf jeder Seite des Halses und der Handfläche auf der Rückseite. Der Daumen und die dritten und vierten Finger sollte die Truhe, um vorwärts oder rückwärts Bewegung verhindern umschließen. Die Position der Finger auf jeder Seite des Halses wird verhindert, dass die Ratte den Kopf drehen.
- Heben Sie die Ratte und drehen Sie es um das ventrale Abdomen verfügbar zu machen.
- Stabilisieren Sie das Hinterteil durch fassen die Füße und die Rute sicher und erweitern sie vom Körper weg.
- Positionieren Sie die Maus oder Ratte aussetzen den Bauch, um sicherzustellen, dass es nach oben blickt.
- Kippen Sie das Tier mit dem Kopf nach unten an über eine 30°-Winkel, um den Darm zu nach vorne fallen lassen.
- Injektion Wahrzeichen sind wie folgt:
- Cranially grenzt eine imaginäre Linie erstreckt sich horizontal über den Körper an der Spitze der Hüfte (von Flanke zu Flanke) im Bereich injiziert werden.
- Die Mittellinie ist die mediale Grenze, als Haare wachsen in entgegengesetzte Richtungen trifft. In haarlose Tiere die Mittellinie erstreckt sich in einer geraden Linie von der Xiphoid bis zum Anus.
- Die seitlichen Rahmen ist eine Linie von oben von der Hüfte bis die Vorhaut des Mannes und von der Oberseite der Hüfte und im Anschluss an die Zitzen in das Weibchen.
- Dies stellt eine dreieckige Fläche für sicheren Injektion.
- Injektion eines Artikels innerhalb der Sehenswürdigkeiten
- Nadel senkrecht zur Wirbelsäule, ab der Mittellinie im Dreieck wie oben beschrieben. Platzieren die Nadel in einem 90° Winkel zur Ebene des Körpers ermöglicht eine sichere Injektion unter Verwendung beider Seiten des Bauches. Dies ist besonders wichtig bei mehreren Injektionen, wie es Gewebetrauma minimiert, indem es ermöglicht Wechsel der Injektionsstellen.
- Wenn die Nadel in einem Winkel von 90° gesetzt ist, wird es "in die Bauchhöhle, zulassend einfacher Bestimmung der Tiefe pop". Dies ist auch ein optisches und haptisches Stichwort, dass die Nadel richtig positioniert ist.
- Aspirieren Sie die Spritze um Platzierung innerhalb der Bauchhöhle und nicht innerhalb der Harnblase, Darm oder vaskulären Strukturen zu gewährleisten.
- Kaudal in der männlichen Maus um zu verhindern, Verwaltung des Artikels in das Skrotum Sac Injektion zu vermeiden. Vermeiden Sie Einspritzen in die Zitzen des Weibchens, Trauma zu verhindern.

Abbildung 2. Wahrzeichen für intraperitoneale Injektion bei Mäusen.
(3) intramuskuläre Injektion
- Zurückhaltung für diese Technik für Mäuse und Ratten erfordert entweder zwei Personen oder die Verwendung eines Schlauches Zurückhaltung. Hier beschriebenen nutzt eine ein-Mann-Methode eine Haltevorrichtung.
- Legen Sie das Tier in der Rückhalteeinrichtung.
- Sobald das Tier in der Röhre ist, greifen Sie die Rute um das Tier mit den Hinterbeinen aus der Tube zu positionieren.
- Fassen Sie die Haut der Flanke am kranialen Teil des Oberschenkelknochens zu verlängern das Bein und verhindern, dass die Knie beugen.
- Positionieren Sie die Rückhalteeinrichtung so, dass es mit den Kopf des Tieres wies nach unten auf dem Tisch steht, oder auf dem Tisch liegen deutete auf den Körper des Technikers zur Stabilisierung des Gerätes zu ermöglichen, während die Injektion durchgeführt wird.
- Injektion Wahrzeichen sind wie folgt: die Maus und Ratte Bein sind klein und die Gesäßmuskulatur (der kaudalen Oberschenkelmuskulatur) bestehend aus der größten Muskelmasse in den hinteren Gliedmaßen; die zweitgrößte Muskelmasse in den hinteren Gliedmaßen ist der Gastrocnemius (Wadenmuskel). Die Injektion erfolgt aus der kaudalen Aspekt des Beines.
- Suchen Sie die Gesäßmuskel Masse posterior in den Oberschenkelknochen. Der Knochen kann getastet und leicht fühlte die großen Muskeln.
- Beachten Sie, dass die Mittellinie des Beines von der hinteren Seite unter dem Gesichtspunkt der Hock am Schwanz läuft. Das Haar hat oft einen Kamm, wo es zusammen, kommt wie es in entgegengesetzte Richtungen von den seitlichen und inneren Oberflächen wächst.
- Injektionen werden in Richtung der lateralen Seite des Oberschenkels ab der Mittellinie gemacht.
- Stechen Sie die Nadel senkrecht in den Oberschenkelknochen aus der Mittellinie, wie oben beschrieben, auf eine maximale Tiefe von 5 mm für den Gesäßmuskel und ein Maximum von 3 mm für die Gastrocnemius.
- Zur Vermeidung von Trauma an den Muskel muss überflüssige Bewegung der Nadel in das Gewebe verhindert werden. Die Spritze sollte in einer Weise gehalten werden, die nicht Neuausrichtung der Hand erfordert, um die Injektion durchführen.
- Aspirieren Sie die Spritze um Platzierung innerhalb des Muskels und nicht in ein Blutgefäß zu gewährleisten.
- Injizieren Sie das Material in einer stetigen, fließenden Bewegung. Nicht injizieren Sie, schnell langsame Erweiterung des Muskels zu ermöglichen. Schnelle Injektion verursacht Gewebetrauma.
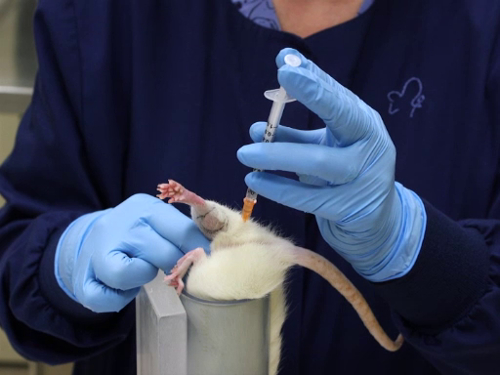
Abbildung 3. Intramuskuläre Injektion in den Gesäßmuskel bei Ratten.
(4) intravenöse Injektion, die unter Verwendung der Rute Ader
- Zurückhaltung des Tieres ist abhängig, ob das Tier betäubt ist oder wach.
- Verwenden Sie einen zylindrischen Zurückhaltung Schlauch für bewusste Mäusen oder Ratten, mit Ausnahme der haarlosen oder nackt Tiere. Aufgrund der öligen Beschaffenheit der haarlose Tiere ist es schwierig zu positionieren und entfernen sie aus dem Acryl Wachstumsbefürworter, wie ihre Haut zur Einhaltung des starren Kunststoffs neigt. So ist ein flexible Kunststoff Kegel verwendet.
- Anderen Injektionsgeräten gehören beleuchtete Plattformen, beheizten Plattformen und starre Kunststoff Kegel, wo die Maus in der Kegel streng mit Spannung auf das Heck aufbewahrt wird.
- Narkotisierten Mäuse benötigen keine Zurückhaltung.
- Wärmen Sie den ganzen Körper oder nur die Rute zu Vasodilatation der Schweif Schiffe zu gewährleisten.
- Wärmen Sie den ganzen Körper mit einer elektrischen Heizkissen auf Medium oder eine zirkulierende Wasser Decke gesetzt.
- Legen Sie das Tier in der Rückhalteeinrichtung, eingehüllt in die Wärmequelle.
- Beobachten Sie das Tier genau, und von der Wärmequelle zu entfernen Sie, sobald die Blutgefäße erweitern. Ganzkörper-Erwärmung kann auch mit der Verwendung einer Wärmelampe in einen Käfig geleitet erreicht werden. Bei der Verwendung einer Wärmelampe müssen eng die Tiere beobachtet werden, da es einfach sie zu überhitzen.
- Bei der Erwärmung des ganzen Körpers nicht möglich ist, heizen die Rute allein lässt sich mit warmen Kompressen aus einem beheizten Handtuch, Wärmflasche, oder das Heck ins warme Wasser eintauchen. Vorsicht muss eingesetzt werden, um nicht zu verbrennen das Heck, weil Wärmflaschen vorgewärmte Handtücher und Warmwasser Temperaturregler nicht verfügen. Es ist üblich für die Wärmequellen, zunächst überhitzt werden. Diese Wärmequellen abkühlen auch schnell.
- Die Verwendung von Gewebe-Öl ist eine weitere Möglichkeit, die Visualisierung der Schiffe zu verbessern.
- Tauchen Sie einen Baumwoll-gespitzten Applikator in das Gewebe-Öl, und gelten Sie die Ölquelle entfernt den Teil des Hecks, die zur Stabilisierung Griff ist. Das Gewebe Öl bewirkt, dass die Schiffe, die mehr klar definierten erscheinen.
- Es gibt ungiftige Öle im Handel erhältlich, die eine Chemikalie in der Formulierung enthalten, die Erwärmung der Haut und Vasodilatation mit Verdunstung schafft. Diese Öle werden angewendet, und nach wenigen Augenblicken, wenn die Gefäße sichtbar sind, wird das überschüssige Öl mit einem Wattebausch entfernt abgewischt.
- Alle Öle können die Rute halten erschweren.
- Wenn Sie Öle zu verwenden, muss die Injektion sofort bei Visualisierung der Schiffe erfolgen.
- Injektion Wahrzeichen sind wie folgt:
- Die seitlichen Schweif Venen befinden sich auf den Seiten des Hecks. Es gibt auch Schiffe, die entlang der dorsalen und ventralen Mittellinien der Rute, die nicht für Injektion Zwecke geeignet sind.
- Das Tier in die Restrainer kann gedreht werden, so dass die seitlichen Schiffe für eine einfache Injektion gerichtet sind. Alternativ kann das Heck gedreht werden, um die Schiffe in ein akzeptabler Position für die Injektion zu bringen.
- Die Schiffe sind sehr oberflächlich. Sie werden mehr oberflächlich, wie sie die Schwanzwurzel erreichen.
- Injektion eines Artikels in die Rute Vene erfordert Geschick. Zur Vermeidung von Verletzungen der Blutgefäße muss überflüssige Bewegung der Nadel verhindert werden. Die Spritze wird in einer Art und Weise gehalten, die nicht Neuausrichtung der Hand erfordert, um die Injektion durchführen.
- Positionieren Sie das Heck, so dass das Schiff sichtbar und unter Spannung gehalten wird. Gelten nicht übermäßige Spannung am Schwanz oder das Schiff kann gestreckt werden und die Durchblutung vermindert.
- Stellen Sie die Nadel direkt über das Schiff soweit distal wie möglich.
- Üben Sie leichten Druck und schieben Sie die Nadel in die Rute Parallel zu den Wirbeln. Vermeiden Sie Angeln die Nadel nach unten die Nadel wird das Schiff Transekt. Die Nadel sollte im Behälter sichtbar sein, da es mindestens 2 mm in das Lumen weit fortgeschritten ist.
- Injizieren Sie das Material in einer langsamen, fließenden Bewegung, Bruch des Schiffes zu vermeiden.
- Besonderes Augenmerk auf die Rute beim Einspritzen. Wenn das Schiff richtig eingesteckt, ist das Injektionsmaterial fließt in das Gefäß mit keinen Widerstand spüren. Das Blutgefäß sollte blanchieren, wie das Blut durch das Injektionsmaterial herausgedrückt wird.
- Wenn die Nadel nicht im Behälter ist, werden starke Widerstände beim Einspritzen. Wenn mit Kraft zu injizieren, wird das Material den subkutanen Raum füllen und die Rute wird mit Positionsnummern versehen. Beenden Sie sofort, wie Material intravenös injiziert werden soll auf das umliegende Gewebe ätzend sein kann. Ziehen Sie die Nadel heraus und versuchen Sie eine weitere Injektion mehr cranially am Heck.
- Ziehen Sie nach der erfolgreichen Injektion die Nadel heraus und üben Sie Druck auf die Injektionsstelle, gute Hämostase zu versichern, bevor er das Tier an den Käfig.
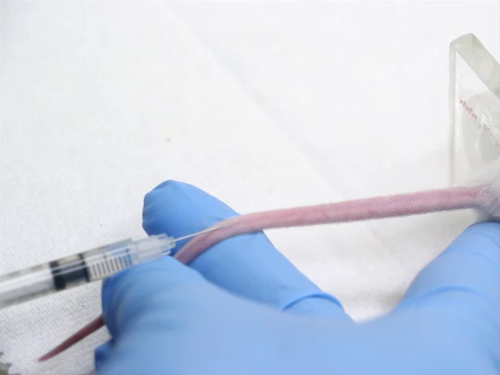
Abbildung 4. Tail Vene Injektion bei Mäusen.
Anwendung und Zusammenfassung
Stoff-Verwaltung ist ein üblicher Bestandteil der experimentelle Protokolle, die Tiere zu nutzen. Wenn Sie eine Route der Lieferung wählen, müssen viele Faktoren einschließlich die technische Kompetenz der Personen, die verantwortlich für die Dosierung, die Tiere, die Größe des Tieres, die Viskosität der Flüssigkeit und die Menge verabreicht werden beraten. Sorgfältige Berücksichtigung dieser Faktoren erhöhen das Wohlbefinden des Tieres und das Gesamtergebnis des Experiments.
Referenzen
- Turner, P.V., Pekow, C., Vasbinder, M. A. and Brabb, T. 2011. Administration of substances to laboratory animals: equipment and considerations, vehicle selection, and solution preparation. JAALAS. 50:5. 614-627.
- Shimizu, S. 2004. Routes of Administration in The Laboratory Mouse. Elsevier.
- Machholz, E., Mulder, G., Ruiz, C., Corning, B. F., Pritchett-Corning, K. R. 2012. Manual Restraint and Common Compound Administration Routes in Mice and Rats. J. Vis. Exp. (67), e2771, doi:10.3791/2771
- Turner, P. V., Brabb, T., Pekow, C., Vasbinder, M. A. 2011. Administration of substances to laboratory animals: routes of administration and factors to consider. JAALAS. 50, 600-613
pringen zu...
Videos aus dieser Sammlung:

Now Playing
Wirkstoffverabreichung I
Lab Animal Research
99.9K Ansichten

Umgang mit Nagetieren und Fixierungstechniken
Lab Animal Research
173.2K Ansichten

Grundlegende Pflegeverfahren
Lab Animal Research
27.6K Ansichten

Grundlagen der Zucht und Entwöhnung
Lab Animal Research
35.5K Ansichten

Identifizierung von Nagetieren I
Lab Animal Research
54.4K Ansichten

Identifizierung von Nagetieren II
Lab Animal Research
25.5K Ansichten

Wirkstoffverabreichung II
Lab Animal Research
34.6K Ansichten

Wirkstoffverabreichung III
Lab Animal Research
31.2K Ansichten

Wirkstoffverabreichung IV
Lab Animal Research
51.2K Ansichten

Blutentnahme I
Lab Animal Research
170.7K Ansichten

Blutentnahme II
Lab Animal Research
72.7K Ansichten

Einleiten und Aufrechterhalten der Anästhesie
Lab Animal Research
50.0K Ansichten

Überlegungen zur Nagetierchirurgie
Lab Animal Research
22.3K Ansichten

Diagnostische Nekropsie und Gewebeentnahme
Lab Animal Research
57.8K Ansichten

Sterile Gewebeentnahme
Lab Animal Research
34.7K Ansichten
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten