Blutentnahme II
Überblick
Quelle: Kay Stewart, RVT, RLATG, Anus; Valerie A. Schroeder, RVT, RLATG. University of Notre Dame, IN
Die Ansammlung von Blut von Mäusen und Ratten für die Analyse kann mittels verschiedener Methoden erfolgen. Jede Methode der Sammlung hat Variationen in der Art von Zurückhaltung erforderlich, die Invasivität des Verfahrens und die Notwendigkeit einer Vollnarkose. 1 In der Vergangenheit die Verwendung von Retro-Orbital Kieferhöhle eingesetzt werden, aber nicht ohne Aussprache. Die Kontroverse im Zusammenhang mit der möglichen Gewebeschäden oder sogar Blindheit, verursacht durch Retro-Orbital blutet führte zur Entwicklung des Gesichts und mandibulären Vene Blutungen Methoden bei Mäusen. Blutentnahme aus der Stammvenen bei Mäusen und Ratten ist eine andere Technik, die entwickelt worden ist. Diese Verfahren erfordern keine Anästhesie und eignen sich daher bei der Verwendung von Anästhetika Blutwerte oder andere Daten verwirren kann.
Grundsätze
Gibt es eine Vena facialis in die Maus, die aus dem Okular Plexus quer über die Wange läuft und der mandibulären Vene, die entlang des Unterkiefers. Beide Schiffe konvergieren in die Halsschlagader direkt unterhalb der Kiefer-Linie, so dass sie leicht zugänglich. Serielle Proben können entweder Behälter entnommen werden durch den Wechsel der Seite verwendet. Keine Seite sollte jedoch öfter als alle 5-7 Tage verwendet werden. 2
Vorkehrungen müssen getroffen werden, während der Durchführung einer Vena facialis bluten. Da der Gehörgang in der Nähe der Vena facialis, befindet wenn die Lanzettenspitze kaudal gerichtet ist, wird der Kanal durchstochen werden. Dadurch wird ein Siphon-Effekt, welches das Blut aus dem Ohr kommen. Trotz dieser Blut kann noch gesammelt werden, und die Maus wird nicht dauerhaften Schaden aufrecht erhalten. Jedoch kann dies dem Tier seine schütteln den Kopf, spritzt Blut im Käfig führen.
Bei Blutungen aus der mandibulären Ader ist die Einstecktiefe der Nadel entscheidend. Eine Einstecktiefe von mehr als 4-5,5 mm kann auf die Muskeln, Nerven und andere Schiffe, die in den Kopf, den Hals und die Mundhöhle sind Trauma führen. Spätere Komplikationen umfassen übermäßigen Blutungen was Hypovolämie, Ertrinken durch die Flüssigkeit in den Mund, und Schäden an oraler Strukturen, die mit Essen und trinken stören.
Zurückhaltung des Tieres ist entscheidend für eine erfolgreiche Beschnittzugabe für Vena facialis und mandibulären Vene Verfahren. Wenn der Griff auf das Genick zu eng ist, kann der Blutfluss in die Vena facialis eingeschränkt werden. Dies führt zu einer Verringerung des Volumens gesammelt. Kollektion Volumen variiert über die Vena facialis und mandibulären Ader bluten. Es ist zwingend notwendig, um die Sammlung Volumen zu begrenzen, so dass sie die maximale Lautstärke für Überleben Blutentnahme nach institutionellen Richtlinien und einer genehmigten Tier Protokoll nicht übersteigt. Hämostase gewährleistet, sobald die gewünschte Menge gesammelt werden wird verhindert, dass zusätzliche oder übermäßigen Blutverlust. 2
Blutentnahme aus der Stammvenen ist eine weitere Alternative für serielle blutet. Die seitlichen Stammvenen ist ein oberflächliches Gefäß, das dorsal, läuft und dann seitlich entlang des tarsal Gelenks. 3 Obwohl dieses Verfahren mehr ästhetisch akzeptabel als Retro-Orbital bluten, wegen der Vorbereitung erforderlich sein kann- und keine Verwendung der Anästhesie für dieses Methode-es kann tatsächlich mehr Stress für das Tier. Komplikationen, die aus einer saphena blutet entstehen können beziehen sich auf die Einstichstelle. Wenn die Punktion nicht direkt auf dem Schiff ist, kann Blut subkutan, pool was ein Hämatom. Blutergüsse, mögliche Infektionen und Begünstigung der Extremität sind andere mögliche Probleme. Diese Methode erfordert eine Ausbildung, aber es ist leicht zu erlernen. Volumes, die mit dieser Methode gesammelt sind zwischen 10-150 µL, abhängig von der Häufigkeit der Probenahme. 4 Proben sind variabel in Qualität, da sie Gewebe Produkte enthalten können. Innerhalb von 24 Stunden aus dem gleichen Bein sollte nicht mehr als vier Blutproben entnommen werden.
Die femorale Ader ist eine weitere Option für die Blutentnahme auf einer Ratte. Die femorale Ader läuft auf den medialen Aspekt des Hinterbeines von der Leiste bis das Kniegelenk vor der Überquerung des Knies und zu den seitlichen saphena, so dass es leicht zugänglich. Obwohl dieses Verfahren ohne den Einsatz von Narkosemittel erfolgen kann, benötigt es zwei Personen eine Person hält das Bein an der Stelle, wo das Bein und Bauch verbinden, um die Vene zu verdecken, während der andere die Venenpunktion führt und das Blut sammelt.
Der Vorteil bei der Verwendung der femoralen Ader ist, dass ein größeres Volumen als von der saphenous Ader leichter entnommen wird. Jedoch da die femorale Ader groß ist, ist es anfällig für Hämatombildung. Dies kann durch zu festen Halt auf dem Bein, verschärft werden, die zusätzliche Druckstellen verursachen können. Mit diesem Blut Erfassungsmethode gibt es Unterschiede in der Höhe von Blutproben durch Blutungen nach dem Entfernen der Nadel. Es ist zwingend notwendig, um die Blutstillung zur Vermeidung dieser übermäßigen Blutverlust zu gewährleisten.
Verfahren
(1) Vena facialis bluten bei Mäusen
- Ausrüstung
- Ansammlung von Blut ist aus einen freien Haken in ein Röhrchen Blut oder eine Eppendorf Tube. In einigen Fällen ist es wünschenswert, das Blut direkt in Hämatokrit Röhren zu sammeln.
- Goldrute Lanzetten werden basierend auf die passende Größe für das Tier je nach Alter und Geschlecht ausgewählt werden.
- Lanzetten sind je nach Alter/Größe von Mäusen wie folgt ausgewählt:
4mm Lancet: 3-4-Wochen alten Mäusen (unter 15 Gramm Körpergewicht)
5mm Lancet: weibliche Mäuse unter 10 Wochen (unter ~ 20 Gramm Körpergewicht)
5mm Lancet: männliche Mäuse jünger als 6 Wochen (unter ~ 20 Gramm Körpergewicht)
5mm Lancet: für Single-Drop Proben (für Blut Abstriche)
5,5 mm Lancet: weibliche Mäuse über 10 Wochen (mehr als ~ 20 Gramm Körpergewicht)
5,5 mm Lancet: männliche Mäuse mehr als 6 Wochen (mehr als ~ 20 Gramm Körpergewicht)
5,5 mm Lancet: große Proben
- Lanzetten sind je nach Alter/Größe von Mäusen wie folgt ausgewählt:
- Zurückhaltung
- Mäuse sind zurückhaltend mit der scruffen Technik.
- Es ist wichtig, dass-seitliche Bewegung des Kopfes minimiert werden. Dies sorgt für präzise und sichere Venenpunktion mit der Lanzette.
- Blutentnahme
- Die richtige Größe-Lanzette ist senkrecht zur Oberfläche der Haut statt.
- Die Lanzette Punkt ist leicht angewinkelt, mit der Spitze in Richtung der Nasenerkers.
- Die Lanzette Klinge eignet sich besonders in einer senkrechten Position.
- Während der Ruhigstellung der Maus, suchen Sie die ungefähre Fläche von der Vena facialis durch die Messung der Länge des Auges unterhalb der seitlichen Augenwinkel und die Breite des Auges kaudal.
- Fühlen Sie mit der Spitze der Lanzette vorsichtig für den Punkt, an dem der Kieferknochen endet.
- Positionieren Sie für bessere Genauigkeit bei der Punktion des Schiffes den Mauszeiger im seitlichen liegen.
- Durchstechen der Haut an der Schulter der Lanzette an diesem Punkt. Dies geschieht mit einem festen Stoß und nicht als einen Dart zu werfen.
- Nach dem Entfernen der Lanzette wird Blut zu fließen beginnen.
- Um die Durchblutung zu unterstützen, positionieren Sie den Mauszeiger mit dem Kopf tiefer als das Herz.
- Sammeln Sie das Blut in die gewünschten Sammelbehälter.
- Tupfen Sie die Punktion Website und Release Druck auf das Genick zur Blutstillung.
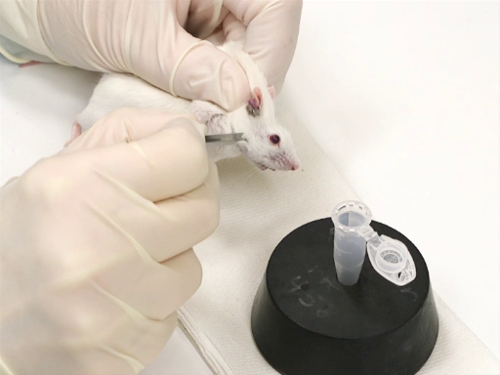
Abbildung 1. Vena facialis bluten bei Mäusen.
(2) mandibulären bluten bei Mäusen: Obwohl sehr ähnlich, die Technik für die Vena facialis bluten, gibt es Unterschiede in Ausstattung und feinen Unterschiede in diesem blutende Verfahren.
- Ausrüstung
- Sammlung des Blutes ist von einen freien Haken in ein Röhrchen Blut oder eine Eppendorf Tube. In einigen Fällen ist es wünschenswert, die direkt in Hämatokrit Röhren sammeln.
- 18-22-g-Nadeln werden anhand der entsprechenden Größe für das Tier je nach Alter und Geschlecht ausgewählt.
- Nadeln sind nach Alter/Größe der Mäuse wie folgt ausgewählt:
22 Gauge: 3-4 Wochen alten Mäusen (unter 15 Gramm Körpergewicht)
20 Gauge: weibliche Mäuse unter 10 Wochen (unter ~ 20 Gramm Körpergewicht)
20 Gauge: männliche Mäuse jünger als 6 Wochen (unter ~ 20 Gramm Körpergewicht)
20 Gauge: für Single-Drop Proben (für Blut Abstriche)
18-Gauge: weibliche Mäuse über 10 Wochen (mehr als ~ 20 Gramm Körpergewicht)
18-Gauge: männliche Mäuse mehr als 6 Wochen (mehr als ~ 20 Gramm Körpergewicht)
18-Gauge: große Proben
- Nadeln sind nach Alter/Größe der Mäuse wie folgt ausgewählt:
- Zurückhaltung
- Mäuse sind zurückhaltend mit der scruffen Technik.
- Es ist wichtig, dass-seitliche Bewegung des Kopfes minimiert werden. Dies sorgt für präzise und sichere Venenpunktion mit der Nadel.
- Blutentnahme
- Die Nadel wird senkrecht zur Oberfläche der Haut gehalten.
- Während der Ruhigstellung der Maus, suchen Sie die ungefähre Fläche der mandibulären Ader durch den Schnittpunkt eine Zeile aus dem Mundwinkel eine Zeile aus der seitlichen Augenwinkel des Auges. Dies deckt sich mit eine kleine, haarlose Grübchen kaudalen in die Ecke des Mundes und leicht unter der Kiefer-Linie zu finden.
- Positionieren Sie für bessere Genauigkeit bei der Punktion des Schiffes den Mauszeiger im seitlichen liegen.
- An dieser Stelle stechen Sie die Haut mit der Spitze der Nadel. Dies geschieht mit einem festen Stoß und nicht als einen Dart zu werfen.
- Die Nadel wird nicht über die Spitze der Abschrägung eingefügt.
- Nach dem Entfernen der Nadel wird Blut zu fließen beginnen.
- Um die Durchblutung zu unterstützen, positionieren Sie den Mauszeiger mit dem Kopf tiefer als das Herz.
- Sammeln Sie das Blut in die gewünschten Sammelbehälter.
- Tupfen Sie die Einstichstelle, und Druck auf das Genick zur Blutstillung.

Abbildung 2. Mandibulären Ader bluten bei Mäusen.
3. Saphenous bluten
- Ausrüstung
- Kunststoff transparent, flexible Zurückhaltung Zapfen können entweder die Maus oder Ratte verwendet werden. Für Mäuse können modifizierte 50 ml konische Kunststoffrohre zur Zurückhaltung verwendet werden. Für Ratten, modifiziert Plexiglasröhren Zurückhaltung-mit einem Schlitz breit genug, um die hinteren Bein-Dose verlängern verwendet werden.
- Bei der Verwendung von Kunststoff Kegel ist es gemessen an der Körperlänge des Tieres, und ein ovales Loch geschnitten auf der Ebene des Oberschenkels.
- Eine konische Rohr kann durch das Abschneiden am Ende des Rohres ermöglichen eine Atmung Loch für eine Maus für dieses Blut Erfassungsmethode geändert werden. Ein Slot ist vom Cap Ende des Rohres über ½ Zoll breit und 2 Zoll lang geschnitten. Die Kanten sind in Tuch Band bedeckt oder geglättet für Tiergesundheit.
- Eine Blutsperre ist mit einer 3 cc Spritze und einer Länge von 2-0 nonabsorbable Naht hergestellt. 3
- Dreifache antibiotische Salbe oder weiße Vaseline dient als feuchtigkeitsbeständig Barriere auf der Haut.
- Eine 22 Gauge-Nadel ist die bevorzugte Größe für die Blutentnahme.
- Blut wird direkt in Hämatokrit Rohre gesammelt.
- Zurückhaltung
- Flexible Kunststoff-Zapfen
- Die Maus oder Ratte wird Nase voran in den Trichter gelegt.
- Ende des Kegels wird gefaltet und mit einem kleinen Bindemittel Clip um zu verhindern, dass das Tier verlassen die Zurückhaltung Kegel geschlossen.
- Das Hinterbein wird sanft durch die ovale Öffnung in die Leistengegend gezogen.
- Konische Rohr für Mäuse
- Die Maus befindet sich in der Röhre Nase voran.
- Das Hinterbein wird vorsichtig in den Steckplatz geführt.
- Der Mittelfinger wird über das Ende des Rohres zu verhindern, dass die Maus verlassen das Rohr gelegt.
- Dem Zeigefinger und dem Daumen stabilisieren die Maus Bein.
- Plexiglas-Zurückhaltung-Rohr für Ratten
- Die Ratte ist in der Röhre Nase voran platziert.
- Das Hinterbein wird vorsichtig in den Steckplatz geführt.
- Das Ende der Röhre ist gesichert, um zu verhindern, dass die Ratte aus sichern und verlassen das Rohr.
- Dem Zeigefinger und dem Daumen stabilisieren die Ratte Bein.
- Flexible Kunststoff-Zapfen
- Blutentnahme
- Das Haar wird von der lateralen Seite des Beines vom Sprunggelenk, das Knie entfernt. Dies kann durch Zupfen, Rasieren oder einer Enthaarungscreme verwenden.
- Sobald das Haar entfernt wurde, wird eine kleine Menge der Salbe aufgetragen und in einer sehr dünnen Schicht auf die haarlose Fläche verteilt.
- Der Druckverband wird als weit cranially wie möglich und verschärfte angewendet.
- Das saphena Schiff quer über die äußere Oberfläche des Beines vom Knie bis zum Knöchel beginnt zu füllen und werden angehoben und einfach zu visualisieren.
- Die Nadel ist senkrecht zur Oberfläche der Haut direkt über das Blutgefäß statt. Punktion des Schiffes. Achten Sie darauf, dass Sie nicht die Nadel tief in das Bein zu vermeiden Punktierung des Muskels oder Knochen schlagen eingesetzt.
- Das Blut wird sich auf der Oberfläche des Beines zur Abholung mit dem Hämatokrit Rohr Wulst.
- Sobald das Blut gesammelt hat, lösen Sie die Blutsperre und Druck über die Punktion zur Blutstillung.
- Sobald die Blutung aufgehört hat, entfernen Sie das Tier aus der Zurückhaltung und dem Hause Käfig zurück.
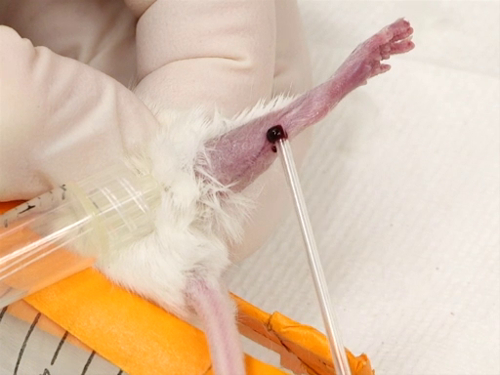
Abbildung 3. Stammvenen bluten bei Mäusen.
4. Femoral Ader für Ratten
- Ausrüstung
- Blut wird in einem Hämatokrit Rohr gesammelt.
- Dreifach antibiotische Salbe ist erforderlich, um eine Barriere zwischen der Haut/Haar und das Blut Droplet erstellen.
- Eine 22 Gauge-Nadel wird verwendet, um die Vene punktieren.
- Ein kleines, tragbares Haarschneider mit ungefähr 1" breite Klinge wird verwendet, um das Haar aus dem Bein zu befestigen.
- Zurückhaltung
- Ratten sind zurückhaltend mit einer klaren, flexiblen Kunststoff Zurückhaltung Kegel.
- Die Kunststoff Kegel werden an der Körperlänge und ein ovales Loch schneiden auf der Ebene des Oberschenkels gemessen. Der Kegel wird geschnitten, so dass das Hinterbein mit Zugriff auf die Vene verwirklicht werden kann.
- Blutentnahme
- Das Haar ist von der Innenfläche des Beines von der Leiste bis zum Knie rasiert.
- Dreifach antibiotische Salbe ist in einer dünnen Schicht auf die Einstichstelle aufgetragen.
- Die Zurückhaltung Person freien dahinterliegende haben die Vene und hält die Ratte mit der Innenfläche des Beines mit Blick auf die Phlebotomist.
- Benutzen Sie die Nadel in die Vene punktieren. Die Nadel wird senkrecht gehalten, um die Blutgefäße und die Punktion erfolgt direkt über die Vene.
- Die Punktion erfolgt wie in der Nähe des Knies wie möglich, für zusätzliche Probenahme anterior das erste Blut-Sammelstelle.
- Das Schiff ist oberflächlich. Die Tiefe der Punktion sollte daher nicht tiefer als die Länge der Schräge der Nadel.
- Um die Durchblutung zu unterstützen, positionieren Sie die Ratte mit dem Bein niedriger als das Herz.
- Das Blut in den Hämatokrit-Röhren zu sammeln, wie es auf der Hautoberfläche Perlen.
- Druck auf das Bein und üben Druck auf die Punktionsstelle zur Blutstillung zu erreichen.
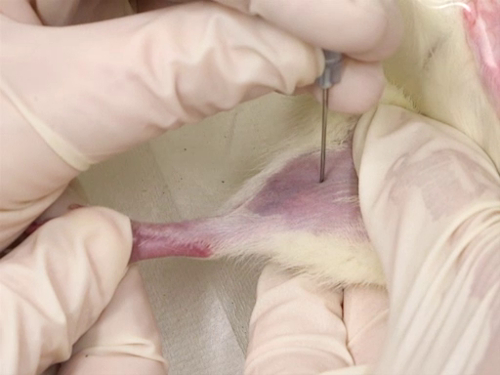
Abbildung 4. Femoral Ader bluten bei Ratten.
Anwendung und Zusammenfassung
Die Methode der Blutentnahme kann dazu führen, dass eine Variation in der Analyse der Probe. Die Spielstärke des Technikers Durchführung der Probenentnahme hat Auswirkungen auf die Qualität der Probe und das wohl des Tieres. Die Verwendung von Anästhetika kann auch die Sample-Qualität beeinflussen. Die hier beschriebenen Methoden sind ohne den Einsatz der Anästhesie durchgeführt, damit diese Variable beseitigt worden. Alle diese Techniken können auch für serielle Probenahme mit minimaler Unannehmlichkeit für das Tier verwendet werden.
Tags
pringen zu...
Videos aus dieser Sammlung:

Now Playing
Blutentnahme II
Lab Animal Research
74.0K Ansichten

Umgang mit Nagetieren und Fixierungstechniken
Lab Animal Research
175.9K Ansichten

Grundlegende Pflegeverfahren
Lab Animal Research
28.1K Ansichten

Grundlagen der Zucht und Entwöhnung
Lab Animal Research
35.9K Ansichten

Identifizierung von Nagetieren I
Lab Animal Research
55.1K Ansichten

Identifizierung von Nagetieren II
Lab Animal Research
25.7K Ansichten

Wirkstoffverabreichung I
Lab Animal Research
101.3K Ansichten

Wirkstoffverabreichung II
Lab Animal Research
35.2K Ansichten

Wirkstoffverabreichung III
Lab Animal Research
31.7K Ansichten

Wirkstoffverabreichung IV
Lab Animal Research
52.1K Ansichten

Blutentnahme I
Lab Animal Research
172.8K Ansichten

Einleiten und Aufrechterhalten der Anästhesie
Lab Animal Research
51.1K Ansichten

Überlegungen zur Nagetierchirurgie
Lab Animal Research
22.6K Ansichten

Diagnostische Nekropsie und Gewebeentnahme
Lab Animal Research
58.5K Ansichten

Sterile Gewebeentnahme
Lab Animal Research
35.0K Ansichten
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten