Method Article
Mycobacterium tuberculosis'in İmmün Reseptör SLAMF1 ile Etkileşiminin İncelenmesi için Floresan Testleri
Bu Makalede
Özet
Bu çalışma, Mycobacterium tuberculosis'in SLAMF1 mikrobiyal sensörü ile etkileşimini değerlendirmek için bir protokol sağlar. Deneyler, akış sitometrisi ve floresan mikroskobu kullanılarak insan monositinden türetilmiş makrofajlar üzerinde gerçekleştirildi. Açıklanan araçlar, patojenler ve immünoreseptörler arasındaki etkileşimleri incelemek için önemlidir.
Özet
Patojenler ve immün reseptörler arasındaki doğrudan etkileşimin değerlendirilmesi genellikle karmaşık teknikler içerir veya transgenik suşların ve genetik olarak tasarlanmış hücrelerin kullanımını ima eder. Burada, makrofaj mikrobiyal sensörü SLAMF1 ile Mycobacterium tuberculosis arasındaki biyokimyasal etkileşimi tespit etmek için alternatif bir yöntem açıklanmaktadır. Akış sitometrisi ve floresan mikroskobu kullanan iki teknik yaklaşım geliştirilmiştir. İnsan makrofajlarından toplam hücre protein ekstraktları üretildi, daha sonra M. tuberculosis (WCMtb) veya M. tuberculosis antijenlerinin (Mtb Ags) tüm hücreleri ile gece boyunca 4 °C'de inkübe edildi ve son olarak formaldehit/glisin/etilen glikol bis (süksinimidil süksinat) tedavisi kullanılarak çapraz bağlandı. Akış sitometrisi ile WCMtb ile SLAMF1 etkileşimi, PE'ye özgü bir anti-SLAMF1 antikoru ile tespit edildi. Floresan mikroskobu ile etkileşimin varlığı, monosit türevli makrofajlardan elde edilen toplam protein ekstraktı ile inkübe edilen poli-D-lizin kaplı slaytlara Rhodamine-PE boyanmış Mtb Ags eklenerek gerçekleştirildi. Çapraz bağlama işleminden sonra SLAMF1, birincil (anti-SLAMF1) ve ikincil (Alexa Fluor 488) antikorlar kullanılarak görselleştirildi. Tahliller, patojen-immünoreseptör etkileşimlerini ölçmek için güçlü bir biyokimyasal araç sağladı ve transgenik hücre hatları ve protein gen ekspresyon modülasyon deneyleri ile ilgili zorlukların üstesinden geldi.
Giriş
142 yıl önce tanımlanan tüberküloza neden olan patojen olan Mycobacterium tuberculosis, şu anda dünya nüfusunun en az dörtte birini enfekte eden küresel bir sorun olmaya devam etmektedir1. Enfekte insanlardan havadaki damlacıklar yoluyla bulaşan M. tuberculosis, akciğerlerdeki alveoler makrofajlara ulaşır ve burada gizli bir durumda uzun süre hayatta kalabilir 2,3. Sadece lokal makrofajik yanıt aktive edilmekle kalmaz, aynı zamanda son yıllarda, periferik monositlerin solunum yollarına alınabileceği ve alveolar makrofajlara farklılaşabileceği ve M. tuberculosis'e karşı fetal kökenli muadillerine göre daha güçlü bir yanıt oluşturduğu tanımlanmıştır 2,4.
Makrofajlar doğuştan gelen bağışıklığın temel oyuncularıdır. M. tuberculosis yutulduktan sonra, makrofajlar, M. tuberculosis'i öldürmek için proinflamatuar sitokinlerin salgılanması, fagolizozomun füzyonu ve diğer bağışıklık hücrelerinin aktivasyonu gibi çok sayıda mikrobisidal fonksiyon gösterir 2,3. Bununla birlikte, bu patojenin karmaşık mimari yapısı, makrofaj metabolizmasını ve fonksiyonlarını ve sonuç olarak enflamatuar sürecidüzenleyebilen efektörler (örneğin proteinler ve lipitler) sağlar 3. Virülans faktörlerinin salgılanması veya konak faktörlerinin sömürülmesi yoluyla makrofaj yanıtlarının bu şekilde manipüle edilmesi, M. tuberculosis tarafından uygulanan farklı kaçış stratejilerine yol açar.Bazı önemli kaçınma mekanizmaları arasında anti-inflamatuar sitokinlerin indüksiyonu, fagolizozom olgunlaşmasının ve asitleşmesinin inhibisyonu, oksidatif stres değişiklikleri, otofaji bozulması ve antijen işleme ve sunumu sırasındaki eksiklikler yer alır 3,5.
Makrofajlar ve M. tuberculosis arasında sıkı bir şekilde düzenlenmiş bir etkileşim, uygun bir immün yanıtın gelişimi için çok önemlidir. Bu nedenle, bu sinapsları incelemek, konak-patojen karışmasının neden olduğu immünoprotektif veya immünopatojenik mekanizmaların tanımlanmasının yanı sıra potansiyel terapötik hedeflerin tanımlanmasının anahtarıdır. TLR'ler 6,7,8, NLR'ler 7,8, kompleman reseptörleri 6,8, C-tipi lektin reseptörleri 6,8 ve çöpçü reseptörleri 6,8 dahil olmak üzere birçok reseptör M. tuberculosis'in tanınmasına ve/veya içselleştirilmesine aracılık eder. Biriken veriler, hem yüzeye bağlı hem de hücre içi PRR'lerin enfeksiyon sırasında önemli bir rol oynadığını, opsonize ve opsonize olmayan M. tuberculosis'i tanıdığını göstermektedir.
Zihad ve Sifat ve ark. yakın zamanda PRR'lerin doğuştan gelen hücreler tarafından M. tuberculosis'in neden olduğu yanıtlara katılımını gözden geçirmişlerdir9. Özellikle, TLR ailesinin çoğu üyesi, M. tuberculosis ligandları 6,7 ile etkileşimde rol oynamıştır. Yüzey TLR2, asillenmiş lipoproteinler, 19-kDa lipoprotein, LprA lipoprotein, LprG lipoprotein, 30-kDa antijen, 38-kDa antijen, MymA, prolin-prolin-glutamik asit (PPE)-57, LAM, LM, PIM, ısı şoku proteini 60, imza proteini Rv1509 ve salgılanan protein ESAT-67 gibi mikobakteriyel antijenleri tanır. Membran TLR4, ısı şoku proteinleri, 38-kDa antijeni, RpfE, Rv0652, Rv0335c, Rv2659c, Rv1738, Rv2627c, Rv2628, GrpE ve HBHA ile etkileşime girer. Öte yandan, endozomal TLR'ler için ligandlar (TLR 3, 7, 8 ve 9) dsRNA, tRNA, ssRNA, fagozomal RNA ve M. tuberculosis'in dsDNA'sını içerir. Ek olarak, TLR2, TLR1 ve TLR6, TLR4 ve TLR9 6,7 ile birlikte hareket ettiğinde bağışıklık tepkilerini başlatmada aktif bir role sahiptir. NOD2 ve NLRP3, Tüberkülozda en iyi karakterize edilen sitoplazmik NLO'lardır. Spesifik ligandları incelenmeye devam etse de, bu reseptörler sırasıyla muramil dipeptit veya ESAT-6 tarafından aktive edilir 7,8. C-tipi lektin reseptörleri klasik olarak M. tuberculosis endositozunda rol oynar. Dectin-2, M. tuberculosis hücre duvarının ManLAM'ı için doğrudan bir PRR görevi görürken, Dectin-1 ligandı henüz keşfedilmemiştir8. Mincle ve MCL'nin her ikisi de kordon faktörü7 olarak da adlandırılan glikolipid trehaloz-6,6'-dimikolatı (TDM) tanır. DCAR, mikobakteriyel glikolipidler fosfatidil-miyo-inositol mannositler (PIM'ler) ile etkileşime girer7. CR3, mikobakteriyel LAM ve PIM'i tanır, DC-SIGN ManLAM'ı bağlar, MR, ManLAM, PIM, LM, 38-kDa glikoprotein, 19-kDa antijen ve diğer mannosile proteinler dahil olmak üzere bir dizi M. tuberculosis bileşenini tanır.
Çözünür CLR'ler arasında ManLam, LM, 60-kDa glikoprotein ve glikoprotein Apa'yı tanıyan SP-A; SP-D, LAM, LM ve PILAM ile etkileşim; ve ManLAM tanımakonusunda uzmanlaşmış MBL 6,7. SR-A ve MARCO, ligandları olarak TDM'ye sahiptir, SR-B1, ESAT-6'yı tanır ve CD36, ManLAM ve LM 7,8'i bağlar. Ek olarak, Dectin-1, Min ve MARCO, M. tuberculosis PAMPs 6,7'yi tespit ettikten sonra sinyalleri tetiklemek için TLR2 veya TLR4 ile de birleşebilir. CD14, opsonize olmayan bakterileri içselleştirme yeteneğine sahip bir yüzey reseptörüdür ve ayrıca ısı şoku proteini Chaperonin 60.1'i tanır. Özellikle, CD14, MARCO ve TLR26 ile birlikte bir ko-reseptör olarak işlev görür. AIM2, M. tuberculosis'in fagozom8'den kaçması üzerine ssDNA'yı algılayabilen sitozolik bir reseptördür. Son olarak, AhR, M. tuberculosis6'dan pigmentli virülans faktörü naftokinon phtiocol'ü bağlayan ligandla aktive olan bir transkripsiyon faktörüdür.
Yukarıda açıklanan etkileşimlerin çoğu varsayılmıştır ve kesin olarak gösterilmemiştir. Bazı reseptörler için ligandlar bile bilinmemektedir, bu da M. tuberculosis immün tanıma alanını daha iyi anlama ihtiyacını güçlendirmektedir. Bu bağlamda, stimülatör molekül SLAMF1 (Signaling Lymphocytic Activation Molecule) yakın zamanda Barbero ve ark.10 tarafından bir M. tuberculosis reseptörü olarak tanımlanmıştır. Sadece bir sinyal molekülü olarak değil, aynı zamanda bir M. tuberculosis sensörü olarak da hareket eden SLAMF1, Tüberkülozda özellikle ilgi çekici bir role sahiptir. SLAMF1, Erk/CREB fosforilasyonu 11,12,13, nötrofillerdeotofaji 14 ve makrofajlarda bakteriyel klirens15 yoluyla T hücreleri tarafından IFN-γ üretimi gibi koruyucu fonksiyonları modüle ederek bağışıklık hücrelerinin aktivasyonunu indükleyebilir.
Reseptörler-ligand etkileşimleri, ELISA, Yüzey Plazmon Rezonansı (SPR), İzotermal Titrasyon Kalorimetrisi (ITC), Floresan Polarizasyonu (FP), X-ışını Kristalografisi, Nükleer Manyetik Rezonans (NMR) Spektroskopisi, Mikro Ölçekli Termoforez (MST), Rezonans Enerji Transferi (örneğin, BRET veya FRET) Konfokal Mikroskopi, Elektron Mikroskobu, Kriyo-Elektron Mikroskobu (Cryo-EM) ve Atomik Kuvvet Mikroskobu (AFM) gibi teknikler kullanılarak yıllar boyunca incelenmiştir16,17, 18,19,20,21,22,23,24,25,26,27,28. Bu yaklaşımlardan bazıları, raportör genlerin, etiketli rekombinant proteinlerin veya kimerik moleküllerin, nakavt, nakavt veya aşırı ekspresyon modellerinin kullanımını ima eder. Alternatif olarak, hesaplama araçları reseptör-ligand etkileşimlerini ve bağlanma bölgelerini tahmin edebilir ve etkileşimlerin kapsamlı bir şekilde anlaşılmasını sağlamak için genellikle biyolojik yaklaşımlarla birlikte kullanılır 29,30,31. Burada, biyokimyasal etkileşimi tespit etmek için iki alternatif ve ayrıca bakterilerin floresan olarak nasıl etiketleneceğine dair bir bölüm açıklanmaktadır. Reseptör-patojen etkileşimlerinin in vitro olarak incelenmesine izin veren bir protokol sunulmakta, özellikle SLAMF1-M. genellikle mevcut ve rutin olarak kullanılan iki teknik olan akış sitometrisi ve floresan mikroskobu yoluyla tüberküloz etkileşimi.
Protokol
İnsan monosit kaynaklı makrofajları içeren tüm prosedürler Helsinki Bildirgesi'ne (2013) uygun olarak ve UNNOBA (COENOBA) Etik Kurulu ile mutabık kalınarak gerçekleştirilmiştir. Numune alınmadan önce yazılı bilgilendirilmiş onam alındı. Erkek/kadın grup dağılımı 13/6 ve ortanca yaş 32 olup, çeyrekler arası aralık (IQR) 18-75 yıl idi. Geçirilmiş patolojiler, komorbiditeler veya Tüberküloz için pozitif tanı varlığı dışlama kriteri olarak tanımlandı. Reaktiflerin ve ekipmanın ayrıntıları Malzeme Tablosunda listelenmiştir.
1. Monosit kaynaklı makrofaj kültürü ve stimülasyonu
- Kan alımı
- Heparinize bir şırıngada damar delinmesi yoluyla sağlıklı donörlerden 60 mL kan elde edin.
NOT: Kan ekstraksiyonu bir biyokimyacı veya flebotomi teknisyeni tarafından yapılmalıdır. - İğneyi kesici alet imha kabına ve bağışçıların kanıyla temas etmiş herhangi bir materyali patolojik atık kabına atın.
- Heparinize bir şırıngada damar delinmesi yoluyla sağlıklı donörlerden 60 mL kan elde edin.
- Monosit izolasyonu ve makrofaj üretimi
- Kanı dikkatlice 50 mL'lik tüplere aktarın ve tuzlu su çözeltisi ile yarı yarıya seyreltin.
- Periferik kan mononükleer hücreleri (PBMC'ler) elde etmek için yoğunluk gradyanlı bir ortam üzerinde santrifüjleme gerçekleştirin.
- PBMC'leri beyazımsı haleden toplayın.
- Trombositleri ortadan kaldırmak için 10 dakika boyunca 400 x g'da tuzlu su çözeltisi ile iki yıkama ve 20 ° C'de 15 dakika boyunca 200 x g'da son bir yıkama yapın.
- Bir hücre sayma odasındaki PBMC'lerin sayısını belirleyin ve CD14 boncukları ile CD14 pozitif manyetik seçimi gerçekleştirin.
NOT: Manyetik seçim sırasında, üreticinin talimatlarını dikkatlice izleyin. Ek olarak, akış sitometrisi kullanılarak izole edilmiş monositlerin saflığı kontrol edilebilir. - RPMI 1640'ta izole edilmiş hücreleri yeniden süspanse edin ve bir hücre sayma odasındaki monosit sayısını belirleyin.
- Yapışmayı arttırmak için serum yokluğunda 24 oyuklu bir hücre kültürü plakasında oyuk başına 500 μL 1 × 106 / mL CD14 pozitif seçilmiş monositleri tohumlayın.
- 2 saat sonra, yapışmayan hücreleri önceden ısıtılmış RPMI 1640 ile yıkayarak çıkarın.
- Makrofajları ayırt etmek için, yapışık monositleri 1 mL tam ortamda (L-glutamin,% 10 fetal sığır serumu (FBS), 100 U / mL penisilin ve 100 μg / mL streptomisin ile desteklenmiş RPMI 1640 ortamı 16-18 saat (gece boyunca) kültürleyin.
- Ertesi gün, kültür ortamını değiştirin. Ortamı çıkarın, 1 mL 1x PBS ile yıkayın ve 1 mL tam ortam ekleyin.
- Makrofajları 24 saat boyunca sonikasyonlu M. tuberculosis (M. tuberculosis antijenleri (Ags)) ile uyarın. 1 × 10 6 monosit türevi makrofaj başına 10 μL M. tuberculosis Ags (10 μL = 1 ×10 6 bakteri) kullanın.
NOT: 10 μL M. tuberculosis Ags (Mtb Ags) = 1 × 106 bakteri, 1 x 108 bakteri/mL olarak 1 OD dikkate alınarak spektrofotometrede OD 600nm ile ölçülür. Tüm kültüradımları için %5 CO 2 içeren bir atmosferde BSL2 biyogüvenlik kabinleri ve 37 °C'de bir inkübatör kullanın.
- SLAMF1 ifadesinin doğrulanması
- Makrofajları tek bir kuyudan toplayın. Kültür plakasını soğuk bir yüzeye yerleştirin. Arka arkaya iki kez 1 mL soğuk FACS (1x PBS +% 2 FBS) ekleyerek yukarı ve aşağı hareketler kullanarak hücreleri ayırın. Toplama için bir sitometri yuvarlak tabanlı tüp kullanın.
- Hücreleri 500 ° C'de 5 dakika boyunca 4 x g'da santrifüjleyin. Süpernatanı atarak atın.
- Hücreleri karanlıkta 4 ° C'de 30 dakika boyunca floroforla birleştirilmiş bir anti-insan SLAMF1 antikoru ile boyayın. 1.25 μL antikor ekledikten sonra girdap.
- FACS kullanarak antikor fazlalığını ortadan kaldırmak için hücreleri yıkayın, peleti FACS'ta yeniden süspanse edin ve numuneyi bir akış sitometresi kullanarak elde edin.
NOT: 1.25 μL anti-SLAMF1 antikoru, 0.5 x 106 makrofajları etiketlemek için kullanılan 0.0625 μg'ye karşılık gelir. Bununla birlikte, antikorun titrasyonunun yanı sıra karşılık gelen izotip veya Floresan Eksi Bir (FMO) kontrolünün gerçekleştirilmesi şiddetle tavsiye edilir.
2. Toplam hücre protein özütü hazırlama
- Lizis tamponu hazırlama
- NaCl 150 mM, Tris 10 mM, EDTA 5 mM, SDS %1, Triton X-100 %1 ve Sodyum Deoksikolat %1 ile Radyo İmmünopresipitasyon Testi (RIPA) tamponu hazırlayın.
- RIPA tamponunu 1 mM fenilmetilsülfonil florür (PMSF) ve Pepstatin A ve Leupeptin gibi proteaz inhibitörleri ile destekleyin.
- Hücre toplama ve protein izolasyonu
- Bir P1000 pipeti kullanarak plaka kuyularından tam RPMI'yi atın ve soğuk 1x PBS ile yukarı ve aşağı pipetleme yaparak makrofajları hasat edin.
- Hücreleri 1.5 mL mikrosantrifüj tüplerine aktarın. Mikrotüp başına bir kuyu toplayın.
- 500 x g'da 4 °C'de 5 dakika santrifüjleyin. Süpernatanı atın.
- 1 mL soğuk PBS ekleyin ve hücreleri aynı mikrosantrifüj tüpünde toplayarak 2.2.2 ve 2.2.3 adımlarını tekrarlayın.
- Hücre peletlerini 100 μL 1x PBS'de yeniden süspanse edin ve dört tüpü bir araya getirin. Adım 2.2.3'ü tekrarlayın. Her tüp 2 x 106 makrofaj içerecektir.
- 100 μL takviye edilmiş RIPA tamponu ekleyin ve süspansiyonu her 10 dakikada bir girdap yaparak 1 saat buz üzerinde inkübe edin.
- 15 dakika boyunca 14.000 x g'da santrifüjleyin. Süpernatanı toplayın ve -20 °C'de kullanılana kadar muhafaza edin.
3. Akış sitometrisi ile M. tuberculosis-SLAMF1 etkileşimi
- Proteinler-bakterilerin çapraz bağlanması
- 1 × 106 tam inaktive edilmiş M. tuberculosis hücrelerini (WCMtb, M. tuberculosis gama ışınlaması ile inaktive edilmiş) 1 x 106 makrofajdan (50 μL) protein özütü ile gece boyunca 4 ° C'de dönen bir mikrotüp tutucuda inkübe edin.
NOT: 10 μL WCMtb = 1 × 106 bakteri, 1 x 108 bakteri/mL olarak 1 OD dikkate alınarak spektrofotometrede OD 600nm ile ölçülür. - Ertesi gün, 1x PBS'de seyreltilmiş 500 μL %1 formaldehit ekleyin. Oda sıcaklığında (RT) çalkalama (çalkalayıcı) altında 15 dakika inkübe edin.
- Suda seyreltilmiş 25 μL 0.125 M glisin ekleyin. RT'de çalkalama (çalkalayıcı) altında 5 dakika inkübe edin.
- 1 mL 1x PBS ile 14.000 x g'da 5 dakika boyunca iki kez yıkayın. Süpernatanı yıkama adımları arasında atın.
- Peleti yeniden süspanse edin ve süspansiyonu 500 μL 2 mM etilen glikol bis (süksinimidil süksinat) (EGS) çapraz bağlayıcı içinde 1: 1 buzlu asetik asit karışımı içinde seyreltilmiş inkübe edin: RT'de 1 saat su.
NOT: Reaktiflerin kullanım sırasında hazırlanması şiddetle tavsiye edilir. EGS'yi hazırlamak için buzlu asetik asit ve su eşit oranlarda karıştırılmalı ve 70 °C'ye ısıtılmalıdır. Çözelti sıcak değilse, EGS tamamen yeniden askıya alınmaz.
- 1 × 106 tam inaktive edilmiş M. tuberculosis hücrelerini (WCMtb, M. tuberculosis gama ışınlaması ile inaktive edilmiş) 1 x 106 makrofajdan (50 μL) protein özütü ile gece boyunca 4 ° C'de dönen bir mikrotüp tutucuda inkübe edin.
- SLAMF1 boyama
- İlk yıkamada 500 μL 1x PBS ve ikinci yıkamada 1 mL kullanarak adım 3.1.4'ü tekrarlayın.
- Protein-bakteri kompleksini karanlıkta 4 ° C'de 30 dakika boyunca bir anti-insan SLAMF1 antikoru ile (adım 1.3.3'te olduğu gibi) antikoru mikrotüpe ekleyerek ve girdaplayarak boyayın. 1 x 106 hücre (2.5 μL veya 0.125 μg) için uygun antikor miktarını kullanın.
- FACS'ı kullanarak antikor fazlalığını ortadan kaldırmak için hücreleri yıkayın, peleti FACS'ta yeniden süspanse edin ve numuneyi bir akış sitometresinde alın (adım 1.3.4'te olduğu gibi).
NOT: İlgili izotip veya FMO kontrolünü gerçekleştirin.
4. M. tuberculosis antijenleri etiketleme
- Rhodamine B'yi etanol içinde 5 mg / mL (1000x) stok konsantrasyonunda yeniden süspanse edin. Kullanana kadar -20 °C'de saklayın.
- 1.5 mL'lik bir mikrosantrifüj tüpüne 100 μL M. tuberculosis Ags başına 1 μL Rhodamine B ekleyin.
- Sürekli çalkalama (girdap) altında RT'de 45 dakika inkübe edin.
- Süpernatan şeffaf olana kadar 1 mL 1x PBS kullanarak 24 ° C'de 5 dakika boyunca 14.000 x g'da en az 3 kez yıkayın. Pelet (Mtb-R Ags) açık pembe görünecektir.
- İlk hacmi eski haline getirmek için Mtb-R Ags'yi 100 μL 1x PBS'de yeniden askıya alın.
NOT: Steril koşullarda çalışılması tavsiye edilir. Deney yapmadan hemen önce boyamanın yapıldığından emin olun.
5. Floresan mikroskobu ile M. tuberculosis-SLAMF1 etkileşimi
- Bakteri-protein çapraz bağlanması
- Yuvarlak burunlu cerrahi cımbız kullanarak 12 mm'lik yuvarlak lamelleri 24 oyuklu kültür plakalarına (oyuk başına 1 lamel) yerleştirin.
NOT: Lamelleri %70 etanol ile iyice temizleyin. İstenirse 30 dakika boyunca UV ışığı altında otoklavlanabilir veya sterilize edilebilirler. - Lameli 400 μL 10 μg/mL Poli-D-Lizin ile gece boyunca 4 °C'de inkübe edin. Işıktan korumak için plakayı alüminyum folyo ile örtün.
- Ertesi gün, plakayı buzdolabından çıkarın ve lameli iki kez 1 mL su ile yıkayın.
- Lamelin kurumasını bekleyin.
- 20 μL (2 x 106) Mtb-R Ags'yi 180 μL 1x PBS içinde seyreltin. Son 200 μL, bir lamel tamamen kaplamak için yeterlidir.
- Lameli Mtb-R Ags ile bir hücre inkübatörde 37 ° C'de 1 saat inkübe edin.
- Kalan sıvıyı atın ve 1 mL 1x PBS ile iki kez yıkayın.
NOT: Bu adımda, Mtb-R'nin lamele doğru yapışması, kırmızı kanala karşılık gelen filtreler kullanılarak bir floresan mikroskobu ile kontrol edilebilir. - Çalkalayıcıda RT'de 30 dakika boyunca 400 μL engelleme tamponu (1x PBS'de% 10 FBS) ekleyin.
- 400 μL blokaj tamponu ile iki kez yıkayın.
- 300 μL 1x PBS içinde seyreltilmiş 100 μL protein özütü ile RT'de çalkalamada (çalkalayıcı) 2 saat inkübe edin.
- 1x PBS'de seyreltilmiş 400 μL %1 formaldehit ekleyin. RT'de çalkalama (çalkalayıcı) altında 15 dakika inkübe edin.
- Su ile seyreltilmiş 500 μL glisin 0.125 M ekleyin. RT'de çalkalama (çalkalayıcı) altında 5 dakika inkübe edin.
- 1 mL 1x PBS ile iki kez yıkayın.
- Çalkalayıcıda RT'de 1 saat boyunca 400 μL 2 mM EGS ekleyin.
- Adım 5.1.13'ü tekrarlayın
NOT: Reaktiflerin kullanım sırasında hazırlanması şiddetle tavsiye edilir.
- Yuvarlak burunlu cerrahi cımbız kullanarak 12 mm'lik yuvarlak lamelleri 24 oyuklu kültür plakalarına (oyuk başına 1 lamel) yerleştirin.
- SLAMF1 boyama
- Kültür plakasının kapağını parafin filme sarın.
- Parafin film kaplı kapağa 60 μL önceden titre edilmiş anti-SLAMF1 birincil antikoru (1:75 seyreltme) damlatın.
- Kavisli ince uçlu cerrahi cımbız ve iğneler kullanarak lameli plakadan dikkatlice çıkarın.
NOT: Lamellerin çıkarılmasını kolaylaştırmak için iğne yaklaşık 45° açıyla bükülebilir. - Antikoru içeren damlanın üzerine lamel ters çevirin. Karanlıkta RT'de 30 dakika kuluçkaya yatırın.
- Lameli kaldırın ve engelleme tamponu ile iki kez yıkayın.
- Lameli ikincil antikoru (1:200 seyreltme) içeren yeni bir damla üzerine ters çevirin. Karanlıkta RT'de 30 dakika kuluçkaya yatırın.
- Adım 5.2.5'i tekrarlayın.
- Fazla sıvıyı çıkarın ve lamel bir cam slayt üzerine yerleştirilmiş bir damla montaj sıvısının üzerine monte edin.
- Yeterli filtreler kullanarak floresan mikroskobu altında gözlemleyin.
NOT: Steril koşullarda çalışılması tavsiye edilir. Bloke edici tampondaki antikorları seyreltin. Mikroskop altında gözlemi engelleyebilecek çizikleri önlemek için lameli dikkatli bir şekilde tutun. Floresan için uygun bir montaj sıvısı şiddetle tavsiye edilir.
Sonuçlar
Bu çalışmada, insan makrofajlarında M. tuberculosis'in immün reseptör SLAMF1 ile etkileşiminin değerlendirilmesine izin veren bir protokol sağlanmıştır (Şekil 1). Bu amaçla sağlıklı vericilerden periferik kan elde edildi. Daha sonra, PBMC'ler yoğunluk gradyanlı ortam üzerinde santrifüjleme ile ayrıldı ve monositler manyetik pozitif seçim ile izole edildi (%≥95 saflıkta, Şekil 2A,B). İzole edilen monositler, monosit türevi makrofajlar elde etmek için 2 saat boyunca plastik kültür plakalarına yapıştırıldı ve daha sonra kültüre edildi. Daha sonra, makrofajlar,10'dan önce bildirildiği gibi SLAMF1 yüzey ekspresyonunu indüklemek için sonikasyonlu M. tuberculosis (Mtb Ags) ile uyarıldı ve yüzey SLAMF1 seviyeleri akış sitometrisi ile doğrulandı (Şekil 2C). Makrofajlar son olarak, hücre lizizini kolaylaştırmak için buz üzerinde girdap ve inkübasyon ile birlikte RIPA lizis tamponu kullanılarak parçalandı. Üretilen toplam protein ekstraktı, etkileşim deneylerinde kullanıldı.
İlk deneysel prosedür setinde, M. tuberculosis'in (WCMtb) tüm hücreleri ile SLAMF1 etkileşimini incelemek için akış sitometrisi kullanıldı (Şekil 3). İlk olarak, SLAMF1 (protein ekstraktındaki içerik) ve WCMtb arasındaki fiziksel etkileşim, 4 ° C'de sürekli rotasyonda birlikte inkübe edilerek teşvik edildi. Daha sonra çapraz bağlama tedavisi gerçekleştirildi ve spesifik bir anti-SLAMF1 antikoru kullanılarak, WCMtb'ye bağlı SLAMF1 reseptörü tespit edildi. Bu tahlilde, SLAMF1 bağlanmasını tespit etmek için ilgilenilen popülasyon olan akış sitometresindeki M. tuberculosis'in boyutuna ve tanecikliğine karşılık gelen voltajları ayarlamak için tek başına WCMtb kullanıldı.
İkinci deneysel yaklaşımda, SLAMF1-M. tüberküloz etkileşimini tespit etmek için floresan mikroskobu kullanılmıştır (Şekil 4). Sonikasyonlu M. tuberculosis'in (Mtb Ags) kullanıldığı bu test, bir öncekini tamamlar. PE florokroma karşılık gelen kanal/filtrede floresan tespitini kolaylaştırmak için Rhodamine B-lekeli Mtb Ags (Mtb-R Ags) kullanıldı. Mtb-R Ag'ler poli-D-lizin kaplı lamellere tutturuldu ve başarılı boyamanın mikroskop gözlemi ile kontrol edildiği kontrol edildi (Şekil 4A). Daha sonra, Mtb-R Ags ile kaplanmış slaytlar, SLAMF1 içeren protein ekstraktları ile inkübe edildi. Çapraz bağlama işleminden sonra, SLAMF1, birincil spesifik bir anti-SLAMF1 antikoru ve ardından PE ile birlikte gözlemlenmek üzere uyumlu bir florokrom ile birleştirilmiş ikincil bir antikor kullanılarak tespit edildi. Mtb-R Ags ve SLAMF1 için iki kanalda ayrı floresan mikroskopi görüntüleri elde edildikten sonra, etkileşim görüntü birleştirme ile doğrulandı (Şekil 4B).
Bu yaklaşımların uygulanması, SLAMF1 ve M. tuberculosis arasında bir etkileşimin varlığını göstermiştir. SLAMF1'in hem tam hem de sonikasyonlu bakterilerle karışması tespit edildi, bu da SLAMF1'e M. tuberculosis10 için yeni bir doğuştan gelen insan makrofaj reseptörü olarak işaret eden hipoteze güç verdi.

Şekil 1: SLAMF1-M. tüberküloz etkileşimini tespit etmek için iş akışı. Periferik kan, sağlıklı donörlerden veniponksiyon yoluyla elde edildi ve periferik kan mononükleer hücrelerini (PBMC'ler) izole etmek için bir yoğunluk gradyan ortamı üzerinde santrifüjlendi. Hücre sayısı belirlendikten sonra, PBMC'ler CD14pos monositlerini saflaştırmak için pozitif manyetik seçime tabi tutuldu. Monositler daha sonra fetal sığır serumu yokluğunda 2 saat boyunca kültür plakalarına yapıştırıldı ve daha sonra monosit türevli makrofajlar elde etmek için takviye edilmiş RPMI'de (dinlenme aşaması) gece boyunca kültürlendi. Daha sonra, makrofajlar, SLAMF1 yüzey ekspresyonunu indüklemek için 24 saat boyunca sonikasyonlu M. tuberculosis (Mtb Ags) ile uyarıldı. SLAMF1 seviyeleri, makrofaj popülasyonunun bir kısmında insan anti-SLAMF1'e özgü bir antikor kullanılarak akış sitometrisi ile test edildi. Kalan makrofajlar toplam protein ekstraktlarını elde etmek için kullanıldı. Hücre lizisi, girdap ve inkübasyonların bir lizis tamponunda buz üzerinde birleştirilmesiyle gerçekleştirildi. Son olarak, SLAMF1 ve M. tuberculosis arasındaki etkileşim, makrofaj proteinlerinin Mtb Ags veya M . tuberculosis'in (WCMtb) tüm hücreleri ile çapraz bağlanmasından sonra akış sitometrisi ve floresan mikroskobu ile değerlendirildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Deneysel ve teknik kontroller. (A) CD14pos monositleri, pozitif manyetik seleksiyon ile PBMC'lerden izole edildi. Elde edilen pozitif (monositler, mavi) ve negatif (kırmızı) hücre fraksiyonları akış sitometrisi ile değerlendirildi (SSC-A vs. FSC-A) başarılı bir seçimi onaylamak için. (B) Pozitif fraksiyonun saflığı, hücre tanecikliğini ve boyutunu analiz eden akış sitometrisi ile doğrulanmıştır (SSC-A vs. FSC-A) olarak adlandırılır. (C) Monosit türevli makrofajlar SSC-A vs. ile seçildi. FSC-A ve daha sonra bir çift tekli stratejisi ile çiftleri dışlamak için kapılı (FSC-A vs. FSC-H ve ardından SSC-A vs. SSC-H) olarak adlandırılır. SLAMF1 yüzey ekspresyonu tek hücrelerde değerlendirildi. Tüm durumlarda (AC), temsili grafikler veya histogramlar gösterilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
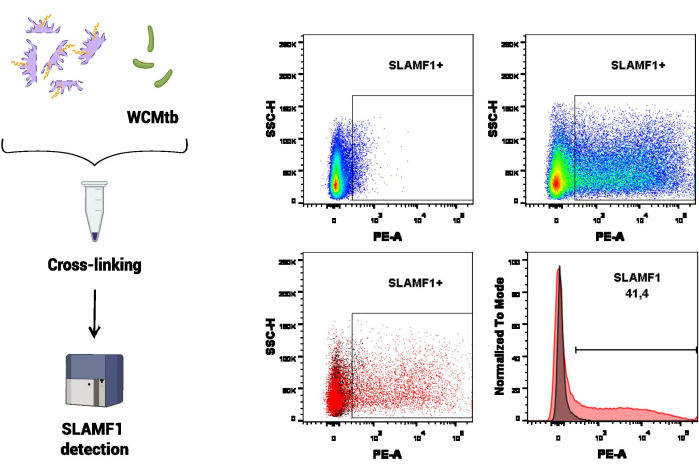
Şekil 3: Akış sitometrisi ile SLAMF1-M. tüberküloz etkileşimi. Makrofaj proteinleri ile M. tuberculosis'in (WCMtb) tüm hücreleri arasındaki çapraz bağlama, protokol bölümünde açıklandığı gibi formaldehit/glisin/etilen glikol bis ile muamele edilerek gerçekleştirildi. Daha sonra, etkileşim, ilgilenilen popülasyonu seçtikten sonra pozitif bir SLAMF1 (PE) sinyali tespit edilerek akış sitometrisi ile değerlendirildi (SSC-A vs. FSC-A) olarak adlandırılır. Üst panel, floresan eksi bir (FMO) kontrolünü (solda) pozitif boyama (sağda) ile karşılaştırarak SLAMF1 için pozitif bir sinyal gösterir. Düşük panel, SLAMF1 sinyali ile FMO kontrolü arasındaki kaplamayı (sol, nokta grafiği ve sağ, histogram) gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: Floresan mikroskobu ile SLAMF1-M. tüberküloz etkileşimi. (A) Mtb Ag'ler, Rhodamine B (Mtb-R Ags) ile boyandı ve yuvarlak bir lamel ile tutturuldu. Mtb-R Ags'nin doğru yapışması ve floresansı, kırmızı kanala karşılık gelen filtreler kullanılarak floresan mikroskobu ile doğrulandı. (B) Makrofaj proteinleri ve Mtb-R Ag'ler arasındaki çapraz bağlama, protokol bölümünde tarif edildiği gibi formaldehit/glisin/etilen glikol bis ile muamele edilerek, ekli Mtb-R Ag'lerin üzerine protein ekstraktı eklenerek gerçekleştirildi. Etkileşim, bir insan anti-SLAMF1 antikoru ve ardından Alexa Fluor 488 etiketli ikincil antikor kullanılarak floresan mikroskobu ile değerlendirildi. Üst mikrograflar SLAMF1 (sol, yeşil) ve Mtb-R Ags (sağ, kırmızı) pozitif sinyalleri gösterir. Düşük mikrograf, etkileşimi sarı renkle kanıtlar (her iki kanalın birleşmesi). Ölçek çubukları 10 μm'ye karşılık gelir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bu çalışma, M. tuberculosis ile Tüberküloz sırasında konak yanıtında yer alan anahtar bir hücre tipi olan insan makrofajlarında eksprese edilen mikrobiyal sensörler arasındaki biyokimyasal etkileşimi incelemek için yararlı bir kılavuz sunmaktadır. Sağlanan protokoller, M. tuberculosis'in fagositlere girişinde rol oynayan moleküllerin deşifre edilmesiyle ilgili olacaktır.
Patojenler ve immünoreseptörler arasındaki gibi biyo-moleküler etkileşimlerin karakterize edilmesi, hem immünoprotektif mekanizmaları hem de M. tuberculosis tarafından ortaya çıkan kaçınma stratejilerini anlamak için çok önemlidir. Çoğu zaman, reseptörün bakteri ligandı ile doğrudan etkileşimini göstermek karmaşık olabilir ve çok yönlülükten yoksun karmaşık teknikler veya sistemler gerektirebilir. Driessen ve ark. M. bovis BCG32'nin mutant eksik suşlarını kullanarak Mycobacteria ve DC-SIGN arasındaki etkileşimde fosfatidilinositol mannosidlerin rolünü inceledi. Bu etkileşimleri incelemeyi başarsalar da, yazarlar mutant suşlar için farklılıklar bulamadılar ve azaltılmış bağlanma gösteren mutant bakterilerin yaratılmasının çok büyük bir görev olacağını tartıştılar32. Diğer yazarlar, TLR2 ile M. tuberculosis 33,34'ün bazı PE / PPE proteinleri arasındaki etkileşimi göstermek için mükemmel ve zahmetli bir çalışma yürüttüler. Bu çalışmalar, reseptör, hücrelerin transfeksiyonu ve yukarıda belirtilen proteinlerin veya belirli protein alanlarınınsaflaştırılması için nakavt farelerin kullanılmasını gerektirmiştir 33,34. Ek olarak, reseptörlerin işlevi sıklıkla çıkarılır, ancak etkileşim güvenilir bir şekilde gösterilmez. Bir örnek, hastalık sonucu ile ilişkili haplotiplerin bulunduğu, ancak M. tuberculosis ile spesifik etkileşimi sıkı bir şekilde çalışılmamış olan çözünür reseptör PTX3'tür35. Bu eksikliklerle ilgili olarak, yöntemimiz, incelenen hedef reseptörün M. tuberculosis ile etkileşimini basit bir şekilde ve erişilebilir kolay yorumlama teknikleriyle değerlendirmeye izin verir.
Önceki noktalarla ilgili olarak ve özellikle SLAMF1 için, E. coli36'dan OmpC ve OmpF ve B. abortus37'den Omp25 ile etkileşimler daha önce değerlendirilmiştir. Degos ve ark.37 , daha sonra SLAMF1'i saflaştırmak ve Western blot ile Omp25 ile etkileşimi analiz etmek için sadece SLAMF1'in hücre dışı alanını kodlayan bir plazmit ile transfekte edilmiş COS-7 hücrelerini kullandı. Ayrıca SLAMF1-/- fareler ve vahşi tip B. abortus veya Omp25 kusurlu bir mutant kullanarak deneyler yaptılar. Berger ve ark. 36 çalışma ayrıca SLAMF1 ve E. coli Omp ve S. typhimurium SseB- arasında doğrudan bir etkileşim olduğuna dair ikna edici kanıtlar gösterdi. SLAMF1-/- fareler, bir SLAMF1mCherry yapısını kodlayan RAW264.7 makrofajları ve ayrıca SLAMF1 ile transfekte edilmiş Jurkat T hücrelerini kullanan bir amplifikasyon testi dahil olmak üzere farklı yaklaşımlar kullandılar. 1 x 108 E. coli kullanarak bir lusiferaz raportörü ile hassas bir sinyal amplifikasyon testi geliştirdiler. Bu bağlamda, bu raporda sunulan biyokimyasal etkileşim tahlillerinin güçlü yönlerinden biri, etkileşimin aslında vahşi tip hücreler ve önceki bir çalışmada10 fonksiyonel değerlendirmeler için kullanılan aynı hücre:bakteri oranı kullanılarak, SLAMF1 ekspresyonunu aşırı ifade etmeye veya iptal etmeye gerek kalmadan bulunmasıdır.
Sağlanan protokol bazı kritik adımlar gerektirir. Bunlardan biri, etkileşim deneylerini gerçekleştirmeden önce insan makrofajlarında SLAMF1 ekspresyonunun doğrulanmasıdır. Bu, aslında reseptör ekspresyonu eksikliğinden kaynaklanacak olan yanlış bir negatif sonuç elde etmekten kaçınmak için çok önemlidir. Burada, SLAMF1 seviyeleri, bu verilerin 2 saatten daha kısa sürede elde edilmesini sağlayan hızlı bir teknik olduğu için akış sitometrisi kullanılarak kontrol edildi. Bununla birlikte, mikroskopi veya Western blot gibi diğer teknikler de kullanılabilir. Nihai hedef protein seviyesinde bir reseptörü incelemek olduğunda, mRNA seviyelerini tanımlayan gerçek zamanlı PCR gibi metodolojileri önermiyoruz. Bir diğer temel adım, çapraz bağlama aşamasıdır. Çapraz bağlayıcıların kullanımı, protein-protein etkileşimlerini stabilize etmeyi amaçlar. Akış sitometrisine dayalı test sırasında, çapraz bağlama adımını uygulamadan SLAMF1 için bir sinyal tespit edemedik. Mikroskopi yaklaşımı söz konusu olduğunda, çapraz bağlama tedavisi kullanılmadan ancak çok düşük hassasiyetle etkileşimi gözlemledik. Bu nedenle, çapraz bağlama adımı her durumda şiddetle tavsiye edilir.
Açıklanan protokol, patojenin yüzeyinde erişilebilen SLAMF1 ve M. tuberculosis antijenleri arasındaki etkileşimin kanıtını sağlar ve SLAMF1'in M. tuberculosis'te bulunan moleküler bir imzayı tanıdığını göstermeye yardımcı olur. Ancak, bu model bazı sınırlamalar göstermektedir. Zayıf nokta, bu protokolün hangi spesifik M. tuberculosis antijeninin SLAMF1 ile etkileşime giren antijen olduğunu belirlememize izin vermemesidir. Buna rağmen, protokol bu amaca ulaşmak için, örneğin bakterilerden saflaştırılmış antijenler kullanılarak değiştirilebilir. Diğer bir sınırlama, makrofajlarda SLAMF1'in ekspresyonunu hangi uyaranın indüklediğini bilme ihtiyacıdır. Bu, seçilen reseptörün bazal koşullarda eksprese edilmemesi veya ekspresyon paterninin bilinmediği durumlarda bir komplikasyon anlamına gelebilir. Son olarak, bu yaklaşımlar SLAMF1'in M. tuberculosis ile etkileşime girmesi için başka moleküller gerektirip gerektirmediğini ayırt etmez. Bu durumda, immünopresipitasyon testleri yapılabilir veya metodolojik şemada daha fazla antikor kullanılabilir.
Bu raporda önerilen metodoloji, diğer immün reseptörlerin, eksprese edildiği diğer hücre tiplerinde aynı reseptörün çalışmasına veya diğer bakteriler veya farklı mikobakteri suşları ile etkileşimi değerlendirmek için kolayca uyarlanabilir. Ayrıca, burada, diğer bakterilere ve hatta canlı suşlara uygulanabilecek bir etiketleme olan sonikasyonlu M. tuberculosis'i floresan olarak boyamak için kısa ve basit bir protokol sağlanmıştır. Bununla birlikte, bu prosedür SLAMF1-M'ye odaklanır. tüberküloz karışması, diğer potansiyel kullanımlar arasında engellenmiş, gecikmiş veya uygunsuz bir etkileşimin sonucunu anlamak, kaçınma mekanizmalarını incelemek veya patojenlerin tanınmasında yer alan potansiyel moleküler hedefleri ortaya çıkarmak yer alır. Benzer şekilde, bu protokol, M. tuberculosis ve makrofajların veya diğer konakçı hücrelerin birlikte evrimini anlamak için yeni terapötik stratejiler ve immünoterapilerin çalışmasına uygulanabilir ve ligand-reseptör dinamiklerini anlamaya çalışan farklı alanlarda da kullanılabilir.
Açıklamalar
Yazarlar herhangi bir çıkar çatışması beyan etmemektedir.
Teşekkürler
Bu çalışma Universidad Nacional del Noroeste de la Provincia de Buenos Aires (hibe numaraları SIB 0618/2019, SIB 2582/2012 V.P.), Agencia Nacional de Promoción Científica y Tecnológica (ANPCyT, hibe numaraları PICT-2012-2459 ve PICT A 2017-1896'dan VP'ye ve PICT-2021-I-INVI-00584'ten A.B.'ye); Florencio Fiorini Vakfı; ve Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET, hibe numarası PIO 15720150100010CO'dan VP'ye). Teknik destek için Natalia Menite ve Gastón Villafañe'ye teşekkür ederiz. Dr. Paula Barrionuevo ve Dr. Luciana Balboa'ya, bu çalışmada sunulan tahlillerin geliştirilmesine yol açan yayın sırasındaki bilimsel tartışma için teşekkür ederiz. Son olarak, çapraz bağlama protokolleri konusundaki tavsiyesi için Dr. Estermann'a teşekkür ederiz, Lic. Moroni, Poly-Lysine ve Lic ile çalışma konusundaki tavsiyeleri için. Moriconi, şematik figürler konusundaki yardımı için.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 488 secondary antibody | Invitrogen | A21121 | For fluorescence microscopy |
| anti-SLAMF1 FITC antibody | eBioscience | 11-1509-42 | For flow cytometry |
| anti-SLAMF1 PE antibody | BioLegend | 306308 | For flow cytometry |
| anti-SLAMF1 primary antibody | BioLegend | 306302 | For fluorescence microscopy |
| Aqua-Poly/Mount | Polysciences | 18606-20 | Mounting media |
| CD14 MicroBeads | Miltenyi Biotec | 130-097-052 | For monocytes isolation |
| Coverslips 12mm | HDA | - | For interaction assay by microscopy |
| EGS | ThermoFisher Scientific | 21565 | For crosslinking treatment |
| FACSCanto II | BD Biosciences | 338960 | Flow cytometer with BD FACSDiva software |
| Fetal Bovine Serum | Natocor | - | Inactivated and irradiated, for macrophages culture |
| Ficoll-Paque PLUS | Cytiva | 17144003 | For PBMCs separation |
| Fiji/ImageJ | Open Source software | - | For micrographs analysis |
| FlowJo 7.6.2 | Tree Star | - | For flow cytometry analysis |
| Formaldehyde | Merck | K47740803613 | For crosslinking treatment |
| Glass slides | Glass Klass | - | For interaction assay by microscopy |
| Glycine | Sigma | G8898 | For crosslinking treatment |
| Imager.A2 | Carl Zeiss | 430005-9901-000 | Fluorescence microscope with Colibri 7 illumination module |
| iMark | BIO-RAD | 1681130 | Microplate absorbance reader |
| L-glutamine | Sigma Aldrich | 49419 | For macrophages culture |
| M. tuberculosis, strain H37Rv, gamma-irradiated whole cells | BEI Resources, NIAID, NIH | NR-14819 | For interaction assay |
| M. tuberculosis, strain H37Rv, whole cell lysate | BEI Resources, NIAID, NIH | NR-14822 | For macrophages stimulation and interaction assay |
| Neofuge 13R | Heal Force | Neofuge 13R | High Speed Refrigerated Centrifuge for protein extraction |
| Penicillin/Streptomycin | Gibco | 15140122 | For macrophages culture |
| PMSF | ThermoFisher Scientific | 36978 | For proteins isolation |
| Poly-D-Lysine | Sigma Aldrich | A-003-M | For coverslips treatment |
| Protease Inhibitor Cocktail | Sigma Aldrich | P8340 | For proteins isolation |
| Rhodamine B | Sigma Aldrich | 21955 | For M. tuberculosis staining |
| RPMI 1640 | Gibco | 11875093 | For macrophages culture |
| Sorvall ST 16/16R centrifuge | ThermoFisher Scientific | 75004240 | For PBMCs and monocytes isolation |
Referanslar
- Global Tuberculosis Report 2023. , World Health Organization. Available at: https://www.who.int/tb/publications/global_report/en/ (2023).
- Ahmad, F., et al. Macrophage: A cell with many faces and functions in tuberculosis. Front Immunol. 13, 882130(2022).
- Bo, H., et al. Mycobacterium tuberculosis-macrophage interaction: Molecular updates. Front Cell Infect Microbiol. 13, 1187205(2023).
- Papp, A. C., et al. AmpliSeq transcriptome analysis of human alveolar and monocyte-derived macrophages over time in response to Mycobacterium tuberculosis infection. PLoS One. 13 (5), e0198069(2018).
- Zhai, W., Wu, F., Zhang, Y., Fu, Y., Liu, Z. The immune escape mechanisms of Mycobacterium tuberculosis. Int J Mol Sci. 20 (2), 340(2019).
- Van Crevel, R., Ottenhoff, T. H. M., Van der Meer, J. W. M. Innate immunity to Mycobacterium tuberculosis. Clin Microbiol Rev. 15 (2), 294-309 (2002).
- Mortaz, E., et al. Interaction of pattern recognition receptors with Mycobacterium tuberculosis. J Clin Immunol. 35 (1), 1-10 (2015).
- Stamm, C. E., Collins, A. C., Shiloh, M. U. Sensing of Mycobacterium tuberculosis and consequences to both host and bacillus. Immunol Rev. 264 (1), 204-219 (2015).
- Zihad, S. M. N. K., et al. Role of pattern recognition receptors in sensing Mycobacterium tuberculosis. Heliyon. 9 (10), e20636(2023).
- Barbero, A. M., et al. SLAMF1 signaling induces Mycobacterium tuberculosis uptake leading to endolysosomal maturation in human macrophages. J Leukoc Biol. 109 (8), 257-273 (2021).
- Pasquinelli, V., et al. Expression of signaling lymphocytic activation molecule-associated protein interrupts IFN-γ production in human tuberculosis. J Immunol. 172 (2), 1177-1185 (2004).
- Pasquinelli, V., et al. Phosphorylation of mitogen-activated protein kinases contributes to interferon-γ production in response to Mycobacterium tuberculosis. J Infect Dis. 207 (2), 340-350 (2012).
- Pasquinelli, V., et al. IFN-γ production during active tuberculosis is regulated by mechanisms that involve IL-17, SLAM, and CREB. J Infect Dis. 199 (5), 661-665 (2009).
- Pellegrini, J. M., et al. Neutrophil autophagy during human active tuberculosis is modulated by SLAMF1. Autophagy. 17 (2), 423-426 (2021).
- Song, T., Dong, C., Xiong, S. Signaling lymphocyte-activation molecule SLAMF1 augments mycobacteria BCG-induced inflammatory response and facilitates bacterial clearance. Int J Med Microbiol. 305 (6), 572-580 (2015).
- Eble, J. A. Titration ELISA as a method to determine the dissociation constant of receptor-ligand interaction. J Vis Exp. (132), e57032(2018).
- Patching, S. G. Surface plasmon resonance spectroscopy for characterization of membrane protein-ligand interactions and its potential for drug discovery. Biochim Biophys Acta Biomembr. 1838 (1), 43-55 (2014).
- Draczkowski, P., Matosiuk, D., Jozwiak, K. Isothermal titration calorimetry in membrane protein research. J Pharm Biomed Anal. 87, 296-304 (2014).
- Smith, D. S., Eremin, S. A. Fluorescence polarization immunoassays and related methods for simple, high-throughput screening of small molecules. Anal Bioanal Chem. 391 (5), 1499-1507 (2008).
- García-Nafría, J., Tate, C. G. Cryo-electron microscopy: Moving beyond X-ray crystal structures for drug receptors and drug development. Annu Rev Pharmacol Toxicol. 60, 51-71 (2020).
- Asami, J., Shimizu, T. Structural and functional understanding of the toll-like receptors. Protein Sci. 30 (4), 761-772 (2021).
- Phạm, T. T. T., Rainey, J. K. On-cell nuclear magnetic resonance spectroscopy to probe cell surface interactions. Biochem Cell Biol. 99 (6), 683-692 (2021).
- El Deeb, S., et al. Microscale thermophoresis as a powerful growing analytical technique for the investigation of biomolecular interaction and the determination of binding parameters. Methods Appl Fluoresc. 10 (4), 045001(2022).
- El Khamlichi, C., et al. Bioluminescence resonance energy transfer as a method to study protein-protein interactions: Application to G protein-coupled receptor biology. Molecules. 24 (3), 505(2019).
- Schneider, P., Willen, L., Smulski, C. R. Tools and techniques to study ligand-receptor interactions and receptor activation by TNF superfamily members. Methods Enzymol. 545, 103-125 (2014).
- Park, A. M. W., Schirmer, P. S. H. Atomic force microscopy: A multifaceted tool to study membrane proteins and their interactions with ligands. Biochim Biophys Acta Biomembr. 1838 (1), 74-89 (2014).
- Zalejski, J., Sun, J., Sharma, A. Unravelling the mystery inside cells by using single-molecule fluorescence imaging. J Imaging. 9 (9), 183(2023).
- Zheng, S., Zou, M., Shao, Y., Wu, H., Wang, X. Two-dimensional measurements of receptor-ligand interactions. Front Mol Biosci. 10, 1075587(2023).
- Zlotnikov, I. D., Kudryashova, E. V. Computer simulation of the receptor-ligand interactions of mannose receptor CD206 in comparison with the lectin concanavalin A model. Biochemistry (Moscow). 87 (1), 54-69 (2022).
- Fu, Y., Zhao, J., Chen, Z. Insights into the molecular mechanisms of protein-ligand interactions by molecular docking and molecular dynamics simulation: A case of oligopeptide binding protein. Comput Math Methods Med. 2018, 7604567(2018).
- Farina, B., et al. A novel approach for studying receptor-ligand interactions on living cells' surface by using NUS/T1ρ-NMR methodologies combined with computational techniques: The RGDechi15D-αvβ5 integrin complex. Comput Struct Biotechnol J. 19, 3303-3318 (2021).
- Driessen, N. N., et al. Role of phosphatidylinositol mannosides in the interaction between mycobacteria and DC-SIGN. Infect Immun. 77 (10), 4538-4547 (2009).
- Bansal, K., et al. Src homology 3-interacting domain of Rv1917c of Mycobacterium tuberculosis induces selective maturation of human dendritic cells by regulating PI3K-MAPK-NF-κB signaling and drives Th2 immune responses. J Biol Chem. 285 (47), 36511-36522 (2010).
- Xu, Y., et al. PPE57 induces activation of macrophages and drives Th1-type immune responses through TLR2. J Mol Med. 93 (6), 645-662 (2015).
- Olesen, R., et al. DC-SIGN (CD209), pentraxin 3 and vitamin D receptor gene variants associate with pulmonary tuberculosis risk in West Africans. Genes Immun. 8, 456-467 (2007).
- Berger, S. B., et al. SLAM is a microbial sensor that regulates bacterial phagosome functions in macrophages. Nat Immunol. 11 (10), 920-927 (2010).
- Degos, C., et al. Omp25-dependent engagement of SLAMF1 by Brucella abortus in dendritic cells limits acute inflammation and favours bacterial persistence in vivo. Cell Microbiol. 22 (4), e13156(2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır