Method Article
Флуоресцентные анализы для изучения взаимодействия микобактерий туберкулеза с иммунным рецептором SLAMF1
В этой статье
Резюме
В этом исследовании представлен протокол оценки взаимодействия Mycobacterium tuberculosis с микробным сенсором SLAMF1. Анализы проводились на макрофагах, полученных из моноцитов человека, с использованием проточной цитометрии и флуоресцентной микроскопии. Описанные инструменты актуальны для изучения взаимодействий между патогенами и иммунорецепторами.
Аннотация
Оценка прямого взаимодействия между патогенами и иммунными рецепторами обычно включает в себя сложные методы или подразумевает использование трансгенных штаммов и генетически модифицированных клеток. В данной работе описан альтернативный метод выявления биохимического взаимодействия между макрофагальным микробным сенсором SLAMF1 и Mycobacterium tuberculosis . Были разработаны два технических подхода с использованием проточной цитометрии и флуоресцентной микроскопии. Генерировали экстракты общих клеточных белков из макрофагов человека, затем инкубировали с целыми клетками антигенов M. tuberculosis (WCMtb) или M. tuberculosis (Mtb Ags) в течение ночи при 4 °C и, наконец, сшивали с помощью обработки формальдегидом/глицином/этиленгликолем bis (сукцинимидилсукцинатом).Взаимодействие SLAMF1 с WCMtb с помощью проточной цитометрии было обнаружено с помощью PE-специфического антитела против SLAMF1. Существование взаимодействия с помощью флуоресцентной микроскопии осуществляли путем присоединения окрашенных Rhodamine-PE Mtb Ags к предметным стеклам, покрытым поли-D-лизином, которые инкубировали с экстрактом общего белка из макрофагов, полученных из моноцитов. После лечения кросслинкингом SLAMF1 визуализировали с использованием первичных (анти-SLAMF1) и вторичных (Alexa Fluor 488) антител. Эти анализы обеспечили мощный биохимический инструмент для измерения взаимодействий патогенов и иммунорецепторов, преодолев трудности, связанные с трансгенными клеточными линиями и экспериментами по модуляции экспрессии белковых генов.
Введение
Mycobacterium tuberculosis, возбудитель туберкулеза, выявленный 142 года назад, остается глобальной проблемой, в настоящее время инфицируя, по меньшей мере, четвертьнаселения мира1. Передаясь воздушно-капельным путем от инфицированных людей, M. tuberculosis достигает альвеолярных макрофагов в легких, где может выживать в течение длительных периодов времени в латентном состоянии 2,3. Мало того, что активируется местный макрофагический ответ, но в последние годы было описано, что периферические моноциты могут рекрутироваться в дыхательные пути и дифференцироваться в альвеолярные макрофаги, вызывая еще более устойчивый ответ против M. tuberculosis, чем их аналог фетальногопроисхождения.
Макрофаги являются основными игроками врожденного иммунитета. При приеме внутрь M. tuberculosis макрофаги проявляют многочисленные микробицидные функции, такие как секреция провоспалительных цитокинов, слияние фаголизосомы и активация других иммунных клеток для уничтожения M. tuberculosis 2,3. Тем не менее, сложная архитектурная структура этого патогена обеспечивает эффекторы (например, белки и липиды), способные регулировать метаболизм и функции макрофагов и, как следствие, воспалительныйпроцесс. Это манипулирование реакциями макрофагов посредством секреции факторов вирулентности или эксплуатации факторов хозяина приводит к различным стратегиям убегания, применяемым M. tuberculosis. Некоторые ключевые механизмы уклонения включают индукцию противовоспалительных цитокинов, ингибирование созревания и закисления фаголизосом, изменения окислительного стресса, нарушение аутофагии и дефицит во время процессинга и презентации антигена 3,5.
Жестко регулируемое взаимодействие между макрофагами и M. tuberculosis имеет решающее значение для развития правильного иммунного ответа. Таким образом, изучение этих синапсов является ключом к выявлению иммунопротекторных или иммунопатогенных механизмов, индуцированных перекрестными помехами между хозяином и патогеном, а также к выявлению потенциальных терапевтических мишеней. Многие рецепторы опосредуют распознавание и/или интернализацию M. tuberculosis, в том числе TLR 6,7,8, NLR 7,8, рецепторы комплемента 6,8, лектиновые рецепторыС-типа 6,8 и рецепторы мусорщика 6,8. Накапливающиеся данные указывают на то, что как поверхностные, так и внутриклеточные PRR играют важную роль во время инфекции, распознавая опсонизированные и неопсонизированные M. tuberculosis.
Zihad and Sifat et al. недавно рассмотрели участие PRR в индуцированных M. tuberculosis ответах врожденных клеток9. В частности, большинство представителей семейства TLR были вовлечены во взаимодействие с лигандами M. tuberculosis 6,7. Surface TLR2 распознает антигены микобактерий, такие как ацилированные липопротеины, липопротеин 19 кДа, липопротеин LprA, липопротеин LprG, антиген 30 кДа, антиген 38 кДа, MymA, пролин-пролин-глутаминовая кислота (PPE)-57, LAM, LM, PIM, белок теплового шока 60, сигнатурный белок Rv1509 и секретируемый белок ESAT-67. Мембрана TLR4 взаимодействует с белками теплового шока, антигеном 38 кДа, RpfE, Rv0652, Rv0335c, Rv2659c, Rv1738, Rv2627c, Rv2628, GrpE и HBHA. С другой стороны, лиганды для эндосомальных TLR (TLR 3, 7, 8 и 9) включают дцРНК, тРНК, ссРНК, фагосомальную РНК и дцДНК M. tuberculosis. Кроме того, TLR2 играет активную роль в инициировании иммунных реакций при совместном действии с TLR1 и TLR6, TLR4 и TLR9 6,7. NOD2 и NLRP3 являются наиболее хорошо охарактеризованными цитоплазматическими NLR при туберкулезе. Хотя их специфические лиганды остаются изученными, эти рецепторы активируются мурамилдипептидом или ESAT-6, соответственно 7,8. Лектиновые рецепторы С-типа классически участвуют в эндоцитозе M. tuberculosis. В то время как Dectin-2 действует как прямой PRR для ManLAM клеточной стенки M. tuberculosis, лиганд Dectin-1 еще не обнаружен8. Mincle и MCL распознают гликолипидный трегалоз-6,6'-димиколат (TDM), также называемый фактором кордового мозга7. DCAR взаимодействует с микобактериальными гликолипидами фосфатидил-мио-инозитолманнозидами (PIMs)7. CR3 распознает микобактериальные LAM и PIM, DC-SIGN лигирует ManLAM, MR распознает ряд компонентов M. tuberculosis, включая ManLAM, PIM, LM, гликопротеин 38 кДа, антиген 19 кДа и другие маннозилированные белки, в то время как лиганд DCIR до сих пор не идентифицирован.
Растворимые CLR включают SP-A, который распознает ManLam, LM, гликопротеин 60 кДа и гликопротеин Apa; SP-D, взаимодействующий с LAM, LM и PILAM; и MBL, которая специализируется на распознавании ManLAM 6,7. SR-A и MARCO имеют TDM в качестве лиганда, SR-B1 распознает ESAT-6, а CD36 связывается с ManLAM и LM 7,8. Кроме того, Dectin-1, Mincle и MARCO также могут сочетаться с TLR2 или TLR4 для запуска сигналов после обнаружения M. tuberculosis PAMPs 6,7. CD14 является поверхностным рецептором, который обладает способностью интернализировать неопсонизированные бактерии, а также распознает белок теплового шока Шаперонин 60.1. В частности, CD14 функционирует как корецептор наряду с MARCO и TLR26. AIM2 является цитозольным рецептором, который может воспринимать одноцепочечную ДНК при выходе M. tuberculosis из фагосомы8. Наконец, AhR является лиганд-активируемым транскрипционным фактором, который связывается с пигментированным фактором вирулентности нафтохинон-фтиоколом M. tuberculosis6.
Многие из описанных выше взаимодействий были постулированы, а не строго продемонстрированы. Даже лиганды для некоторых рецепторов остаются неизвестными, что усиливает необходимость лучшего понимания области иммунораспознавания M. tuberculosis. В этом контексте костимулирующая молекула SLAMF1 (Signaling Lymphocytic Activation Molecule) была недавно описана как рецептор M. tuberculosis в Barbero et al.10. Действуя не только как сигнальная молекула, но и как сенсор M. tuberculosis, SLAMF1 играет особенно интригующую роль при туберкулезе. SLAMF1 может индуцировать активацию иммунных клеток путем модуляции защитных функций, таких как производство ИФН-γ Т-клетками посредством фосфорилирования Erk/CREB 11,12,13, аутофагия в нейтрофилах 14 и бактериальный клиренс в макрофагах15.
Взаимодействие рецепторов и лигандов изучалось на протяжении многих лет с использованием таких методов, как ИФА, поверхностный плазмонный резонанс (SPR), изотермическая титрованная калориметрия (ITC), флуоресцентная поляризация (FP), рентгеновская кристаллография, спектроскопия ядерного магнитного резонанса (ЯМР), микромасштабный термофорез (MST), резонансный перенос энергии (например, BRET или FRET), конфокальная микроскопия, электронная микроскопия, криоэлектронная микроскопия (крио-EM) и атомно-силовая микроскопия (AFM)16,17, 18,19,20,21,22,23,24,25,26,27,28. Некоторые из этих подходов подразумевают использование репортерных генов, меченых рекомбинантных белков или химерных молекул, моделей нокаута, нокдауна или сверхэкспрессии. В качестве альтернативы, вычислительные инструменты могут предсказывать рецептор-лигандные взаимодействия и сайты связывания и часто используются в сочетании с биологическими подходами для получения всестороннего понимания взаимодействий 29,30,31. В этой статье описываются две альтернативы для обнаружения биохимического взаимодействия, а также раздел о том, как флуоресцентно мечить бактерии. Представлен протокол, который позволяет изучать рецептор-патогенные взаимодействия in vitro, в частности, оценивать взаимодействие SLAMF1-M. tuberculosis с помощью проточной цитометрии и флуоресцентной микроскопии, двух обычно доступных и регулярно используемых методов.
протокол
Все процедуры с участием макрофагов, полученных из моноцитов человека, были выполнены в соответствии с Хельсинкской декларацией (2013) и по согласованию с Комитетом по этике UNNOBA (COENOBA). Письменное информированное согласие было получено до сбора пробы. Распределение мужчин и женщин в группах было 13/6, а средний возраст составил 32 года, с межквартильным диапазоном (МКР) 18-75 лет. Наличие предшествующих патологий, сопутствующих заболеваний или положительный диагноз на туберкулез были определены как критерии исключения. Подробная информация о реагентах и оборудовании приведена в Таблице материалов.
1. Культивирование и стимуляция макрофагов, полученных из моноцитов
- Забор крови
- Получить 60 мл крови от здоровых доноров методом венепункции в гепаринизированном шприце.
ПРИМЕЧАНИЕ: Забор крови должен быть выполнен биохимиком или техником по флеботомии. - Выбросьте иглу в контейнер для утилизации острых предметов и любой материал, который контактировал с кровью донора, в контейнер для патологических отходов.
- Получить 60 мл крови от здоровых доноров методом венепункции в гепаринизированном шприце.
- Выделение моноцитов и генерация макрофагов
- Осторожно перелейте кровь в пробирки объемом 50 мл и разбавьте ее наполовину физиологическим раствором.
- Выполнение центрифугирования на среде с градиентом плотности для получения мононуклеарных клеток периферической крови (ПМЦ).
- Соберите PBMC с белесого ореола.
- Выполните два промывки солевым раствором при 400 х г в течение 10 минут и последнее промывание при 200 х г в течение 15 минут при 20 °C для устранения тромбоцитов.
- Определите количество PBMC в камере для подсчета клеток и выполните положительный магнитный отбор CD14 с помощью гранул CD14.
ПРИМЕЧАНИЕ: При выборе магнитного поля внимательно следуйте инструкциям производителя. Кроме того, проверить чистоту выделенных моноцитов можно с помощью проточной цитометрии. - Ресуспендировать выделенные клетки в RPMI 1640 и определить количество моноцитов в камере для подсчета клеток.
- Затравка 500 мкл 1 × 106/мл CD14 положительных отобранных моноцитов на лунку в 24-луночном планшете для культивирования клеток в отсутствие сыворотки для повышения адгезивности.
- Через 2 ч удалите неадгезивные клетки, промыв их предварительно подогретым РПМИ 1640.
- Для дифференцировки макрофагов культивируют адгезивные моноциты в течение дополнительных 16-18 ч (в течение ночи) в 1 мл полной среды (среда RPMI 1640 с добавлением L-глутамина, 10% фетальной бычьей сыворотки (FBS), 100 ЕД/мл пенициллина и 100 мкг/мл стрептомицина).
- На следующий день смените питательную среду. Удалите среду, промойте 1 мл 1x PBS и добавьте 1 мл готового носителя.
- Стимулируйте макрофаги ультразвуком M. tuberculosis (M. tuberculosis antigens (Ags)) в течение 24 ч. Используйте 10 мкл M. tuberculosis Ags (10 мкл = 1 ×10 6 бактерий) на 1 ×10 6 моноцитарных макрофагов.
ПРИМЕЧАНИЕ: 10 μL M. tuberculosis Ags (Mtb Ags) = 1 × 106 бактерий, количественно определяемых по O.D. 600нм в спектрофотометре с учетом O.D. 1 как 1 x 108 бактерий/мл. Используйте шкафы биобезопасности BSL2 и инкубатор при температуре 37 °C в атмосфере с 5%CO2 для всех этапов культивирования.
- Подтверждение экспрессии SLAMF1
- Соберите макрофаги из одной лунки. Поставьте тарелку с культурой на холодную поверхность. Отделите ячейки движениями вверх и вниз, добавив 1 мл холодного FACS (1x PBS + 2% FBS) два раза подряд. Для сбора используйте цитометрическую трубку с круглым дном.
- Центрифугируйте клетки при давлении 500 x g в течение 5 минут при 4 °C. Выбросьте надосадочную жидкость, сбросив ее.
- Окрашивать клетки флуорофорным антителом SLAMF1 к человеку в течение 30 минут при 4 °C в темноте. Вихрь после добавления 1,25 мкл антитела.
- Промойте клетки для устранения избытка антител с помощью FACS, повторно суспендируйте гранулу в FACS и получите образец с помощью проточного цитометра.
ПРИМЕЧАНИЕ: 1,25 мкл антитела против SLAMF1 соответствует 0,0625 мкг, которое используется для мечения 0,5 x 106 макрофагов. Тем не менее, настоятельно рекомендуется титрование антитела, а также выполнение соответствующего изотипа или контроля флуоресценции минус один (FMO).
2. Приготовление экстракта общего клеточного белка
- Подготовка буфера для лизиса
- Приготовьте буфер для радиоиммуноципитации (RIPA) с NaCl 150 мМ, Трис 10 мМ, ЭДТА 5 мМ, SDS 1%, Тритон X-100 1% и дезоксихолат натрия 1%.
- Дополните буфер RIPA 1 мМ фенилметилсульфонилфторидом (PMSF) и ингибиторами протеазы, такими как пепстатин А и лейпептин.
- Сбор клеток и выделение белков
- Отбросьте полный RPMI из лунок планшета с помощью пипетки P1000 и соберите макрофаги путем пипетирования вверх и вниз холодным 1x PBS.
- Переложите ячейки в микроцентрифужные пробирки объемом 1,5 мл. Соберите по одной лунке на микротрубку.
- Центрифугируйте при 500 x g в течение 5 мин при 4 °C. Выбросьте надосадочную жидкость.
- Добавьте 1 мл холодного PBS и повторите шаги 2.2.2 и 2.2.3, собирая клетки в ту же микроцентрифужную пробирку.
- Ресуспендируйте клеточные гранулы в 100 мкл 1x PBS и объедините четыре пробирки. Повторите шаг 2.2.3. Каждая пробирка будет содержать 2 x 106 макрофагов.
- Добавьте 100 мкл дополненного буфера RIPA и инкубируйте суспензию на льду в течение 1 ч, вортексируя каждые 10 мин.
- Центрифугируйте при давлении 14 000 x g в течение 15 мин. Соберите надосадочную жидкость и сохраните до использования при температуре -20 °C.
3. Взаимодействие M. tuberculosis -SLAMF1 методом проточной цитометрии
- Белково-бактериальная сшивка
- Инкубировать 1 × 106 целых инактивированных клеток M. tuberculosis (WCMtb, M. tuberculosis , инактивированных гамма-облучением) с экстрактом белка из 1 x 106 макрофагов (50 мкл) в течение ночи при 4 °C во вращающемся держателе микротрубок.
ПРИМЕЧАНИЕ: 10 мкл WCMtb = 1 × 106 бактерий, количественно определяемых по O.D. 600нм на спектрофотометре с учетом O.D. 1 как 1 x 108 бактерий/мл. - На следующий день добавьте 500 мкл 1% формальдегида, разведенного в 1x PBS. Инкубировать в течение 15 минут при перемешивании (шейкере) при комнатной температуре (RT).
- Добавьте 25 мкл 0,125 М глицина, разведенного в воде. Инкубировать в течение 5 минут при перемешивании (шейкере) при RT.
- Дважды вымойте 1 мл 1x PBS при 14 000 x g в течение 5 минут. Выбросьте надосадочную жидкость между этапами стирки.
- Повторно суспендируйте гранулу и инкубируйте суспензию в 500 мкл 2 мМ сшивающего агента этиленгликоля биса (сукцинимидилсукцината) (EGS), разведенного в смеси ледяной уксусной кислоты:вода в соотношении 1:1 в течение 1 ч при RT.
ПРИМЕЧАНИЕ: Настоятельно рекомендуется готовить реагенты во время использования. Для приготовления EGS необходимо смешать ледяную уксусную кислоту и воду в равных пропорциях и нагреть до 70 °C. Если раствор не горячий, EGS не полностью ресуспендируется.
- Инкубировать 1 × 106 целых инактивированных клеток M. tuberculosis (WCMtb, M. tuberculosis , инактивированных гамма-облучением) с экстрактом белка из 1 x 106 макрофагов (50 мкл) в течение ночи при 4 °C во вращающемся держателе микротрубок.
- Окрашивание SLAMF1
- Повторите шаг 3.1.4, используя 500 мкл 1x PBS в первой стирке и 1 мл во второй.
- Окрашивайте белково-бактериальный комплекс в течение 30 мин при 4 °C в темноте антителом против человека SLAMF1 (как на шаге 1.3.3) путем добавления антитела в микротрубку и вортексинга. Используйте количество антитела, подходящее для 1 x 106 клеток (2,5 мкл или 0,125 мкг).
- Промойте клетки для устранения избытка антител с помощью FACS, повторно суспендируйте гранулу в FACS и получите образец в проточном цитометре (как в шаге 1.3.4).
ПРИМЕЧАНИЕ: Выполните управление соответствующим изотипом или FMO.
4. Мечение антигенов M. tuberculosis
- Ресуспендируйте родамин В в этаноле в исходной концентрации 5 мг/мл (1000x). Хранить при температуре -20 °C до использования.
- Добавьте 1 мкл родамина B на 100 мкл M. tuberculosis Ags в микроцентрифужную пробирку объемом 1,5 мл.
- Инкубировать в течение 45 мин при РТ при непрерывном перемешивании (вихре).
- Простирайте не менее 3 раз при 14 000 x g в течение 5 минут при 24 °C с использованием 1 мл 1x PBS до тех пор, пока надосадочная жидкость не станет прозрачной. Пеллета (Mtb-R Ags) будет выглядеть светло-розовой.
- Суспендируйте Mtb-R Ags в 100 мкл 1x PBS для восстановления исходного объема.
ПРИМЕЧАНИЕ: Рекомендуется работать в стерильных условиях. Убедитесь, что окрашивание выполняется непосредственно перед проведением экспериментов.
5. Взаимодействие M. tuberculosis и SLAMF1 методом флуоресцентной микроскопии
- Сшивание бактерий и белков
- Введите круглые покровные стекла диаметром 12 мм в 24-луночные культуральные планшеты (1 покровное стекло на лунку) с помощью хирургического пинцета с круглым носиком.
ПРИМЕЧАНИЕ: Тщательно очистите покровные стекла 70% этанолом. При желании они могут быть автоклавированы или стерилизованы под ультрафиолетовым излучением в течение 30 минут. - Инкубируйте покровное стекло с 400 мкл 10 мкг/мл поли-D-лизина в течение ночи при 4 °C. Накройте тарелку алюминиевой фольгой, чтобы защитить ее от света.
- На следующий день достаньте тарелку из холодильника и дважды промойте покровную крышку 1 мл воды.
- Дайте покровному листу высохнуть.
- Разведите 20 мкл (2 x 106) Mtb-R Ags в 180 мкл 1x PBS. Последних 200 мкл достаточно, чтобы полностью покрыть покровное стекло.
- Инкубируйте покровное стекло с Mtb-R Ags в течение 1 ч при 37 °C в клеточном инкубаторе.
- Слейте остатки жидкости и дважды промойте 1 мл 1x PBS.
ПРИМЕЧАНИЕ: На этом этапе правильная адгезия Mtb-R к покровному стеклу может быть проверена с помощью флуоресцентного микроскопа с использованием фильтров, соответствующих красному каналу. - Добавьте 400 мкл блокирующего буфера (10% FBS в 1x PBS) в течение 30 минут при RT в перемешивании (шейкере).
- Дважды промойте с 400 μл блокирующего буфера.
- Инкубировать со 100 мкл белкового экстракта, разведенного в 300 мкл 1x PBS, в течение 2 ч при RT в перемешивании (шейкере).
- Добавьте 400 мкл 1% формальдегида, разведенного в 1x PBS. Инкубировать в течение 15 минут при перемешивании (шейкере) при RT.
- Добавьте 500 мкл глицина 0,125 М, разведенного в воде. Инкубировать в течение 5 минут при перемешивании (шейкере) при RT.
- Умойтесь дважды 1 мл 1x PBS.
- Добавьте 400 мкл 2 мМ EGS в течение 1 ч при RT при перемешивании (шейкере).
- Повторите шаг 5.1.13
ПРИМЕЧАНИЕ: Настоятельно рекомендуется готовить реагенты во время использования.
- Введите круглые покровные стекла диаметром 12 мм в 24-луночные культуральные планшеты (1 покровное стекло на лунку) с помощью хирургического пинцета с круглым носиком.
- Окрашивание SLAMF1
- Заверните крышку тарелки для культуры в парафиновую пленку.
- Добавьте каплю 60 мкл предварительно титруемого первичного антитела против SLAMF1 (разведение 1:75) на крышку, покрытую парафиновой пленкой.
- Осторожно снимите покровное стекло с пластины с помощью изогнутого хирургического пинцета с тонким концом и игл.
ПРИМЕЧАНИЕ: Чтобы облегчить снятие покровных стекол, иглу можно согнуть примерно под углом 45°. - Переверните покровную крышку над каплей, содержащей антитело. Инкубировать в течение 30 минут при RT в темноте.
- Поднимите покровное стекло и дважды промойте с помощью блокирующего буфера.
- Переверните покровное стекло над новой каплей, содержащей вторичное антитело (разведение 1:200). Инкубировать в течение 30 минут при RT в темноте.
- Повторите шаг 5.2.5.
- Удалите лишнюю жидкость и закрепите покровное стекло на каплю монтажной жидкости, помещенную на предметное стекло.
- Наблюдайте под флуоресцентным микроскопом с использованием соответствующих фильтров.
ПРИМЕЧАНИЕ: Рекомендуется работать в стерильных условиях. Разведите антитела в блокирующем буфере. Обращайтесь с покровным стеклом осторожно, чтобы не поцарапать его, которые могут затруднить наблюдение под микроскопом. Настоятельно рекомендуется использовать монтажную жидкость, подходящую для флуоресценции.
Результаты
В данной работе представлен протокол, позволяющий оценить взаимодействие M. tuberculosis с иммунным рецептором SLAMF1 в макрофагах человека (рис. 1). С этой целью была получена периферическая кровь от здоровых доноров. Затем PBMC разделяли центрифугированием на среде с градиентом плотности, а моноциты выделяли методом магнитного положительного отбора (чистота ≥95%, рис. 2A, B). Выделенные моноциты приклеивали к пластиковым культуральным планшетам в течение 2 ч для получения макрофагов, полученных из моноцитов, а затем культивировали ON. После этого макрофаги стимулировали ультразвуковой M . tuberculosis (Mtb Ags) для индуцирования поверхностной экспрессии SLAMF1, как сообщалось ранее10, а поверхностные уровни SLAMF1 подтверждали с помощью проточной цитометрии (рис. 2C)). Макрофаги были окончательно лизированы с использованием буфера для лизиса RIPA в сочетании с вортексингом и инкубацией на льду для облегчения лизиса клеток. Полученный экстракт общего белка был использован в анализах взаимодействия.
В первом наборе экспериментальных процедур для изучения взаимодействия SLAMF1 с целыми клетками M. tuberculosis (WCMtb) использовалась проточная цитометрия (рис. 3). Во-первых, физическое взаимодействие между SLAMF1 (содержащимся в белковом экстракте) и WCMtb стимулировалось путем их совместной инкубации ON в непрерывном вращении при 4 °C. Затем проводили лечение перекрестным сшиванием, и с помощью специфического антитела против SLAMF1 обнаруживали рецептор SLAMF1, который был связан с WCMtb. В этом анализе только WCMtb был использован для установки напряжений, соответствующих размеру и зернистости M. tuberculosis в проточном цитометре, который представлял интерес для обнаружения связывания SLAMF1.
Во втором экспериментальном подходе флуоресцентная микроскопия использовалась для обнаружения взаимодействия SLAMF1-M. tuberculosis (рис. 4). Этот анализ, в котором использовался ультразвуковой анализ M. tuberculosis (Mtb Ags), дополняет предыдущий. Для облегчения детектирования флуоресценции в канале/фильтре, соответствующем флуорохрому ПЭ, использовали окрашенные Mtb Ags с родамином B (Mtb-R Ags). Mtb-R Ag прикрепляли к покровным стеклам, покрытым поли-D-лизином, и успешное окрашивание проверяли с помощью микроскопа (рис. 4A). После этого предметные стекла, покрытые Mtb-R Ags, инкубировали с белковыми экстрактами, содержащими SLAMF1. После сшивки SLAMF1 был обнаружен с помощью первичного специфического антитела против SLAMF1, за которым следовало вторичное антитело, связанное с совместимым флуорохромом, для совместного наблюдения с ТЭЛА. После получения отдельных изображений флуоресцентной микроскопии в двух каналах для Mtb-R Ags и SLAMF1 взаимодействие было подтверждено слиянием изображений (рис. 4B).
Выполнение этих подходов продемонстрировало существование взаимодействия между SLAMF1 и M. tuberculosis. Было обнаружено перекрестное взаимодействие SLAMF1 как с цельными, так и с облученными бактериями, что подкрепило гипотезу, указывающую на SLAMF1 как на новый врожденный рецептор макрофагов человека для M. tuberculosis10.

Рисунок 1: Рабочий процесс по выявлению взаимодействия SLAMF1-M. tuberculosis . Периферическую кровь получали от здоровых доноров методом венепункции и центрифугировали в среде с градиентом плотности для выделения мононуклеарных клеток периферической крови (ПМЦ). После определения количества клеток PBMC подвергали положительному магнитному отбору для очистки моноцитов CD14pos . Затем моноциты приклеивали к культуральным планшетам в течение 2 ч в отсутствие фетальной бычьей сыворотки, а затем культивировали в течение ночи в дополненном RPMI (стадия покоя) для получения макрофагов, полученных из моноцитов. После этого макрофаги стимулировали ультразвуковым M . tuberculosis (Mtb Ags) в течение 24 ч для индуцирования поверхностной экспрессии SLAMF1. Уровни SLAMF1 были проверены с помощью проточной цитометрии с использованием специфического антитела человека против SLAMF1 в части популяции макрофагов. Остальные макрофаги были использованы для получения экстрактов общего белка. Лизис клеток проводили путем совмещения вортексинга и инкубации на льду в буфере для лизиса. Наконец, взаимодействие между SLAMF1 и M. tuberculosis оценивали с помощью проточной цитометрии и флуоресцентной микроскопии после сшивания белков макрофагов с Mtb Ags или целыми клетками M. tuberculosis (WCMtb). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Экспериментальный и технический контроль. (A) Моноциты CD14pos были выделены из PBMC методом положительного магнитного отбора. Полученные положительные (моноциты, синие) и отрицательные (красные) клеточные фракции оценивали методом проточной цитометрии (SSC-A в сравнении с SSC-A. FSC-A) для подтверждения успешного выбора. (B) Чистота положительной фракции была подтверждена проточной цитометрией, анализирующей зернистость и размер клеток (SSC-A в сравнении с SSC-A в сравнении с SSC-A FSC-A). (C) Макрофаги, полученные из моноцитов, были отобраны с помощью SSC-A в сопоставлении. FSC-A, а затем стробируется для исключения дублетов с помощью стратегии двойного синглета (FSC-A против FSC-H, за которым следует SSC-A vs. SSC-H). Поверхностную экспрессию SLAMF1 оценивали в одиночных клетках. Во всех случаях (A-C) отображаются репрезентативные графики или гистограммы. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
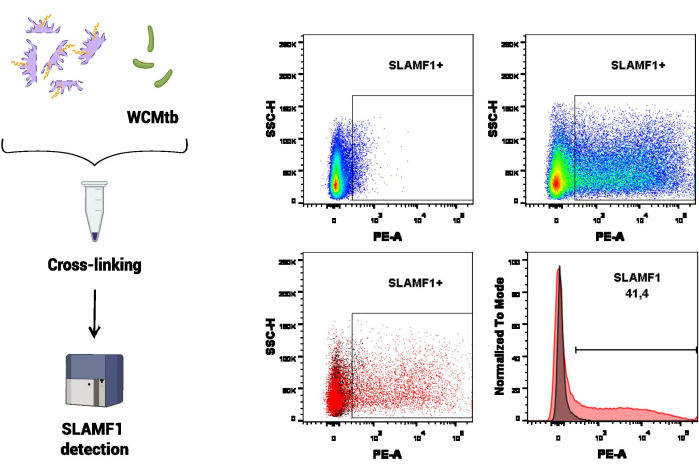
Рисунок 3: Взаимодействие SLAMF1-M. tuberculosis с помощью проточной цитометрии. Кросслинкинг между белками макрофагов и целыми клетками M. tuberculosis (WCMtb) осуществляли путем обработки формальдегидом/глицином/этиленгликолем бисом, как описано в разделе протокола. Затем взаимодействие оценивали с помощью проточной цитометрии путем обнаружения положительного сигнала SLAMF1 (PE) после выбора интересующей популяции (SSC-A vs. FSC-A). На верхней панели отображается положительный сигнал для SLAMF1, сравнивая контроль флуоресценции минус один (FMO) (слева) с положительным окрашиванием (справа). На нижней панели показано наложение (слева, точечный график и справа, гистограмма) между сигналом SLAMF1 и FMO управлением. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 4: Взаимодействие SLAMF1-M. tuberculosis с помощью флуоресцентной микроскопии. (A) Mtb Ags окрашивали родамином B (Mtb-R Ags) и прикрепляли к круглому покровному стеклу. Правильная адгезия и флуоресценция Mtb-R Ags были подтверждены флуоресцентной микроскопией с использованием фильтров, соответствующих красному каналу. (B) Перекрестное сшивание между белками макрофагов и Mtb-R Ags осуществляли путем обработки формальдегидом/глицином/этиленгликолем bis, как описано в разделе протокола, путем добавления белкового экстракта поверх прикрепленного Mtb-R Ags. Взаимодействие оценивали с помощью флуоресцентной микроскопии с использованием человеческого антитела против SLAMF1 с последующим добавлением вторичного антитела, меченного Alexa Fluor 488. На верхних микрофотографиях видны положительные сигналы SLAMF1 (слева, зеленый) и Mtb-R Ags (справа, красный). Низкий микроснимок свидетельствует о взаимодействии желтым цветом (слияние обоих каналов). Масштабные линейки соответствуют 10 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Это исследование является полезным руководством для изучения биохимического взаимодействия между M. tuberculosis и микробными сенсорами, экспрессируемыми в макрофагах человека, ключевом типе клеток, участвующем в реакции хозяина во время туберкулеза. Предоставленные протоколы будут актуальны для расшифровки молекул, которые играют роль в проникновении M. tuberculosis в фагоциты.
Характеристика биомолекулярных взаимодействий, таких как взаимодействие между патогенами и иммунорецепторами, имеет решающее значение для понимания как иммунозащитных механизмов, так и стратегий уклонения, вызванных M. tuberculosis. Во многих случаях демонстрация прямого взаимодействия рецептора с его бактериальным лигандом может быть сложной задачей и может потребовать сложных методов или систем, лишенных универсальности. Driessen et al. изучали роль фосфатидилинозитол маннозидов во взаимодействии между микобактериями и DC-SIGN с использованием мутантных дефицитных штаммов M. bovis BCG32. Несмотря на то, что им удалось изучить эти взаимодействия, авторы не обнаружили различий для мутантных штаммов и отметили, что создание мутантных бактерий, демонстрирующих сниженное связывание, будетогромной задачей. Другие авторы провели отличную и кропотливую работу, чтобы продемонстрировать взаимодействие между TLR2 и некоторыми белками PE/PPE M. tuberculosis33,34. Эти исследования требовали использования мышей с нокаутом для получения рецептора, трансфекции клеток и очистки вышеупомянутых белков или определенных белковых доменов33,34. Кроме того, часто делается вывод о функции рецепторов, но взаимодействие достоверно не демонстрируется. В качестве примера можно привести растворимый рецептор PTX3, для которого были обнаружены гаплотипы, связанные с исходом заболевания, но специфическое взаимодействие которого с M. tuberculosis строго не изучено. В связи с этими недостатками наш метод позволяет оценить взаимодействие исследуемого рецептора-мишени с M. tuberculosis простым способом и с помощью доступных методик легкой интерпретации.
Что касается предыдущих пунктов, в частности для SLAMF1, то ранее было оценено взаимодействие с OmpC и OmpF из E. coli36 и Omp25 из B. abortus37. Degos et al.37 использовали клетки COS-7, трансфицированные плазмидой, кодирующей только внеклеточный домен SLAMF1, чтобы затем очистить SLAMF1 и проанализировать взаимодействие с Omp25 с помощью вестерн-блоттинга. Они также проводили эксперименты с использованием мышей SLAMF1-/- и B. abortus дикого типа или Omp25-дефектного мутанта. Berger et al. В 36 работах также были представлены убедительные доказательства прямого взаимодействия между SLAMF1 и E. coli Omp и S. typhimurium SseB-. Они использовали различные подходы, в том числе мышей SLAMF1-/-, макрофаги RAW264.7, кодирующие конструкцию SLAMF1mCherry, а также анализ амплификации с использованием SLAMF1-трансфицированных Т-клеток Jurkat. Они разработали анализ чувствительного усиления сигнала с помощью люциферазного репортера с использованием 1 x 108E. coli. В связи с этим, одним из преимуществ анализов биохимического взаимодействия, представленных в этом отчете, является то, что взаимодействие было фактически обнаружено с использованием клеток дикого типа и того же соотношения клеток:бактерий, которое использовалось для функциональной оценки в предыдущей работе10, без необходимости сверхэкспрессии или отмены экспрессии SLAMF1.
Предоставленный протокол включает в себя некоторые важные шаги. Одним из них является подтверждение экспрессии SLAMF1 в макрофагах человека перед проведением анализов взаимодействия. Это имеет решающее значение для того, чтобы избежать получения ложноотрицательного результата, который на самом деле был бы связан с отсутствием экспрессии рецепторов. Здесь уровни SLAMF1 были проверены с помощью проточной цитометрии, поскольку это быстрый метод, позволяющий получить эти данные менее чем за 2 часа. Тем не менее, можно использовать и другие методы, такие как микроскопия или вестерн-блоттинг. Мы не рекомендуем такие методологии, как ПЦР в реальном времени, которые определяют уровни мРНК, когда конечной целью является изучение рецептора на уровне белка. Еще одним фундаментальным этапом является этап сшивки. Использование сшивающих агентов направлено на стабилизацию белок-белковых взаимодействий. Во время анализа на основе проточной цитометрии нам не удалось обнаружить сигнал на SLAMF1 без применения этапа сшивки. В случае микроскопического подхода мы наблюдали взаимодействие без использования лечения кросслинкингом, но с очень низкой чувствительностью. Поэтому этап сшивания настоятельно рекомендуется во всех случаях.
Описанный протокол предоставляет доказательства взаимодействия между SLAMF1 и антигенами M. tuberculosis , доступными на поверхности патогена, помогая продемонстрировать, что SLAMF1 распознает молекулярную сигнатуру, присутствующую у M. tuberculosis. Однако эта модель имеет некоторые ограничения. Слабым местом является то, что этот протокол не позволяет определить, какой именно антиген M. tuberculosis взаимодействует с SLAMF1. Несмотря на это, протокол может быть изменен для достижения этой цели, например, с использованием очищенных антигенов бактерий. Еще одним ограничением является необходимость знать, какой стимул индуцирует экспрессию SLAMF1 в макрофагах. Это может означать осложнение, если выбранный рецептор не экспрессируется в базальных условиях или для которых характер экспрессии неизвестен. Наконец, эти подходы не различают, требуются ли SLAMF1 другие молекулы для взаимодействия с M. tuberculosis. В этом случае можно было бы провести иммунопреципитацию или использовать в методической схеме большее количество антител.
Предложенная в данном отчете методология может быть легко адаптирована для изучения других иммунных рецепторов, того же рецептора в других типах клеток, в которых он экспрессируется, или для оценки взаимодействия с другими бактериями или штаммами различных микобактерий. Более того, в данном случае предоставляется краткий и простой протокол для флуоресцентного окрашивания M. tuberculosis ультразвуком, маркировка, которая может быть применена к другим бактериям и даже живым штаммам. Тем не менее, эта процедура фокусируется на перекрестных помехах SLAMF1-M. tuberculosis , другие потенциальные применения включают понимание результата заблокированного, отсроченного или неадекватного взаимодействия, изучение механизмов уклонения или выявление потенциальных молекулярных мишеней, участвующих в распознавании патогенов. Аналогичным образом, этот протокол может быть применен для изучения новых терапевтических стратегий и иммунотерапии для понимания коэволюции M. tuberculosis и макрофагов или других клеток-хозяев, а также может быть использован в различных областях, которые стремятся понять динамику лиганд-рецепторов.
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Эта работа была поддержана Национальным университетом Норвегии провинции Буэнос-Айрес (номера грантов SIB 0618/2019, SIB 2582/2012 для V.P.), Agencia Nacional de Promoción Científica y Tecnológica (ANPCyT, номера грантов PICT-2012-2459 и PICT A 2017-1896 для V.P. и PICT-2021-I-INVI-00584 для A.B.); Фонд Флоренсио Фиорини; и Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET, grant no PIO 157201501000CO to V.P.). Благодарим Наталью Мените и Гастона Вильяфанье за техническую поддержку. Мы выражаем признательность д-ру Пауле Баррионуэво и д-ру Лусиане Бальбоа за научную дискуссию во время публикации, которая привела к разработке анализов, представленных в этой работе. Наконец, мы благодарим доктора Эстермана за его советы по протоколам кросслинкинга, Lic. Морони за советы по работе с полилизином и ликом. Морикони за помощь в составлении схематических рисунков.
Материалы
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 488 secondary antibody | Invitrogen | A21121 | For fluorescence microscopy |
| anti-SLAMF1 FITC antibody | eBioscience | 11-1509-42 | For flow cytometry |
| anti-SLAMF1 PE antibody | BioLegend | 306308 | For flow cytometry |
| anti-SLAMF1 primary antibody | BioLegend | 306302 | For fluorescence microscopy |
| Aqua-Poly/Mount | Polysciences | 18606-20 | Mounting media |
| CD14 MicroBeads | Miltenyi Biotec | 130-097-052 | For monocytes isolation |
| Coverslips 12mm | HDA | - | For interaction assay by microscopy |
| EGS | ThermoFisher Scientific | 21565 | For crosslinking treatment |
| FACSCanto II | BD Biosciences | 338960 | Flow cytometer with BD FACSDiva software |
| Fetal Bovine Serum | Natocor | - | Inactivated and irradiated, for macrophages culture |
| Ficoll-Paque PLUS | Cytiva | 17144003 | For PBMCs separation |
| Fiji/ImageJ | Open Source software | - | For micrographs analysis |
| FlowJo 7.6.2 | Tree Star | - | For flow cytometry analysis |
| Formaldehyde | Merck | K47740803613 | For crosslinking treatment |
| Glass slides | Glass Klass | - | For interaction assay by microscopy |
| Glycine | Sigma | G8898 | For crosslinking treatment |
| Imager.A2 | Carl Zeiss | 430005-9901-000 | Fluorescence microscope with Colibri 7 illumination module |
| iMark | BIO-RAD | 1681130 | Microplate absorbance reader |
| L-glutamine | Sigma Aldrich | 49419 | For macrophages culture |
| M. tuberculosis, strain H37Rv, gamma-irradiated whole cells | BEI Resources, NIAID, NIH | NR-14819 | For interaction assay |
| M. tuberculosis, strain H37Rv, whole cell lysate | BEI Resources, NIAID, NIH | NR-14822 | For macrophages stimulation and interaction assay |
| Neofuge 13R | Heal Force | Neofuge 13R | High Speed Refrigerated Centrifuge for protein extraction |
| Penicillin/Streptomycin | Gibco | 15140122 | For macrophages culture |
| PMSF | ThermoFisher Scientific | 36978 | For proteins isolation |
| Poly-D-Lysine | Sigma Aldrich | A-003-M | For coverslips treatment |
| Protease Inhibitor Cocktail | Sigma Aldrich | P8340 | For proteins isolation |
| Rhodamine B | Sigma Aldrich | 21955 | For M. tuberculosis staining |
| RPMI 1640 | Gibco | 11875093 | For macrophages culture |
| Sorvall ST 16/16R centrifuge | ThermoFisher Scientific | 75004240 | For PBMCs and monocytes isolation |
Ссылки
- Global Tuberculosis Report 2023. , World Health Organization. Available at: https://www.who.int/tb/publications/global_report/en/ (2023).
- Ahmad, F., et al. Macrophage: A cell with many faces and functions in tuberculosis. Front Immunol. 13, 882130(2022).
- Bo, H., et al. Mycobacterium tuberculosis-macrophage interaction: Molecular updates. Front Cell Infect Microbiol. 13, 1187205(2023).
- Papp, A. C., et al. AmpliSeq transcriptome analysis of human alveolar and monocyte-derived macrophages over time in response to Mycobacterium tuberculosis infection. PLoS One. 13 (5), e0198069(2018).
- Zhai, W., Wu, F., Zhang, Y., Fu, Y., Liu, Z. The immune escape mechanisms of Mycobacterium tuberculosis. Int J Mol Sci. 20 (2), 340(2019).
- Van Crevel, R., Ottenhoff, T. H. M., Van der Meer, J. W. M. Innate immunity to Mycobacterium tuberculosis. Clin Microbiol Rev. 15 (2), 294-309 (2002).
- Mortaz, E., et al. Interaction of pattern recognition receptors with Mycobacterium tuberculosis. J Clin Immunol. 35 (1), 1-10 (2015).
- Stamm, C. E., Collins, A. C., Shiloh, M. U. Sensing of Mycobacterium tuberculosis and consequences to both host and bacillus. Immunol Rev. 264 (1), 204-219 (2015).
- Zihad, S. M. N. K., et al. Role of pattern recognition receptors in sensing Mycobacterium tuberculosis. Heliyon. 9 (10), e20636(2023).
- Barbero, A. M., et al. SLAMF1 signaling induces Mycobacterium tuberculosis uptake leading to endolysosomal maturation in human macrophages. J Leukoc Biol. 109 (8), 257-273 (2021).
- Pasquinelli, V., et al. Expression of signaling lymphocytic activation molecule-associated protein interrupts IFN-γ production in human tuberculosis. J Immunol. 172 (2), 1177-1185 (2004).
- Pasquinelli, V., et al. Phosphorylation of mitogen-activated protein kinases contributes to interferon-γ production in response to Mycobacterium tuberculosis. J Infect Dis. 207 (2), 340-350 (2012).
- Pasquinelli, V., et al. IFN-γ production during active tuberculosis is regulated by mechanisms that involve IL-17, SLAM, and CREB. J Infect Dis. 199 (5), 661-665 (2009).
- Pellegrini, J. M., et al. Neutrophil autophagy during human active tuberculosis is modulated by SLAMF1. Autophagy. 17 (2), 423-426 (2021).
- Song, T., Dong, C., Xiong, S. Signaling lymphocyte-activation molecule SLAMF1 augments mycobacteria BCG-induced inflammatory response and facilitates bacterial clearance. Int J Med Microbiol. 305 (6), 572-580 (2015).
- Eble, J. A. Titration ELISA as a method to determine the dissociation constant of receptor-ligand interaction. J Vis Exp. (132), e57032(2018).
- Patching, S. G. Surface plasmon resonance spectroscopy for characterization of membrane protein-ligand interactions and its potential for drug discovery. Biochim Biophys Acta Biomembr. 1838 (1), 43-55 (2014).
- Draczkowski, P., Matosiuk, D., Jozwiak, K. Isothermal titration calorimetry in membrane protein research. J Pharm Biomed Anal. 87, 296-304 (2014).
- Smith, D. S., Eremin, S. A. Fluorescence polarization immunoassays and related methods for simple, high-throughput screening of small molecules. Anal Bioanal Chem. 391 (5), 1499-1507 (2008).
- García-Nafría, J., Tate, C. G. Cryo-electron microscopy: Moving beyond X-ray crystal structures for drug receptors and drug development. Annu Rev Pharmacol Toxicol. 60, 51-71 (2020).
- Asami, J., Shimizu, T. Structural and functional understanding of the toll-like receptors. Protein Sci. 30 (4), 761-772 (2021).
- Phạm, T. T. T., Rainey, J. K. On-cell nuclear magnetic resonance spectroscopy to probe cell surface interactions. Biochem Cell Biol. 99 (6), 683-692 (2021).
- El Deeb, S., et al. Microscale thermophoresis as a powerful growing analytical technique for the investigation of biomolecular interaction and the determination of binding parameters. Methods Appl Fluoresc. 10 (4), 045001(2022).
- El Khamlichi, C., et al. Bioluminescence resonance energy transfer as a method to study protein-protein interactions: Application to G protein-coupled receptor biology. Molecules. 24 (3), 505(2019).
- Schneider, P., Willen, L., Smulski, C. R. Tools and techniques to study ligand-receptor interactions and receptor activation by TNF superfamily members. Methods Enzymol. 545, 103-125 (2014).
- Park, A. M. W., Schirmer, P. S. H. Atomic force microscopy: A multifaceted tool to study membrane proteins and their interactions with ligands. Biochim Biophys Acta Biomembr. 1838 (1), 74-89 (2014).
- Zalejski, J., Sun, J., Sharma, A. Unravelling the mystery inside cells by using single-molecule fluorescence imaging. J Imaging. 9 (9), 183(2023).
- Zheng, S., Zou, M., Shao, Y., Wu, H., Wang, X. Two-dimensional measurements of receptor-ligand interactions. Front Mol Biosci. 10, 1075587(2023).
- Zlotnikov, I. D., Kudryashova, E. V. Computer simulation of the receptor-ligand interactions of mannose receptor CD206 in comparison with the lectin concanavalin A model. Biochemistry (Moscow). 87 (1), 54-69 (2022).
- Fu, Y., Zhao, J., Chen, Z. Insights into the molecular mechanisms of protein-ligand interactions by molecular docking and molecular dynamics simulation: A case of oligopeptide binding protein. Comput Math Methods Med. 2018, 7604567(2018).
- Farina, B., et al. A novel approach for studying receptor-ligand interactions on living cells' surface by using NUS/T1ρ-NMR methodologies combined with computational techniques: The RGDechi15D-αvβ5 integrin complex. Comput Struct Biotechnol J. 19, 3303-3318 (2021).
- Driessen, N. N., et al. Role of phosphatidylinositol mannosides in the interaction between mycobacteria and DC-SIGN. Infect Immun. 77 (10), 4538-4547 (2009).
- Bansal, K., et al. Src homology 3-interacting domain of Rv1917c of Mycobacterium tuberculosis induces selective maturation of human dendritic cells by regulating PI3K-MAPK-NF-κB signaling and drives Th2 immune responses. J Biol Chem. 285 (47), 36511-36522 (2010).
- Xu, Y., et al. PPE57 induces activation of macrophages and drives Th1-type immune responses through TLR2. J Mol Med. 93 (6), 645-662 (2015).
- Olesen, R., et al. DC-SIGN (CD209), pentraxin 3 and vitamin D receptor gene variants associate with pulmonary tuberculosis risk in West Africans. Genes Immun. 8, 456-467 (2007).
- Berger, S. B., et al. SLAM is a microbial sensor that regulates bacterial phagosome functions in macrophages. Nat Immunol. 11 (10), 920-927 (2010).
- Degos, C., et al. Omp25-dependent engagement of SLAMF1 by Brucella abortus in dendritic cells limits acute inflammation and favours bacterial persistence in vivo. Cell Microbiol. 22 (4), e13156(2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены