Method Article
Mycobacterium tuberculosis Immune Receptor SLAMF1과의 상호 작용 연구를 위한 형광 분석
요약
이 연구는 Mycobacterium tuberculosis 와 SLAMF1 미생물 센서의 상호 작용을 평가하기 위한 프로토콜을 제공합니다. 이 분석은 유세포 분석 및 형광 현미경을 사용하여 인간 단핵구 유래 대식세포에 대해 수행되었습니다. 설명된 도구는 병원체와 면역수용체 간의 상호 작용을 연구하는 데 관련이 있습니다.
초록
병원체와 면역 수용체 간의 직접적인 상호 작용에 대한 평가에는 일반적으로 정교한 기술이 필요하거나 형질전환 균주 및 유전자 조작 세포의 사용을 암시합니다. 여기에서는 대식세포 미생물 센서 SLAMF1과 Mycobacterium tuberculosis 사이의 생화학적 상호 작용을 감지하는 대안적인 방법이 설명됩니다. 유세포 분석법과 형광 현미경을 사용하는 두 가지 기술적 접근 방식이 개발되었습니다. 인간 대식세포에서 총 세포 단백질 추출물을 생성한 다음 4°C에서 하룻밤 동안 M. tuberculosis (WCMtb) 또는 M. tuberculosis 항원(Mtb Ags)의 전체 세포와 함께 배양한 후 최종적으로 포름알데히드/글리신/에틸렌 글리콜 bis(succinimidyl succinate) 처리를 사용하여 가교결합시켰습니다. 유세포 분석에 의한 WCMtb와의 SLAMF1 상호 작용은 PE 특이적 항-SLAMF1 항체로 검출되었습니다. 형광 현미경 검사에 의한 상호 작용의 존재는 Rhodamine-PE 염색 Mtb Ag를 poly-D-lysine 코팅 슬라이드에 부착하여 수행되었으며, 이는 단핵구 유래 대식세포의 총 단백질 추출물과 함께 배양되었습니다. 가교결합 치료 후 1차(anti-SLAMF1) 및 2차(Alexa Fluor 488) 항체를 사용하여 SLAMF1을 시각화했습니다. 이 분석은 병원체-면역수용체 상호작용을 측정할 수 있는 강력한 생화학적 도구를 제공하여 형질전환 세포주 및 단백질 유전자 발현 조절 실험과 관련된 어려움을 극복했습니다.
서문
결핵을 유발하는 병원체로 142년 전에 확인된 결핵균(Mycobacterium tuberculosis)은 현재 전 세계 인구의 4분의 1 이상을 감염시키고 있으며, 전 세계적인 문제로 남아 있습니다1. 감염된 사람의 공기 중 비말을 통해 전염되는 M. tuberculosis는 폐의 폐포 대식세포에 도달하여 잠복 상태에서 장기간 생존할 수 있습니다 2,3. 국소 대식반응(macrophagic response)이 활성화될 뿐만 아니라, 최근 몇 년 동안 말초 단핵구(peripheral monocyte)가 호흡기로 동원되어 폐포 대식세포(alveolar macrophage)로 분화할 수 있으며, 이는 태아에서 유래한 대식세포보다 결핵균에 대해 훨씬 더 강력한 반응을 일으킬 수 있다고 설명되었습니다 2,4.
대식세포는 선천성 면역의 근본적인 역할을 합니다. 결핵균을 섭취하면 대식세포는 전염증성 사이토카인 분비, 식작용 융합, 결핵균을 죽이기 위한 다른 면역세포의 활성화와 같은 수많은 살균 기능을 나타냅니다 2,3. 그러나 이 병원체의 복잡한 구조적 구조는 대식세포 대사 및 기능을 조절할 수 있는 효과기(예: 단백질 및 지질)를 제공하며, 결과적으로 염증 과정을 조절할 수 있습니다3. 독성 인자의 분비 또는 숙주 인자의 이용을 통한 이러한 대식세포 반응의 조작은 M. tuberculosis 에 의해 가해지는 다양한 탈출 전략으로 이어집니다.주요 회피 기전으로는 항염증성 사이토카인 유도, 식분해체 성숙 및 산성화 억제, 산화 스트레스 변화, 자가포식 중단, 항원 처리 및 발표 중 결핍 등이 있습니다 3,5.
대식세포와 결핵균 사이의 엄격하게 조절된 상호 작용은 적절한 면역 반응의 발달에 매우 중요합니다. 따라서 이러한 시냅스를 연구하는 것은 숙주-병원체 누화에 의해 유도되는 면역 보호 또는 면역 병원성 메커니즘을 식별하고 잠재적인 치료 표적을 식별하는 데 중요합니다. TLR 6,7,8, NLR 7,8, 보체 수용체 6,8, C형 렉틴 수용체 6,8, 넝마 수용체6,8 및 넝마 수용체 6,8을 포함한 많은 수용체가 M. tuberculosis의 인식 및/또는 내재화를 매개합니다 . 누적된 데이터에 따르면 표면 결합 및 세포 내 PRR은 모두 감염 중에 중요한 역할을 하며, 옵소니화된 결핵과 비옵소니화된 M. 결핵을 인식합니다.
Zihad와 Sifat 등은 최근 선천성 세포에 의한 M. 결핵 유발 반응에 PRR의 참여를 검토했다9. 특히, TLR 계열의 대부분의 구성원은 M. tuberculosis ligands 6,7과의 상호 작용에 연루되어 있습니다. 표면 TLR2는 아실화 지단백질, 19-kDa 지단백질, LprA 지단백질, LprG 지단백질, 30-kDa 항원, 38-kDa 항원, MymA, 프롤린-프롤린-글루탐산(PPE)-57, LAM, LM, PIM, 열 충격 단백질 60, 시그니처 단백질 Rv1509 및 분비 단백질 ESAT-67과 같은 마이코박테리아 항원을 인식합니다. 멤브레인 TLR4는 열 충격 단백질, 38-kDa 항원, RpfE, Rv0652, Rv0335c, Rv2659c, Rv1738, Rv2627c, Rv2628, GrpE 및 HBHA와 상호 작용합니다. 한편, 엔도솜 TLR(TLR 3, 7, 8, 9)의 리간드에는 dsRNA, tRNA, ssRNA, 식체 RNA, 다발성 결핵의 dsDNA가 있다. 또한, TLR2는 TLR1 및 TLR6, TLR4 및 TLR9와 함께 작용할 때 면역 반응을 시작하는 데 적극적인 역할을 합니다 6,7. NOD2 및 NLRP3는 결핵에서 가장 잘 특성화된 세포질 NLR입니다. 이들의 특이적 리간드는 아직 연구 중이지만, 이러한 수용체는 각각무라밀 디펩타이드 또는 ESAT-6 7,8에 의해 활성화됩니다. C형 렉틴 수용체는 고전적으로 M. tuberculosis endocytosis에 관여합니다. Dectin-2는 M. tuberculosis 세포벽의 ManLAM에 대한 직접적인 PRR 역할을 하지만, Dectin-1 리간드는 아직 발견되지 않았다8. Mincle과 MCL은 모두 탯줄 인자7이라고도 하는 당지질 트레할로스-6,6'-디마이콜레이트(TDM)를 인식합니다. DCAR은 마이코박테리아 당지질인 포스파티딜-미오-이노시톨 만노사이드(PIM)7와 상호 작용합니다. CR3는 마이코박테리아 LAM과 PIM을 인식하고, DC-SIGN은 ManLAM을 연결하며, MR은 ManLAM, PIM, LM, 38-kDa 당단백질, 19-kDa 항원 및 기타 만노실화 단백질을 포함한 여러 M. 결핵 성분을 인식하지만 DCIR 리간드는 아직 확인되지 않았습니다.
용해성 CLR에는 ManLam, LM, 60-kDa 당단백질 및 당단백질 Apa를 인식하는 SP-A가 포함됩니다. LAM, LM 및 PILAM과 상호 작용하는 SP-D; ManLAM 인식을 전문으로 하는 MBL 6,7. 땀세포(scavenger receptor)는 또한 식세포 PRR입니다. SR-A와 MARCO는 TDM을 리간드로 가지고 있고, SR-B1은 ESAT-6을 인식하며, CD36은 ManLAM과 LM 7,8에 결합합니다. 또한 Dectin-1, Mincle 및 MARCO는 TLR2 또는 TLR4와 결합하여 M. tuberculosis PAMP 6,7을 감지한 후 신호를 트리거할 수도 있습니다. CD14는 비놉소나화 박테리아를 내재화할 수 있는 능력을 가지고 있으며 열충격 단백질인 샤페로닌 60.1도 인식하는 표면 수용체입니다. 특히, CD14는 MARCO 및 TLR2와 함께 보조 수용체로 기능합니다6. AIM2는 결핵균(M. tuberculosis)이 식체(phagosome)8에서 탈출할 때 ssDNA를 감지할 수 있는 세포질 수용체(cytosolic receptor)입니다. 마지막으로, AhR은 M. tuberculosis6의 색소 독성 인자 나프토퀴논 프티오콜과 결합하는 리간드 활성화 전사 인자입니다.
위에서 설명한 많은 상호 작용은 가정되었으며 엄격하게 입증되지 않았습니다. 특정 수용체에 대한 리간드조차도 아직 알려지지 않은 상태로 남아 있으며, 이는 M. tuberculosis 면역 인식 분야를 더 잘 이해할 필요성을 강화합니다. 이러한 맥락에서, 공동자극 분자 SLAMF1(Signaling Lymphocytic Activation Molecule)은 최근 Barbero 등에 의해 M. tuberculosis receptor로 기술되었습니다.10. SLAMF1은 신호 분자뿐만 아니라 결핵 센서로 작용함으로써 결핵에서 특히 흥미로운 역할을 합니다. SLAMF1은 Erk/CREB 인산화 11,12,13, 호중구의 자가포식 14, 대식세포의 세균 제거15를 통해 T 세포에 의한 IFN-γ 생성과 같은 보호 기능을 조절하여 면역 세포의 활성화를 유도할 수 있습니다.
수용체-리간드 상호 작용은 ELISA, 표면 플라즈몬 공명(SPR), 등온 적정 열량측정법(ITC), 형광 편광(FP), X선 결정학, 핵 자기 공명(NMR) 분광법, 마이크로 열영동(MST), 공명 에너지 전달(예: BRET 또는 FRET) 컨포칼 현미경, 전자 현미경, 초저온 전자 현미경(Cryo-EM) 및 원자력 현미경(AFM)16,17, 18,19,20,21,22,23,24,25,26,27,28. 이러한 접근법 중 일부는 리포터 유전자, 표지된 재조합 단백질 또는 키메라 분자, 녹아웃(knockout), 넉다운(knockdown) 또는 과발현 모델의 사용을 의미합니다. 대안적으로, 컴퓨터 도구는 수용체-리간드 상호 작용 및 결합 부위를 예측할 수 있으며 상호 작용에 대한 포괄적인 이해를 얻기 위해 생물학적 접근 방식과 함께 자주 사용됩니다 29,30,31. 여기에서는 생화학적 상호 작용을 감지하기 위한 두 가지 대안과 박테리아를 형광 표지하는 방법에 대한 섹션에 대해 설명합니다. 체외에서 수용체-병원체 상호 작용을 연구할 수 있는 프로토콜이 제시되며, 특히 일반적으로 사용 가능하고 일상적으로 사용되는 두 가지 기술인 유세포 분석 및 형광 현미경을 통한 SLAMF1-M 결핵 참여를 평가합니다.
프로토콜
인간 단핵구 유래 대식세포와 관련된 모든 절차는 헬싱키 선언(2013)과 UNNOBA 윤리위원회(COENOBA)에 따라 수행되었습니다. 검체 채취 전에 서면 동의서를 받았습니다. 남성/여성 그룹 분포는 13/6이었고 평균 연령은 32세였으며 사분위수 범위(IQR)는 18-75세였습니다. 이전의 병리학적 유무, 동반질환 또는 결핵에 대한 양성 진단이 있는 경우를 제외 기준으로 정의하였다. 시약 및 장비에 대한 자세한 내용은 재료 표에 나열되어 있습니다.
1. 단핵구 유래 대식세포 배양 및 자극
- 채혈
- 헤파린화된 주사기에 정맥 천자를 넣어 건강한 기증자로부터 60mL의 혈액을 채취합니다.
알림: 혈액 추출은 생화학자 또는 정맥 절개술 기술자가 수행해야 합니다. - 날카로운 물건 폐기 용기에 담긴 바늘과 병리학적 폐기물 용기에 담긴 기증자의 혈액과 접촉한 모든 물질을 폐기하십시오.
- 헤파린화된 주사기에 정맥 천자를 넣어 건강한 기증자로부터 60mL의 혈액을 채취합니다.
- 단핵구 분리 및 대식세포 생성
- 혈액을 50mL 튜브에 조심스럽게 옮기고 식염수로 반으로 희석합니다.
- 밀도 구배 매체에서 원심분리를 수행하여 말초 혈액 단핵 세포(PBMC)를 얻습니다.
- 희끄무레한 후광에서 PBMC를 수집합니다.
- 400 x g에서 식염수로 10분 동안 2회 세척하고 200 x g 에서 200 x g 으로 15분 동안 최종 세척하여 혈소판을 제거합니다.
- 세포 계수 챔버에서 PBMC의 수를 측정하고 CD14 비드를 사용하여 CD14 포지티브 자기 선택을 수행합니다.
알림: 마그네틱 선택 중에는 제조업체의 지침을 주의 깊게 따르십시오. 또한 유세포 분석을 사용하여 분리된 단핵구의 순도를 확인할 수 있습니다. - RPMI 1640에서 분리된 세포를 재현탁하고 세포 계수 챔버에서 단핵구의 수를 측정합니다.
- 순응도를 촉진하기 위해 혈청이 없는 상태에서 24웰 세포 배양 플레이트에 웰당 1 × 106/ mL CD14 양성 선택된 단핵구 500μL를 시딩합니다.
- 2시간 후, 예열된 RPMI 1640으로 세척하여 비부착 세포를 제거합니다.
- 대식세포를 구별하기 위해 부착 단핵구를 1mL의 완전한 배지(L-글루타민이 보충된 RPMI 1640 배지, 10% 소 태아 혈청(FBS), 페니실린 100U/mL 및 스트렙토마이신 100μg/mL)에서 추가로 16-18시간(하룻밤) 동안 배양합니다.
- 다음날, 배양 매체를 바꾸십시오. 매체를 제거하고 1x PBS 1mL로 세척한 다음 전체 배지 1mL를 추가합니다.
- 24 시간 동안 초음파 화 된 M. tuberculosis (M. tuberculosis antigens (Ags))로 대식 세포를 자극합니다. 1 × 106 monocyte 유래 대식세포당 10 μL의 M. tuberculosis Ags (10 μL = 1 × 106 bacteria)를 사용합니다.
참고 : 10 μL의 M. tuberculosis Ags (Mtb Ags) = 1 × 106 박테리아, 분광 광도계에서 O.D. 600nm 로 정량화 된 O.D. 1을 1 x 108 bacteria / mL로 간주합니다. 모든 배양 단계에 대해 5% CO2 가 있는 대기에서 37°C의 BSL2 생물 안전 캐비닛과 인큐베이터를 사용하십시오.
- SLAMF1 발현의 확증
- 하나의 웰에서 대식세포를 수집합니다. 배양 플레이트를 차가운 표면에 놓습니다. 1mL의 저온 FACS(1x PBS + 2% FBS)를 2회 연속 첨가하여 상하 이동을 사용하여 세포를 분리합니다. 채취를 위해 세포분석 라운드 바닥 튜브를 사용합니다.
- 500 x g 에서 4°C에서 5분 동안 셀을 원심분리합니다. 상등액을 버리는 것으로 버리십시오.
- 어둠 속에서 4°C에서 30분 동안 형광단 결합 항인간 SLAMF1 항체로 세포를 염색합니다. 항체 1.25μL를 첨가한 후 Vortex.
- FACS를 사용하여 과잉 항체를 제거하기 위해 세포를 세척하고, FACS에 펠릿을 재현탁하고, 유세포 분석기를 사용하여 샘플을 획득합니다.
참고: 1.25μL의 항-SLAMF1 항체는 0.5 x 106 대식세포를 표지하는 데 사용되는 0.0625μg에 해당합니다. 그러나 항체의 적정과 해당 동형 또는 FMO(Fluorescence Minus One) 제어를 수행하는 것이 강력히 권장됩니다.
2. 총 세포 단백질 추출물 준비
- 용해 완충액 준비
- NaCl 150mM, Tris 10mM, EDTA 5mM, SDS 1%, Triton X-100 1% 및 Sodium Deoxycholate 1%로 무선 면역침전 분석(RIPA) 완충액을 준비합니다.
- RIPA 완충액에 1mM 페닐메틸설포닐 플루오라이드(PMSF)와 펩스타틴 A 및 류펩틴과 같은 프로테아제 억제제를 보충합니다.
- 세포 수집 및 단백질 분리
- P1000 피펫을 사용하여 플레이트 웰에서 전체 RPMI를 폐기하고 차가운 1x PBS로 상하 피펫팅하여 대식세포를 수확합니다.
- 세포를 1.5mL 마이크로 원심분리 튜브로 옮깁니다. 마이크로튜브당 웰 1개를 수집합니다.
- 500 x g 에서 4°C에서 5분간 원심분리기. 상등액을 버리십시오.
- 차가운 PBS 1mL를 추가하고 2.2.2 및 2.2.3 단계를 반복하여 동일한 마이크로 원심분리 튜브에서 세포를 수집합니다.
- 100μL의 1x PBS에 세포 펠릿을 재현탁하고 4개의 튜브를 풀링합니다. 2.2.3단계를 반복합니다. 각 튜브에는 2 x 106 개의 대식 세포가 들어 있습니다.
- 100μL의 RIPA 완충액을 추가하고 10분마다 볼텍싱하면서 얼음 위에서 현탁액을 1시간 동안 배양합니다.
- 14,000 x g 에서 15분 동안 원심분리기 상등액을 수집하고 -20 °C에서 사용할 때까지 보존합니다.
3. M. tuberculosis -유세포 분석에 의한 SLAMF1 상호 작용
- 단백질-박테리아 가교
- 1 x 106 대식세포(50 μL)의 단백질 추출물과 함께 1 × 106 전체 불활성화 M. tuberculosis 세포(WCMtb, M. tuberculosis, 감마선 조사에 의해 비활성화됨)를 회전하는 마이크로튜브 홀더에서 4°C에서 하룻밤 동안 배양합니다.
참고 : 10 μL의 WCMtb = 1 × 106 박테리아, 분광 광도계에서 O.D. 600nm 로 정량화 된 O.D. 1을 1 x 108 bacteria / mL로 간주합니다. - 다음 날, 1x PBS에 희석된 1% 포름알데히드 500μL를 첨가합니다. 실온(RT)에서 교반(셰이커)으로 15분 동안 배양합니다.
- 물에 희석된 0.125M 글리신 25μL를 추가합니다. RT에서 교반(셰이커)으로 5분 동안 배양합니다.
- 14,000 x g 에서 1x PBS 1mL로 5분 동안 2회 세척합니다. 세척 단계 사이에 상층액을 버리십시오.
- 펠렛을 재현탁하고 빙초산:물의 1:1 혼합물에 희석된 2mM의 에틸렌 글리콜 비스(숙시니미딜 석시네이트)(EGS) 교차결합제 500μL에서 현탁액을 실온에서 1시간 동안 배양합니다.
알림: 사용 시 시약을 준비하는 것이 좋습니다. EGS를 준비하려면 빙초산과 물을 동일한 비율로 혼합하고 70°C로 가열해야 합니다. 용액이 뜨겁지 않으면 EGS가 완전히 재현탁되지 않습니다.
- 1 x 106 대식세포(50 μL)의 단백질 추출물과 함께 1 × 106 전체 불활성화 M. tuberculosis 세포(WCMtb, M. tuberculosis, 감마선 조사에 의해 비활성화됨)를 회전하는 마이크로튜브 홀더에서 4°C에서 하룻밤 동안 배양합니다.
- SLAMF1 염색
- 첫 번째 세척에서 500μL의 1x PBS를 사용하고 두 번째 세척에서 1mL를 사용하여 3.1.4단계를 반복합니다.
- 마이크로튜브에 항체를 추가하고 볼텍싱하여 어두운 곳에서 4°C에서 30분 동안 항인간 SLAMF1 항체(1.3.3단계 참조)로 단백질-박테리아 복합체를 염색합니다. 1 x 106 cells (2.5 μL 또는 0.125 μg)에 적합한 항체 양을 사용합니다.
- FACS를 사용하여 과잉 항체를 제거하기 위해 세포를 세척하고, FACS에 펠릿을 재현탁하고, 유세포 분석기에서 샘플을 획득합니다(1.3.4단계 참조).
알림: 해당 isotype 또는 FMO 제어를 수행합니다.
4. M. 결핵 항원 라벨링
- 로다민 B를 에탄올에 5mg/mL(1000x)의 스톡 농도로 재현탁합니다. 사용할 때까지 -20 °C에서 보관하십시오.
- 1.5mL 마이크로 원심분리기 튜브에 M. tuberculosis Ags 100μL당 1μL의 Rhodamine B를 추가합니다.
- RT에서 45분 동안 지속적인 교반(와류) 하에서 배양합니다.
- 상등액이 투명해질 때까지 1mL의 1x PBS를 사용하여 14,000 x g 에서 24°C에서 5분 동안 최소 3회 세척합니다. 펠릿(Mtb-R Ags)은 연한 분홍색으로 보입니다.
- 100μL의 1x PBS에서 Mtb-R Ag를 재현탁하여 초기 부피를 복원합니다.
알림: 멸균 상태에서 작업하는 것이 좋습니다. 실험을 수행하기 직전에 염색이 수행되었는지 확인하십시오.
5. M. 결핵 - 형광 현미경에 의한 SLAMF1 상호 작용
- 박테리아-단백질 가교
- 둥근 노즈 수술용 핀셋을 사용하여 12mm 원형 커버슬립을 24웰 배양 플레이트(웰당 1개의 커버슬립)에 삽입합니다.
알림: 커버슬립을 70% 에탄올로 철저히 청소하십시오. 원하는 경우 30분 동안 자외선 아래에서 오토클레이브 또는 멸균할 수 있습니다. - 커버슬립을 400μL의 10μg/mL Poly-D-Lysine으로 4°C에서 밤새 배양합니다. 빛으로부터 보호하기 위해 알루미늄 호일로 플레이트를 덮으십시오.
- 다음날 냉장고에서 플레이트를 제거하고 물 1mL로 커버 슬립을 두 번 씻으십시오.
- 커버슬립을 말리십시오.
- 20μL(2 x 106)의 Mtb-R Ag를 180μL의 1x PBS로 희석합니다. 최종 200μL는 커버슬립을 완전히 덮기에 충분합니다.
- 세포 배양기에서 37°C에서 1시간 동안 Mtb-R Ags로 커버슬립을 배양합니다.
- 남은 액체는 버리고 1x PBS 1mL로 두 번 씻으십시오.
참고: 이 단계에서는 빨간색 채널에 해당하는 필터를 사용하여 형광 현미경으로 커버슬립에 대한 Mtb-R의 올바른 접착력을 확인할 수 있습니다. - 교반(shaker)의 RT에서 30분 동안 400μL의 블로킹 버퍼(1x PBS에서 10% FBS)를 추가합니다.
- 400 μL의 블로킹 버퍼로 두 번 세척합니다.
- 300μL의 1x PBS에 희석된 단백질 추출물 100μL를 교반(shaker)에서 2시간 동안 배양합니다.
- 1x PBS에 희석된 1% 포름알데히드 400μL를 추가합니다. RT에서 교반(셰이커) 하에서 15분 동안 배양합니다.
- 물에 희석된 0.125M의 글리신 500μL를 첨가합니다. RT에서 교반(셰이커)으로 5분 동안 배양합니다.
- 1x PBS 1mL로 두 번 씻으십시오.
- 교반(셰이커)에서 RT에서 1시간 동안 2mM EGS 400μL를 추가합니다.
- 5.1.13단계를 반복합니다.
알림: 사용 시 시약을 준비하는 것이 좋습니다.
- 둥근 노즈 수술용 핀셋을 사용하여 12mm 원형 커버슬립을 24웰 배양 플레이트(웰당 1개의 커버슬립)에 삽입합니다.
- SLAMF1 염색
- 배양 플레이트의 뚜껑을 파라핀 필름으로 감쌉니다.
- 파라핀 필름으로 덮인 뚜껑에 이전에 적정된 anti-SLAMF1 1차 항체 60μL(1:75 희석)를 한 방울 떨어뜨립니다.
- 구부러진 가는 팁 수술용 핀셋과 바늘을 사용하여 플레이트에서 커버슬립을 조심스럽게 제거합니다.
알림: 커버슬립 제거를 용이하게 하기 위해 바늘을 약 45° 각도로 구부릴 수 있습니다. - 항체가 들어 있는 방울 위에 커버슬립을 뒤집습니다. 어둠 속에서 RT에서 30분 동안 배양합니다.
- 커버슬립을 들어 올리고 차단 버퍼로 두 번 세탁하십시오.
- 2차 항체(1:200 희석)를 포함하는 새 방울 위에 커버슬립을 뒤집습니다. 어둠 속에서 RT에서 30분 동안 배양합니다.
- 5.2.5단계를 반복합니다.
- 여분의 액체를 제거하고 유리 슬라이드에 놓인 장착 액체 한 방울에 커버 슬립을 장착합니다.
- 적절한 필터를 사용하여 형광 현미경 아래에서 관찰하십시오.
알림: 멸균 상태에서 작업하는 것이 좋습니다. 차단 버퍼에서 항체를 희석합니다. 현미경으로 관찰하는 데 방해가 될 수 있는 긁힘을 방지하기 위해 커버슬립을 조심스럽게 다루십시오. 형광에 적합한 장착 유체를 적극 권장합니다.
결과
이 연구에서는 인간 대식세포에서 M. tuberculosis와 면역 수용체 SLAMF1의 상호 작용을 평가할 수 있는 프로토콜이 제공됩니다(그림 1). 이를 위해 건강한 기증자로부터 말초 혈액을 채취했습니다. 그런 다음 밀도 구배 배지에서 원심분리를 통해 PBMC를 분리하고 단핵구를 자기 양성 선택(≥95% 순도, 그림 2A,B)으로 분리했습니다. 분리된 단핵구를 단핵구 유래 대식세포를 얻기 위해 2시간 동안 플라스틱 배양 플레이트에 부착한 후 ON으로 배양했습니다. 그 후,10 이전에 보고된 바와 같이 SLAMF1 표면 발현을 유도하기 위해 초음파 처리된 M. tuberculosis(Mtb Ags)로 대식세포를 자극하고, 유세포 분석으로 표면 SLAMF1 수준을 확인했습니다(그림 2C). 대식세포는 세포 용해를 촉진하기 위해 얼음에서 볼텍싱(vortexing) 및 배양(incubation)과 결합된 RIPA 용해 완충액을 사용하여 최종적으로 용해되었습니다. 생성된 총 단백질 추출물은 상호 작용 분석에 사용되었습니다.
첫 번째 실험 절차에서는 M. tuberculosis(WCMtb)의 전체 세포와 SLAMF1의 상호 작용을 연구하기 위해 유세포 분석이 사용되었습니다(그림 3). 첫째, SLAMF1(단백질 추출물의 함량)과 WCMtb 사이의 물리적 상호 작용은 4°C에서 연속 회전으로 함께 ON으로 배양하여 촉진되었습니다. 그런 다음 가교 결합을 수행하고, 특정 항-SLAMF1 항체를 사용하여 WCMtb에 결합된 SLAMF1 수용체를 검출했습니다. 이 분석에서는 WCMtb 단독으로 사용하여 SLAMF1 결합을 검출하기 위한 관심 모집단인 유세포 분석기에서 M. tuberculosis의 크기 및 입도에 해당하는 전압을 설정했습니다.
두 번째 실험 접근법에서는 SLAMF1-M. 결핵 상호작용을 검출하기 위해 형광 현미경 검사법을 사용했습니다(그림 4). 초음파 처리된 M. tuberculosis (Mtb Ags)가 사용된 이 분석은 이전 분석을 보완합니다. 로다민 B-염색 Mtb Ags(Mtb-R Ags)를 사용하여 PE 형광 색소에 해당하는 채널/필터에서 형광 검출을 용이하게 했습니다. Mtb-R Ag를 poly-D-lysine 코팅된 커버슬립에 부착하고 현미경 관찰을 통해 성공적인 염색을 확인했습니다(그림 4A). 그 후, Mtb-R Ags로 코팅된 슬라이드를 SLAMF1을 함유하는 단백질 추출물과 함께 배양했습니다. 가교결합 처리 후, 1차 특이적 항-SLAMF1 항체를 사용한 후 PE와 함께 관찰하기 위해 호환 가능한 형광 색소에 결합된 2차 항체를 사용하여 SLAMF1을 검출했습니다. Mtb-R Ags 및 SLAMF1에 대한 두 채널에서 개별 형광 현미경 이미지를 얻은 후 이미지 병합으로 상호 작용이 확증되었습니다(그림 4B).
이러한 접근법을 수행함으로써 SLAMF1과 M. tuberculosis 사이에 상호 작용이 존재함을 입증했습니다. SLAMF1과 초음파 처리된 박테리아 모두와 교차하는 것이 검출되었으며, 이는 SLAMF1이 M. tuberculosis10에 대한 새로운 선천적 인간 대식세포 수용체임을 가리키는 가설에 힘을 실어주었습니다.

그림 1: SLAMF1-M. 결핵 상호작용을 감지하는 워크플로우. 말초 혈액은 정맥 천자를 통해 건강한 기증자로부터 채취하고 밀도 구배 배지를 통해 원심분리하여 말초 혈액 단핵 세포(PBMC)를 분리했습니다. 세포의 수를 측정한 후, PBMC는 CD14pos 단핵구를 정제하기 위해 양성 자기 선택을 수행했습니다. 그런 다음 소태아 혈청이 없는 상태에서 2시간 동안 단핵구를 배양 플레이트에 부착한 다음 보충된 RPMI(휴지 단계)에서 하룻밤 동안 배양하여 단핵구 유래 대식세포를 얻었습니다. 그 후, 대식세포를 24시간 동안 초음파 처리된 M. tuberculosis(Mtb Ags)로 자극하여 SLAMF1 표면 발현을 유도했습니다. SLAMF1 수치는 대식세포 집단의 일부에서 인간 항-SLAMF1 특이적 항체를 사용하여 유세포 분석으로 테스트되었습니다. 나머지 대식세포는 총 단백질 추출물을 얻는 데 사용되었습니다. 세포 용해는 용해 완충액에서 얼음 위에서 와류(vortexing)와 배양을 결합하여 수행되었습니다. 마지막으로, 대식세포 단백질을 Mtb Ags 또는 M. tuberculosis(WCMtb)의 전체 세포와 가교한 후 SLAMF1과 M. tuberculosis 사이의 상호 작용을 유세포 분석 및 형광 현미경으로 평가했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 실험 및 기술적 대조군.(A) CD14pos 단핵구는 양성 자기 선택에 의해 PBMC에서 분리되었습니다. 그 결과로 생성된 양성(단핵구, 파란색) 및 음성(빨간색) 세포 분획을 유세포 분석법(SSC-A vs. FSC-A)를 사용하여 성공적인 선택을 확인합니다. (B) 양성 분획의 순도는 세포 입도 및 크기를 분석하는 유세포 분석법(SSC-A vs. FSC-A)를 사용합니다. (C) 단핵구 유래 대식세포는 SSC-A vs. FSC-A를 사용한 다음 이중 singlets-strategy(FSC-A 대 . FSC-H에 이어 SSC-A 대 SSC-H)를 사용합니다. SLAMF1 표면 발현은 단일 세포에서 평가되었습니다. 모든 경우(A-C)에서 대표 플롯 또는 히스토그램이 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
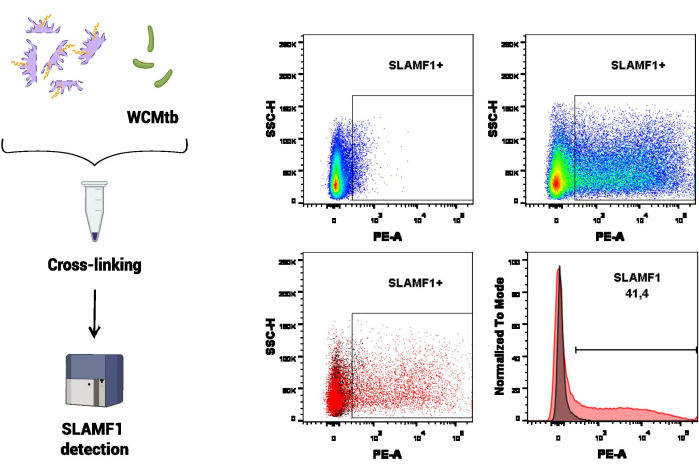
그림 3: 유세포 분석에 의한 SLAMF1-M. 결핵 상호 작용. 대식세포 단백질과 M. tuberculosis (WCMtb)의 전체 세포 사이의 가교는 프로토콜 섹션에 설명된 대로 포름알데히드/글리신/에틸렌 글리콜 비스로 처리하여 수행했습니다. 그런 다음, 관심 모집단(SSC-A vs. FSC-A)를 사용합니다. 상단 패널은 SLAMF1에 대한 양성 신호를 보여주며, FMO(Fluorescence Minus One) 대조군(왼쪽)과 양성 염색(오른쪽)을 비교합니다. 하단 패널에는 SLAMF1 신호와 FMO 제어 사이의 오버레이(왼쪽, 도트 플롯 및 오른쪽, 히스토그램)가 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 형광 현미경 검사에 의한 SLAMF1-M. 결핵 상호 작용. (A) Mtb Ags는 로다민 B(Mtb-R Ags)로 염색되고 원형 커버슬립에 부착되었습니다. Mtb-R Ags의 정확한 접착력과 형광은 적색 채널에 해당하는 필터를 사용한 형광 현미경 검사로 확증되었습니다. (B) 대식세포 단백질과 Mtb-R Ag 사이의 가교결합은 첨부된 Mtb-R Ags 위에 단백질 추출물을 첨가하여 프로토콜 섹션에 설명된 대로 포름알데히드/글리신/에틸렌 글리콜 비스로 처리하여 수행되었습니다. 상호 작용은 인간 항 SLAMF1 항체를 사용한 형광 현미경 검사와 Alexa Fluor 488 표지 2차 항체로 평가되었습니다. 상단 현미경 사진은 SLAMF1(왼쪽, 녹색) 및 Mtb-R Ags(오른쪽, 빨간색) 양의 신호를 보여줍니다. 낮은 현미경 사진은 상호 작용이 노란색으로 표시된다는 것을 나타냅니다(두 채널의 병합). 스케일 바는 10μm에 해당합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 연구는 결핵 중 숙주 반응에 관여하는 주요 세포 유형인 인간 대식세포에서 발현되는 미생물 센서와 M. tuberculosis 의 생화학적 상호 작용을 연구하는 데 유용한 가이드를 제공합니다. 제공된 프로토콜은 결핵균(M. tuberculosis )이 식세포(phagocyte)로 진입하는 데 중요한 역할을 하는 분자를 해독하는 데 관련이 있습니다.
병원체와 면역수용체 간의 상호 작용과 같은 생체 분자 상호 작용을 특성화하는 것은 M. tuberculosis에 의해 유발된 면역 보호 메커니즘과 회피 전략을 이해하는 데 매우 중요합니다. 많은 경우, 수용체와 박테리아 리간드의 직접적인 상호 작용을 입증하는 것은 복잡할 수 있으며 다재다능함이 부족한 정교한 기술이나 시스템이 필요할 수 있습니다. Driessen 등은 M. bovis BCG32의 돌연변이 결핍 균주를 사용하여 Mycobacteria와 DC-SIGN 사이의 상호 작용에서 포스파티딜이노시톨 만노사이드의 역할을 연구했습니다. 그들은 이러한 상호 작용을 연구할 수 있었지만 저자들은 돌연변이 균주에 대한 차이점을 찾지 못했고 결합이 감소된 돌연변이 박테리아를 생성하는 것이 엄청난 작업이 될 것이라고 논의했습니다32. 다른 저자들은 TLR2와 M. tuberculosis의 일부 PE/PPE 단백질 사이의 상호 작용을 입증하기 위해 훌륭하고 힘든 작업을 수행했습니다 33,34. 이러한 연구는 수용체, 세포의 형질주입 및 앞서 언급한 단백질 또는 특정 단백질 도메인의 정제를 위해 녹아웃 마우스의 사용을 필요로 했습니다33,34. 또한 수용체의 기능은 종종 추론되지만 상호 작용은 안정적으로 입증되지 않습니다. 예를 들어 용해성 수용체 PTX3는 질병 결과와 관련된 일배체형이 발견되었지만 M. tuberculosis와의 특정 상호 작용은 엄격하게 연구되지 않았습니다35. 이러한 단점과 관련하여, 본 연구의 방법은 연구 중인 표적 수용체와 결핵균의 상호 작용을 간단한 방법으로 그리고 쉽게 해석할 수 있는 접근 가능한 기법으로 평가할 수 있습니다.
이전 요점, 특히 SLAMF1에 관해서는 E. coli36 의 OmpC 및 OmpF 및 B. abortus37 의 Omp25와의 상호 작용이 이전에 평가되었습니다. Degos 등37 은 SLAMF1의 세포외 도메인만을 인코딩하는 플라스미드로 형질주입된 COS-7 세포를 사용하여 SLAMF1을 정제하고 웨스턴 블롯에 의한 Omp25와의 상호작용을 분석했습니다. 그들은 또한 SLAMF1-/- 마우스와 야생형 B. abortus 또는 Omp25 결함 돌연변이를 사용하여 실험을 수행했습니다. Berger 외. 36 연구는 또한 SLAMF1과 E. coli Omp 및 S. typhimurium SseB- 사이의 직접적인 상호 작용에 대한 강력한 증거를 보여주었습니다. 연구진은 SLAMF1-/- 마우스, SLAMF1mCherry 구조체를 인코딩하는 RAW264.7 대식세포, SLAMF1 형질주입 Jurkat T 세포를 사용한 증폭 분석 등 다양한 접근법을 사용했습니다. 그들은 1 x 108 E. coli를 사용하여 루시페라제 리포터로 민감한 신호 증폭 분석을 개발했습니다. 이와 관련하여, 본 보고서에 제시된 생화학적 상호작용 분석법의 한 가지 강점은 상호작용이 SLAMF1 발현을 과발현하거나 폐지할 필요 없이 이전 연구10에서 기능적 평가에 사용된 세포:박테리아와 동일한 비율의 야생형 세포를 사용하여 실제로 발견되었다는 것입니다.
제공된 프로토콜에는 몇 가지 중요한 단계가 수반됩니다. 그 중 하나는 상호 작용 분석을 수행하기 전에 인간 대식세포에서 SLAMF1 발현을 확증하는 것입니다. 이것은 실제로 수용체 발현의 부족으로 인한 위음성 결과를 얻는 것을 피하는 데 중요합니다. 여기에서 SLAMF1 수준은 2시간 이내에 이 데이터를 얻을 수 있는 빠른 기술이기 때문에 유세포 분석을 사용하여 확인했습니다. 그러나 현미경 또는 웨스턴 블롯과 같은 다른 기술을 사용할 수 있습니다. 궁극적인 목표가 단백질 수준에서 수용체를 연구하는 것인 경우 mRNA 수준을 식별하는 Real-Time PCR과 같은 방법론은 권장하지 않습니다. 또 다른 기본 단계는 가교 단계입니다. 교차결합제의 사용은 단백질-단백질 상호작용을 안정화하기 위한 것입니다. 유세포 분석을 기반으로 한 분석 중에 cross-linking 단계를 적용하지 않으면 SLAMF1에 대한 신호를 검출할 수 없었습니다. 현미경 접근법의 경우, 가교 처리를 사용하지 않고 매우 낮은 민감도로 상호 작용을 관찰했습니다. 따라서 모든 경우에 가교 단계를 적극 권장합니다.
설명된 프로토콜은 병원체 표면에서 접근할 수 있는 SLAMF1과 M. tuberculosis 항원 간의 상호 작용에 대한 증거를 제공하여 SLAMF1이 M. tuberculosis에 존재하는 분자 신호를 인식한다는 것을 입증하는 데 도움이 됩니다. 그러나 이 모델에는 몇 가지 제한 사항이 있습니다. 약점은 이 프로토콜로 인해 어떤 특정 M. tuberculosis 항원이 SLAMF1과 상호 작용하는지 식별할 수 없다는 것입니다. 그럼에도 불구하고, 예를 들어 박테리아에서 정제된 항원을 사용하여 이러한 목적을 달성하기 위해 프로토콜을 수정할 수 있습니다. 또 다른 한계는 어떤 자극이 대식세포에서 SLAMF1의 발현을 유도하는지 알아야 한다는 것입니다. 이는 선택된 수용체가 기저 조건에서 발현되지 않거나 발현 패턴을 알 수 없는 경우 합병증을 암시할 수 있습니다. 마지막으로, 이러한 접근법은 SLAMF1이 M. tuberculosis와 상호 작용하기 위해 다른 분자를 필요로 하는지 여부를 구별하지 않습니다. 이 경우, 면역침전 분석을 수행하거나 더 많은 항체를 방법론적 체계에 사용할 수 있습니다.
이 보고서에서 제안된 방법론은 다른 면역 수용체, 발현되는 다른 세포 유형에서 동일한 수용체의 다른 면역 수용체에 대한 연구 또는 다른 박테리아 또는 다른 마이코박테리아 균주와의 상호 작용을 평가하는 데 쉽게 적용할 수 있습니다. 또한, 여기에서는 초음파 처리된 M. tuberculosis를 형광 염색하기 위한 짧고 간단한 프로토콜이 제공되며, 이는 다른 박테리아 및 살아있는 균주에도 적용될 수 있는 라벨링입니다. 그러나 이 절차는 SLAMF1-M. 결핵 누화에 중점을 두고 있으며, 다른 잠재적인 용도로는 차단, 지연 또는 부적절한 상호 작용의 결과 이해, 회피 메커니즘 연구 또는 병원체 인식과 관련된 잠재적인 분자 표적 파악 등이 있습니다. 마찬가지로, 이 프로토콜은 M. tuberculosis 와 대식세포 또는 기타 숙주 세포의 공진화를 이해하기 위한 새로운 치료 전략 및 면역 요법 연구에 적용될 수 있으며 리간드-수용체 역학을 이해하려는 다양한 분야에서도 사용될 수 있습니다.
공개
저자는 이해 상충이 없음을 선언합니다.
감사의 말
이 작업은 Universidad Nacional del Noroeste de la Provincia de Buenos Aires(보조금 번호 SIB 0618/2019, SIB 2582/2012에서 V.P.), Agencia Nacional de Promoción Científica y Tecnológica(ANPCyT, 보조금 번호 PICT-2012-2459 및 PICT A 2017-1896에서 V.P. 및 PICT-2021-I-INVI-00584에서 A.B.)의 지원을 받았습니다. 플로렌시오 피오리니 재단; 및 Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET, 보조금 번호 PIO 15720150100010CO to V.P.). 기술 지원을 해주신 Natalia Menite와 Gastón Villafañe에게 감사드립니다. 우리는 Paula Barrionuevo 박사와 Luciana Balboa 박사가 이 연구에서 제시된 분석법의 개발을 야기한 출판물 중 과학적 토론에 대해 감사를 표합니다. 마지막으로 가교 프로토콜에 대한 조언을 해주신 Estermann 박사님, Lic. Poly-Lysine 및 Lic 작업에 대한 조언을 해주신 Moroni. Moriconi는 도식도에 도움을 주었습니다.
자료
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 488 secondary antibody | Invitrogen | A21121 | For fluorescence microscopy |
| anti-SLAMF1 FITC antibody | eBioscience | 11-1509-42 | For flow cytometry |
| anti-SLAMF1 PE antibody | BioLegend | 306308 | For flow cytometry |
| anti-SLAMF1 primary antibody | BioLegend | 306302 | For fluorescence microscopy |
| Aqua-Poly/Mount | Polysciences | 18606-20 | Mounting media |
| CD14 MicroBeads | Miltenyi Biotec | 130-097-052 | For monocytes isolation |
| Coverslips 12mm | HDA | - | For interaction assay by microscopy |
| EGS | ThermoFisher Scientific | 21565 | For crosslinking treatment |
| FACSCanto II | BD Biosciences | 338960 | Flow cytometer with BD FACSDiva software |
| Fetal Bovine Serum | Natocor | - | Inactivated and irradiated, for macrophages culture |
| Ficoll-Paque PLUS | Cytiva | 17144003 | For PBMCs separation |
| Fiji/ImageJ | Open Source software | - | For micrographs analysis |
| FlowJo 7.6.2 | Tree Star | - | For flow cytometry analysis |
| Formaldehyde | Merck | K47740803613 | For crosslinking treatment |
| Glass slides | Glass Klass | - | For interaction assay by microscopy |
| Glycine | Sigma | G8898 | For crosslinking treatment |
| Imager.A2 | Carl Zeiss | 430005-9901-000 | Fluorescence microscope with Colibri 7 illumination module |
| iMark | BIO-RAD | 1681130 | Microplate absorbance reader |
| L-glutamine | Sigma Aldrich | 49419 | For macrophages culture |
| M. tuberculosis, strain H37Rv, gamma-irradiated whole cells | BEI Resources, NIAID, NIH | NR-14819 | For interaction assay |
| M. tuberculosis, strain H37Rv, whole cell lysate | BEI Resources, NIAID, NIH | NR-14822 | For macrophages stimulation and interaction assay |
| Neofuge 13R | Heal Force | Neofuge 13R | High Speed Refrigerated Centrifuge for protein extraction |
| Penicillin/Streptomycin | Gibco | 15140122 | For macrophages culture |
| PMSF | ThermoFisher Scientific | 36978 | For proteins isolation |
| Poly-D-Lysine | Sigma Aldrich | A-003-M | For coverslips treatment |
| Protease Inhibitor Cocktail | Sigma Aldrich | P8340 | For proteins isolation |
| Rhodamine B | Sigma Aldrich | 21955 | For M. tuberculosis staining |
| RPMI 1640 | Gibco | 11875093 | For macrophages culture |
| Sorvall ST 16/16R centrifuge | ThermoFisher Scientific | 75004240 | For PBMCs and monocytes isolation |
참고문헌
- Global Tuberculosis Report 2023. , World Health Organization. Available at: https://www.who.int/tb/publications/global_report/en/ (2023).
- Ahmad, F., et al. Macrophage: A cell with many faces and functions in tuberculosis. Front Immunol. 13, 882130(2022).
- Bo, H., et al. Mycobacterium tuberculosis-macrophage interaction: Molecular updates. Front Cell Infect Microbiol. 13, 1187205(2023).
- Papp, A. C., et al. AmpliSeq transcriptome analysis of human alveolar and monocyte-derived macrophages over time in response to Mycobacterium tuberculosis infection. PLoS One. 13 (5), e0198069(2018).
- Zhai, W., Wu, F., Zhang, Y., Fu, Y., Liu, Z. The immune escape mechanisms of Mycobacterium tuberculosis. Int J Mol Sci. 20 (2), 340(2019).
- Van Crevel, R., Ottenhoff, T. H. M., Van der Meer, J. W. M. Innate immunity to Mycobacterium tuberculosis. Clin Microbiol Rev. 15 (2), 294-309 (2002).
- Mortaz, E., et al. Interaction of pattern recognition receptors with Mycobacterium tuberculosis. J Clin Immunol. 35 (1), 1-10 (2015).
- Stamm, C. E., Collins, A. C., Shiloh, M. U. Sensing of Mycobacterium tuberculosis and consequences to both host and bacillus. Immunol Rev. 264 (1), 204-219 (2015).
- Zihad, S. M. N. K., et al. Role of pattern recognition receptors in sensing Mycobacterium tuberculosis. Heliyon. 9 (10), e20636(2023).
- Barbero, A. M., et al. SLAMF1 signaling induces Mycobacterium tuberculosis uptake leading to endolysosomal maturation in human macrophages. J Leukoc Biol. 109 (8), 257-273 (2021).
- Pasquinelli, V., et al. Expression of signaling lymphocytic activation molecule-associated protein interrupts IFN-γ production in human tuberculosis. J Immunol. 172 (2), 1177-1185 (2004).
- Pasquinelli, V., et al. Phosphorylation of mitogen-activated protein kinases contributes to interferon-γ production in response to Mycobacterium tuberculosis. J Infect Dis. 207 (2), 340-350 (2012).
- Pasquinelli, V., et al. IFN-γ production during active tuberculosis is regulated by mechanisms that involve IL-17, SLAM, and CREB. J Infect Dis. 199 (5), 661-665 (2009).
- Pellegrini, J. M., et al. Neutrophil autophagy during human active tuberculosis is modulated by SLAMF1. Autophagy. 17 (2), 423-426 (2021).
- Song, T., Dong, C., Xiong, S. Signaling lymphocyte-activation molecule SLAMF1 augments mycobacteria BCG-induced inflammatory response and facilitates bacterial clearance. Int J Med Microbiol. 305 (6), 572-580 (2015).
- Eble, J. A. Titration ELISA as a method to determine the dissociation constant of receptor-ligand interaction. J Vis Exp. (132), e57032(2018).
- Patching, S. G. Surface plasmon resonance spectroscopy for characterization of membrane protein-ligand interactions and its potential for drug discovery. Biochim Biophys Acta Biomembr. 1838 (1), 43-55 (2014).
- Draczkowski, P., Matosiuk, D., Jozwiak, K. Isothermal titration calorimetry in membrane protein research. J Pharm Biomed Anal. 87, 296-304 (2014).
- Smith, D. S., Eremin, S. A. Fluorescence polarization immunoassays and related methods for simple, high-throughput screening of small molecules. Anal Bioanal Chem. 391 (5), 1499-1507 (2008).
- García-Nafría, J., Tate, C. G. Cryo-electron microscopy: Moving beyond X-ray crystal structures for drug receptors and drug development. Annu Rev Pharmacol Toxicol. 60, 51-71 (2020).
- Asami, J., Shimizu, T. Structural and functional understanding of the toll-like receptors. Protein Sci. 30 (4), 761-772 (2021).
- Phạm, T. T. T., Rainey, J. K. On-cell nuclear magnetic resonance spectroscopy to probe cell surface interactions. Biochem Cell Biol. 99 (6), 683-692 (2021).
- El Deeb, S., et al. Microscale thermophoresis as a powerful growing analytical technique for the investigation of biomolecular interaction and the determination of binding parameters. Methods Appl Fluoresc. 10 (4), 045001(2022).
- El Khamlichi, C., et al. Bioluminescence resonance energy transfer as a method to study protein-protein interactions: Application to G protein-coupled receptor biology. Molecules. 24 (3), 505(2019).
- Schneider, P., Willen, L., Smulski, C. R. Tools and techniques to study ligand-receptor interactions and receptor activation by TNF superfamily members. Methods Enzymol. 545, 103-125 (2014).
- Park, A. M. W., Schirmer, P. S. H. Atomic force microscopy: A multifaceted tool to study membrane proteins and their interactions with ligands. Biochim Biophys Acta Biomembr. 1838 (1), 74-89 (2014).
- Zalejski, J., Sun, J., Sharma, A. Unravelling the mystery inside cells by using single-molecule fluorescence imaging. J Imaging. 9 (9), 183(2023).
- Zheng, S., Zou, M., Shao, Y., Wu, H., Wang, X. Two-dimensional measurements of receptor-ligand interactions. Front Mol Biosci. 10, 1075587(2023).
- Zlotnikov, I. D., Kudryashova, E. V. Computer simulation of the receptor-ligand interactions of mannose receptor CD206 in comparison with the lectin concanavalin A model. Biochemistry (Moscow). 87 (1), 54-69 (2022).
- Fu, Y., Zhao, J., Chen, Z. Insights into the molecular mechanisms of protein-ligand interactions by molecular docking and molecular dynamics simulation: A case of oligopeptide binding protein. Comput Math Methods Med. 2018, 7604567(2018).
- Farina, B., et al. A novel approach for studying receptor-ligand interactions on living cells' surface by using NUS/T1ρ-NMR methodologies combined with computational techniques: The RGDechi15D-αvβ5 integrin complex. Comput Struct Biotechnol J. 19, 3303-3318 (2021).
- Driessen, N. N., et al. Role of phosphatidylinositol mannosides in the interaction between mycobacteria and DC-SIGN. Infect Immun. 77 (10), 4538-4547 (2009).
- Bansal, K., et al. Src homology 3-interacting domain of Rv1917c of Mycobacterium tuberculosis induces selective maturation of human dendritic cells by regulating PI3K-MAPK-NF-κB signaling and drives Th2 immune responses. J Biol Chem. 285 (47), 36511-36522 (2010).
- Xu, Y., et al. PPE57 induces activation of macrophages and drives Th1-type immune responses through TLR2. J Mol Med. 93 (6), 645-662 (2015).
- Olesen, R., et al. DC-SIGN (CD209), pentraxin 3 and vitamin D receptor gene variants associate with pulmonary tuberculosis risk in West Africans. Genes Immun. 8, 456-467 (2007).
- Berger, S. B., et al. SLAM is a microbial sensor that regulates bacterial phagosome functions in macrophages. Nat Immunol. 11 (10), 920-927 (2010).
- Degos, C., et al. Omp25-dependent engagement of SLAMF1 by Brucella abortus in dendritic cells limits acute inflammation and favours bacterial persistence in vivo. Cell Microbiol. 22 (4), e13156(2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유