Method Article
فحوصات التألق لدراسة تفاعل المتفطرة السلية مع المستقبل المناعي SLAMF1
In This Article
Summary
توفر هذه الدراسة بروتوكولا لتقييم تفاعل المتفطرة السلية مع المستشعر الميكروبي SLAMF1. تم إجراء المقايسات على البلاعم البشرية المشتقة من الخلايا الوحيدة باستخدام قياس التدفق الخلوي والفحص المجهري الفلوري. الأدوات الموصوفة ذات صلة بدراسة التفاعلات بين مسببات الأمراض والمستقبلات المناعية.
Abstract
عادة ما يتضمن تقييم التفاعل المباشر بين مسببات الأمراض والمستقبلات المناعية تقنيات متطورة أو يعني استخدام السلالات المعدلة وراثيا والخلايا المعدلة وراثيا. هنا ، يتم وصف طريقة بديلة للكشف عن التفاعل الكيميائي الحيوي بين المستشعر الميكروبي للبلاعم SLAMF1 والمتفطرة السلية . تم تطوير طريقتين تقنيتين تستخدمان قياس التدفق الخلوي والفحص المجهري الفلوري. تم إنشاء مستخلصات بروتين الخلية الكلية من البلاعم البشرية ، ثم تحضنها بخلايا كاملة من مستضدات المتفطرة السلية (WCMtb) أو مستضدات السل (Mtb Ags) بين عشية وضحاها عند 4 درجات مئوية وأخيرا تم ربطها باستخدام معالجة الفورمالديهايد / الجلايسين / الإيثيلين جلايكول مكرر (سكسينيميديل سكسينات). تم الكشف عن تفاعل SLAMF1 مع WCMtb عن طريق قياس التدفق الخلوي باستخدام جسم مضاد مضاد ل SLAMF1 خاص ب PE. تم إجراء وجود تفاعل عن طريق الفحص المجهري الفلوري عن طريق ربط Mtb Ags الملون بالرودامين-PE بالشرائح المطلية ب poly-D-lysine ، والتي تم تحضينها بمستخلص البروتين الكلي من الضامة المشتقة من الخلايا الأحادية. بعد العلاج بالربط المتقاطع ، تم تصور SLAMF1 باستخدام الأجسام المضادة الأولية (المضادة ل SLAMF1) والثانوية (Alexa Fluor 488). قدمت المقايسات أداة كيميائية حيوية قوية لقياس تفاعلات مسببات الأمراض والمستقبلات المناعية ، والتغلب على الصعوبات المرتبطة بخطوط الخلايا المعدلة وراثيا وتجارب تعديل التعبير الجيني للبروتين.
Introduction
لا تزال المتفطرة السلية ، وهي العامل الممرض المسبب للسل الذي تم تحديده قبل 142 عاما ، تشكل تحديا عالميا ، حيث تصيب حاليا ما لا يقل عن ربع سكانالعالم1. ينتقل عن طريق الرذاذ المحمول جوا من الأشخاص المصابين ، يصل M. السل إلى البلاعم السنخية في الرئتين حيث يمكنه البقاء على قيد الحياة لفترات طويلة في حالة كامنة2،3. لم يتم تنشيط الاستجابة الضامة المحلية فحسب ، بل تم وصفها في السنوات الأخيرة أنه يمكن تجنيد الخلايا الوحيدة المحيطية في الجهاز التنفسي وتمايزها إلى بلاعم سنخية ، مما يولد استجابة أقوى ضد المتفطرة السلية من نظيرتها من أصل الجنين2،4.
البلاعم هي لاعبون أساسيون في المناعة الفطرية. عند ابتلاع M. tuberculosis ، تظهر البلاعم العديد من وظائف مبيدات الميكروبات ، مثل إفراز السيتوكينات المسببة للالتهابات ، واندماج البلعمة ، وتنشيط الخلايا المناعية الأخرى من أجل قتل M. tuberculosis2،3. ومع ذلك ، فإن الهيكل المعماري المعقد لهذا العامل الممرض يوفر مؤثرات (مثل البروتينات والدهون) قادرة على تنظيم عملية التمثيل الغذائي للبلاعم ووظائفها ، وبالتالي العملية الالتهابية3. يؤدي هذا التلاعب باستجابات البلاعم ، من خلال إفراز عوامل الفوعة أو استغلال العوامل المضيفة ، إلى استراتيجيات هروب مختلفة يمارسها المتفطرة السلية. تتضمن بعض آليات التهرب الرئيسية تحريض السيتوكينات المضادة للالتهابات ، وتثبيط نضوج البلعمة وتحمضها ، وتغيرات الإجهاد التأكسدي ، واضطراب الالتهام الذاتي ، وأوجه القصور أثناء معالجة المستضد وتقديمه3،5.
يعد التفاعل المنظم بإحكام بين البلاعم والمتفطرة السلية أمرا بالغ الأهمية لتطوير استجابة مناعية مناسبة. لذلك ، تعد دراسة هذه المشابك أمرا أساسيا لتحديد آليات الحماية المناعية أو المسببة للأمراض المناعية الناجمة عن الحديث المتبادل بين المضيف وممرض الأمراض ، بالإضافة إلى تحديد الأهداف العلاجية المحتملة. تتوسط العديد من المستقبلات في التعرف على المتفطرة السلية و / أو استيعابها ، بما في ذلك TLRs6،7،8 ، NLRs7،8 ، المستقبلات التكميلية6،8 ، مستقبلات الليكتين من النوعC 6،8 ، ومستقبلات الزبال6،8. تشير البيانات المتراكمة إلى أن كلا من PRRs المرتبطة بالسطح وداخل الخلايا تلعب دورا مهما أثناء العدوى ، حيث تتعرف على M . tuberculosis غير المضاد للنسب.
قام Zihad و Sifat et al. مؤخرا بمراجعة مشاركة PRRs في الاستجابات الناجمة عن مرض السل بواسطة الخلايا الفطرية9. على وجه الخصوص ، تورط معظم أفراد عائلة TLR في التفاعل مع M. tuberculosis ligands6،7. يتعرف Surface TLR2 على مستضدات البكتيريا الفطرية مثل البروتينات الدهنية الأسيلية ، والبروتين الدهني 19 كيلو دالتون ، والبروتين الدهني LprA ، والبروتين الدهني LprG ، ومستضد 30 كيلو دالتون ، ومستضد 38 كيلو دالتون ، و MymA ، وحمض البرولين البرولين والجلوتاميك (PPE) -57 ، و LAM ، و LM ، و PIM ، وبروتين الصدمة الحرارية 60 ، والبروتين المميز Rv1509 والبروتين المفرز ESAT-67. يتفاعل الغشاء TLR4 مع بروتينات الصدمة الحرارية ، ومستضد 38-kDa ، و RpfE ، و Rv0652 ، و Rv0335c ، و Rv2659c ، و Rv1738 ، و Rv2627c ، و Rv2628 ، و GrpE ، و HBHA. من ناحية أخرى ، تشمل روابط TLRs الداخلية (TLR 3 و 7 و 8 و 9) dsRNA و tRNA و ssRNA و RNA البلعمي و dsDNA ل M. tuberculosis. بالإضافة إلى ذلك ، يلعب TLR2 دورا نشطا في بدء الاستجابات المناعية عند العمل جنبا إلى جنب مع TLR1 و TLR6 و TLR4 و TLR96،7. NOD2 و NLRP3 هما أكثر NLRs السيتوبلازمية تميزا في مرض السل. على الرغم من أن روابطها المحددة لا تزال قيد الدراسة ، إلا أن هذه المستقبلات يتم تنشيطها بواسطة ثنائي الببتيد الموراميل أو ESAT-6 ، على التوالي7،8. تشارك مستقبلات الليكتين من النوع C بشكل كلاسيكي في الالتقام الخلوي السلي. بينما يعمل Dectin-2 كPRR مباشر ل ManLAM من M. السل جدار الخلية ، لم يتم اكتشاف ترابط Dectin-1 بعد8. يتعرف كل من Mincle و MCL على glycolipid trehalose-6،6′-dimycolate (TDM) ، ويسمى أيضا عامل الحبل7. يتفاعل DCAR مع مانوسيدات جليكوليبيدات الفطريات فوسفاتيديل-ميو-إينوزيتول (PIMs)7. يتعرف CR3 على LAM و PIM ، ويربط DC-Sign ManLAM ، ويتعرف MR على عدد من M . مكونات السل ، بما في ذلك ManLAM و PIM و LM و 38-kDa glycoprotein و 19-kDa والبروتينات المنوسلة الأخرى بينما لا يزال رابط DCIR مجهول الهوية.
تشمل CLRs القابلة للذوبان SP-A ، الذي يتعرف على ManLam و LM و 60-kDa glycoprotein و Glycoprotein Apa ؛ SP-D يتفاعل مع LAM و LM و PILAM ؛ و MBL ، المتخصصة في التعرف على ManLAM6،7. مستقبلات الزبال هي أيضا PRRs البلعمة. SR-A و MARCO لديهما TDM كرابط ، و SR-B1 يتعرف على ESAT-6 ، و CD36 يربط ManLAM و LM7،8. بالإضافة إلى ذلك ، يمكن أيضا دمج Dectin-1 و Mincle و MARCO مع TLR2 أو TLR4 لتشغيل الإشارات بعد اكتشاف M. tuberculosis PAMPs6،7. CD14 هو مستقبل سطحي لديه القدرة على استيعاب البكتيريا غير المتطرفة ويتعرف أيضا على بروتين الصدمة الحرارية Chaperonin 60.1. على وجه الخصوص ، يعمل CD14 كمستقبل مشترك جنبا إلى جنب مع MARCO و TLR26. AIM2 هو مستقبل العصارة الخلوية يمكنه استشعار ssDNA عند M. السل يهرب من البلعمة8. أخيرا ، AhR هو عامل نسخ منشط بالترابط يربط عامل الفوعة المصطبغ naphthoquinone phthiocol من M. tuberculosis6.
تم افتراض العديد من التفاعلات الموضحة أعلاه ولم يتم إثباتها بدقة. حتى الروابط الخاصة بمستقبلات معينة لا تزال غير معروفة ، مما يعزز الحاجة إلى فهم أفضل لمجال التعرف المناعي على السل . في هذا السياق ، تم وصف الجزيء التكلفة SLAMF1 (جزيء تنشيط الخلايا الليمفاوية الإرشادية) مؤخرا بأنه مستقبلات M. السل بواسطة Barbero et al.10. من خلال العمل ليس فقط كجزيء إشارة ولكن أيضا كمستشعر M. tuberculosis ، يلعب SLAMF1 دورا مثيرا للاهتمام بشكل خاص في مرض السل. يمكن أن يحفز SLAMF1 تنشيط الخلايا المناعية عن طريق تعديل الوظائف الوقائية مثل إنتاج IFN-γ بواسطة الخلايا التائية من خلال فسفرة Erk / CREB11،12،13 ، والالتهام الذاتي في العدلات14 ، والتصفية البكتيرية في الضامة15.
تمت دراسة تفاعلات المستقبلات والترابط على مر السنين باستخدام تقنيات مثل ELISA ، رنين البلازمون السطحي (SPR) ، كالوريمتر المعايرة بالتحليل الحجمي متساوي الحرارة (ITC) ، الاستقطاب الفلوري (FP) ، علم البلورات بالأشعة السينية ، التحليل الطيفي بالرنين المغناطيسي النووي (NMR) ، الرحلان الحراري المجهري المجهري (MST) ، نقل طاقة الرنين (على سبيل المثال ، BRET أو FRET) المجهر متحد البؤر ، المجهر الإلكتروني ، المجهر الإلكتروني بالتبريد (Cryo-EM) والفحص المجهري للقوة الذرية (AFM) 16،17 ، 18،19،20،21،22،23،24،25،26،27،28. تشير بعض هذه الأساليب إلى استخدام جينات المراسل ، أو البروتينات المؤتلفة المسماة أو الجزيئات الوهمية ، أو الضربة القاضية ، أو نماذج الخروج المبالغ فيها ، أو نماذج الإفراط في التعبير. بدلا من ذلك ، يمكن للأدوات الحسابية التنبؤ بتفاعلات المستقبلات والترابط ومواقع الربط وغالبا ما تستخدم جنبا إلى جنب مع الأساليب البيولوجية لاكتساب فهم شامل للتفاعلات29،30،31. هنا ، يتم وصف بديلين للكشف عن التفاعل الكيميائي الحيوي وأيضا قسم حول كيفية تسمية البكتيريا بالفلورسنت. يتم تقديم بروتوكول يسمح بدراسة تفاعلات المستقبلات ومسببات الأمراض في المختبر ، ولا سيما تقييم SLAMF1-M. مشاركة السل من خلال قياس التدفق الخلوي والفحص المجهري الفلوري ، وهما تقنيتان متاحتان عادة وتستخدمان بشكل روتيني.
Protocol
تم تنفيذ جميع الإجراءات التي تنطوي على البلاعم البشرية المشتقة من الخلايا الوحيدة وفقا لإعلان هلسنكي (2013) وبالاتفاق مع لجنة الأخلاقيات التابعة لمكتب الأمم المتحدة لبناء السلام (COENOBA). تم الحصول على موافقة خطية مستنيرة قبل جمع العينات. كان توزيع مجموعة الذكور / الإناث 13/6 ، وكان متوسط العمر 32 عاما ، مع نطاق رباعي (IQR) من 18-75 سنة. تم تعريف وجود أمراض سابقة أو أمراض مصاحبة أو تشخيص إيجابي للسل على أنه معايير استبعاد. تفاصيل الكواشف والمعدات مدرجة في جدول المواد.
1. ثقافة البلاعم المشتقة من الخلايا الأحادية والتحفيز
- سحب الدم
- الحصول على 60 مل من الدم من المتبرعين الأصحاء عن طريق بزل الوريد في حقنة هيبارينية.
ملاحظة: يجب إجراء استخراج الدم بواسطة خبير كيمياء حيوية أو فني فصد الفصد. - تخلص من الإبرة في حاوية التخلص من الأدوات الحادة وأي مادة كانت على اتصال بدم المتبرعين في حاوية النفايات المرضية.
- الحصول على 60 مل من الدم من المتبرعين الأصحاء عن طريق بزل الوريد في حقنة هيبارينية.
- عزل الخلايا الأحادية وتوليد البلاعم
- انقل الدم بعناية إلى أنابيب سعة 50 مل وقم بتخفيفه بمقدار النصف بمحلول ملحي.
- إجراء الطرد المركزي على وسائط متدرجة الكثافة للحصول على خلايا الدم المحيطية أحادية النواة (PBMCs).
- اجمع PBMCs من الهالة البيضاء.
- قم بإجراء غسلتين بمحلول ملحي عند 400 × جم لمدة 10 دقائق وغسل نهائي عند 200 × جم لمدة 15 دقيقة عند 20 درجة مئوية للتخلص من الصفائح الدموية.
- حدد عدد PBMCs في غرفة عد الخلايا وقم بإجراء الاختيار المغناطيسي الإيجابي CD14 باستخدام حبات CD14.
ملاحظة: أثناء الاختيار المغناطيسي ، اتبع تعليمات الشركة المصنعة بعناية. بالإضافة إلى ذلك ، يمكن للمرء التحقق من نقاء الخلايا الوحيدة المعزولة باستخدام قياس التدفق الخلوي. - أعد تعليق الخلايا المعزولة في RPMI 1640 وحدد عدد الخلايا الوحيدة في غرفة عد الخلايا.
- بذرة 500 ميكرولتر من 1 × 106 / مل CD14 إيجابية الخلايا الوحيدة المختارة لكل بئر في صفيحة زراعة الخلايا المكونة من 24 بئرا في غياب المصل لتعزيز الالتصاق.
- بعد ساعتين ، قم بإزالة الخلايا غير الملتصقة عن طريق غسلها باستخدام RPMI 1640 الدافئ مسبقا.
- للتمييز بين البلاعم ، قم بزراعة الخلايا الوحيدة الملتصقة لمدة 16-18 ساعة إضافية (بين عشية وضحاها) في 1 مل من الوسائط الكاملة (وسط RPMI 1640 مكمل ب L-glutamine ، و 10٪ مصل بقري جنيني (FBS) ، و 100 U / مل من البنسلين ، و 100 ميكروغرام / مل من الستربتومايسين).
- في اليوم التالي ، قم بتغيير وسيط الثقافة. قم بإزالة الوسط ، واغسله ب 1 مل من 1x PBS ، وأضف 1 مل من الوسائط الكاملة.
- تحفيز البلاعم مع M. السل صوتنة (M. مستضدات السل (Ags)) لمدة 24 ساعة. استخدم 10 ميكرولتر من M. tuberculosis Ags (10 ميكرولتر = 1 × 106 بكتيريا) لكل 1 × 106 ضامة مشتقة من الخلايا الوحيدة.
ملاحظة: 10 ميكرولتر من M. tuberculosis Ags (Mtb Ags) = 1 × 106 بكتيريا ، مقاسة كميا بواسطة OD 600نانومتر في مقياس الطيف الضوئي مع الأخذ في الاعتبار OD 1 ك 1 × 108 بكتيريا / مل. استخدم خزانات السلامة البيولوجية BSL2 وحاضنة عند 37 درجة مئوية في جو به 5٪ ثاني أكسيد الكربون2 لجميع خطوات الاستزراع.
- تأكيد تعبير SLAMF1
- اجمع البلاعم من بئر واحد. ضع لوحة الثقافة على سطح بارد. افصل الخلايا باستخدام حركات لأعلى ولأسفل عن طريق إضافة 1 مل من FACS البارد (1x PBS + 2٪ FBS) مرتين متتاليتين. استخدم أنبوب قياس الخلايا المستدير السفلي للتجميع.
- الطرد المركزي للخلايا عند 500 × جم لمدة 5 دقائق عند 4 درجات مئوية. تخلص من المادة الطافية عن طريق إلقائها.
- قم بتلطيخ الخلايا بجسم مضاد مضاد للإنسان SLAMF1 مقترن بالفلوروفور لمدة 30 دقيقة عند 4 درجات مئوية في الظلام. دوامة بعد إضافة 1.25 ميكرولتر من الجسم المضاد.
- اغسل الخلايا للتخلص من فائض الأجسام المضادة باستخدام FACS ، وأعد تعليق الحبيبات في FACS ، واحصل على العينة باستخدام مقياس التدفق الخلوي.
ملاحظة: 1.25 ميكرولتر من الجسم المضاد ل SLAMF1 يتوافق مع 0.0625 ميكروغرام المستخدم لتسمية 0.5 × 106 ضامة. ومع ذلك ، يوصى بشدة بمعايرة الجسم المضاد ، بالإضافة إلى إجراء النمط الإسوائي المقابل أو التحكم في التألق ناقص واحد (FMO).
2. تحضير مستخلص بروتين الخلية الكلي
- تحضير عازلة التحلل
- قم بإعداد المخزن المؤقت لمقايسة الترسيب المناعي الراديوي (RIPA) باستخدام كلوريد الصوديوم 150 ملي مولار ، تريس 10 ملي مولار ، EDTA 5 ملي مولار ، SDS 1٪ ، تريتون X-100 1٪ ومنقوص الأكسجين الصوديوم 1٪.
- مكمل RIPA المؤقت مع 1 ملي مولار فينيل ميثيل سلفونيل فلوريد (PMSF) ومثبطات البروتياز مثل البيبستاتين أ والليوببتين.
- جمع الخلايا وعزل البروتين
- تخلص من RPMI الكامل من آبار الصفائح باستخدام ماصة P1000 وحصد البلاعم عن طريق سحب العينات لأعلى ولأسفل باستخدام 1x PBS البارد.
- نقل الخلايا إلى أنابيب الطرد المركزي الدقيقة سعة 1.5 مل. اجمع بئر واحد لكل أنبوب صغير.
- جهاز طرد مركزي عند 500 × جم لمدة 5 دقائق عند 4 درجات مئوية. تخلص من المادة الطافية.
- أضف 1 مل من PBS البارد وكرر الخطوتين 2.2.2 و 2.2.3 لجمع الخلايا في نفس أنبوب الطرد المركزي الدقيق.
- أعد تعليق كريات الخلية في 100 ميكرولتر من 1x PBS وتجمع أربعة أنابيب. كرر الخطوة 2.2.3. سيحتوي كل أنبوب على 2 × 106 ضامة.
- أضف 100 ميكرولتر من المخزن المؤقت RIPA المكملة واحتضن التعليق على الجليد لمدة ساعة واحدة ، مع الدوران كل 10 دقائق.
- جهاز طرد مركزي عند 14,000 × جم لمدة 15 دقيقة. اجمع المادة الطافية وحفظها حتى تستخدم عند -20 درجة مئوية.
3. M. السل -SLAMF1 التفاعل عن طريق قياس التدفق الخلوي
- البروتينات والبكتيريا المتقاطعة
- احتضان 1 × 106 خلايا مفطيرة السل المعطلة الكاملة (WCMtb ، M. tuberculosis المعطلة عن طريق تشعيع جاما) مع مستخلص البروتين من 1 × 106 بلاعم (50 ميكرولتر) بين عشية وضحاها عند 4 درجات مئوية في حامل أنبوب دقيق دوار.
ملاحظة: 10 ميكرولتر من WCMtb = 1 × 106 بكتيريا ، مقسومة كميا بواسطة OD 600نانومتر في مقياس الطيف الضوئي مع الأخذ في الاعتبار OD 1 مثل 1 × 108 بكتيريا / مل. - في اليوم التالي ، أضف 500 ميكرولتر من 1٪ فورمالديهايد مخفف في 1x PBS. احتضان لمدة 15 دقيقة تحت التحريك (شاكر) في درجة حرارة الغرفة (RT).
- أضف 25 ميكرولتر من 0.125 م جلايسين مخفف في الماء. احتضان لمدة 5 دقائق تحت التحريك (شاكر) في RT.
- اغسل مرتين ب 1 مل من 1x PBS عند 14,000 × جم لمدة 5 دقائق. تخلص من المادة الطافية بين خطوات الغسيل.
- أعد تعليق الحبيبات واحتضان المعلق في 500 ميكرولتر من 2 ملي مولار من الإيثيلين جلايكول مكرر (السكسينيميديل سكسينات) (EGS) المخفف في خليط 1: 1 من حمض الخليك الجليدي: الماء لمدة 1 ساعة في RT.
ملاحظة: يوصى بشدة بإعداد الكواشف في وقت الاستخدام. لتحضير EGS ، يجب خلط حمض الخليك الجليدي والماء بنسب متساوية وتسخينه إلى 70 درجة مئوية. إذا لم يكن المحلول ساخنا ، فلن يتم تعليق EGS تماما.
- احتضان 1 × 106 خلايا مفطيرة السل المعطلة الكاملة (WCMtb ، M. tuberculosis المعطلة عن طريق تشعيع جاما) مع مستخلص البروتين من 1 × 106 بلاعم (50 ميكرولتر) بين عشية وضحاها عند 4 درجات مئوية في حامل أنبوب دقيق دوار.
- تلطيخ SLAMF1
- كرر الخطوة 3.1.4 باستخدام 500 ميكرولتر من 1x PBS في الغسيل الأول و 1 مل في الثانية.
- قم بتلطيخ مركب البروتين والبكتيريا لمدة 30 دقيقة عند 4 درجات مئوية في الظلام باستخدام جسم مضاد مضاد للإنسان SLAMF1 (كما في الخطوة 1.3.3) عن طريق إضافة الجسم المضاد إلى الأنبوب الدقيق والدوامة. استخدم كمية الجسم المضاد المناسبة ل 1 × 106 خلايا (2.5 ميكرولتر أو 0.125 ميكروغرام).
- اغسل الخلايا للتخلص من الأجسام المضادة الزائدة باستخدام FACS ، وأعد تعليق الحبيبات في FACS ، واحصل على العينة في مقياس التدفق الخلوي (كما في الخطوة 1.3.4).
ملاحظة: قم بإجراء التحكم في النمط المتماثل أو FMO المقابل.
4. وضع العلامات على مستضدات السل
- أعد تعليق الرودامين ب في الإيثانول بتركيز مخزون 5 مجم / مل (1000x). يحفظ في درجة حرارة -20 درجة مئوية حتى الاستخدام.
- أضف 1 ميكرولتر من الرودامين ب لكل 100 ميكرولتر من M. tuberculosis Ags في أنبوب طرد مركزي دقيق سعة 1.5 مل.
- احتضان لمدة 45 دقيقة في RT تحت التحريض المستمر (الدوامة).
- اغسل 3 مرات على الأقل عند 14,000 × جم لمدة 5 دقائق عند 24 درجة مئوية باستخدام 1 مل من 1x PBS حتى يصبح المادة الطافية شفافة. ستبدو الحبيبات (Mtb-R Ags) وردية فاتحة.
- أعد تعليق Mtb-R Ags في 100 ميكرولتر من 1x PBS لاستعادة وحدة التخزين الأولية.
ملاحظة: يوصى بالعمل في ظل ظروف معقمة. تأكد من إجراء التلوين مباشرة قبل إجراء التجارب.
5. M. السل - تفاعل SLAMF1 عن طريق الفحص المجهري الفلوري
- الربط المتقاطع بين البكتيريا والبروتين
- أدخل أغطية مستديرة مقاس 12 مم في ألواح استزراع ذات 24 بئرا (غطاء واحد لكل بئر) باستخدام ملاقط جراحية مستديرة الأنف.
ملاحظة: نظف الغطاء جيدا باستخدام 70٪ من الإيثانول. إذا رغبت في ذلك ، يمكن تعقيمها أو تعقيمها تحت ضوء الأشعة فوق البنفسجية لمدة 30 دقيقة. - احتضان الغطاء ب 400 ميكرولتر من 10 ميكروغرام / مل Poly-D-Lysine طوال الليل عند 4 درجات مئوية. غطي الطبق بورق الألمنيوم لحمايته من الضوء.
- في اليوم التالي ، أخرج الطبق من الثلاجة واغسل الغطاء مرتين ب 1 مل من الماء.
- دع الغطاء يجف.
- خفف 20 ميكرولتر (2 × 106) من Mtb-R Ags في 180 ميكرولتر من 1x PBS. 200 ميكرولتر الأخيرة كافية لتغطية الغطاء بالكامل.
- احتضان الغطاء باستخدام Mtb-R Ags لمدة ساعة واحدة عند 37 درجة مئوية في حاضنة خلية.
- تخلص من السائل المتبقي واغسله مرتين ب 1 مل من 1x PBS.
ملاحظة: في هذه الخطوة ، يمكن التحقق من الالتصاق الصحيح ل Mtb-R بالغطاء باستخدام مجهر مضان باستخدام المرشحات المقابلة للقناة الحمراء. - أضف 400 ميكرولتر من المخزن المؤقت للحجب (10٪ FBS في 1x PBS) لمدة 30 دقيقة عند RT في التحريض (شاكر).
- يغسل مرتين باستخدام 400 ميكرولتر من المخزن المؤقت للحظر.
- احتضان مع 100 ميكرولتر من مستخلص البروتين المخفف في 300 ميكرولتر من 1x PBS لمدة ساعتين في RT في التحريض (شاكر).
- أضف 400 ميكرولتر من 1٪ فورمالديهايد مخفف في 1x PBS. احتضان لمدة 15 دقيقة تحت التحريك (شاكر) في RT.
- أضف 500 ميكرولتر من الجلايسين 0.125 م المخفف في الماء. احتضان لمدة 5 دقائق تحت التحريك (شاكر) في RT.
- يغسل مرتين باستخدام 1 مل من 1x PBS.
- أضف 400 ميكرولتر من 2 ملي مولار EGS لمدة ساعة واحدة في RT في التحريض (شاكر).
- كرر الخطوة 5.1.13
ملاحظة: يوصى بشدة بإعداد الكواشف في وقت الاستخدام.
- أدخل أغطية مستديرة مقاس 12 مم في ألواح استزراع ذات 24 بئرا (غطاء واحد لكل بئر) باستخدام ملاقط جراحية مستديرة الأنف.
- تلطيخ SLAMF1
- لف غطاء لوحة الثقافة بغشاء البارافين.
- أضف قطرة من 60 ميكرولتر من الجسم المضاد الأولي المضاد ل SLAMF1 الذي تم معايرته مسبقا (تخفيف 1:75) على الغطاء المغطى بغشاء البارافين.
- قم بإزالة الغطاء بعناية من اللوحة باستخدام ملاقط وإبر جراحية منحنية ذات طرف رفيع.
ملاحظة: لتسهيل إزالة الغطاء ، يمكن ثني الإبرة بزاوية 45 درجة تقريبا. - اقلب الغطاء فوق القطرة التي تحتوي على الجسم المضاد. احتضن لمدة 30 دقيقة في RT في الظلام.
- ارفع الغطاء واغسله مرتين باستخدام المخزن المؤقت المانعب.
- اقلب الغطاء فوق قطرة جديدة تحتوي على الجسم المضاد الثانوي (تخفيف 1: 200). احتضن لمدة 30 دقيقة في RT في الظلام.
- كرر الخطوة 5.2.5.
- قم بإزالة السائل الزائد وقم بتركيب الغطاء على قطرة من سائل التثبيت الموضوعة على شريحة زجاجية.
- راقب تحت المجهر الفلوري باستخدام مرشحات مناسبة.
ملاحظة: يوصى بالعمل في ظل ظروف معقمة. تمييع الأجسام المضادة في المخزن المؤقت المانعب. تعامل مع الغطاء بعناية لتجنب الخدوش التي قد تعيق المراقبة تحت المجهر. يوصى بشدة باستخدام سائل متصاعد مناسب للتألق.
النتائج
في هذا العمل ، يتم توفير بروتوكول يسمح بتقييم تفاعل المتفطرة السلية مع المستقبل المناعي SLAMF1 في البلاعم البشرية (الشكل 1). تحقيقا لهذه الغاية ، تم الحصول على الدم المحيطي من متبرعين أصحاء. بعد ذلك ، تم فصل PBMCs عن طريق الطرد المركزي فوق وسائط تدرج الكثافة ، وتم عزل الخلايا الوحيدة عن طريق الانتقاء الإيجابي المغناطيسي (≥نقاء 95٪ ، الشكل 2 أ ، ب). تم لصق الخلايا الوحيدة المعزولة بألواح الاستزراع البلاستيكية لمدة ساعتين للحصول على البلاعم المشتقة من الخلايا الأحادية ثم زراعتها على. بعد ذلك ، تم تحفيز البلاعم باستخدام M. tuberculosis (Mtb Ags) للحث على التعبير السطحي SLAMF1 كما تم الإبلاغ عنه قبل10 ، وتم تأكيد مستويات SLAMF1 السطحية عن طريق قياس التدفق الخلوي (الشكل 2C). تم تحلل البلاعم أخيرا باستخدام المخزن المؤقت لتحلل RIPA جنبا إلى جنب مع الدوامة والحضانة على الجليد لتسهيل تحلل الخلايا. تم استخدام مستخلص البروتين الكلي المتولد في فحوصات التفاعل.
في المجموعة الأولى من الإجراءات التجريبية ، تم استخدام قياس التدفق الخلوي لدراسة تفاعل SLAMF1 مع الخلايا الكاملة من M. tuberculosis (WCMtb) (الشكل 3). أولا ، تم تعزيز التفاعل الجسدي بين SLAMF1 (المحتوى الموجود في مستخلص البروتين) و WCMtb عن طريق احتضانهما معا في دوران مستمر عند 4 درجات مئوية. ثم تم إجراء علاج الربط المتقاطع ، وباستخدام جسم مضاد محدد مضاد ل SLAMF1 ، تم الكشف عن مستقبل SLAMF1 المرتبط ب WCMtb. في هذا الفحص ، تم استخدام WCMtb وحده لضبط الفولتية المقابلة لحجم ودقة M. tuberculosis في مقياس التدفق الخلوي ، والذي كان السكان المعنيين باكتشاف ارتباط SLAMF1.
في النهج التجريبي الثاني ، تم استخدام الفحص المجهري الفلوري للكشف عن SLAMF1-M. تفاعل السل (الشكل 4). هذا الاختبار ، الذي تم فيه استخدام M. tuberculosis (Mtb Ags) ، يكمل الاختبار السابق. تم استخدام Mtb Ags الملون بالرودامين B (Mtb-R Ags) لتسهيل الكشف عن التألق في القناة / المرشح المقابل لفلوروكروم PE. تم إرفاق Mtb-R Ags بأغطية مطلية ب poly-D-lysine ، وتم فحص التلوين الناجح عن طريق الملاحظة المجهرية (الشكل 4 أ). بعد ذلك ، تم تحضين الشرائح المطلية ب Mtb-R Ags بمستخلصات البروتين التي تحتوي على SLAMF1. بعد العلاج بالربط المتقاطع ، تم اكتشاف SLAMF1 باستخدام جسم مضاد أولي محدد مضاد ل SLAMF1 متبوعا بجسم مضاد ثانوي مقترن بفلوروكروم متوافق ليتم ملاحظته بشكل مشترك مع PE. بعد الحصول على صور مجهرية فلورية فردية في قناتين Mtb-R Ags و SLAMF1 ، تم تأكيد التفاعل عن طريق دمج الصور (الشكل 4 ب).
أظهر أداء هذه الأساليب وجود تفاعل بين SLAMF1 و M. tuberculosis. تم الكشف عن الحديث المتبادل ل SLAMF1 مع كل من البكتيريا الكاملة والصوتنة ، مما أعطى قوة للفرضية التي تشير إلى SLAMF1 كمستقبل فطري جديد للبلاعم البشرية ل M. tuberculosis10.

الشكل 1: سير العمل للكشف عن تفاعل السل SLAMF1-M. تم الحصول على الدم المحيطي من متبرعين أصحاء عن طريق بزل الوريد والطرد المركزي فوق وسط متدرج الكثافة لعزل خلايا الدم المحيطية أحادية النواة (PBMCs). بعد تحديد عدد الخلايا ، تعرضت PBMCs لانتقاء مغناطيسي إيجابي لتنقية الخلايا الوحيدة CD14pos. ثم تم لصق الخلايا الوحيدة بألواح الاستزراع لمدة ساعتين في غياب مصل الأبقار الجنينية ثم زراعتها بين عشية وضحاها في RPMI مكمل (خطوة الراحة) للحصول على البلاعم المشتقة من الخلايا الأحادية. بعد ذلك ، تم تحفيز البلاعم باستخدام M. السل المونيكيت (Mtb Ags) لمدة 24 ساعة للحث على التعبير السطحي SLAMF1. تم اختبار مستويات SLAMF1 عن طريق قياس التدفق الخلوي باستخدام جسم مضاد بشري محدد مضاد ل SLAMF1 في جزء صغير من مجموعة البلاعم. تم استخدام البلاعم المتبقية للحصول على مستخلصات البروتين الكلي. تم إجراء تحلل الخلايا عن طريق الجمع بين الدوامة والحضانات على الجليد في مخزن مؤقت للتحلل. أخيرا ، تم تقييم التفاعل بين SLAMF1 و M. tuberculosis عن طريق قياس التدفق الخلوي والفحص المجهري الفلوري بعد الربط المتبادل لبروتينات البلاعم مع Mtb Ags أو الخلايا الكاملة من M. tuberculosis (WCMtb). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: الضوابط التجريبية والتقنية. (أ) تم عزل الخلايا الوحيدة CD14pos من PBMCs عن طريق الانتقاء المغناطيسي الإيجابي. تم تقييم أجزاء الخلايا الإيجابية (الوحيدة ، الزرقاء) والسالبة (الحمراء) الناتجة عن طريق قياس التدفق الخلوي (SSC-A مقابل. FSC-A) لتأكيد الاختيار الناجح. (ب) تم تأكيد نقاء الجزء الموجب عن طريق قياس التدفق الخلوي الذي يحلل حبيبات الخلية وحجمها (SSC-A مقابل. FSC-A). (ج) تم اختيار البلاعم المشتقة من الخلايا الأحادية بواسطة SSC-A مقابل. FSC-A ثم مسورة لاستبعاد الزوجي من خلال استراتيجية فردية مزدوجة (FSC-A مقابل. FSC-H متبوعا ب SSC-A مقابل. SSC-H). تم تقييم التعبير السطحي SLAMF1 في الخلايا المفردة. في جميع الحالات (A-C) ، يتم عرض المخططات التمثيلية أو الرسوم البيانية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
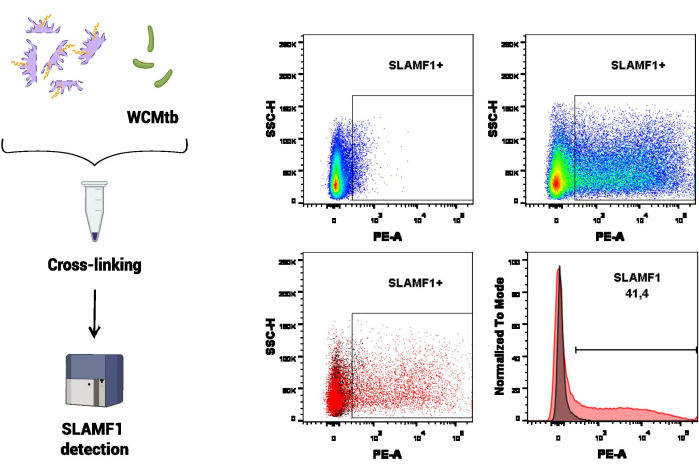
الشكل 3: SLAMF1-M. تفاعل السل عن طريق قياس التدفق الخلوي. تم إجراء الربط المتبادل بين بروتينات البلاعم والخلايا الكاملة من المتفطرة السلية (WCMtb) عن طريق المعالجة بالفورمالديهايد / الجلايسين / الإيثيلين جلايكول مكرر ، كما هو موضح في قسم البروتوكول. بعد ذلك ، تم تقييم التفاعل عن طريق قياس التدفق الخلوي عن طريق اكتشاف إشارة SLAMF1 (PE) موجبة بعد اختيار السكان محل الاهتمام (SSC-A مقابل. FSC-A). تظهر اللوحة العلوية إشارة إيجابية ل SLAMF1 ، حيث تقارن التحكم في التألق ناقص واحد (FMO) (يسار) مع التلوين الإيجابي (يمين). تظهر اللوحة المنخفضة التراكب (اليسار ، المخطط النقطي واليمين ، الرسم البياني) بين إشارة SLAMF1 والتحكم في FMO. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: SLAMF1-M. تفاعل السل عن طريق المجهر الفلوري. (أ) تم تلطيخ Mtb Ags بالرودامين B (Mtb-R Ags) وإرفاقها بغطاء دائري. تم تأكيد الالتصاق الصحيح والمضان ل Mtb-R Ags بواسطة المجهر الفلوري باستخدام المرشحات المقابلة للقناة الحمراء. (ب) تم إجراء الربط المتبادل بين بروتينات البلاعم و Mtb-R Ags عن طريق المعالجة بالفورمالديهايد / الجلايسين / الإيثيلين جلايكول مكرر كما هو موضح في قسم البروتوكول عن طريق إضافة مستخلص البروتين فوق Mtb-R Ags المرفق. تم تقييم التفاعل عن طريق الفحص المجهري الفلوري باستخدام جسم مضاد بشري مضاد ل SLAMF1 متبوعا بجسم مضاد ثانوي يحمل علامة Alexa Fluor 488. تظهر الصور المجهرية العلوية إشارات إيجابية SLAMF1 (يسار ، أخضر) و Mtb-R Ags (يمين ، أحمر). يدل الميكروغراف المنخفض على التفاعل باللون الأصفر (دمج كلتا القناتين). تتوافق أشرطة المقياس مع 10 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
Discussion
توفر هذه الدراسة دليلا مفيدا لدراسة التفاعل الكيميائي الحيوي بين المتفطرة السلية وأجهزة الاستشعار الميكروبية المعبر عنها في البلاعم البشرية ، وهي نوع خلوي رئيسي يشارك في استجابة المضيف أثناء السل. ستكون البروتوكولات المقدمة ذات صلة بفك تشفير الجزيئات التي تلعب دورا في دخول المتفطرة السلية إلى الخلايا البلعمة.
يعد توصيف التفاعلات الجزيئية الحيوية ، مثل تلك الموجودة بين مسببات الأمراض والمستقبلات المناعية ، أمرا بالغ الأهمية لفهم كل من آليات الحماية المناعية واستراتيجيات التهرب التي أثارها مرض السل. في كثير من الأحيان ، يمكن أن يكون إظهار التفاعل المباشر للمستقبل مع الترابط البكتيري معقدا وقد يتطلب تقنيات أو أنظمة متطورة تفتقر إلى التنوع. درس دريسن وآخرون دور مانوسيدات الفوسفاتيديلينوسيتول في التفاعل بين البكتيريا الفطرية و DC-SIGN باستخدام سلالات ناقصة طافرة من M. bovis BCG32. على الرغم من أنهم تمكنوا من دراسة هذه التفاعلات ، إلا أن المؤلفين لم يجدوا اختلافات في السلالات الطافرة وناقشوا أن تكوين البكتيريا الطافرة التي تظهر انخفاضا في الارتباط سيكون مهمة هائلة32. قام مؤلفون آخرون بعمل ممتاز وشاق لإثبات التفاعل بين TLR2 وبعض بروتينات PE / PPE ل M. tuberculosis33،34. تطلبت هذه الدراسات استخدام الفئران بالضربة القاضية للمستقبلات ، وتعداء الخلايا ، وتنقية البروتينات المذكورة أعلاه أو مجالات بروتين معينة33،34. بالإضافة إلى ذلك ، غالبا ما يتم الاستدلال على وظيفة المستقبلات ، ولكن لا يتم إثبات التفاعل بشكل موثوق. مثال على ذلك هو المستقبل القابل للذوبان PTX3 ، والذي تم العثور على الأنماط الفردانية المرتبطة بنتائج المرض ، ولكن تفاعله المحدد مع M. tuberculosis لم تتم دراسته بدقة35. فيما يتعلق بأوجه القصور هذه ، تسمح طريقتنا بتقييم تفاعل المستقبل المستهدف قيد الدراسة مع المتفطرة السلية بطريقة بسيطة وبتقنيات سهلة التفسير.
فيما يتعلق بالنقاط السابقة ، وخاصة بالنسبة ل SLAMF1 ، تم تقييم التفاعلات مع OmpC و OmpF من بكتريا قولونية36 و Omp25 من B. abortus37 تم تقييمها مسبقا. استخدم Degos et al.37 خلايا COS-7 التي تم نقلها باستخدام بلازميد يشفر فقط المجال خارج الخلية ل SLAMF1 ثم تنقية SLAMF1 وتحليل التفاعل مع Omp25 بواسطة اللطخة الغربية. كما أجروا تجارب باستخدام الفئران SLAMF1 - / - والنوع البري B. إجهاض أو طفرة معيبة Omp25. بيرغر وآخرون. أظهر 36 عملا أيضا دليلا مقنعا على التفاعل المباشر بين SLAMF1 و E. coli Omp و S. typhimurium SseB-. استخدموا طرقا مختلفة ، بما في ذلك الفئران SLAMF1 - / - ، والضامة RAW264.7 التي تشفر بنية SLAMF1mCherry ، وكذلك مقايسة التضخيم باستخدام خلايا Jurkat T المنقولة SLAMF1. طوروا مقايسة تضخيم إشارة حساسة باستخدام مراسل لوسيفيراز باستخدام 1 × 108بكتريا قولونية. في هذا الصدد ، تتمثل إحدى نقاط قوة فحوصات التفاعل الكيميائي الحيوي المقدمة في هذا التقرير في أن التفاعل تم العثور عليه بالفعل باستخدام خلايا من النوع البري ونفس نسبة الخلايا: البكتيريا المستخدمة في التقييمات الوظيفية في عمل سابق10 ، دون الحاجة إلى الإفراط في التعبير عن تعبير SLAMF1 أو إلغائه.
يستلزم البروتوكول المقدم بعض الخطوات الحاسمة. أحدها هو تأكيد تعبير SLAMF1 في البلاعم البشرية قبل إجراء فحوصات التفاعل. هذا أمر بالغ الأهمية لتجنب الحصول على نتيجة سلبية خاطئة ، والتي قد تكون في الواقع بسبب نقص التعبير عن المستقبلات. هنا ، تم فحص مستويات SLAMF1 باستخدام قياس التدفق الخلوي لأنها تقنية سريعة تسمح بالحصول على هذه البيانات في أقل من ساعتين. ومع ذلك ، يمكن استخدام تقنيات أخرى ، مثل الفحص المجهري أو اللطخة الغربية. لا نوصي بمنهجيات مثل تفاعل البوليميراز المتسلسل في الوقت الفعلي التي تحدد مستويات الرنا المرسال عندما يكون الهدف النهائي هو دراسة مستقبل على مستوى البروتين. خطوة أساسية أخرى هي مرحلة الربط المتبادل. يسعى استخدام الروابط المتشابكة إلى استقرار تفاعلات البروتين والبروتين. أثناء الفحص القائم على قياس التدفق الخلوي ، لم نتمكن من اكتشاف إشارة ل SLAMF1 دون تطبيق خطوة الربط المتبادل. في حالة نهج الفحص المجهري ، لاحظنا التفاعل دون استخدام علاج الربط المتقاطع ولكن بحساسية منخفضة للغاية. لذلك ، يوصى بشدة بخطوة الربط المتبادل في جميع الحالات.
يوفر البروتوكول الموصوف دليلا على التفاعل بين مستضدات السل SLAMF1 و M. السل التي يمكن الوصول إليها على سطح العامل الممرض ، مما يساعد على إثبات أن SLAMF1 يتعرف على التوقيع الجزيئي الموجود في M. tuberculosis. ومع ذلك ، يظهر هذا النموذج بعض القيود. نقطة الضعف هي أن هذا البروتوكول لا يسمح لنا بتحديد أي مستضد محدد من المتفطرة السلية هو الذي يتفاعل مع SLAMF1. على الرغم من ذلك ، يمكن تعديل البروتوكول لتحقيق هذه الغاية ، على سبيل المثال ، باستخدام مستضدات منقاة من البكتيريا. قيد آخر هو الحاجة إلى معرفة الحافز الذي يحفز التعبير عن SLAMF1 في الضامة. قد يعني هذا حدوث مضاعفات إذا لم يتم التعبير عن المستقبل المختار في الظروف القاعدية أو التي يكون نمط التعبير عنها غير معروف. أخيرا ، لا تميز هذه الأساليب ما إذا كان SLAMF1 يتطلب جزيئات أخرى للتفاعل مع المتفطرة السلية. في هذه الحالة ، يمكن إجراء فحوصات الترسيب المناعي ، أو يمكن استخدام المزيد من الأجسام المضادة في المخطط المنهجي.
يمكن تكييف المنهجية المقترحة في هذا التقرير بسهولة مع دراسة المستقبلات المناعية الأخرى ، أو نفس المستقبل في أنواع الخلايا الأخرى التي يتم التعبير عنها ، أو لتقييم التفاعل مع البكتيريا أو سلالات البكتيريا الفطرية المختلفة. علاوة على ذلك ، هنا ، يتم توفير بروتوكول قصير وبسيط لصبغة M . tuberculosis الفلورية ، وهي علامة يمكن تطبيقها على البكتيريا الأخرى وحتى السلالات الحية. ومع ذلك ، يركز هذا الإجراء على SLAMF1-M. الحديث المتبادل عن مرض السل ، وتشمل الاستخدامات المحتملة الأخرى فهم نتيجة التفاعل المحظور أو المتأخر أو غير المناسب ، أو دراسة آليات التهرب ، أو الكشف عن الأهداف الجزيئية المحتملة المشاركة في التعرف على مسببات الأمراض. وبالمثل ، يمكن تطبيق هذا البروتوكول على دراسة الاستراتيجيات العلاجية الجديدة والعلاجات المناعية لفهم التطور المشترك لمرض السل المتفطرة والضامة أو الخلايا المضيفة الأخرى ويمكن استخدامه أيضا في مجالات مختلفة تسعى إلى فهم ديناميكيات مستقبلات الترابط.
Disclosures
يعلن أصحاب البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
تم دعم هذا العمل من قبل الجامعة الوطنية للنورويست في مقاطعة بوينس آيرس (أرقام المنح SIB 0618/2019 ، SIB 2582/2012 to V.P.) ، Agencia Nacional de Promoción Científica y Tecnológica (ANPCyT، أرقام المنح PICT-2012-2459 و PICT A 2017-1896 إلى V.P. و PICT-2021-I-INVI-00584 to A.B.) ؛ مؤسسة فلورينسيو فيوريني ؛ و Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET, grant number PIO 15720150100010CO to V.P.). نشكر ناتاليا مينيتي وجاستون فيلافاني على الدعم الفني. نعرب عن تقديرنا للدكتورة باولا باريونويفو والدكتورة لوسيانا بالبوا على المناقشة العلمية أثناء النشر التي أدت إلى تطوير المقايسات المقدمة في هذا العمل. نشكر أخيرا الدكتور إسترمان على نصيحته بشأن بروتوكولات الربط المتقاطع ، Lic. موروني لنصيحته بشأن العمل مع Poly-Lysine و Lic. موريكوني لمساعدته في الأرقام التخطيطية.
Materials
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 488 secondary antibody | Invitrogen | A21121 | For fluorescence microscopy |
| anti-SLAMF1 FITC antibody | eBioscience | 11-1509-42 | For flow cytometry |
| anti-SLAMF1 PE antibody | BioLegend | 306308 | For flow cytometry |
| anti-SLAMF1 primary antibody | BioLegend | 306302 | For fluorescence microscopy |
| Aqua-Poly/Mount | Polysciences | 18606-20 | Mounting media |
| CD14 MicroBeads | Miltenyi Biotec | 130-097-052 | For monocytes isolation |
| Coverslips 12mm | HDA | - | For interaction assay by microscopy |
| EGS | ThermoFisher Scientific | 21565 | For crosslinking treatment |
| FACSCanto II | BD Biosciences | 338960 | Flow cytometer with BD FACSDiva software |
| Fetal Bovine Serum | Natocor | - | Inactivated and irradiated, for macrophages culture |
| Ficoll-Paque PLUS | Cytiva | 17144003 | For PBMCs separation |
| Fiji/ImageJ | Open Source software | - | For micrographs analysis |
| FlowJo 7.6.2 | Tree Star | - | For flow cytometry analysis |
| Formaldehyde | Merck | K47740803613 | For crosslinking treatment |
| Glass slides | Glass Klass | - | For interaction assay by microscopy |
| Glycine | Sigma | G8898 | For crosslinking treatment |
| Imager.A2 | Carl Zeiss | 430005-9901-000 | Fluorescence microscope with Colibri 7 illumination module |
| iMark | BIO-RAD | 1681130 | Microplate absorbance reader |
| L-glutamine | Sigma Aldrich | 49419 | For macrophages culture |
| M. tuberculosis, strain H37Rv, gamma-irradiated whole cells | BEI Resources, NIAID, NIH | NR-14819 | For interaction assay |
| M. tuberculosis, strain H37Rv, whole cell lysate | BEI Resources, NIAID, NIH | NR-14822 | For macrophages stimulation and interaction assay |
| Neofuge 13R | Heal Force | Neofuge 13R | High Speed Refrigerated Centrifuge for protein extraction |
| Penicillin/Streptomycin | Gibco | 15140122 | For macrophages culture |
| PMSF | ThermoFisher Scientific | 36978 | For proteins isolation |
| Poly-D-Lysine | Sigma Aldrich | A-003-M | For coverslips treatment |
| Protease Inhibitor Cocktail | Sigma Aldrich | P8340 | For proteins isolation |
| Rhodamine B | Sigma Aldrich | 21955 | For M. tuberculosis staining |
| RPMI 1640 | Gibco | 11875093 | For macrophages culture |
| Sorvall ST 16/16R centrifuge | ThermoFisher Scientific | 75004240 | For PBMCs and monocytes isolation |
References
- Global Tuberculosis Report 2023. , World Health Organization. Available at: https://www.who.int/tb/publications/global_report/en/ (2023).
- Ahmad, F., et al. Macrophage: A cell with many faces and functions in tuberculosis. Front Immunol. 13, 882130(2022).
- Bo, H., et al. Mycobacterium tuberculosis-macrophage interaction: Molecular updates. Front Cell Infect Microbiol. 13, 1187205(2023).
- Papp, A. C., et al. AmpliSeq transcriptome analysis of human alveolar and monocyte-derived macrophages over time in response to Mycobacterium tuberculosis infection. PLoS One. 13 (5), e0198069(2018).
- Zhai, W., Wu, F., Zhang, Y., Fu, Y., Liu, Z. The immune escape mechanisms of Mycobacterium tuberculosis. Int J Mol Sci. 20 (2), 340(2019).
- Van Crevel, R., Ottenhoff, T. H. M., Van der Meer, J. W. M. Innate immunity to Mycobacterium tuberculosis. Clin Microbiol Rev. 15 (2), 294-309 (2002).
- Mortaz, E., et al. Interaction of pattern recognition receptors with Mycobacterium tuberculosis. J Clin Immunol. 35 (1), 1-10 (2015).
- Stamm, C. E., Collins, A. C., Shiloh, M. U. Sensing of Mycobacterium tuberculosis and consequences to both host and bacillus. Immunol Rev. 264 (1), 204-219 (2015).
- Zihad, S. M. N. K., et al. Role of pattern recognition receptors in sensing Mycobacterium tuberculosis. Heliyon. 9 (10), e20636(2023).
- Barbero, A. M., et al. SLAMF1 signaling induces Mycobacterium tuberculosis uptake leading to endolysosomal maturation in human macrophages. J Leukoc Biol. 109 (8), 257-273 (2021).
- Pasquinelli, V., et al. Expression of signaling lymphocytic activation molecule-associated protein interrupts IFN-γ production in human tuberculosis. J Immunol. 172 (2), 1177-1185 (2004).
- Pasquinelli, V., et al. Phosphorylation of mitogen-activated protein kinases contributes to interferon-γ production in response to Mycobacterium tuberculosis. J Infect Dis. 207 (2), 340-350 (2012).
- Pasquinelli, V., et al. IFN-γ production during active tuberculosis is regulated by mechanisms that involve IL-17, SLAM, and CREB. J Infect Dis. 199 (5), 661-665 (2009).
- Pellegrini, J. M., et al. Neutrophil autophagy during human active tuberculosis is modulated by SLAMF1. Autophagy. 17 (2), 423-426 (2021).
- Song, T., Dong, C., Xiong, S. Signaling lymphocyte-activation molecule SLAMF1 augments mycobacteria BCG-induced inflammatory response and facilitates bacterial clearance. Int J Med Microbiol. 305 (6), 572-580 (2015).
- Eble, J. A. Titration ELISA as a method to determine the dissociation constant of receptor-ligand interaction. J Vis Exp. (132), e57032(2018).
- Patching, S. G. Surface plasmon resonance spectroscopy for characterization of membrane protein-ligand interactions and its potential for drug discovery. Biochim Biophys Acta Biomembr. 1838 (1), 43-55 (2014).
- Draczkowski, P., Matosiuk, D., Jozwiak, K. Isothermal titration calorimetry in membrane protein research. J Pharm Biomed Anal. 87, 296-304 (2014).
- Smith, D. S., Eremin, S. A. Fluorescence polarization immunoassays and related methods for simple, high-throughput screening of small molecules. Anal Bioanal Chem. 391 (5), 1499-1507 (2008).
- García-Nafría, J., Tate, C. G. Cryo-electron microscopy: Moving beyond X-ray crystal structures for drug receptors and drug development. Annu Rev Pharmacol Toxicol. 60, 51-71 (2020).
- Asami, J., Shimizu, T. Structural and functional understanding of the toll-like receptors. Protein Sci. 30 (4), 761-772 (2021).
- Phạm, T. T. T., Rainey, J. K. On-cell nuclear magnetic resonance spectroscopy to probe cell surface interactions. Biochem Cell Biol. 99 (6), 683-692 (2021).
- El Deeb, S., et al. Microscale thermophoresis as a powerful growing analytical technique for the investigation of biomolecular interaction and the determination of binding parameters. Methods Appl Fluoresc. 10 (4), 045001(2022).
- El Khamlichi, C., et al. Bioluminescence resonance energy transfer as a method to study protein-protein interactions: Application to G protein-coupled receptor biology. Molecules. 24 (3), 505(2019).
- Schneider, P., Willen, L., Smulski, C. R. Tools and techniques to study ligand-receptor interactions and receptor activation by TNF superfamily members. Methods Enzymol. 545, 103-125 (2014).
- Park, A. M. W., Schirmer, P. S. H. Atomic force microscopy: A multifaceted tool to study membrane proteins and their interactions with ligands. Biochim Biophys Acta Biomembr. 1838 (1), 74-89 (2014).
- Zalejski, J., Sun, J., Sharma, A. Unravelling the mystery inside cells by using single-molecule fluorescence imaging. J Imaging. 9 (9), 183(2023).
- Zheng, S., Zou, M., Shao, Y., Wu, H., Wang, X. Two-dimensional measurements of receptor-ligand interactions. Front Mol Biosci. 10, 1075587(2023).
- Zlotnikov, I. D., Kudryashova, E. V. Computer simulation of the receptor-ligand interactions of mannose receptor CD206 in comparison with the lectin concanavalin A model. Biochemistry (Moscow). 87 (1), 54-69 (2022).
- Fu, Y., Zhao, J., Chen, Z. Insights into the molecular mechanisms of protein-ligand interactions by molecular docking and molecular dynamics simulation: A case of oligopeptide binding protein. Comput Math Methods Med. 2018, 7604567(2018).
- Farina, B., et al. A novel approach for studying receptor-ligand interactions on living cells' surface by using NUS/T1ρ-NMR methodologies combined with computational techniques: The RGDechi15D-αvβ5 integrin complex. Comput Struct Biotechnol J. 19, 3303-3318 (2021).
- Driessen, N. N., et al. Role of phosphatidylinositol mannosides in the interaction between mycobacteria and DC-SIGN. Infect Immun. 77 (10), 4538-4547 (2009).
- Bansal, K., et al. Src homology 3-interacting domain of Rv1917c of Mycobacterium tuberculosis induces selective maturation of human dendritic cells by regulating PI3K-MAPK-NF-κB signaling and drives Th2 immune responses. J Biol Chem. 285 (47), 36511-36522 (2010).
- Xu, Y., et al. PPE57 induces activation of macrophages and drives Th1-type immune responses through TLR2. J Mol Med. 93 (6), 645-662 (2015).
- Olesen, R., et al. DC-SIGN (CD209), pentraxin 3 and vitamin D receptor gene variants associate with pulmonary tuberculosis risk in West Africans. Genes Immun. 8, 456-467 (2007).
- Berger, S. B., et al. SLAM is a microbial sensor that regulates bacterial phagosome functions in macrophages. Nat Immunol. 11 (10), 920-927 (2010).
- Degos, C., et al. Omp25-dependent engagement of SLAMF1 by Brucella abortus in dendritic cells limits acute inflammation and favours bacterial persistence in vivo. Cell Microbiol. 22 (4), e13156(2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved