Method Article
Antikora Bağımlı Hücre Aracılı Sitotoksisite Raportörü Biyotahlil Kullanılarak Kanser Hücrelerinde Antikora Bağımlı, Hücre Aracılı Sitotoksisitenin Değerlendirilmesi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Burada, bir ADCC biyo-tahlil kiti kullanarak antikora bağımlı, hücre aracılı sitotoksisite (ADCC) testi için bir protokol sunuyoruz. Bu yöntem, ADCC mekanizmasını aydınlatmak ve kanser immünoterapisinde antikorların terapötik potansiyelini değerlendirmek için değerli bir araç sunmaktadır.
Özet
Antikora bağımlı, hücre aracılı sitotoksisite (ADCC) yöntemi, kanser immünoterapisinde terapötik antikorların etkinliğini değerlendirmek için önemli bir araçtır. Kanser hücrelerinde ADCC aktivitesinin değerlendirilmesi, antikor bazlı tedavilerin geliştirilmesi ve optimizasyonu için gereklidir. Burada, efektör hücreler olarak tiroid kanseri hücrelerini kullanarak ADCC reaksiyonunun kantitatif değerlendirmesi için bir ADCC biyo-tahlil kitinin kullanılması için metodolojik bir yaklaşım öneriyoruz. Protokol, terapötik bir antikor varlığında efektör hücrelerin hedef kanser hücreleri ile farklı oranlarda ko-kültürünü içerir. Bu deneyde kullanılan ADCC biyotahlil kiti, Aktive Edilmiş T hücresi (NFAT) yanıt elemanlarının Nükleer Faktörünün kontrolü altında bir lusiferaz raportör genini eksprese eden genetik olarak tasarlanmış efektör hücreleri içerir. Yüzey antijeninin hedef hücreler üzerindeki antikorlar ve efektör hücreler ile bağlanması üzerine, efektör hücreler lusiferaz salgılar ve lüminesans sinyalinin ölçümü yoluyla sitotoksisitenin ölçülmesini sağlar. Konvansiyonel ADCC testlerinin aksine, bu yöntem hedef antijenin antikorlar ve efektör hücrelerle bağlandığını kanıtladı ve bu da kısa sürede güvenilir sonuçlar üretebildi.
Giriş
Antikora bağımlı, hücre aracılı sitotoksisite (ADCC), antikorların bağışıklık aracılı hücre öldürme etkileri gösterdiği önemli bir mekanizmadır 1,2,3. Bağışıklık hücreleri, hedef hücrelerin yüzey antijenleri ile etkileşime girerek granzimleri, perforini serbest bırakan ve hedef hücre ölümüne yol açan terapötik antikora bağlanarak aktive edilir. Bu bağışıklık hücreleri, doğal öldürücü (NK) hücreleri ve nötrofilleri 2,3,4,5,6,7 içerir. ADCC testi, terapötik antikorun 8,9 etkinliğini değerlendirmek için önemli bir araç haline gelmiştir.
Konvansiyonel ADCC tahlilinde, periferik kan mononükleer hücreleri (PBMC'ler) veya doğal öldürücü hücreler, hedefin hücre ölüm oranını ölçerek terapötik bir antikorun etkinliğini izlemek için efektör hücreler olarak kullanılır. Yöntemimiz, Aktive Edilmiş T hücresi (NFAT) yanıt elemanlarının Nükleer Faktörünün kontrolü altında bir lusiferaz raportör geni eksprese eden genetik olarak tasarlanmış efektör hücreleri içeren bir ADCC biyo-tahlil kiti kullanır. Daha sonra yüzey antijeninin hedef hücreler üzerindeki bağlanmasını antikor ve efektör hücrelerle ölçeriz. Bu yöntem, insan PBMC hücrelerine ihtiyaç duymadan kısa bir süre içinde meydana gelen ADCC reaksiyonuna dayanmaktadır. Deneysel adımlar, terapötik antikorların varlığında efektör hücrelerin hedef hücrelerle ko-kültürünü içerir.
İnkübasyon sırasında, terapötik antikor, hedef hücrelerin yüzeyindeki hedef antijene bağlanır, bu da efektör hücrelerin ve bir antikorun Fc fragmanının bağlanmasına yol açar. Bu, NFAT yanıt elemanını aktive eder ve ADCC reaksiyonunun kantitatif değerlendirmesi için lüminesans sinyallerini serbest bırakır.
Deneyi gerçekleştirmeden önce, hedef hücrelerdeki hedef antijenin ekspresyonu, akış sitometrisi veya western blotlama ile doğrulanmalıdır. Hedef hücreler kültürlenir ve deneyden önce 24 saat boyunca 96 oyuklu plakalara geçirilir. Terapötik bir antikorun farklı konsantrasyonları, hesaplanan efektör-hedef hücre oranını elde etmek için efektör hücrelerin farklı hücre sayıları ile birlikte eklenir.
Bu yöntemdeki anahtar adımlar arasında (1) hedef hücrelerin ve efektör hücrelerin hazırlanması, (2) efektör-hedef hücre oranları, (3) farklı antikor konsantrasyonlarının hazırlanması ve (4) değişen inkübasyon süresi yer alır. İnkübasyondan sonra, lüminesans sinyalleri bir luminometre kullanılarak ölçülür ve ADCC aktivitesinin kantitatif bir okumasını sağlar. ADCC'yi ölçmek için diğer yöntemlerle karşılaştırıldığında, bu yöntemin çalıştırılması nispeten basittir ve sonuçlar doğrudur.
ADCC raportör biyo-tahlili, ADCC yolu aktivasyonunda hedef antijenin, terapötik antikorun ve bağışıklık hücrelerinin bağlanmasını gösterir. Bu bağlanma, V158 (yüksek afiniteli) varyantı olan FcyRIIIa reseptörü ile stabil bir şekilde eksprese eden FcγRIIIa hücreleri ile efektör hücreler tarafından tasarlanmış Jurkat hücrelerindeki NFAT yolu yoluyla gen transkripsiyonunu aktive eder. NFAT yanıt elemanı, efektör hücrelerde(10,11) lusiferaz ekspresyonuna aracılık eder. ADCC'nin Etki Mekanizmasındaki (MOA) antikorun biyolojik aktivitesi, NFAT yolundan üretilen lusiferaz sinyali ile ölçülür. Efektör hücrelerdeki lusiferaz sinyali - FcγRIIIa reseptörü eksprese eden Jurket hücreleri - bir lüminesans okuyucusu kullanılarak ölçülür (Şekil 1). Testin sinyal-gürültü oranı yüksektir.
Protokol
1. Hedef hücrelerde EGFR ve VEGFR ekspresyonunun tespiti
NOT: Hedef hücrelerde hedef antijenin ekspresyonunu tespit etmek için western blotlama kullanın.
- Numune hazırlama
- %10 fetal sığır serumu (FBS), %1 L-glutamin ve %1 antibiyotik (Penisilin-Streptomisin) ile desteklenmiş Roswell Park Memorial Institute (RPMI) ortamını kullanarak T75 şişelerindeki hücreleri (BHT-101 ve SW-1736 insan tiroid kanseri hücre hatları) kültürleyin.
- Kültür ortamını çıkararak ve hücreleri PBS ile yıkayarak hücreleri% 80 birleştiğinde hasat edin. 5 mL PBS ekleyin ve hücreleri kültür şişesinden çıkarmak için bir hücre kazıyıcı kullanarak hücreleri kazıyın. Hücreleri 15 mL'lik konik bir tüpe aktarın.
- Hücreleri bir hücre sayacı ile sayın.
- BHT-101 × SW-1736 hücrelerinin 56'sını 15 mL konik tüplere koyun.
- Hücreleri oda sıcaklığında 5 dakika boyunca 135 × g'da döndürün. Süpernatan PBS'yi çıkarın.
- Buz üzerinde 5 dakika boyunca proteaz-fosfataz inhibitörleri içeren 100 μL RIPA lizis tamponu ekleyerek hücre peletini parçalayın. Lizatı 2 mL'lik bir tüpe aktarın, 15.000 × g'da 15 dakika santrifüjleyin ve süpernatanı yeni 2 mL'lik tüpe aktarın.
- Bir bikinkoninik asit (BCA) tahlil kiti kullanarak hücre lizatının protein konsantrasyonunu ölçün.
- Her numuneden hücre lizatından 70 μg protein alın, %10 2-merkaptoetanol ile takviye edilmiş 2x Laemmli numune tamponu ekleyin ve numunelerin denatürasyonu için numuneleri 100 °C'de 5 dakika kaynatın.
- Jel elektroforezi ve membran transferi
- Damıtılmış su (4,7 mL), %30 akrilamid (2,7 mL), 1,5 M Tris Tamponu, pH 8,8 (2,5 mL), %10 sodyum dodesil sülfat (0,1 mL), %10 amonyum persülfat (100 μL) ve TEMED (10 μL) kullanarak %8 sodyum dodesil sülfat (SDS) poliakrilamid jeli hazırlayın.
- %8 SDS-poliakrilamid jel içinde 70 μg denatüre edilmiş numuneyi 80 V'ta 20 dakika ve 120 V'ta 100 dakika çalıştırın.
- Jel üzerindeki proteini 90 dakika boyunca 100 V'ta bir poliviniliden florür (PVDF) membranına aktarın.
- Transferden sonra, membranı 1 saat boyunca TBS-T tamponunda (20 mM Tris pH 7.6, 140 mM NaCl,% 0.2 Tween-20) seyreltilmiş %7 yağsız sütle bloke edin.
- Antikor inkübasyonu
- Tıkalı zarı fare anti-Epidermal Büyüme Faktörü Reseptörü (EGFR) ve tavşan anti-Vasküler Endotelyal Büyüme Faktörü Reseptörü (VEGFR) monoklonal antikorları (% 7 yağsız sütte 1: 1.000'de seyreltilmiş) ile gece boyunca 4 ° C'de inkübe edin.
- İnkübasyondan sonra, zarı Tris tamponlu tuzlu su-Tween (TBS-T) tamponu (20 mM Tris pH 7.6, 140 mM NaCl,% 0.2 Tween-20) ile 7 dakika boyunca iyice yıkayın ve 4x tekrarlayın.
- Membranı HRP ile konjuge ikincil antikor (% 7 yağsız sütte (TBS-T) 1: 4.000'de seyreltilmiş) 1 saat inkübe edin.
- İnkübasyondan sonra, zarı TBS-T tamponu ile 7 dakika boyunca iyice yıkayın ve 4 kez tekrarlayın.
- Protein tespiti
- 1 mL HRP substrat peroksit çözeltisinin 1 mL HRP substrat Luminol Reaktifi (her iki reaktif de kemilüminesan substrat kitinden alınmıştır) ile karıştırılmasıyla hazırlanan kemilüminesan HRP substratında membranı 2 dakika inkübe edin.
- Bir görüntüleme sistemi kullanarak zarı görselleştirin.
2. Hedef hücrelerin hazırlanması
- Hedef T hücrelerini, BHT-101 ve SW-1736 hücrelerini, T-75 şişelerinde %10 FBS, %1 L-glutamin ve %1 antibiyotik (Penisilin-Streptomisin) ile desteklenmiş RPMI ortamında %80 birleşene kadar katlanarak kültürleyin.
- Ortamı çıkardıktan sonra, hücreleri PBS ile bir kez yıkayın. Yapışık hücreleri çıkarmak için hücreleri 1 ml enzimatik olmayan hücre ayrışma tamponu ile 5 dakika inkübe edin. Enzimatik olmayan hücre ayrışma tamponunun reaksiyonunu durdurmak için PBS ekleyin. Hücreleri 5 dakika boyunca 135 × g'da döndürün ve 5 mL PBS ekleyin.
NOT: Burada, zar yüzey proteininin bütünlüğünü korumak için enzimatik olmayan bir hücre ayrışma tamponu kullanıyoruz. - Hücreleri sayın ve bunları 15.000 hücre / kuyuda 96 oyuklu, berrak, düz bir tabana sahip beyaz polistiren mikroplakalarda tohumlayın.
3. Terapötik antikorun değişen konsantrasyonlarının hazırlanması
- Bu protokolü takip etmek için, EGFR'yi bağlamak için Cetuximab (kimerik anti-EGFR antikoru) kullanın ve negatif kontrol olarak Bevacizumab (insanlaştırılmış anti VEGF-A antikoru) kullanın.
- 33.6 mL RPMI-1640'a (kitte verilir) 1.4 mL düşük IgG serumu ekleyerek ADCC Bioassay tamponunu hazırlayın.
- Antikorların seyreltilmesi için ADCC Bioassay tamponu kullanın. Her antikorun 400 μL'sini üç farklı konsantrasyonda hazırlayın: 30 μg/mL, 3 μg/mL ve 0.3 μg/mL (3x konsantrasyon) 10 μg/mL, 1 μg/mL nihai konsantrasyonu elde etmek için ve 0.1 μg/mL optimal dozu tespit etmek için geniş spektrumlu kapsama alanı için.
NOT: Nihai antikor konsantrasyonları, 96 oyuklu bir plakanın her bir oyuğunda 25 μL kültürlenmiş hedef hücre, 25 μL efektör hücre ve 25 μL antikora dayanmaktadır.
4. Efektör hücrelerin hazırlanması
- Efektör hücrelerini kullanmadan önce -80 °C'de saklayın.
- ADCC Biyotahlil Tamponunu kullanmadan önce en az 37 dakika boyunca 30 ° C'lik bir su banyosunda önceden ısıtın.
- ADCC Biyotahlil Efektör hücrelerini -80 °C soğuk hava deposundan 37 °C su banyosuna (yaklaşık 2-3 dakika) yerleştirerek çözdürün. Şişeyi nazikçe sallayın ve görsel olarak inceleyin, ancak çözdürme işlemi sırasında ters çevirmeyin.
- 630ul Efektör hücrelerini, 3.6 mL ADCC Test Tamponu içeren 15 mL'lik bir tüpe aktarın. Tüpü 2x hafifçe ters çevirerek iyice karıştırın.
5. Efektör hücrelerin antikor ve hedef hücrelerle inkübasyonu
- Gece boyunca inkübasyondan sonra, ortamı hedef hücrelerden çıkarın (oyuk başına 15.000 kanser hücresi) ve 25 μL ADCC Biyotahlil tamponu ve 25 μL Cetuximab (EGFR antagonisti) ve Bevacizumab (VEGF antagonisti) Şekil 2'ye göre her bir kuyucukta 0.1 μg / mL, 1 μg / mL veya 10 μg / mL hedef hücrelerin nihai konsantrasyonunu elde etmek için.
- Hedef hücreleri içeren 96 oyuklu mikroplakaya oyuk başına 25 μL ADCC biyotahlil tamponunda 75.000 efektör hücre ekleyin. No mAb olarak etiketlenen kuyucuklar antikor kontrolü yapmaz (Şekil 2).
- Boş kontrol için AB (ADCC Bioassay tamponu) olarak etiketlenmiş kuyulara ADCC Bioassay tamponu ekleyin.
- Plakayı 6 saat inkübe edin.
6. ADCC aktivitesinin kantitatif okuması
- Luciferaz Test Substratına (liyofilize) Luciferase Test tamponu ekleyerek ölçümden 4 saat önce lusiferaz tahlil reaktifini hazırlayın.
- Hedef hücrelerin, antikorun ve efektör hücrelerin 6 saatlik inkübasyonundan sonra, her bir oyuğa 75 μL lusiferaz tahlil reaktifi ekleyin ve 30 dakika inkübe edin.
- Kuluçka süresinin ardından, ADCC aktivitesinin kantitatif bir okumasını sağlayan bir luminometre kullanarak her bir oyuktaki lüminesans sinyalini ölçün.
- Veri analizi için, katlama İndüksiyonunu aşağıdaki gibi hesaplayın:
Katlama indüksiyonu = RLU (antikor kaynaklı - arka plan) / RLU (antikor kontrolü yok - arka plan).
RLU'nun bağıl lüminesans birimleri olduğu yerde; İndüklenen antikor, B3 ila B8 ve C3 ila C8 kuyularıdır; Antikor kontrolü yok = B2 ve C2; Arka plan = A2 kuyusundan A5'e kadar olan ortalama RLU (Şekil 2).
Sonuçlar
Hedef BHT-101 ve SW-1736 hücrelerinde EGFR ve VEGFR ekspresyonu western blot kullanılarak tespit edildi. EGFR ekspresyonu hem BHT-101 hem de SW-1736 hücrelerinde tespit edildi, ancak VEGFR ekspresyonu tespit edilmedi (Şekil 3).
ADCC biyotahlil kitini kullanarak, hedef hücreler olarak EGFR pozitif hücre hatları, BHT-101 ve SW-1736 kullanarak anti-EGFR antikoru setuksimabın ADCC reaksiyonunu tespit ettik. Bir VEGF inaktivatörü olan bevacizumab, negatif kontrol antikoru olarak kullanıldı. Farklı konsantrasyonlarda antikorlar ve efektör hücreler hedef hücrelerle inkübe edildi. Lüminesans sinyali bir plaka okuyucu kullanılarak tespit edildi (Şekil 2). Cetuximab (anti-EGFR antikor) gruplarında daha yüksek bir ADCC aktivite indüksiyonu foldu bulundu, ancak her iki hücre hattı için Bevacizumab'da (VEGF antagonisti) ADCC aktivitesi görülmedi. Bu, her iki hücre hattı için EGFR hücre dışı membran antijenlerini hedef alan ADCC etkisini gösterdi. Bu yöntem kullanılarak, ADCC reaksiyonu, iki anaplastik tiroid kanseri hücre hattında (BHT101 ve SW1736) Cetuximab varlığında doğrulanmıştır (Şekil 4).
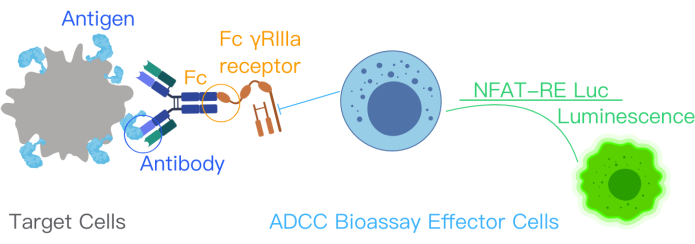
Şekil 1: ADCC biyo-tahlil kiti ile ADCC reaksiyonunu gösteren şematik bir diyagram. Terapötik antikordaki antijen bağlanma bölgeleri, hedef hücrelerdeki yüzey antijenlerine bağlanır. Bu bağlanma, antikorun Fc kısmının, NFAT-RE luc ile genetik olarak tasarlanmış ve efektör hücrelerde bir lüminesans sinyali üreten efektör hücrelerin FcƳRIIIa reseptörlerine bağlanmasına yol açar. Bu şekil, ADCC Reporter Bioassay Core kit kılavuzundan12 izni ile değiştirilmiştir. Kısaltmalar: ADCC = Antikora bağımlı hücre aracılı sitotoksisite; Fc = Parça kristalleşebilir bölge; NFAT = Aktive Edilmiş T Hücresinin Nükleer Faktörü; RE = Yanıt öğesi; luc = lusiferaz. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: ADCC ko-kültür sisteminin 96 oyuklu plaka tasarımının lüminesans okuması ve deneysel diyagramı. Lüminesans sinyalleri bir lüminesans okuyucu tarafından okunur. Sıra A: 1st-9 inci kuyular ADCC Biyotahlil Tamponu içerir. Sıra B: 3rd-8. kuyular BHT101'in ADCC reaksiyon sistemini (hedef hücreler + antikor + efektör hücreler) içerir. 2. kuyu antikorsuzdur. 9. kuyu sadece ADCC Bioassay tamponu içerir. Satır C: 3rd-8. kuyular SW-1736'nın ADCC reaksiyon sistemini (hedef hücre + antikor + efektör hücreler) içerir. 2. kuyu antikorsuzdur. 9. kuyu sadece ADCC Bioassay tamponu içerir. Sıra D: 1st-9 uncu kuyularda Tahlil Tamponu bulunmaktadır. Kısaltmalar: ADCC = Antikora bağımlı hücre aracılı sitotoksisite; AB = ADCC Biyotahlil tamponu; VEGFR = vasküler epitelyal büyüme faktörü reseptörü; EGFR = Epidermal Büyüme Faktörü Reseptörü; mAb = monoklonal antikor. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
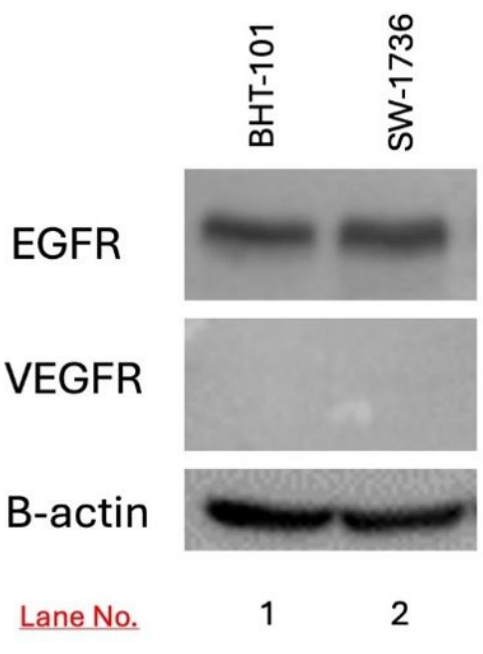
Şekil 3: BHT-101 ve SW-1736 tiroid karsinomunda western blot kullanılarak EGFR ve VEGFR ekspresyonunun saptanması. EGFR ekspresyonu, ancak VEGFR değil, her iki hücre hattında da tespit edildi. Yükleme kontrolü olarak B-aktin kullanıldı. Kısaltmalar: EGFR = epidermal büyüme faktörü reseptörü; VEGFR = vasküler epidermal büyüme faktörü. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
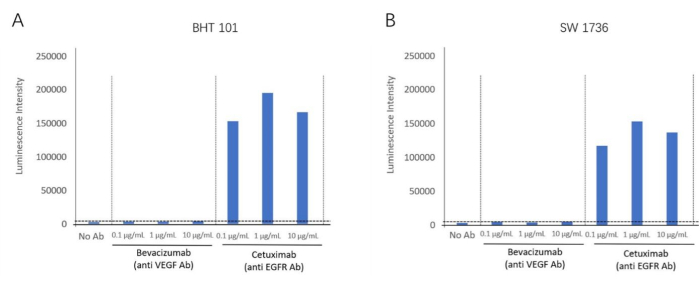
Şekil 4: ADCC aktivitesinin katlanma indüksiyonu. (A) Tiroid kanseri hücre hattı BHT-101, anti-EGFR antikoru Cetuximab'ın varlığında bir ADCC etkisi gösterir. (B) Tiroid kanseri hücre hattı SW-1736, anti-EGFR antikoru Cetuximab'ın varlığında bir ADCC etkisi sergiler. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Burada, terapötik bir antikorun ADCC reaksiyonunu değerlendirmek için ADCC Biyoassay yöntemini sunduk. Yöntem basittir ve ölçüm için basit bir "ekle-karıştır-oku" formatı kullanır.
Deneyi yapmadan önce, hedef hücrelerdeki hedef antijenin ekspresyonu, akış sitometrisi veya western blotlama ile doğrulanmalıdır. Akış sitometrisi, yüzey antijenini tespit etmek için daha iyi bir araç olacaktır. Bununla birlikte, akış sitometrisinin kullanılması hücreleri strese sokabilir, apoptoza neden olabilir ve hücrenin canlılığını ve dolayısıyla genel analizi etkileyebilir. Ayrıca, batı lekelemeden daha pahalıya mal olur. Bu deneyde, hedeflenen antijenler bilinen hücre yüzeyi antijenleri olduğu için daha hızlı ve daha uygun maliyetli bir yöntem olarak western blotlama kullandık.
Efektör hücreler olarak, FcγRIIIa reseptörünü, V158 (yüksek afinite) varyantını ve ateşböceği lusiferazın ekspresyonunu yönlendiren bir NFAT yanıt elemanını kararlı bir şekilde eksprese eden tasarlanmış Jurkat hücreleri kullanıldı. NFAT yolunun aktivasyonu, lusiferaz üretimi ile sonuçlanır ve aktivitesi, lüminesans okuması şeklinde ölçülür. Sinyal aynı zamanda ADCC'nin aktivitesini de temsil eder.
İlk olarak, hedef hücreler (T), nemlendirilmiş bir CO2 inkübatörde 37 ° C'de 6 saat boyunca 96 oyuklu plakalarda değişen miktarlarda antikor varlığında efektör hücreler (E) ile inkübe edilir. Sinyali optimize etmek için 5:1'lik efektör: hedef oranı kullanılır. Örneğin, 15.000 hedef hücreye 75.000 efektör hücre eklendi. İnkübasyonun sonunda, her bir oyuğa Bio-Glo lusiferaz tahlil reaktifi eklenir, 30 dakika inkübe edilir ve lüminesans (RLU, bağıl lusiferaz birimleri) bir lüminesans plakası okuyucusu kullanılarak ölçülür.
Bu protokoldeki temel kritik adımlar şunlardır: (1) Efektör hücrelerin işlenmesi. Hücre şişesi, çözdürme işlemi sırasında ters çevrilmemeli, hafifçe sallanmalı ve istenmeyen hücre ölümünü önlemek veya biyolojik algılama performansını etkilemek için çözüldükten hemen sonra kullanılmalıdır. (2). Lüminesans ölçümleri için şeffaf, düz tabanlı beyaz polistiren 96 oyuklu mikroplakaların kullanılması önemlidir, çünkü lüminesans okuyucunun altından yakalanır.
Bu çalışmada, anti-EGFR antikoru olan setuksimabın hedef hücre miktarına ve antikor konsantrasyonuna bağlı olarak daha güçlü ve daha zayıf ADCC reaksiyonlarını gözlemledik. Zayıf ADCC reaksiyonlarının kalibrasyonunu ele almanın bazı nedenleri: (1) ADCC raportör biyo-tahlilinin okumaları, bu çalışmanın ADCC reaksiyon sisteminde kuyu başına sabit sayıda 75.000 hücre bulunan efektör hücrelerden (E) gelir. Bu nedenle, hedef hücrelerin (T) kalitesini optimize etmek, geliştirilebilecek bir husustur. Bu çalışmadaki E:T oranı 5:1 idi ve bu oran 20:1'e kadar ayarlanabiliyordu. (2) Antikor konsantrasyonu da ADCC reaksiyonunu etkileyen önemli faktörlerden biridir. Optimal konsantrasyon aralığını keşfetmek için antikorların seri seyreltilmesi yoluyla ayarlamalar yapılabilir, böylece ADCC raporunda maksimum yanıt elde edilir. (3) Antikorların, hedef hücrelerin ve efektör hücrelerin kuluçka süresi de deneysel sonuçlar için çok önemlidir. Bu çalışmada, optimal ADCC reaksiyonunu elde etmek için 24 saate kadar uzatılabilen 6 saat inkübe ettik. (4) Ek olarak, ADCC testi için tampon çözeltisinin (düşük IgG) konsantrasyonunun da araştırılması gerekir. ADCC yanıtı için optimal serum konsantrasyonu %1 ila %10 aralığında elde edilebilir.
Bu deneysel yöntem hızlı ve anlaşılırdır ve basit bir "ekle-karıştır-oku" protokolü aracılığıyla bir gün içinde tamamlanmasına izin verir. Sonuçlar stabildir ve toplu teste uygundur. Bununla birlikte, bu biyo-tahlil kiti, efektör hücreler olarak PBMC veya NK hücrelerini kullanan geleneksel ADCC yöntemleri gibi hücre ölümünü tespit etmez12,13. Bunun yerine, efektör hücreler olarak Jurkat hücrelerini eksprese eden FcγRIIIa reseptörü kullanır, bu da hücreler genetik olarak değiştirildiği için daha pahalıya mal olur. Geleneksel ADCC deneylerine13,14 kıyasla, sağlıklı bireylerden kan bağışı gereksinimini ortadan kaldırır ve bağışıklık hücrelerinin çıkarılmasının karmaşık sürecini önler, böylece sonuçları etkileyebilecek bireysel varyasyonları azaltır. Tespit edilen lüminesans sinyalleri, hedef hücrelerin gerçek ölümünden değil, efektör hücrelerin hedef hücrelere bağlanmasından kaynaklanmaktadır. Bu nedenle, standart ADCC tespit yöntemlerine kıyasla tutarsızlıklar olabilir. Ayrıca, tripsinden daha pahalı olan hücre ayrışma tamponu, zar bütünlüğünü korumak için yapışık hücreleri ayırmak için kullanılır.
ADCC raportör gen analizi, terapötik antikor ilaçlarının kitle tespiti için bir etkinlik analizi yöntemi olarak hizmet eden mükemmel doğruluk ve stabilite gösterir. Aynı zamanda terapötik moleküllerin karakterizasyonu ve süreç geliştirme için kritik bir analiz yöntemi olarak da işlev görebilir15.
Özetle, ADCC önemli bir immün mekanizmadır ve ADCC'nin kantitatif tespiti immünoterapi alanında büyük önem taşımaktadır. Bu deneysel yöntem, ADCC15'in kantitatif ölçümü için etkili bir araç sunar.
Açıklamalar
Tüm yazarlar herhangi bir çıkar çatışması beyan etmez.
Teşekkürler
Bu çalışmayı desteklediği için Prof. Zeng'e (IMCB, A*STAR) minnettarız. Bu çalışma, Çin Ulusal Doğa Bilimleri Vakfı (NSFC) Gençlik Vakfı (82202231) ve Çin'in Zhejiang Eyaleti Tıp ve Sağlık Bilimi ve Teknolojisi Projesi (2021KY110,2024KY824) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.5% Trypsin-EDTA | Gibco | 15400-054 | Dilute 10x in PBS to make 0.05% Trypsin |
| 1x Tris Buffer Saline (TBS) | 1st BASE | BUF-3030-1X1L | For membrane washing in western blotting |
| 1.5 M Tris Buffer, pH 8.8 | 1st BASE | BUF-1419-1L-pH8.8 | For SDS gel preparation |
| 2-Mercaptoethanol | Sigma Aldrich | M7522-100ML | For sample preparation of western blotting |
| 30% Acrylamide/Bis solution | Bio-Rad | #1610158 | For SDS gel preparation |
| 4x Laemmli Buffer | Bio-Rad | #1610747 | For sample preparation of western blotting |
| 96-well white polystyrene microplate with clear flat bottom | Corning Incorporated | 3610 | For ADCC assay |
| ADCC Bioassay Effector cells (0.65 mL) | Promega | G7011 | Includes in ADCC reporter bioassay core kit (Promega G7010), 1 x 1 vial |
| ADCC reporter bioassay core kit | Promega | G7010 | Mentioned as ADCC bioassay kit for ADCC assay in this experiment |
| Ammonium Persulfate | Sigma Aldrich | A3678-25G | For SDS gel preparation |
| Bevacizumab (Humanized Anti VEGF-antibody) | MVASI | - | Use as negative control antibody in ADCC asssay |
| BHT-101 | Leibniz Institute DSMZ | ACC279 | Human anaplastic papillary thyroid cancer cell line |
| Bio-Glo Luciferase Assay Buffer | Promega | G7941 | Includes in ADCC reporter bioassay core kit (Promega G7010), 1 x 10 mL |
| Bio-Glo Luciferase Assay Substrate (Lyophilized) | Promega | G7941 | Includes in ADCC reporter bioassay core kit (Promega G7010), 1 x 1 vial |
| Cell scraper | GenFollower | GD00235 | To remove cell from culture flask |
| Cetuximab (Chimeric anti-EGFR antibody) | ERBITUX | - | Use as therapeutic antibody in ADCC assay |
| Chemiluminescent HRP substrate | Merck Millipore | WBKLS0500 | For protein detection in western blotting |
| Distilled water | Gibco | 15230-162 | For SDS gel preparation |
| Fetal Bovine Serum (FBS) | Gibco | 10270-106 | Culture media supplement |
| iBright CL1500 imaging system | Thermo Scientific | 2462621100038 | For protein detection in western blotting |
| L-glutamine, 200 mM | Gibco | 25030-081 | Culture media supplement |
| Low IgG Serum | Promega | G7110 | Includes in ADCC reporter bioassay core kit (Promega G7010), 1 x 4 mL |
| Megafuge 8R | Thermo Scientific | 42876589 | Centrifuge |
| Mouse anti-EGFR monoclonal antibodies | BD Biosciences | 610016 | Primary antibody in western blotting |
| Mouse anti-VEGFR monoclonal antibodies | BD Biosciences | 571194 | Primary antibody in western blotting |
| non-enzymatic cell dissociation buffer | Sigma Aldrich | C5789-100ML | For cell harvesting from T75 flask |
| Penicillin-Streptomycin | PAN Biotech | P06-07100 | Antibacterial for culture media |
| Phosphate Buffered Saline (PBS), pH 7.2, Sterile filtered | 1st BASE | CUS-2048-1x1L | Use as washing solution for cells |
| Pierce BCA assay kit | Thermo Scientific | 23225 | To measure protein concentration |
| Protease and phosphatase inhibitor | Thermo Scientific | A32959 | For protein digestion in sample preparation for western blotting |
| PVDF membrane (Immobilin-P) | Merck Millipore | IPVH00010 | For protein transfer in western blotting |
| Rabbit anti-mouse IgG, Fcγ HRP-conjugated secondary antibody | Jackson ImmunoResearch | 315-035-046 | Secondary antibody in western blotting |
| Roswell Park Memorial Institute (RPMI) medium | Capricorn Scientific | RPMI-XA | Cell culture media |
| RPMI-1640 | Promega | G7080 | Includes in ADCC reporter bioassay core kit (Promega G7010), 1 x 36 mL |
| Skim milk powder | Merck Millipore | 70166-500G | For membrane blocking in western blotting |
| Sodium Dodecyl Sulfate | 1st BASE | BIO-2050-500g | For SDS gel preparation |
| SW-1736 | Cytion | 300453 | Human thyroid squamous cell cancer cell line |
| T75 culture flasks | SPL Lifesciences | 70075 | Cell culture flask |
| Tecan Multimode Reader model Spark 10M | Tecan | 1607000294 | for luminicence quantification |
| TEMED | Bio-Rad | #1610801 | For SDS gel preparation |
| Tween-20 | Promega | H5151 | For membrane washing in western blotting |
| Vi-cell XR cell viability analyzer | Beckman Coulter | AL15072 | Cell counter |
Referanslar
- Zahavi, D., AlDeghaither, D., O'Connell, Enhancing antibody-dependent cell-mediated cytotoxicity: a strategy for improving antibody-based immunotherapy. Antib Ther. 1 (1), 7-12 (2018).
- Fenis, A., Demaria, O., Gauthier, L., Vivier, E. New immune cell engagers for cancer immunotherapy. Nat Rev Immunol. 24 (7), 471-486 (2024).
- Pinto, S., Pahl, J., Schottelius, A., Carter, P. J. Reimagining antibody-dependent cellular cytotoxicity in cancer: the potential of natural killer cell engagers. Trends Immunol. 43 (11), 932-946 (2022).
- Ochoa, M. C., et al. Antibody-dependent cell cytotoxicity: immunotherapy strategies enhancing effector NK cells. Immunol Cell Biol. 95 (4), 347-355 (2017).
- Wang, W., Erbe, A. K., Hank, J. A., Morris, Z. S. NK cell-mediated antibody-dependent cellular cytotoxicity in cancer immunotherapy. Front Immunol. 6, 368 (2015).
- Chung, S., et al. Characterization of in vitro antibody-dependent cell-mediated cytotoxicity activity of therapeutic antibodies - impact of effector cells. J Immunol Methods. 407, 63-75 (2014).
- Shimasaki, N., Jain, A., Campana, D. NK cells for cancer immunotherapy. Nat Rev Drug Discov. 19 (3), 200-218 (2020).
- Cheng, Z. J., et al. Development of a robust reporter-based ADCC assay with frozen, thaw-and-use cells to measure Fc effector function of therapeutic antibodies. J Immunol Methods. 414, 69-81 (2014).
- Parekh, B. S., et al. Development and validation of an antibody-dependent cell-mediated cytotoxicity-reporter gene assay. MAbs. 4 (3), 310-318 (2012).
- Hogarth, P. M., Pietersz, G. A. Fc receptor-targeted therapies for the treatment of inflammation, cancer and beyond. Nat Rev Drug Discov. 11 (4), 311-331 (2012).
- Chung, S., et al. Quantitative evaluation of fucose reducing effects in a humanized antibody on Fcgamma receptor binding and antibody-dependent cell-mediated cytotoxicity activities. MAbs. 4 (3), 326-340 (2012).
- . ADCC Reporter Bioassay Core Kit Technical Manual Available from: https://www.promega.sg/-/media/files/resources/protocols/technical-manuals/101/adcc-reporter-bioassay-core-kit-protocol.pdf?rev=bec36264c0b6470591ded081377d207d&sc_lang=en (2023)
- Miller, A. S., Tejada, M. L., Gazzano-Santoro, H. Methods for measuring antibody-dependent cell-mediated cytotoxicity in vitro. Methods Mol Biol. 1134, 59-65 (2014).
- Lo Nigro, C., et al. NK-mediated antibody-dependent cell-mediated cytotoxicity in solid tumors: biological evidence and clinical perspectives. Ann Transl Med. 7 (5), 105 (2019).
- Gómez Román, V. R., Murray, J. C., Weiner, L. M., Ackerman, M. E., Nimmerjahn, F. . Antibody Fc. , 1-27 (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır