Method Article
تقييم السمية الخلوية المعتمدة على الأجسام المضادة والوسيطة الخلوية في الخلايا السرطانية باستخدام الاختبار الحيوي لمراسل السمية الخلوية المعتمد على الأجسام المضادة
* These authors contributed equally
In This Article
Summary
هنا ، نقدم بروتوكولا لمقايسة السمية الخلوية المعتمدة على الأجسام المضادة (ADCC) باستخدام مجموعة المقايسة الحيوية ADCC. توفر هذه الطريقة أداة قيمة لتوضيح آلية ADCC وتقييم الإمكانات العلاجية للأجسام المضادة في العلاج المناعي للسرطان.
Abstract
تمثل طريقة السمية الخلوية المعتمدة على الأجسام المضادة والوسطاء الخلوي (ADCC) أداة مهمة لتقييم فعالية الأجسام المضادة العلاجية في العلاج المناعي للسرطان. يعد تقييم نشاط مركز أبوظبي للسرطان في الخلايا السرطانية أمرا ضروريا لتطوير وتحسين العلاجات القائمة على الأجسام المضادة. هنا ، نقترح نهجا منهجيا لاستخدام مجموعة الاختبار الحيوي ADCC للتقييم الكمي لتفاعل ADCC باستخدام خلايا سرطان الغدة الدرقية كخلايا مستجيبة. يتضمن البروتوكول الزراعة المشتركة للخلايا المستجيبة مع الخلايا السرطانية المستهدفة بنسب مختلفة في وجود جسم مضاد علاجي. تتضمن مجموعة المقايسة الحيوية ADCC المستخدمة في هذه التجربة الخلايا المستجيبة المعدلة وراثيا التي تعبر عن جين مراسل لوسيفيراز تحت سيطرة العوامل النووية لعناصر استجابة الخلايا التائية المنشطة (NFAT). عند ارتباط المستضد السطحي بالخلايا المستهدفة بالأجسام المضادة والخلايا المستجيبة ، تطلق الخلايا المستجيبة لوسيفيراز ، مما يتيح القياس الكمي للسمية الخلوية من خلال قياس إشارة اللمعان. على عكس فحوصات ADCC التقليدية ، أثبتت هذه الطريقة ارتباط المستضد المستهدف بالأجسام المضادة والخلايا المستجيبة ، والتي يمكن أن تؤدي إلى نتائج موثوقة في فترة قصيرة.
Introduction
السمية الخلوية المعتمدة على الأجسام المضادة (ADCC) هي آلية مهمة تمارس من خلالها الأجسام المضادة تأثيرات قتل الخلايا بوساطة المناعة1،2،3. يتم تنشيط الخلايا المناعية عن طريق الارتباط بالجسم المضاد العلاجي ، الذي يتفاعل مع المستضدات السطحية للخلايا المستهدفة لإطلاق الجرانزيم ، البيرفورين ، مما يؤدي إلى موت الخلية المستهدفة. تشمل هذه الخلايا المناعية الخلايا القاتلة الطبيعية (NK) والعدلات2،3،4،5،6،7. أصبح اختبار ADCC أداة مهمة لتقييم فعالية الأجسام المضادة العلاجية8،9.
في مقايسة ADCC التقليدية ، يتم استخدام خلايا الدم المحيطية أحادية النواة (PBMCs) أو الخلايا القاتلة الطبيعية كخلايا مستجيبة لمراقبة فعالية الجسم المضاد العلاجي عن طريق تحديد معدل موت الخلايا المستهدفة. تستخدم طريقتنا مجموعة المقايسة الحيوية ADCC التي تتضمن خلايا مستجيبة معدلة وراثيا تعبر عن جين مراسل لوسيفيراز تحت سيطرة العامل النووي لعناصر استجابة الخلايا التائية المنشطة (NFAT). ثم نقوم بتحديد ارتباط المستضد السطحي بالخلايا المستهدفة بالجسم المضاد والخلايا المستجيبة. تعتمد هذه الطريقة على تفاعل ADCC الذي يحدث في فترة قصيرة دون الحاجة إلى خلايا PBMC البشرية. تشمل الخطوات التجريبية الزراعة المشتركة للخلايا المستجيبة مع الخلايا المستهدفة في وجود الأجسام المضادة العلاجية.
أثناء الحضانة ، يرتبط الجسم المضاد العلاجي بالمستضد المستهدف على سطح الخلايا المستهدفة ، مما يؤدي إلى ارتباط الخلايا المستجيبة وجزء Fc للجسم المضاد. يؤدي هذا إلى تنشيط عنصر استجابة NFAT وإطلاق إشارات تلألؤ للتقييم الكمي لتفاعل ADCC.
قبل إجراء التجربة ، يجب تأكيد التعبير عن المستضد المستهدف في الخلايا المستهدفة إما عن طريق قياس التدفق الخلوي أو النشاف الغربي. يتم زراعة الخلايا المستهدفة وتمريرها إلى ألواح 96 بئرا لمدة 24 ساعة قبل التجربة. تتم إضافة تركيزات مختلفة من الجسم المضاد العلاجي مع عدد الخلايا المختلفة للخلايا المستجيبة لتحقيق نسبة الخلايا المحسوبة من المستجيب إلى الهدف.
تشمل الخطوات الرئيسية في هذه الطريقة (1) تحضير الخلايا المستهدفة والخلايا المستجيبة ، (2) نسب الخلايا المستجيبة إلى الهدف ، (3) تحضير تركيزات مختلفة من الجسم المضاد ، و (4) مدة حضانة متفاوتة. بعد الحضانة ، يتم قياس إشارات التلألؤ باستخدام مقياس الإضاءة ، مما يوفر قراءة كمية لنشاط ADCC. بالمقارنة مع الطرق الأخرى لقياس ADCC ، فإن هذه الطريقة سهلة التشغيل نسبيا ، والنتائج دقيقة.
يشير الاختبار الحيوي لمراسل ADCC إلى ارتباط المستضد المستهدف والأجسام المضادة العلاجية والخلايا المناعية في تنشيط مسار ADCC. ينشط هذا الارتباط النسخ الجيني من خلال مسار NFAT في خلايا Jurkat المهندسة بالخلايا المستجيبة مع التعبير بثبات عن مستقبلات FcγRIIIa ، متغير V158 (عالي التقارب). يتوسط عنصر استجابة NFAT في التعبير عن لوسيفيراز في الخلايا المستجيبة10،11. يتم قياس النشاط البيولوجي للجسم المضاد في آلية العمل (MOA) ل ADCC من خلال إشارة لوسيفيراز المنتجة من مسار NFAT. يتم قياس إشارة لوسيفيراز في الخلايا المستجيبة - مستقبلات FcγRIIIa التي تعبر عن خلايا Jurket - باستخدام قارئ التلألؤ (الشكل 1). نسبة الإشارة إلى الضوضاء في الفحص عالية.
Protocol
1. الكشف عن تعبير EGFR و VEGFR في الخلايا المستهدفة
ملاحظة: استخدم النشاف الغربي للكشف عن تعبير المستضد المستهدف في الخلايا المستهدفة.
- تحضير العينة
- استزراع الخلايا (خطوط خلايا سرطان الغدة الدرقية البشرية BHT-101 و SW-1736) في قوارير T75 باستخدام وسط معهد روزويل بارك التذكاري (RPMI) المكملة بمصل بقري الجنين بنسبة 10٪ (FBS) ، و 1٪ L-glutamine ، و 1٪ مضادات حيوية (Penicillin-Streptomycin).
- احصد الخلايا عندما تكون ملتصقة بنسبة 80٪ عن طريق إزالة وسائط الثقافة وغسل الخلايا باستخدام PBS. أضف 5 مل من PBS وقم بإلغاء الخلايا باستخدام مكشطة الخلايا لإزالة الخلايا من قارورة الثقافة. انقل الخلايا إلى أنبوب مخروطي سعة 15 مل.
- عد الخلايا بعداد الخلايا.
- Aliquot 5 × 106 من خلايا BHT-101 و SW-1736 في أنابيب مخروطية سعة 15 مل.
- قم بتدوير الخلايا عند 135 × جم لمدة 5 دقائق في درجة حرارة الغرفة. قم بإزالة PBS الطافي.
- قم بتحلل حبيبات الخلية عن طريق إضافة 100 ميكرولتر من المخزن المؤقت لتحلل RIPA الذي يحتوي على مثبطات البروتياز والفوسفاتيز لمدة 5 دقائق على الثلج. انقل المحللة إلى أنبوب سعة 2 مل ، وجهاز الطرد المركزي عند 15,000 × جم لمدة 15 دقيقة ، وانقل المادة الطافية إلى أنبوب جديد سعة 2 مل.
- قم بقياس تركيز البروتين في محللة الخلية باستخدام مجموعة مقايسة حمض البيسنجونينيك (BCA).
- Aliquot 70 ميكروغرام من البروتين من محللة الخلية من كل عينة ، أضف 2x عازلة عينة Laemmli مكملة بنسبة 10٪ 2-mercaptoethanol ، وغلي العينات عند 100 درجة مئوية لمدة 5 دقائق لتمسخ العينات.
- الرحلان الكهربائي للهلام ونقل الغشاء
- تحضير 8٪ جل بولي أكريلاميد دوديسيل الصوديوم (SDS) باستخدام الماء المقطر (4.7 مل) ، 30٪ أكريلاميد (2.7 مل) ، 1.5 M Tris Buffer ، درجة الحموضة 8.8 (2.5 مل) ، 10٪ كبريتات دوديسيل الصوديوم (0.1 مل) ، 10٪ بيرسلفات الأمونيوم (100 ميكرولتر) ، و TEMED (10 ميكرولتر).
- قم بتشغيل 70 ميكروغرام من العينات المشوهة في جل SDS-بولي أكريلاميد بنسبة 8٪ عند 80 فولت لمدة 20 دقيقة وعند 120 فولت لمدة 100 دقيقة.
- انقل البروتين الموجود على الجل إلى غشاء فلوريد البولي فينيلدين (PVDF) عند 100 فولت لمدة 90 دقيقة.
- بعد النقل ، قم بسد الغشاء بحليب خالي الدسم بنسبة 7٪ مخفف في مخزن TBS-T (20 ملي مولار تريس الرقم الهيدروجيني 7.6 ، 140 ملي كلوريد الصوديوم ، 0.2٪ توين -20) لمدة 1 ساعة.
- حضانة الأجسام المضادة
- احتضان الغشاء المسدود بمستقبلات عامل نمو البشرة المضادة للفأر (EGFR) والأجسام المضادة أحادية النسيلة لمستقبلات عامل النمو البطاني للأوعية الدموية للأرانب (مخففة عند 1: 1,000 في حليب خالي الدسم بنسبة 7٪) طوال الليل عند 4 درجات مئوية.
- بعد الحضانة ، اغسل الغشاء جيدا باستخدام محلول ملحي مخفض (TBS-T) (20 ملي مولار Tris pH 7.6 ، 140 ملي كلوريد الصوديوم ، 0.2٪ Tween-20) لمدة 7 دقائق وكرر 4x.
- احتضان الغشاء بالجسم المضاد الثانوي المترافق ب HRP (مخفف عند 1: 4,000 في حليب خالي الدسم بنسبة 7٪ (TBS-T)) لمدة ساعة واحدة.
- بعد الحضانة ، اغسل الغشاء جيدا باستخدام المخزن المؤقت TBS-T لمدة 7 دقائق وكرر ذلك 4 مرات.
- كشف البروتين
- احتضان الغشاء في ركيزة HRP الكيميائية المحضرة عن طريق خلط 1 مل من محلول بيروكسيد الركيزة HRP مع 1 مل من كاشف لومينول الركيزة HRP (كلا الكواشف من مجموعة الركيزة الكيميائية المضيئة) لمدة دقيقتين.
- تصور الغشاء باستخدام نظام التصوير.
2. تحضير الخلايا المستهدفة
- استزراع الخلايا التائية المستهدفة ، خلايا BHT-101 و SW-1736 بشكل كبير حتى 80٪ ملتقى في وسائط RPMI مكملة بنسبة 10٪ FBS و 1٪ L-glutamine و 1٪ مضادات حيوية (Penicillin-Streptomycin) في قوارير T-75.
- بعد إزالة الوسائط ، اغسل الخلايا مرة واحدة باستخدام PBS. احتضان الخلايا ب 1 مل من المخزن المؤقت لتفكك الخلايا غير الأنزيمية لمدة 5 دقائق لطرد الخلايا الملتصقة. أضف PBS لإيقاف تفاعل المخزن المؤقت لتفكك الخلايا غير الأنزيمية. قم بتدوير الخلايا عند 135 × جم لمدة 5 دقائق وأضف 5 مل من PBS.
ملاحظة: هنا ، نستخدم مخازلة لتفكك الخلايا غير الأنزيمية للحفاظ على سلامة بروتين سطح الغشاء. - عد الخلايا وبذرها في 15,000 خلية / بئر في 96 بئرا من البوليسترين الأبيض ذات قاع شفاف ومسطح.
3. تحضير تركيزات متفاوتة من الجسم المضاد العلاجي
- لاتباع هذا البروتوكول ، استخدم سيتوكسيماب (الجسم المضاد الخيمري المضاد ل EGFR) لربط EGFR واستخدام Bevacizumab (جسم مضاد مضاد ل VEGF-A) كعنصر تحكم سلبي.
- قم بإعداد المخزن المؤقت للمقايسة الحيوية من ADCC عن طريق إضافة 1.4 مل من مصل IgG منخفض إلى 33.6 مل من RPMI-1640 (المتوفرة في المجموعة).
- استخدم المخزن المؤقت للمقايسة الحيوية ADCC لتخفيف الأجسام المضادة. تحضير 400 ميكرولتر من كل جسم مضاد بثلاثة تركيزات مختلفة: 30 ميكروغرام / مل ، و 3 ميكروغرام / مل ، و 0.3 ميكروغرام / مل (تركيز 3x) للحصول على التركيز النهائي البالغ 10 ميكروغرام / مل ، و 1 ميكروغرام / مل ، و 0.1 ميكروغرام / مل لتغطية واسعة الطيف للكشف عن الجرعة المثلى.
ملاحظة: تعتمد تركيزات الأجسام المضادة النهائية على 25 ميكرولتر من الخلايا المستهدفة المستنبتة ، و 25 ميكرولتر من الخلايا المستجيبة ، و 25 ميكرولتر من الجسم المضاد في كل بئر من صفيحة 96 بئرا.
4. تحضير الخلايا المستجيبة
- قم بتخزين خلايا المستجيب عند -80 درجة مئوية قبل الاستخدام.
- قم بتسخين المخزن المؤقت للمقايسة الحيوية من ADCC في حمام مائي بدرجة حرارة 37 درجة مئوية لمدة 30 دقيقة على الأقل قبل الاستخدام.
- قم بإذابة خلايا مستجيب المقايسة الحيوية ADCC من التخزين البارد -80 درجة مئوية عن طريق وضعها في حمام مائي 37 درجة مئوية (حوالي 2-3 دقائق). قم بالصخور برفق وفحص القارورة بصريا ، لكن لا تقلبها أثناء عملية الذوبان.
- انقل 630 لتر من خلايا المستجيب إلى أنبوب سعة 15 مل يحتوي على 3.6 مل من المخزن المؤقت لفحص ADCC. تخلط جيدا عن طريق قلب الأنبوب برفق 2x.
5. حضانة الخلايا المستجيبة بالجسم المضاد والخلايا المستهدفة
- بعد الحضانة بين عشية وضحاها ، قم بإزالة الوسائط من الخلايا المستهدفة (15,000 خلية سرطانية لكل بئر) وأضف 25 ميكرولتر من المخزن المؤقت للمقايسة الحيوية ADCC و 25 ميكرولتر من سيتوكسيماب (مضاد EGFR) و Bevacizumab (مضاد VEGF) للحصول على التركيز النهائي البالغ 0.1 ميكروغرام / مل ، أو 1 ميكروغرام / مل ، أو 10 ميكروغرام / مل من الخلايا المستهدفة في كل بئر وفقا للشكل 2.
- أضف 75,000 خلية مستجيب في 25 ميكرولتر من المخزن المؤقت للمقايسة الحيوية ADCC لكل بئر في الصفيحة الدقيقة المكونة من 96 بئرا التي تحتوي على الخلايا المستهدفة. تعمل الآبار المسماة على أنها لا يوجد mAb كأي تحكم في الأجسام المضادة (الشكل 2).
- أضف المخزن المؤقت للمقايسة الحيوية من ADCC إلى الآبار المسماة AB (المخزن المؤقت للمقايسة الحيوية ADCC) للتحكم الفارغ.
- احتضان اللوحة لمدة 6 ساعات.
6. القراءة الكمية لنشاط مجلس أبوظبي للتوزيع
- قم بإعداد كاشف فحص لوسيفيراز قبل 4 ساعات من القياس عن طريق إضافة المخزن المؤقت لفحص لوسيفيراز إلى ركيزة فحص لوسيفيراز (المجففة بالتجميد).
- بعد 6 ساعات من حضانة الخلايا المستهدفة والأجسام المضادة والخلايا المستجيبة ، أضف 75 ميكرولتر من كاشف فحص لوسيفيراز إلى كل بئر واحتضنه لمدة 30 دقيقة.
- بعد فترة الحضانة ، قم بقياس إشارة التلألؤ في كل بئر باستخدام مقياس الإضاءة ، مما يوفر قراءة كمية لنشاط ADCC.
- لتحليل البيانات ، احسب الحث الطية على النحو التالي:
تحريض الطي = RLU (أجسام مضادة مستحثة - خلفية) / RLU (لا يوجد تحكم في الأجسام المضادة - خلفية).
حيث RLU هي وحدات تلألؤ نسبية ؛ الأجسام المضادة المستحثة هي الآبار B3 إلى B8 و C3 إلى C8. لا يوجد تحكم في الأجسام المضادة = B2 و C2 ؛ الخلفية = متوسط RLU من البئر A2 إلى A5 (الشكل 2).
النتائج
تم الكشف عن التعبير عن EGFR و VEGFR في خلايا BHT-101 و SW-1736 المستهدفة باستخدام النشاف الغربي. تم اكتشاف تعبير EGFR في كل من خلايا BHT-101 و SW-1736 ولكن ليس تعبير VEGFR (الشكل 3).
باستخدام مجموعة الاختبار الحيوي ADCC ، اكتشفنا تفاعل ADCC للجسم المضاد ل EGFR ، سيتوكسيماب ، باستخدام خطوط الخلايا الإيجابية ل EGFR ، BHT-101 و SW-1736 ، كخلايا مستهدفة. تم استخدام Bevacizumab ، وهو منشط VEGF ، كجسم مضاد للتحكم السلبي. تم تحضين تركيزات مختلفة من الأجسام المضادة والخلايا المستجيبة مع الخلايا المستهدفة. تم الكشف عن إشارة التلألؤ باستخدام قارئ لوحة (الشكل 2). تم العثور على طية أعلى من تحريض نشاط ADCC في مجموعات Cetuximab (الأجسام المضادة المضادة ل EGFR) ، ولكن لم يلاحظ أي نشاط ADCC في Bevacizumab (مضاد VEGF) لكلا خطي الخلايا. أظهر هذا تأثير ADCC الذي يستهدف مستضدات الغشاء خارج الخلية EGFR لكلا خطي الخلايا. باستخدام هذه الطريقة ، تم التحقق من صحة تفاعل ADCC في وجود سيتوكسيماب في خطين من خلايا سرطان الغدة الدرقية الكشمي (BHT101 و SW1736) (الشكل 4).
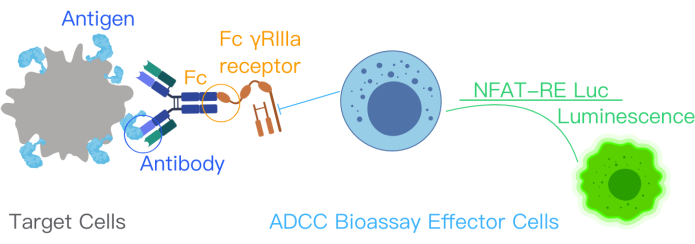
الشكل 1: رسم تخطيطي يوضح تفاعل ADCC مع مجموعة المقايسة الحيوية ADCC. ترتبط مواقع ربط المستضد في الجسم المضاد العلاجي بالمستضدات السطحية في الخلايا المستهدفة. يؤدي هذا الارتباط إلى ارتباط جزء Fc من الجسم المضاد بمستقبلات FcƳRIIIa للخلايا المستجيبة ، والتي تم هندستها وراثيا باستخدام NFAT-RE luc ، مما ينتج عنه إشارة تلألؤ في الخلايا المستجيبة. تم تعديل هذا الرقم من دليل مجموعة أدوات المقايسة الحيوية الأساسية من ADCC Reporter بإذن12. الاختصارات: ADCC = السمية الخلوية المعتمدة على الأجسام المضادة ؛ Fc = منطقة قابلة للتبلور شظية ؛ NFAT = العامل النووي للخلية التائية المنشطة ؛ RE = عنصر الاستجابة ؛ لوك = لوسيفيراز. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: قراءة التلألؤ والرسم التخطيطي التجريبي لتصميم الألواح المكونة من 96 بئرا لنظام الاستزراع المشترك ADCC. تتم قراءة إشارات التلألؤ بواسطة قارئ التلألؤ. الصف أ: 1شارع 9 يحتوي على عازلة المقايسة الحيوية ADCC. الصف ب: تحتويالآبار 3rd-8 على نظام تفاعل ADCC الخاص ب BHT101 (الخلايا المستهدفة + الجسم المضاد + الخلايا المستجيبة). البئر 2بدون جسم مضاد. يحتويالبئر التاسع على المخزن المؤقت للمقايسة الحيوية ADCC فقط. الصف C: تحتويالآبار 3rd-8 على نظام تفاعل ADCC الخاص ب SW-1736 (الخلية المستهدفة + الجسم المضاد + الخلايا المستجيبة). البئر 2بدون جسم مضاد. يحتويالبئر التاسع على المخزن المؤقت للمقايسة الحيوية ADCC فقط. الصف D: 1st-9 الآبار تحتوي على مخزن الفحص. الاختصارات: ADCC = السمية الخلوية المعتمدة على الأجسام المضادة ؛ AB = المخزن المؤقت للمقايسة الحيوية ADCC ؛ VEGFR = مستقبلات عامل النمو الظهاري الظهاري الوعائي ؛ EGFR = مستقبلات عامل نمو البشرة. mAb = الجسم المضاد أحادي النسيلة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
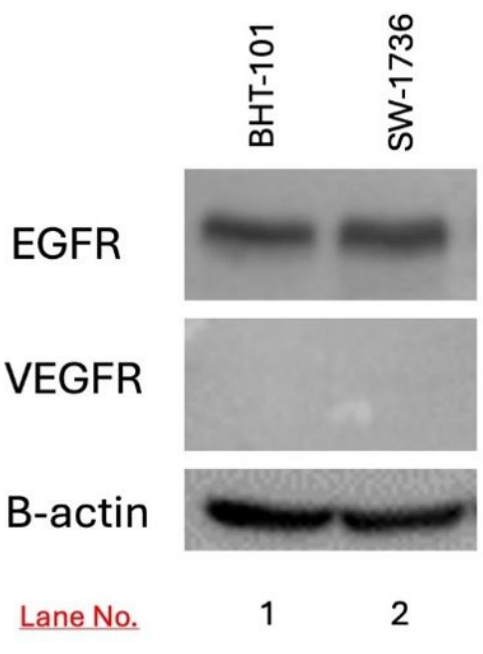
الشكل 3: الكشف عن تعبير EGFR و VEGFR في سرطان الغدة الدرقية BHT-101 و SW-1736 باستخدام النشاف الغربي. تم الكشف عن التعبير عن EGFR ، ولكن ليس VEGFR ، في كلا خطي الخلايا. تم استخدام B-actin كعنصر تحكم في التحميل. الاختصارات: EGFR = مستقبلات عامل نمو البشرة. VEGFR = عامل نمو البشرة الوعائية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
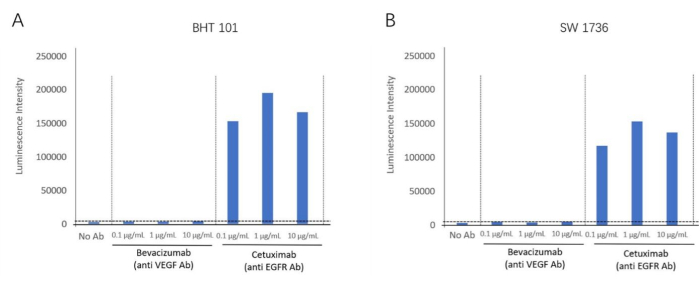
الشكل 4: تحريض أضعاف نشاط ADCC. (أ) يظهر خط خلايا سرطان الغدة الدرقية BHT-101 تأثير ADCC في وجود الجسم المضاد المضاد ل EGFR سيتوكسيماب. (ب) يظهر خط خلايا سرطان الغدة الدرقية SW-1736 تأثير ADCC في وجود الجسم المضاد ل EGFR سيتوكسيماب. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
هنا ، قدمنا طريقة المقايسة الحيوية ADCC لتقييم تفاعل ADCC للجسم المضاد العلاجي. الطريقة واضحة ومباشرة وتستخدم تنسيقا بسيطا "إضافة ومزيج قراءة" للقياس.
قبل إجراء التجربة ، يجب تأكيد التعبير عن المستضد المستهدف في الخلايا المستهدفة إما عن طريق قياس التدفق الخلوي أو النشاف الغربي. سيكون قياس التدفق الخلوي أداة أفضل للكشف عن المستضد السطحي. ومع ذلك ، فإن استخدام قياس التدفق الخلوي يمكن أن يضغط على الخلايا ، مما يتسبب في موت الخلايا المبرمج ويؤثر على صلاحية الخلية ، وبالتالي التحليل الشامل. بالإضافة إلى ذلك ، فإنه يكلف أكثر من النشاف الغربي. في هذه التجربة ، استخدمنا النشاف الغربي كطريقة أسرع وأكثر فعالية من حيث التكلفة لأن المستضدات المستهدفة معروفة بمستضدات سطح الخلية.
تم استخدام خلايا Jurkat المهندسة ، والتي عبرت بثبات عن مستقبل FcγRIIIa ، ومتغير V158 (التقارب العالي) ، وعنصر استجابة NFAT الذي يحفز التعبير عن لوسيفيراز اليراع ، كخلايا مستجيبة. يؤدي تنشيط مسار NFAT إلى إنتاج لوسيفيراز ، ويتم قياس نشاطه في شكل قراءة لمعان. تمثل الإشارة أيضا نشاط شركة أبوظبي للتوزيع (ADCC).
أولا ، يتم تحضين الخلايا المستهدفة (T) بالخلايا المستجيبة (E) في وجود كميات متفاوتة من الأجسام المضادة في ألواح 96 بئرا لمدة 6 ساعات عند 37 درجة مئوية في حاضنة ثاني أكسيد الكربونالمرطبة. المستجيب: يتم استخدام نسبة الهدف 5: 1 لتحسين الإشارة. على سبيل المثال ، تمت إضافة 75,000 خلية مستجيبة إلى 15,000 خلية مستهدفة. في نهاية الحضانة ، يضاف كاشف فحص Bio-Glo luciferase إلى كل بئر ، ويتم تحضينه لمدة 30 دقيقة ، ويتم قياس التلألؤ (RLU ، وحدات لوسيفيراز النسبية) باستخدام قارئ لوحة التلألؤ.
الخطوات الحاسمة الرئيسية في هذا البروتوكول هي: (1) التعامل مع الخلايا المستجيبة. لا ينبغي قلب قارورة الخلية أثناء عملية الذوبان ، أو الصخور برفق ، ويجب استخدامها مباشرة بعد الذوبان لمنع موت الخلايا غير المرغوب فيه أو التأثير على أداء الكشف البيولوجي. (2). من المهم استخدام ألواح دقيقة من البوليسترين الأبيض المكونة من 96 بئرا ذات قاع شفاف ومسطح لقياسات التلألؤ لأن التلألؤ يتم التقاطه من أسفل القارئ.
في هذه الدراسة ، لاحظنا تفاعلات ADCC الأقوى والأضعف للجسم المضاد ل EGFR ، سيتوكسيماب ، اعتمادا على كمية الخلايا المستهدفة وتركيز الأجسام المضادة. بعض الأسباب للتعامل مع معايرة تفاعلات ADCC الضعيفة: (1) تأتي قراءات المقايسة الحيوية لمراسل ADCC من الخلايا المستجيبة (E) ، مع عدد ثابت يبلغ 75,000 خلية لكل بئر في نظام تفاعل ADCC لهذه الدراسة. لذلك ، فإن تحسين جودة الخلايا المستهدفة (T) هو أحد الجوانب التي يمكن تحسينها. كانت نسبة E: T في هذه الدراسة 5: 1 ، والتي يمكن تعديلها حتى 20: 1. (2) يعد تركيز الأجسام المضادة أيضا أحد العوامل المهمة التي تؤثر على تفاعل ADCC. يمكن إجراء التعديلات من خلال التخفيف التسلسلي للأجسام المضادة لاستكشاف نطاق التركيز الأمثل ، وبالتالي تحقيق أقصى استجابة في تقرير ADCC. (3) يعد وقت حضانة الأجسام المضادة والخلايا المستهدفة والخلايا المستجيبة أمرا بالغ الأهمية أيضا للنتائج التجريبية. في هذه الدراسة ، قمنا بتحضين لمدة 6 ساعات ، والتي يمكن تمديدها حتى 24 ساعة لتحقيق تفاعل ADCC الأمثل. (4) بالإضافة إلى ذلك ، يجب أيضا استكشاف تركيز المحلول العازل (IgG منخفض) لمقايسة ADCC. يمكن تحقيق تركيز المصل الأمثل لاستجابة ADCC في حدود 1٪ إلى 10٪.
هذه الطريقة التجريبية سريعة ومباشرة ، مما يسمح بالإكمال في غضون يوم واحد من خلال بروتوكول بسيط "إضافة ومزيج قراءة". النتائج مستقرة وقابلة للاختبار على دفعات. ومع ذلك ، فإن مجموعة المقايسة الحيوية هذه لا تكتشف موت الخلايا مثل طرق ADCC التقليدية التي تستخدم خلايا PBMC أو NK كخلايا مستجيبة12،13. بدلا من ذلك ، فإنه يستخدم مستقبلات FcγRIIIa التي عبر عنها خلايا Jurkat كخلايا مستجيبة ، والتي ستكلف أكثر لأن الخلايا معدلة وراثيا. بالمقارنة مع تجارب ADCC التقليدية13،14 ، فإنه يلغي متطلبات التبرع بالدم من الأفراد الأصحاء ويتجنب العملية المعقدة لاستخراج الخلايا المناعية ، وبالتالي التخفيف من الاختلافات الفردية التي يمكن أن تؤثر على النتائج. إشارات التلألؤ المكتشفة ناتجة عن ارتباط الخلايا المستجيبة بالخلايا المستهدفة ، وليس من الموت الفعلي للخلايا المستهدفة. لذلك ، قد تكون هناك تناقضات مقارنة بطرق الكشف القياسية ADCC. علاوة على ذلك ، يتم استخدام المخزن المؤقت لتفكك الخلايا ، وهو أغلى من التربسين ، لفصل الخلايا الملتصقة للحفاظ على سلامة الغشاء.
يظهر التحليل الجيني لمراسل ADCC دقة واستقرارا ممتازين ، حيث يعمل كطريقة لتحليل الفعالية للكشف الشامل عن أدوية الأجسام المضادة العلاجية. يمكن أن تعمل أيضا كطريقة تحليل نقدية لتوصيف الجزيئات العلاجية وتطويرالعملية 15.
باختصار ، يعد ADCC آلية مناعية مهمة ، ويحمل الكشف الكمي عن ADCC أهمية كبيرة في مجال العلاج المناعي. توفر هذه الطريقة التجريبية وسيلة فعالة للقياس الكمي ل ADCC15.
Disclosures
يعلن جميع المؤلفين عدم وجود تضارب في المصالح.
Acknowledgements
نحن ممتنون للبروفيسور تسنغ (IMCB ، A * STAR) لدعمه هذا العمل. تم دعم هذه الدراسة من قبل مؤسسة الشباب للمؤسسة الوطنية للعلوم الطبيعية في الصين (NSFC) (82202231) ، ومشروع العلوم والتكنولوجيا الطبية والصحية في مقاطعة تشجيانغ ، الصين (2021KY110،2024KY824).
Materials
| Name | Company | Catalog Number | Comments |
| 0.5% Trypsin-EDTA | Gibco | 15400-054 | Dilute 10x in PBS to make 0.05% Trypsin |
| 1x Tris Buffer Saline (TBS) | 1st BASE | BUF-3030-1X1L | For membrane washing in western blotting |
| 1.5 M Tris Buffer, pH 8.8 | 1st BASE | BUF-1419-1L-pH8.8 | For SDS gel preparation |
| 2-Mercaptoethanol | Sigma Aldrich | M7522-100ML | For sample preparation of western blotting |
| 30% Acrylamide/Bis solution | Bio-Rad | #1610158 | For SDS gel preparation |
| 4x Laemmli Buffer | Bio-Rad | #1610747 | For sample preparation of western blotting |
| 96-well white polystyrene microplate with clear flat bottom | Corning Incorporated | 3610 | For ADCC assay |
| ADCC Bioassay Effector cells (0.65 mL) | Promega | G7011 | Includes in ADCC reporter bioassay core kit (Promega G7010), 1 x 1 vial |
| ADCC reporter bioassay core kit | Promega | G7010 | Mentioned as ADCC bioassay kit for ADCC assay in this experiment |
| Ammonium Persulfate | Sigma Aldrich | A3678-25G | For SDS gel preparation |
| Bevacizumab (Humanized Anti VEGF-antibody) | MVASI | - | Use as negative control antibody in ADCC asssay |
| BHT-101 | Leibniz Institute DSMZ | ACC279 | Human anaplastic papillary thyroid cancer cell line |
| Bio-Glo Luciferase Assay Buffer | Promega | G7941 | Includes in ADCC reporter bioassay core kit (Promega G7010), 1 x 10 mL |
| Bio-Glo Luciferase Assay Substrate (Lyophilized) | Promega | G7941 | Includes in ADCC reporter bioassay core kit (Promega G7010), 1 x 1 vial |
| Cell scraper | GenFollower | GD00235 | To remove cell from culture flask |
| Cetuximab (Chimeric anti-EGFR antibody) | ERBITUX | - | Use as therapeutic antibody in ADCC assay |
| Chemiluminescent HRP substrate | Merck Millipore | WBKLS0500 | For protein detection in western blotting |
| Distilled water | Gibco | 15230-162 | For SDS gel preparation |
| Fetal Bovine Serum (FBS) | Gibco | 10270-106 | Culture media supplement |
| iBright CL1500 imaging system | Thermo Scientific | 2462621100038 | For protein detection in western blotting |
| L-glutamine, 200 mM | Gibco | 25030-081 | Culture media supplement |
| Low IgG Serum | Promega | G7110 | Includes in ADCC reporter bioassay core kit (Promega G7010), 1 x 4 mL |
| Megafuge 8R | Thermo Scientific | 42876589 | Centrifuge |
| Mouse anti-EGFR monoclonal antibodies | BD Biosciences | 610016 | Primary antibody in western blotting |
| Mouse anti-VEGFR monoclonal antibodies | BD Biosciences | 571194 | Primary antibody in western blotting |
| non-enzymatic cell dissociation buffer | Sigma Aldrich | C5789-100ML | For cell harvesting from T75 flask |
| Penicillin-Streptomycin | PAN Biotech | P06-07100 | Antibacterial for culture media |
| Phosphate Buffered Saline (PBS), pH 7.2, Sterile filtered | 1st BASE | CUS-2048-1x1L | Use as washing solution for cells |
| Pierce BCA assay kit | Thermo Scientific | 23225 | To measure protein concentration |
| Protease and phosphatase inhibitor | Thermo Scientific | A32959 | For protein digestion in sample preparation for western blotting |
| PVDF membrane (Immobilin-P) | Merck Millipore | IPVH00010 | For protein transfer in western blotting |
| Rabbit anti-mouse IgG, Fcγ HRP-conjugated secondary antibody | Jackson ImmunoResearch | 315-035-046 | Secondary antibody in western blotting |
| Roswell Park Memorial Institute (RPMI) medium | Capricorn Scientific | RPMI-XA | Cell culture media |
| RPMI-1640 | Promega | G7080 | Includes in ADCC reporter bioassay core kit (Promega G7010), 1 x 36 mL |
| Skim milk powder | Merck Millipore | 70166-500G | For membrane blocking in western blotting |
| Sodium Dodecyl Sulfate | 1st BASE | BIO-2050-500g | For SDS gel preparation |
| SW-1736 | Cytion | 300453 | Human thyroid squamous cell cancer cell line |
| T75 culture flasks | SPL Lifesciences | 70075 | Cell culture flask |
| Tecan Multimode Reader model Spark 10M | Tecan | 1607000294 | for luminicence quantification |
| TEMED | Bio-Rad | #1610801 | For SDS gel preparation |
| Tween-20 | Promega | H5151 | For membrane washing in western blotting |
| Vi-cell XR cell viability analyzer | Beckman Coulter | AL15072 | Cell counter |
References
- Zahavi, D., AlDeghaither, D., O'Connell, Enhancing antibody-dependent cell-mediated cytotoxicity: a strategy for improving antibody-based immunotherapy. Antib Ther. 1 (1), 7-12 (2018).
- Fenis, A., Demaria, O., Gauthier, L., Vivier, E. New immune cell engagers for cancer immunotherapy. Nat Rev Immunol. 24 (7), 471-486 (2024).
- Pinto, S., Pahl, J., Schottelius, A., Carter, P. J. Reimagining antibody-dependent cellular cytotoxicity in cancer: the potential of natural killer cell engagers. Trends Immunol. 43 (11), 932-946 (2022).
- Ochoa, M. C., et al. Antibody-dependent cell cytotoxicity: immunotherapy strategies enhancing effector NK cells. Immunol Cell Biol. 95 (4), 347-355 (2017).
- Wang, W., Erbe, A. K., Hank, J. A., Morris, Z. S. NK cell-mediated antibody-dependent cellular cytotoxicity in cancer immunotherapy. Front Immunol. 6, 368 (2015).
- Chung, S., et al. Characterization of in vitro antibody-dependent cell-mediated cytotoxicity activity of therapeutic antibodies - impact of effector cells. J Immunol Methods. 407, 63-75 (2014).
- Shimasaki, N., Jain, A., Campana, D. NK cells for cancer immunotherapy. Nat Rev Drug Discov. 19 (3), 200-218 (2020).
- Cheng, Z. J., et al. Development of a robust reporter-based ADCC assay with frozen, thaw-and-use cells to measure Fc effector function of therapeutic antibodies. J Immunol Methods. 414, 69-81 (2014).
- Parekh, B. S., et al. Development and validation of an antibody-dependent cell-mediated cytotoxicity-reporter gene assay. MAbs. 4 (3), 310-318 (2012).
- Hogarth, P. M., Pietersz, G. A. Fc receptor-targeted therapies for the treatment of inflammation, cancer and beyond. Nat Rev Drug Discov. 11 (4), 311-331 (2012).
- Chung, S., et al. Quantitative evaluation of fucose reducing effects in a humanized antibody on Fcgamma receptor binding and antibody-dependent cell-mediated cytotoxicity activities. MAbs. 4 (3), 326-340 (2012).
- . ADCC Reporter Bioassay Core Kit Technical Manual Available from: https://www.promega.sg/-/media/files/resources/protocols/technical-manuals/101/adcc-reporter-bioassay-core-kit-protocol.pdf?rev=bec36264c0b6470591ded081377d207d&sc_lang=en (2023)
- Miller, A. S., Tejada, M. L., Gazzano-Santoro, H. Methods for measuring antibody-dependent cell-mediated cytotoxicity in vitro. Methods Mol Biol. 1134, 59-65 (2014).
- Lo Nigro, C., et al. NK-mediated antibody-dependent cell-mediated cytotoxicity in solid tumors: biological evidence and clinical perspectives. Ann Transl Med. 7 (5), 105 (2019).
- Gómez Román, V. R., Murray, J. C., Weiner, L. M., Ackerman, M. E., Nimmerjahn, F. . Antibody Fc. , 1-27 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved