Method Article
Valutazione della citotossicità cellulo-mediata anticorpo-dipendente nelle cellule tumorali utilizzando il biotest del reporter di citotossicità cellulo-mediata anticorpo-dipendente
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Qui, presentiamo un protocollo per un test di citotossicità cellulo-mediata (ADCC) anticorpo-dipendente utilizzando un kit di biotest ADCC. Questo metodo offre uno strumento prezioso per chiarire il meccanismo dell'ADCC e valutare il potenziale terapeutico degli anticorpi nell'immunoterapia del cancro.
Abstract
Il metodo per la citotossicità cellulo-mediata (ADCC) anticorpo-dipendente rappresenta uno strumento importante per valutare l'efficacia degli anticorpi terapeutici nell'immunoterapia del cancro. La valutazione dell'attività dell'ADCC nelle cellule tumorali è essenziale per lo sviluppo e l'ottimizzazione di trattamenti basati su anticorpi. Qui, proponiamo un approccio metodologico all'utilizzo di un kit di biodosaggio ADCC per la valutazione quantitativa della reazione ADCC utilizzando cellule tumorali tiroidee come cellule effettrici. Il protocollo prevede la co-coltura di cellule effettrici con cellule tumorali bersaglio in diversi rapporti in presenza di un anticorpo terapeutico. Il kit di biodosaggio ADCC utilizzato in questo esperimento include le cellule effettrici geneticamente modificate che esprimono un gene reporter della luciferasi sotto il controllo degli elementi di risposta del fattore nucleare delle cellule T attivate (NFAT). Dopo il legame dell'antigene di superficie sulle cellule bersaglio con gli anticorpi e le cellule effettrici, le cellule effettrici rilasciano luciferasi, consentendo la quantificazione della citotossicità attraverso la misurazione del segnale di luminescenza. A differenza dei test ADCC convenzionali, questo metodo ha dimostrato il legame dell'antigene bersaglio con gli anticorpi e le cellule effettrici, che possono produrre risultati affidabili in un breve periodo.
Introduzione
La citotossicità cellulo-mediata (ADCC) anticorpo-dipendente è un meccanismo importante attraverso il quale gli anticorpi esercitano effetti immuno-mediati di uccisione cellulare 1,2,3. Le cellule immunitarie vengono attivate legandosi all'anticorpo terapeutico, che interagisce con gli antigeni di superficie delle cellule bersaglio per rilasciare granzimi, la perforina, portando alla morte delle cellule bersaglio. Queste cellule immunitarie includono cellule natural killer (NK) e neutrofili 2,3,4,5,6,7. Il test ADCC è diventato uno strumento importante per valutare l'efficacia dell'anticorpo terapeutico 8,9.
Nel test ADCC convenzionale, le cellule mononucleate del sangue periferico (PBMC) o le cellule natural killer vengono utilizzate come cellule effettrici per monitorare l'efficacia di un anticorpo terapeutico quantificando il tasso di morte cellulare del bersaglio. Il nostro metodo utilizza un kit di biotest ADCC che include cellule effettrici geneticamente modificate che esprimono un gene reporter della luciferasi sotto il controllo degli elementi di risposta del fattore nucleare delle cellule T attivate (NFAT). Quantifichiamo quindi il legame dell'antigene di superficie sulle cellule bersaglio con l'anticorpo e le cellule effettrici. Questo metodo si basa sulla reazione ADCC che si verifica in un breve periodo senza richiedere cellule PBMC umane. Le fasi sperimentali includono la co-coltura di cellule effettrici con cellule bersaglio in presenza di anticorpi terapeutici.
Durante l'incubazione, l'anticorpo terapeutico si lega all'antigene bersaglio sulla superficie delle cellule bersaglio, il che porta al legame delle cellule effettrici e del frammento Fc di un anticorpo. Questo attiva l'elemento di risposta NFAT e rilascia segnali di luminescenza per la valutazione quantitativa della reazione ADCC.
Prima di eseguire l'esperimento, l'espressione dell'antigene bersaglio nelle cellule bersaglio deve essere confermata mediante citometria a flusso o western blotting. Le cellule bersaglio vengono coltivate e fatte passare in piastre a 96 pozzetti per 24 ore prima dell'esperimento. Diverse concentrazioni di un anticorpo terapeutico vengono sommate insieme a diverse conta cellulare di cellule effettrici per ottenere il rapporto calcolato-cellula effettrice/cellula bersaglio.
Le fasi chiave di questo metodo includono (1) la preparazione delle cellule bersaglio e delle cellule effettrici, (2) i rapporti tra cellule effettrici e cellule bersaglio, (3) la preparazione di diverse concentrazioni dell'anticorpo e (4) la durata variabile dell'incubazione. Dopo l'incubazione, i segnali di luminescenza vengono misurati utilizzando un luminometro, fornendo una lettura quantitativa dell'attività dell'ADCC. Rispetto ad altri metodi per misurare l'ADCC, questo metodo è relativamente semplice da utilizzare e i risultati sono accurati.
Il biotest reporter ADCC indica il legame dell'antigene bersaglio, dell'anticorpo terapeutico e delle cellule immunitarie nell'attivazione della via ADCC. Questo legame attiva la trascrizione genica attraverso la via NFAT nelle cellule effettrici Jurkat ingegnerizzate con recettore FcγRIIIa ad espressione stabile, la variante V158 (ad alta affinità). L'elemento di risposta NFAT media l'espressione della luciferasi nelle cellule effettrici10,11. L'attività biologica dell'anticorpo nel meccanismo d'azione (MOA) dell'ADCC è quantificata attraverso il segnale della luciferasi prodotto dalla via NFAT. Il segnale della luciferasi nelle cellule effettrici - cellule di Jurket che esprimono il recettore FcγRIIIa - viene quantificato utilizzando un lettore di luminescenza (Figura 1). Il rapporto segnale/rumore del test è elevato.
Protocollo
1. Identificazione dell'espressione di EGFR e VEGFR in cellule bersaglio
NOTA: Utilizzare il western blotting per rilevare l'espressione dell'antigene bersaglio nelle cellule bersaglio.
- Preparazione del campione
- Coltura delle cellule (linee cellulari di carcinoma tiroideo umano BHT-101 e SW-1736) in fiasche T75 utilizzando il terreno del Roswell Park Memorial Institute (RPMI) integrato con il 10% di siero fetale bovino (FBS), l'1% di L-glutammina e l'1% di antibiotici (penicillina-streptomicina).
- Raccogliere le cellule quando sono confluenti all'80% rimuovendo il terreno di coltura e lavando le cellule con PBS. Aggiungere 5 mL di PBS e raschiare le cellule utilizzando un raschietto per rimuovere le cellule dal pallone di coltura. Trasferire le cellule in una provetta conica da 15 mL.
- Contare le celle con un contatore di celle.
- Aliquotare 5 × 106 cellule BHT-101 e SW-1736 in provette coniche da 15 mL.
- Centrifugare le celle a 135 × g per 5 minuti a temperatura ambiente. Rimuovere il surnatante PBS.
- Lisi il pellet cellulare aggiungendo 100 μl di tampone di lisi RIPA contenente inibitori della proteasi-fosfatasi per 5 minuti su ghiaccio. Trasferire il lisato in una provetta da 2 ml, centrifugare a 15.000 × g per 15 minuti e trasferire il surnatante in una nuova provetta da 2 ml.
- Misurare la concentrazione proteica del lisato cellulare utilizzando un kit di dosaggio dell'acido bicinconninico (BCA).
- Aliquotare 70 μg di proteine dal lisato cellulare da ciascun campione, aggiungere 2 tamponi per campioni di Laemmli integrati con 2-mercaptoetanolo al 10% e far bollire i campioni a 100 °C per 5 minuti per la denaturazione dei campioni.
- Elettroforesi su gel e trasferimento di membrana
- Preparare il gel di poliacrilammide dodecil solfato di sodio (SDS) all'8% utilizzando acqua distillata (4,7 mL), acrilammide al 30% (2,7 mL), tampone Tris 1,5 M, pH 8,8 (2,5 mL), dodecil solfato di sodio al 10% (0,1 mL), persolfato di ammonio al 10% (100 μL) e TEMED (10 μL).
- Eseguire 70 μg di campioni denaturati nel gel di poliacrilammide SDS all'8% a 80 V per 20 minuti e a 120 V per 100 minuti.
- Trasferire la proteina sul gel su una membrana di fluoruro di polivinilidene (PVDF) a 100 V per 90 minuti.
- Dopo il trasferimento, bloccare la membrana con latte scremato al 7% diluito in tampone TBS-T (20 mM Tris pH 7,6, 140 mM NaCl, 0,2% Tween-20) per 1 ora.
- Incubazione degli anticorpi
- Incubare la membrana ostruita con anticorpi monoclonali anti-recettore del fattore di crescita epidermico (EGFR) di topo e anti-recettore del fattore di crescita endoteliale vascolare (VEGFR) di coniglio (diluiti a 1:1.000 in latte scremato al 7%) per una notte a 4 °C.
- Dopo l'incubazione, lavare accuratamente la membrana con tampone Saline-Tween (TBS-T) tamponato con Tris (20 mM Tris pH 7,6, 140 mM NaCl, 0,2% Tween-20) per 7 minuti e ripetere 4 volte.
- Incubare la membrana con l'anticorpo secondario coniugato HRP (diluito a 1:4.000 in latte scremato al 7% (TBS-T)) per 1 ora.
- Dopo l'incubazione, lavare accuratamente la membrana con tampone TBS-T per 7 minuti e ripetere 4 volte.
- Rilevamento di proteine
- Incubare la membrana nel substrato chemiluminescente HRP preparato mescolando 1 mL di soluzione di perossido di substrato HRP con 1 mL di reagente Luminol del substrato HRP (entrambi i reagenti provengono dal kit del substrato chemiluminescente) per 2 minuti.
- Visualizzare la membrana utilizzando un sistema di imaging.
2. Preparazione delle cellule bersaglio
- Colture esponenziali delle cellule T bersaglio, BHT-101 e SW-1736 fino a quando l'80% di confluenza in terreni RPMI integrati con il 10% di FBS, l'1% di L-glutammina e l'1% di antibiotici (penicillina-streptomicina) in fiasche di T-75.
- Dopo aver rimosso il terreno, lavare le celle una volta con PBS. Incubare le cellule con 1 ml di tampone di dissociazione cellulare non enzimatico per 5 minuti per rimuovere le cellule aderenti. Aggiungere PBS per fermare la reazione del tampone di dissociazione cellulare non enzimatico. Centrifugare le cellule a 135 × g per 5 minuti e aggiungere 5 ml di PBS.
NOTA: In questo caso, utilizziamo un tampone di dissociazione cellulare non enzimatico per preservare l'integrità delle proteine della superficie di membrana. - Contare le cellule e seminarle a 15.000 cellule/pozzetti in micropiastre di polistirene bianco a 96 pozzetti con fondo piatto e trasparente.
3. Preparazione di concentrazioni variabili dell'anticorpo terapeutico
- Per seguire questo protocollo, utilizzare Cetuximab (anticorpo chimerico anti-EGFR) per legare l'EGFR e utilizzare Bevacizumab (anticorpo umanizzato anti VEGF-A) come controllo negativo.
- Preparare il tampone ADCC Bioassay aggiungendo 1,4 mL di siero a basse IgG in 33,6 mL di RPMI-1640 (fornito nel kit).
- Utilizzare il tampone ADCC Bioassay per la diluizione degli anticorpi. Preparare 400 μL di ciascun anticorpo in tre diverse concentrazioni: 30 μg/mL, 3 μg/mL e 0,3 μg/mL (concentrazione 3x) per ottenere la concentrazione finale di 10 μg/mL, 1 μg/mL e 0,1 μg/mL per una copertura ad ampio spettro per rilevare la dose ottimale.
NOTA: Le concentrazioni finali di anticorpi si basano su 25 μL di cellule bersaglio in coltura, 25 μL di cellule effettrici e 25 μL di anticorpi in ciascun pozzetto di una piastra a 96 pozzetti.
4. Preparazione delle cellule effettrici
- Conservare le celle effettrici a -80 °C prima dell'uso.
- Preriscaldare il tampone ADCC Bioassay a bagnomaria a 37 °C per almeno 30 minuti prima dell'uso.
- Scongelare le cellule effettrici ADCC Bioassay da celle frigorifere a -80 °C mettendole in un bagno d'acqua a 37 °C (circa 2-3 minuti). Scuotere delicatamente e ispezionare visivamente la fiala, ma non capovolgerla durante il processo di scongelamento.
- Trasferire 630 ul di cellule effettrici in una provetta da 15 mL contenente 3,6 mL di tampone per saggi ADCC. Mescolare bene capovolgendo delicatamente il tubo 2 volte.
5. Incubazione di cellule effettrici con anticorpi e cellule bersaglio
- Dopo un'incubazione notturna, rimuovere il terreno dalle cellule bersaglio (15.000 cellule tumorali per pozzetto) e aggiungere 25 μl del tampone ADCC Bioassay e 25 μl di Cetuximab (antagonista dell'EGFR) e Bevacizumab (antagonista del VEGF) per ottenere la concentrazione finale di 0,1 μg/mL, 1 μg/mL o 10 μg/mL delle cellule bersaglio in ciascun pozzetto secondo la Figura 2.
- Aggiungere 75.000 cellule effettrici in 25 μl di tampone per biodosaggio ADCC per pozzetto nella micropiastra a 96 pozzetti contenente le cellule bersaglio. I pozzetti etichettati come No mAb agiscono come nessun controllo anticorpale (Figura 2).
- Aggiungere il tampone ADCC Bioassay ai pozzetti etichettati come AB (ADCC Bioassay buffer) per il controllo in bianco.
- Incubare la piastra per 6 ore.
6. Lettura quantitativa dell'attività dell'ADCC
- Preparare il reagente del dosaggio della luciferasi 4 ore prima della misurazione aggiungendo il tampone del saggio della luciferasi al substrato del saggio della luciferasi (liofilizzato).
- Dopo 6 ore di incubazione delle cellule bersaglio, degli anticorpi e delle cellule effettrici, aggiungere 75 μl di reagente del saggio della luciferasi a ciascun pozzetto e incubare per 30 minuti.
- Dopo il periodo di incubazione, misurare il segnale di luminescenza in ciascun pozzetto utilizzando un luminometro, fornendo una lettura quantitativa dell'attività dell'ADCC.
- Per l'analisi dei dati, calcolare l'induzione della piega come segue:
Induzione del fold = RLU (anticorpi indotti - background) / RLU (nessun controllo anticorpale - background).
Dove RLU è l'unità di luminescenza relativa; Gli anticorpi indotti sono i pozzetti da B3 a B8 e da C3 a C8; Nessun controllo anticorpale = B2 e C2; Background = RLU medio dal pozzo A2 ad A5 (Figura 2).
Risultati
L'espressione di EGFR e VEGFR nelle cellule bersaglio BHT-101 e SW-1736 è stata rilevata mediante western blotting. L'espressione di EGFR è stata rilevata in entrambe le cellule BHT-101 e SW-1736, ma non l'espressione di VEGFR (Figura 3).
Utilizzando il kit di biodosaggio ADCC, abbiamo rilevato la reazione ADCC dell'anticorpo anti-EGFR, cetuximab, utilizzando linee cellulari EGFR-positive, BHT-101 e SW-1736, come cellule bersaglio. Il bevacizumab, un inattivatore del VEGF, è stato utilizzato come anticorpo di controllo negativo. Diverse concentrazioni di anticorpi e cellule effettrici sono state incubate con le cellule bersaglio. Il segnale di luminescenza è stato rilevato utilizzando un lettore di piastre (Figura 2). Una maggiore riduzione dell'induzione dell'attività dell'ADCC è stata riscontrata nei gruppi trattati con cetuximab (anticorpi anti-EGFR), ma non è stata osservata alcuna attività dell'ADCC in Bevacizumab (antagonista del VEGF) per entrambe le linee cellulari. Ciò ha dimostrato l'effetto dell'ADCC mirato agli antigeni di membrana extracellulare dell'EGFR per entrambe le linee cellulari. Utilizzando questo metodo, la reazione ADCC è stata convalidata in presenza di Cetuximab in due linee cellulari di carcinoma tiroideo anaplastico (BHT101 e SW1736) (Figura 4).
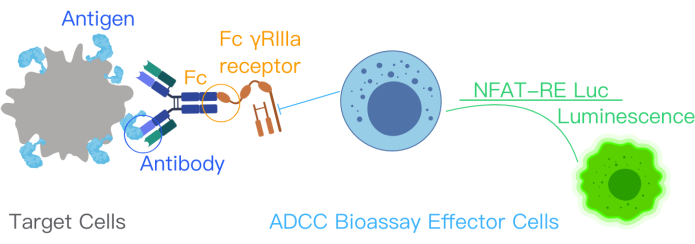
Figura 1: Un diagramma schematico che mostra la reazione dell'ADCC con il kit di biodosaggio ADCC. I siti di legame dell'antigene nell'anticorpo terapeutico si legano agli antigeni di superficie nelle cellule bersaglio. Questo legame porta al legame della porzione Fc dell'anticorpo ai recettori FcƳRIIIa delle cellule effettrici, che sono state geneticamente modificate con NFAT-RE luc, producendo un segnale di luminescenza nelle cellule effettrici. Questa figura è stata modificata dal manuale del kit ADCC Reporter Bioassay Core con il permesso12. Abbreviazioni: ADCC = citotossicità cellulo-mediata anticorpo-dipendente; Fc = regione cristallizzabile del frammento; NFAT = Fattore nucleare della cellula T attivata; RE = Elemento di risposta; luc = Luciferasi. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Lettura della luminescenza e diagramma sperimentale del design della piastra a 96 pozzetti del sistema di co-coltura ADCC. I segnali di luminescenza vengono letti da un lettore di luminescenza. Fila A: i pozzettida 1 ° a 9contengono il tampone ADCC Bioassay. Fila B: i pozzettida 3 a 8contengono il sistema di reazione ADCC di BHT101 (cellule bersaglio + anticorpo + cellule effettrici). Il 2° pozzetto è senza anticorpi. Il 9° pozzetto contiene solo il tampone ADCC Bioassay. Fila C: i pozzettida 3 a 8contengono il sistema di reazione ADCC di SW-1736 (cellula bersaglio + anticorpo + cellule effettrici). Il 2° pozzetto è senza anticorpi. Il 9° pozzetto contiene solo il tampone ADCC Bioassay. Fila D: i pozzettida 1 ° a 9contengono tampone di saggio. Abbreviazioni: ADCC = citotossicità cellulo-mediata anticorpo-dipendente; AB = tampone per il biodosaggio ADCC; VEGFR = Recettore del fattore di crescita dell'epitelio vascolare; EGFR = Recettore del Fattore di Crescita Epidermico; mAb = anticorpo monoclonale. Clicca qui per visualizzare una versione più grande di questa figura.
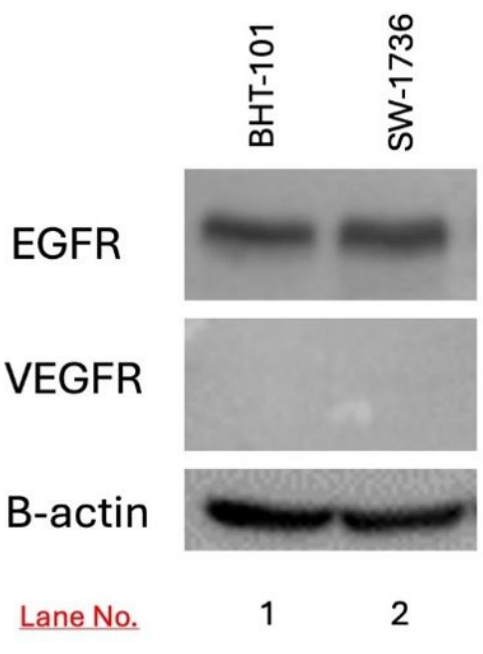
Figura 3: Rilevamento dell'espressione di EGFR e VEGFR nel carcinoma tiroideo BHT-101 e SW-1736 mediante western blotting. L'espressione di EGFR, ma non di VEGFR, è stata rilevata in entrambe le linee cellulari. La b-actina è stata utilizzata come controllo del carico. Abbreviazioni: EGFR = recettore del fattore di crescita epidermico; VEGFR = fattore di crescita vascolare dell'epidermide. Clicca qui per visualizzare una versione più grande di questa figura.
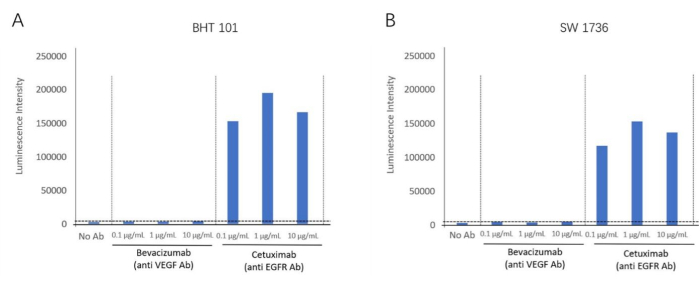
Figura 4: Induzione del fold dell'attività dell'ADCC. (A) La linea cellulare di carcinoma tiroideo BHT-101 mostra un effetto ADCC in presenza dell'anticorpo anti-EGFR Cetuximab. (B) La linea cellulare di carcinoma tiroideo SW-1736 mostra un effetto ADCC in presenza dell'anticorpo anti-EGFR Cetuximab. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Qui, abbiamo presentato il metodo ADCC Bioassay per valutare la reazione ADCC di un anticorpo terapeutico. Il metodo è semplice e utilizza un semplice formato "aggiungi-mix-leggi" per la misurazione.
Prima di eseguire l'esperimento, l'espressione dell'antigene bersaglio nelle cellule bersaglio deve essere confermata mediante citometria a flusso o western blotting. La citometria a flusso sarà uno strumento migliore per rilevare l'antigene di superficie. Tuttavia, l'uso della citometria a flusso può stressare le cellule, causando apoptosi e influenzando la vitalità della cellula e, quindi, l'analisi complessiva. Inoltre, costa più del western blotting. In questo esperimento, abbiamo utilizzato il western blotting come metodo più rapido ed economico perché gli antigeni mirati sono noti antigeni di superficie cellulare.
Come cellule effettrici sono state utilizzate cellule Jurkat ingegnerizzate, che esprimevano stabilmente il recettore FcγRIIIa, la variante V158 (alta affinità) e un elemento di risposta NFAT che guida l'espressione della luciferasi della lucciola. L'attivazione della via NFAT provoca la produzione di luciferasi e la sua attività è quantificata sotto forma di lettura della luminescenza. Il segnale rappresenta anche l'attività dell'ADCC.
In primo luogo, le cellule bersaglio (T) vengono incubate con cellule effettrici (E) in presenza di quantità variabili di anticorpi in piastre a 96 pozzetti per 6 ore a 37 °C in un incubatore di CO2 umidificato. Il rapporto effettore:target di 5:1 viene utilizzato per ottimizzare il segnale. Ad esempio, 75.000 cellule effettrici sono state aggiunte a 15.000 cellule bersaglio. Al termine dell'incubazione, il reagente del saggio della luciferasi Bio-Glo viene aggiunto a ciascun pozzetto, incubato per 30 minuti e la luminescenza (RLU, unità relative di luciferasi) viene misurata utilizzando un lettore di piastre a luminescenza.
I passaggi critici chiave di questo protocollo sono: (1) La manipolazione delle cellule effettrici. La fiala di cellule non deve essere capovolta durante il processo di scongelamento, ma deve essere utilizzata delicatamente e deve essere utilizzata immediatamente dopo lo scongelamento per prevenire la morte cellulare indesiderata o influire sulle prestazioni del rilevamento biologico. (2). È importante utilizzare micropiastre a 96 pozzetti in polistirene bianco con fondo piatto e trasparente per le misurazioni della luminescenza perché la luminescenza viene catturata dal fondo del lettore.
In questo studio, abbiamo osservato le reazioni ADCC più forti e più deboli dell'anticorpo anti-EGFR, cetuximab, a seconda della quantità di cellule bersaglio e della concentrazione di anticorpi. Alcuni motivi per gestire la calibrazione delle reazioni ADCC deboli: (1) Le letture del biotest reporter ADCC provengono da cellule effettrici (E), con un numero costante di 75.000 cellule per pozzetto nel sistema di reazione ADCC di questo studio. Pertanto, l'ottimizzazione della qualità delle cellule bersaglio (T) è un aspetto che può essere migliorato. Il rapporto E:T in questo studio era di 5:1, che poteva essere regolato fino a 20:1. (2) Anche la concentrazione di anticorpi è uno dei fattori importanti che influenzano la reazione dell'ADCC. Gli aggiustamenti possono essere effettuati attraverso la diluizione seriale degli anticorpi per esplorare l'intervallo di concentrazione ottimale, ottenendo così la massima risposta nel rapporto ADCC. (3) Anche il tempo di incubazione degli anticorpi, delle cellule bersaglio e delle cellule effettrici è cruciale per i risultati sperimentali. In questo studio, abbiamo incubato per 6 ore, che possono essere estese fino a 24 ore per ottenere la reazione ADCC ottimale. (4) Inoltre, è necessario esplorare anche la concentrazione della soluzione tampone (basse IgG) per il test ADCC. La concentrazione sierica ottimale per la risposta all'ADCC può essere raggiunta nell'intervallo compreso tra l'1% e il 10%.
Questo metodo sperimentale è rapido e semplice, consentendo il completamento entro un giorno attraverso un semplice protocollo "add-mix-read". I risultati sono stabili e suscettibili di test in batch. Tuttavia, questo kit di biotest non rileva la morte cellulare come i metodi ADCC convenzionali che utilizzano cellule PBMC o NK come cellule effettrici12,13. Invece, utilizza cellule Jurkat espresse dal recettore FcγRIIIa come cellule effettrici, che costeranno di più perché le cellule sono geneticamente modificate. Rispetto ai tradizionali esperimenti ADCC13,14, elimina la necessità di donazioni di sangue da individui sani ed evita il complesso processo di estrazione delle cellule immunitarie, mitigando così le variazioni individuali che potrebbero influire sui risultati. I segnali di luminescenza rilevati provengono dal legame delle cellule effettrici alle cellule bersaglio, non dalla morte effettiva delle cellule bersaglio. Pertanto, potrebbero esserci discrepanze rispetto ai metodi di rilevamento ADCC standard. Inoltre, il tampone di dissociazione cellulare, che è più costoso della tripsina, viene utilizzato per staccare le cellule aderenti per mantenere l'integrità della membrana.
L'analisi del gene reporter ADCC dimostra un'eccellente accuratezza e stabilità, fungendo da metodo di analisi dell'efficacia per la rilevazione di massa di farmaci anticorpali terapeutici. Può anche funzionare come metodo di analisi critico per la caratterizzazione di molecole terapeutiche e lo sviluppo di processi15.
In sintesi, l'ADCC è un importante meccanismo immunitario e la rilevazione quantitativa dell'ADCC riveste una grande importanza nel campo dell'immunoterapia. Questo metodo sperimentale offre un mezzo efficace per la misurazione quantitativa dell'ADCC15.
Divulgazioni
Tutti gli autori dichiarano di non avere conflitti di interesse.
Riconoscimenti
Siamo grati al Prof. Zeng (IMCB, A*STAR) per aver sostenuto questo lavoro. Questo studio è stato sostenuto dalla Youth Foundation of National Natural Science Foundation of China (NSFC) (82202231) e dal Medical and Health Science and Technology Project della provincia di Zhejiang, Cina (2021KY110,2024KY824).
Materiali
| Name | Company | Catalog Number | Comments |
| 0.5% Trypsin-EDTA | Gibco | 15400-054 | Dilute 10x in PBS to make 0.05% Trypsin |
| 1x Tris Buffer Saline (TBS) | 1st BASE | BUF-3030-1X1L | For membrane washing in western blotting |
| 1.5 M Tris Buffer, pH 8.8 | 1st BASE | BUF-1419-1L-pH8.8 | For SDS gel preparation |
| 2-Mercaptoethanol | Sigma Aldrich | M7522-100ML | For sample preparation of western blotting |
| 30% Acrylamide/Bis solution | Bio-Rad | #1610158 | For SDS gel preparation |
| 4x Laemmli Buffer | Bio-Rad | #1610747 | For sample preparation of western blotting |
| 96-well white polystyrene microplate with clear flat bottom | Corning Incorporated | 3610 | For ADCC assay |
| ADCC Bioassay Effector cells (0.65 mL) | Promega | G7011 | Includes in ADCC reporter bioassay core kit (Promega G7010), 1 x 1 vial |
| ADCC reporter bioassay core kit | Promega | G7010 | Mentioned as ADCC bioassay kit for ADCC assay in this experiment |
| Ammonium Persulfate | Sigma Aldrich | A3678-25G | For SDS gel preparation |
| Bevacizumab (Humanized Anti VEGF-antibody) | MVASI | - | Use as negative control antibody in ADCC asssay |
| BHT-101 | Leibniz Institute DSMZ | ACC279 | Human anaplastic papillary thyroid cancer cell line |
| Bio-Glo Luciferase Assay Buffer | Promega | G7941 | Includes in ADCC reporter bioassay core kit (Promega G7010), 1 x 10 mL |
| Bio-Glo Luciferase Assay Substrate (Lyophilized) | Promega | G7941 | Includes in ADCC reporter bioassay core kit (Promega G7010), 1 x 1 vial |
| Cell scraper | GenFollower | GD00235 | To remove cell from culture flask |
| Cetuximab (Chimeric anti-EGFR antibody) | ERBITUX | - | Use as therapeutic antibody in ADCC assay |
| Chemiluminescent HRP substrate | Merck Millipore | WBKLS0500 | For protein detection in western blotting |
| Distilled water | Gibco | 15230-162 | For SDS gel preparation |
| Fetal Bovine Serum (FBS) | Gibco | 10270-106 | Culture media supplement |
| iBright CL1500 imaging system | Thermo Scientific | 2462621100038 | For protein detection in western blotting |
| L-glutamine, 200 mM | Gibco | 25030-081 | Culture media supplement |
| Low IgG Serum | Promega | G7110 | Includes in ADCC reporter bioassay core kit (Promega G7010), 1 x 4 mL |
| Megafuge 8R | Thermo Scientific | 42876589 | Centrifuge |
| Mouse anti-EGFR monoclonal antibodies | BD Biosciences | 610016 | Primary antibody in western blotting |
| Mouse anti-VEGFR monoclonal antibodies | BD Biosciences | 571194 | Primary antibody in western blotting |
| non-enzymatic cell dissociation buffer | Sigma Aldrich | C5789-100ML | For cell harvesting from T75 flask |
| Penicillin-Streptomycin | PAN Biotech | P06-07100 | Antibacterial for culture media |
| Phosphate Buffered Saline (PBS), pH 7.2, Sterile filtered | 1st BASE | CUS-2048-1x1L | Use as washing solution for cells |
| Pierce BCA assay kit | Thermo Scientific | 23225 | To measure protein concentration |
| Protease and phosphatase inhibitor | Thermo Scientific | A32959 | For protein digestion in sample preparation for western blotting |
| PVDF membrane (Immobilin-P) | Merck Millipore | IPVH00010 | For protein transfer in western blotting |
| Rabbit anti-mouse IgG, Fcγ HRP-conjugated secondary antibody | Jackson ImmunoResearch | 315-035-046 | Secondary antibody in western blotting |
| Roswell Park Memorial Institute (RPMI) medium | Capricorn Scientific | RPMI-XA | Cell culture media |
| RPMI-1640 | Promega | G7080 | Includes in ADCC reporter bioassay core kit (Promega G7010), 1 x 36 mL |
| Skim milk powder | Merck Millipore | 70166-500G | For membrane blocking in western blotting |
| Sodium Dodecyl Sulfate | 1st BASE | BIO-2050-500g | For SDS gel preparation |
| SW-1736 | Cytion | 300453 | Human thyroid squamous cell cancer cell line |
| T75 culture flasks | SPL Lifesciences | 70075 | Cell culture flask |
| Tecan Multimode Reader model Spark 10M | Tecan | 1607000294 | for luminicence quantification |
| TEMED | Bio-Rad | #1610801 | For SDS gel preparation |
| Tween-20 | Promega | H5151 | For membrane washing in western blotting |
| Vi-cell XR cell viability analyzer | Beckman Coulter | AL15072 | Cell counter |
Riferimenti
- Zahavi, D., AlDeghaither, D., O'Connell, Enhancing antibody-dependent cell-mediated cytotoxicity: a strategy for improving antibody-based immunotherapy. Antib Ther. 1 (1), 7-12 (2018).
- Fenis, A., Demaria, O., Gauthier, L., Vivier, E. New immune cell engagers for cancer immunotherapy. Nat Rev Immunol. 24 (7), 471-486 (2024).
- Pinto, S., Pahl, J., Schottelius, A., Carter, P. J. Reimagining antibody-dependent cellular cytotoxicity in cancer: the potential of natural killer cell engagers. Trends Immunol. 43 (11), 932-946 (2022).
- Ochoa, M. C., et al. Antibody-dependent cell cytotoxicity: immunotherapy strategies enhancing effector NK cells. Immunol Cell Biol. 95 (4), 347-355 (2017).
- Wang, W., Erbe, A. K., Hank, J. A., Morris, Z. S. NK cell-mediated antibody-dependent cellular cytotoxicity in cancer immunotherapy. Front Immunol. 6, 368 (2015).
- Chung, S., et al. Characterization of in vitro antibody-dependent cell-mediated cytotoxicity activity of therapeutic antibodies - impact of effector cells. J Immunol Methods. 407, 63-75 (2014).
- Shimasaki, N., Jain, A., Campana, D. NK cells for cancer immunotherapy. Nat Rev Drug Discov. 19 (3), 200-218 (2020).
- Cheng, Z. J., et al. Development of a robust reporter-based ADCC assay with frozen, thaw-and-use cells to measure Fc effector function of therapeutic antibodies. J Immunol Methods. 414, 69-81 (2014).
- Parekh, B. S., et al. Development and validation of an antibody-dependent cell-mediated cytotoxicity-reporter gene assay. MAbs. 4 (3), 310-318 (2012).
- Hogarth, P. M., Pietersz, G. A. Fc receptor-targeted therapies for the treatment of inflammation, cancer and beyond. Nat Rev Drug Discov. 11 (4), 311-331 (2012).
- Chung, S., et al. Quantitative evaluation of fucose reducing effects in a humanized antibody on Fcgamma receptor binding and antibody-dependent cell-mediated cytotoxicity activities. MAbs. 4 (3), 326-340 (2012).
- . ADCC Reporter Bioassay Core Kit Technical Manual Available from: https://www.promega.sg/-/media/files/resources/protocols/technical-manuals/101/adcc-reporter-bioassay-core-kit-protocol.pdf?rev=bec36264c0b6470591ded081377d207d&sc_lang=en (2023)
- Miller, A. S., Tejada, M. L., Gazzano-Santoro, H. Methods for measuring antibody-dependent cell-mediated cytotoxicity in vitro. Methods Mol Biol. 1134, 59-65 (2014).
- Lo Nigro, C., et al. NK-mediated antibody-dependent cell-mediated cytotoxicity in solid tumors: biological evidence and clinical perspectives. Ann Transl Med. 7 (5), 105 (2019).
- Gómez Román, V. R., Murray, J. C., Weiner, L. M., Ackerman, M. E., Nimmerjahn, F. . Antibody Fc. , 1-27 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon