Method Article
使用抗体依赖性细胞介导的细胞毒性报告基因生物测定评估癌细胞中抗体依赖性、细胞介导的细胞毒性
* 这些作者具有相同的贡献
摘要
在这里,我们提出了一种使用 ADCC 生物测定试剂盒进行抗体依赖性、细胞介导的细胞毒性 (ADCC) 测定的方案。该方法为阐明 ADCC 机制和评估抗体在癌症免疫治疗中的治疗潜力提供了有价值的工具。
摘要
抗体依赖性细胞介导的细胞毒性 (ADCC) 方法代表了评估治疗性抗体在癌症免疫治疗中疗效的重要工具。评估癌细胞中的 ADCC 活性对于开发和优化基于抗体的治疗方法至关重要。在这里,我们提出了一种利用 ADCC 生物测定试剂盒使用甲状腺癌细胞作为效应细胞定量评估 ADCC 反应的方法。该方案涉及在治疗性抗体存在下以不同比例将效应细胞与靶癌细胞共培养。本实验中使用的 ADCC 生物测定试剂盒包括在活化 T 细胞核因子 (NFAT) 反应元件控制下表达荧光素酶报告基因的基因工程效应细胞。当靶细胞上的表面抗原与抗体和效应细胞结合后,效应细胞释放荧光素酶,从而能够通过测量发光信号来定量细胞毒性。与传统的 ADCC 检测相比,该方法证明了靶抗原与抗体和效应细胞的结合,可以在短时间内产生可靠的结果。
引言
抗体依赖性细胞介导的细胞毒性 (ADCC) 是抗体发挥免疫介导的细胞杀伤作用的重要机制 1,2,3。免疫细胞通过与治疗性抗体结合而被激活,治疗性抗体与靶细胞的表面抗原相互作用,释放出颗粒酶、穿孔素,导致靶细胞死亡。这些免疫细胞包括自然杀伤 (NK) 细胞和中性粒细胞 2,3,4,5,6,7。ADCC 测定已成为评估治疗性抗体疗效的重要工具 8,9。
在传统的 ADCC 测定中,外周血单核细胞 (PBMC) 或自然杀伤细胞用作效应细胞,通过定量靶标的细胞死亡率来监测治疗性抗体的疗效。我们的方法使用 ADCC 生物测定试剂盒,该试剂盒包括在活化 T 细胞核因子 (NFAT) 反应元件控制下表达荧光素酶报告基因的基因工程效应细胞。然后,我们量化靶细胞上的表面抗原与抗体和效应细胞的结合。该方法基于短时间内发生的 ADCC 反应,无需人 PBMC 细胞。实验步骤包括在治疗性抗体存在下效应细胞与靶细胞共培养。
在孵育过程中,治疗性抗体与靶细胞表面的靶抗原结合,从而导致效应细胞与抗体的 Fc 片段结合。这会激活 NFAT 响应元件并释放发光信号,用于定量评估 ADCC 反应。
在进行实验之前,必须通过流式细胞术或蛋白质印迹法确认靶抗原在靶细胞中的表达。在实验前培养靶细胞并传代到96孔板中24小时。将不同浓度的治疗性抗体与不同细胞计数的效应细胞相加,以达到计算出的效应细胞与靶细胞比率。
该方法的关键步骤包括 (1) 制备靶细胞和效应细胞,(2) 效应细胞与靶细胞的比例,(3) 制备不同浓度的抗体,以及 (4) 不同的孵育持续时间。孵育后,使用发光计测量发光信号,提供 ADCC 活性的定量读数。与其他测量 ADCC 的方法相比,这种方法作相对简单,结果准确。
ADCC 报告基因生物测定表明靶抗原、治疗性抗体和免疫细胞在 ADCC 通路激活中的结合。这种结合通过效应细胞工程 Jurkat 细胞中的 NFAT 通路激活基因转录,该细胞具有稳定表达的 FcγRIIIa 受体,即 V158(高亲和力)变体。NFAT 反应元件介导效应细胞中荧光素酶的表达10,11。抗体在 ADCC 作用机制 (MOA) 中的生物活性通过 NFAT 通路产生的荧光素酶信号进行量化。使用发光读取器定量效应细胞 - 表达FcγRIIIa受体的Jurket细胞 - 中的荧光素酶信号(图1)。该测定的信噪比很高。
研究方案
1. 检测靶细胞中的 EGFR 和 VEGFR 表达
注:使用 western blotting 检测靶细胞中靶抗原的表达。
- 样品制备
- 使用补充有 10% 胎牛血清 (FBS)、1% L-谷氨酰胺和 1% 抗生素(青霉素-链霉素)的罗斯威尔公园纪念研究所 (RPMI) 培养基,在 T75 培养瓶中培养细胞(BHT-101 和 SW-1736 人甲状腺癌细胞系)。
- 当细胞汇合度达到 80% 时,通过去除培养基并用 PBS 洗涤细胞来收获细胞。加入 5 mL PBS,使用细胞刮刀刮除细胞,从培养瓶中取出细胞。将细胞转移到 15 mL 锥形管中。
- 用细胞计数器计数细胞。
- 将 5 × 10、6 个 BHT-101 和 SW-1736 细胞分装到 15 mL 锥形管中。
- 在室温下以 135 × g 离心细胞 5 分钟。去除上清液 PBS。
- 通过在冰上加入 100 μL 含有蛋白酶-磷酸酶抑制剂的 RIPA 裂解缓冲液 5 分钟来裂解细胞沉淀。将裂解物转移至 2 mL 试管中,以 15,000 × g 离心 15 分钟,然后将上清液转移到新的 2 mL 试管中。
- 使用二辛可宁酸 (BCA) 检测试剂盒测量细胞裂解物的蛋白质浓度。
- 从每个样品的细胞裂解物中分装 70 μg 蛋白质,加入 2x Laemmli 样品缓冲液,补充有 10% 2-巯基乙醇,并将样品在 100 °C 下煮沸 5 分钟以使样品变性。
- 凝胶电泳和膜转移
- 使用蒸馏水 (4.7 mL)、30% 丙烯酰胺 (2.7 mL)、1.5 M Tris 缓冲液、pH 8.8 (2.5 mL)、10% 十二烷基硫酸钠 (0.1 mL)、10% 过硫酸铵 (100 μL) 和 TEMED (10 μL) 制备 8% 十二烷基硫酸钠 (SDS) 聚丙烯酰胺凝胶。
- 在 80 V 下在 8% SDS-聚丙烯酰胺凝胶中运行 70 μg 变性样品 20 分钟,在 120 V 下运行 100 分钟。
- 将凝胶上的蛋白质在 100 V 下转移到聚偏二氟乙烯 (PVDF) 膜上 90 分钟。
- 转移后,用在 TBS-T 缓冲液(20 mM Tris pH 7.6、140 mM NaCl、0.2% Tween-20)中稀释的 7% 脱脂牛奶封闭膜 1 小时。
- 抗体孵育
- 将封闭的膜与小鼠抗表皮生长因子受体 (EGFR) 和兔抗血管内皮生长因子受体 (VEGFR) 单克隆抗体(在 7% 脱脂牛奶中以 1:1,000 稀释)在 4 °C 下孵育过夜。
- 孵育后,用 Tris 缓冲盐水 - 吐温 (TBS-T) 缓冲液(20 mM Tris pH 7.6、140 mM NaCl、0.2% 吐温-20)彻底洗涤膜 7 分钟,然后重复 4 次。
- 将膜与 HRP 偶联的二抗(在 7% 脱脂牛奶 (TBS-T) 中以 1:4,000 稀释))孵育 1 小时。
- 孵育后,用 TBS-T 缓冲液彻底洗涤膜 7 分钟,然后重复 4 次。
- 蛋白质检测
- 通过将 1 mL HRP 底物过氧化物溶液与 1 mL HRP 底物鲁米诺试剂(两种试剂均来自化学发光底物试剂盒)混合制备的化学发光 HRP 底物中孵育膜 2 分钟。
- 使用成像系统可视化膜。
2. 靶细胞的制备
- 在 T-75 培养瓶中,以指数方式培养靶 T 细胞、BHT-101 和 SW-1736 细胞,直到 80% 汇合在补充有 10% FBS、1% L-谷氨酰胺和 1% 抗生素(青霉素-链霉素)的 RPMI 培养基中。
- 去除培养基后,用 PBS 洗涤细胞一次。将细胞与 1 ml 非酶细胞解离缓冲液孵育 5 分钟以去除贴壁细胞。添加 PBS 以终止非酶细胞解离缓冲液的反应。将细胞以 135 × g 离心 5 分钟,并加入 5 mL PBS。
注:在这里,我们使用非酶细胞解离缓冲液来保持膜表面蛋白的完整性。 - 对细胞进行计数,并以 15,000 个细胞/孔的密度接种在 96 孔、透明、平底的白色聚苯乙烯微孔板中。
3. 制备不同浓度的治疗性抗体
- 要遵循此方案,请使用西妥昔单抗(嵌合抗 EGFR 抗体)结合 EGFR,并使用贝伐珠单抗(人源化抗 VEGF-A 抗体)作为阴性对照。
- 通过将 1.4 mL 低 IgG 血清添加到 33.6 mL RPMI-1640(试剂盒中提供)中来制备 ADCC 生物测定缓冲液。
- 使用 ADCC Bioassay 缓冲液稀释抗体。制备 400 μL 三种不同浓度的抗体:30 μg/mL、3 μg/mL 和 0.3 μg/mL(3 倍浓度),得到 10 μg/mL、1 μg/mL 和 0.1 μg/mL 的最终浓度,以实现广谱覆盖,以检测最佳剂量。
注:最终抗体浓度基于 96 孔板每个孔中 25 μL 培养的靶细胞、25 μL 效应细胞和 25 μL 抗体。
4. 效应细胞的制备
- 使用前将效应细胞储存在 -80 °C。
- 使用前,将 ADCC 生物测定缓冲液在 37 °C 水浴中预热至少 30 分钟。
- 将 ADCC 生物测定效应细胞置于 37 °C 水浴中(约 2-3 分钟),将其从 -80 °C 冷藏中解冻。轻轻摇晃并目视检查样品瓶,但在解冻过程中不要将其倒置。
- 将 630 μl 效应细胞转移至含有 3.6 mL ADCC 检测缓冲液的 15 mL 试管中。轻轻将试管倒置 2 次,充分混合。
5. 效应细胞与抗体和靶细胞的孵育
- 过夜孵育后,从靶细胞中取出培养基(每孔 15,000 个癌细胞),并加入 25 μL ADCC 生物测定缓冲液和 25 μL 西妥昔单抗(EGFR 拮抗剂)和贝伐珠单抗(VEGF 拮抗剂),根据 图 2,每个孔中的靶细胞的最终浓度为 0.1 μg/mL、1 μg/mL 或 10 μg/mL。
- 将 75,000 个效应细胞加入每孔 25 μL ADCC 生物测定缓冲液中,加入到含有靶细胞的 96 孔微孔板中。标记为 No mAb 的孔充当 No Antibody 对照(图 2)。
- 将 ADCC 生物测定缓冲液添加到标记为 AB(ADCC 生物测定缓冲液)的孔中以进行空白对照。
- 将板孵育 6 小时。
6. ADCC 活性的定量读数
- 通过在荧光素酶测定底物(冻干)中加入荧光素酶测定缓冲液,在测量前 4 小时制备荧光素酶测定试剂。
- 靶细胞、抗体和效应细胞孵育 6 小时后,向每个孔中加入 75 μL 荧光素酶检测试剂并孵育 30 分钟。
- 孵育期结束后,使用光度计测量每个孔中的发光信号,提供 ADCC 活性的定量读数。
- 对于数据分析,按如下方式计算折叠归纳:
倍数诱导 = RLU(抗体诱导 - 背景)/ RLU(无抗体对照 - 背景)。
其中 RLU 是相对发光单位;诱导的抗体是 B3 至 B8 和 C3 至 C8 孔;无抗体对照 = B2 和 C2;背景 = 从 A2 到 A5 孔的平均 RLU(图 2)。
结果
使用 western blotting 检测靶 BHT-101 和 SW-1736 细胞中 EGFR 和 VEGFR 的表达。在 BHT-101 和 SW-1736 细胞中均检测到 EGFR 表达,但未检测到 VEGFR 表达(图 3)。
使用 ADCC 生物测定试剂盒,我们以 EGFR 阳性细胞系 BHT-101 和 SW-1736 作为靶细胞检测抗 EGFR 抗体西妥昔单抗的 ADCC 反应。贝伐珠单抗是一种 VEGF 灭活剂,用作阴性对照抗体。将不同浓度的抗体和效应细胞与靶细胞一起孵育。使用读板器检测发光信号(图 2)。在西妥昔单抗 (抗 EGFR 抗体) 组中发现更高的 ADCC 活性诱导倍数,但在贝伐珠单抗 (VEGF 拮抗剂) 中未观察到两种细胞系的 ADCC 活性。这证明了针对两种细胞系的 EGFR 细胞外膜抗原的 ADCC 效应。通过使用这种方法,在西妥昔单抗存在下,在两种间变性甲状腺癌细胞系 (BHT101 和 SW1736) 中验证了 ADCC 反应(图 4)。
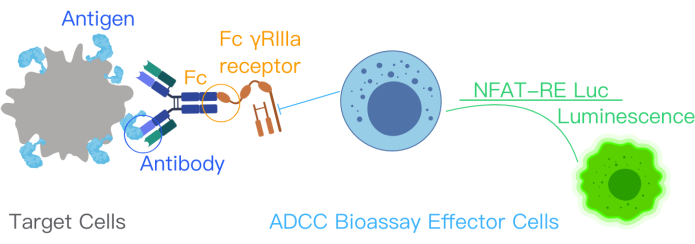
图 1:ADCC 与 ADCC 生物测定试剂盒反应的示意图。 治疗性抗体中的抗原结合位点与靶细胞中的表面抗原结合。这种结合导致抗体的 Fc 部分与效应细胞的 FcƳRIIIa 受体结合,这些受体已使用 NFAT-RE luc 进行基因工程改造,在效应细胞中产生发光信号。该图经许可12 修改自 ADCC Reporter Bioassay Core 试剂盒手册。缩写: ADCC = 抗体依赖性细胞介导的细胞毒性;Fc = 片段可结晶区;NFAT = 活化 T 细胞的核因子;RE = 响应元件;luc = 荧光素酶。 请单击此处查看此图的较大版本。

图 2:ADCC 共培养系统的 96 孔板设计的发光读数和实验图。 发光信号由发光读数仪读取。A 行:第 1 个-第 9个孔含有 ADCC 生物测定缓冲液。B 行:第 3个至第 8 个孔包含 BHT101 的 ADCC 反应系统(靶细胞 + 抗体 + 效应细胞)。第 2 个孔没有抗体。第 9 个孔仅包含 ADCC 生物测定缓冲液。C 行:第 3个至第 8 个孔包含 SW-1736 的 ADCC 反应系统(靶细胞 + 抗体 + 效应细胞)。第 2 个孔没有抗体。第 9 个孔仅包含 ADCC 生物测定缓冲液。D 行:第 1 个-第 9个孔含有检测缓冲液。缩写: ADCC = 抗体依赖性细胞介导的细胞毒性;AB = ADCC 生物测定缓冲液;VEGFR = 血管上皮生长因子受体;EGFR = 表皮生长因子受体;mAb = 单克隆抗体。请单击此处查看此图的较大版本。
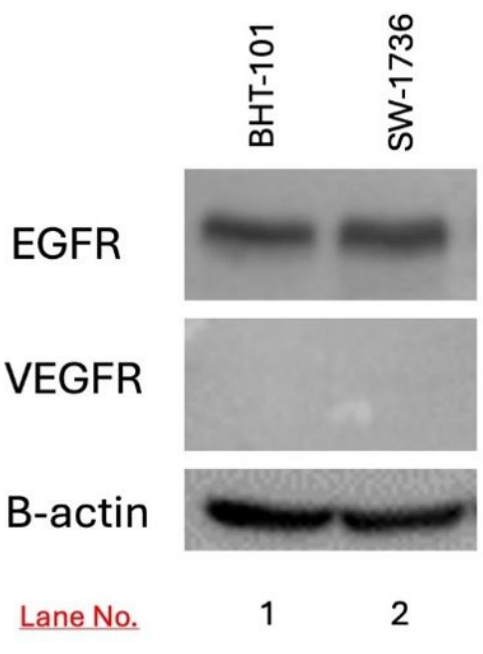
图 3:使用 western blotting 检测 BHT-101 和 SW-1736 甲状腺癌中 EGFR 和 VEGFR 的表达。 在两种细胞系中均检测到 EGFR 的表达,但未检测到 VEGFR 的表达。使用 B-肌动蛋白作为负载对照。缩写:EGFR = 表皮生长因子受体;VEGFR = 血管表皮生长因子。 请单击此处查看此图的较大版本。
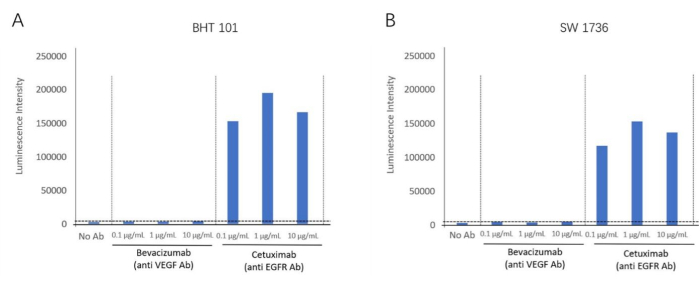
图 4:ADCC 活性的倍数诱导。 (A) 甲状腺癌细胞系 BHT-101 在抗 EGFR 抗体西妥昔单抗存在下表现出 ADCC 效应。(B) 甲状腺癌细胞系 SW-1736 在抗 EGFR 抗体西妥昔单抗存在下表现出 ADCC 效应。 请单击此处查看此图的较大版本。
讨论
在这里,我们提出了用于评估治疗性抗体的 ADCC 反应的 ADCC 生物测定方法。该方法简单明了,采用简单的 "add-mix-read" 格式进行测量。
在进行实验之前,必须通过流式细胞术或 western blotting 确认靶抗原在靶细胞中的表达。流式细胞术将是检测表面抗原的更好工具。然而,使用流式细胞术会给细胞带来压力,导致细胞凋亡并影响细胞活力,从而影响整体分析。此外,它的成本高于蛋白质印迹法。在本实验中,我们使用 western blotting 作为一种更快、更具成本效益的方法,因为靶向抗原是已知的细胞表面抗原。
使用稳定表达 FcγRIIIa 受体、V158 (高亲和力) 变体和驱动萤火虫荧光素酶表达的 NFAT 反应元件的工程化 Jurkat 细胞作为效应细胞。NFAT 通路的激活导致荧光素酶的产生,其活性以发光读数的形式进行定量。该信号还代表 ADCC 的活动。
首先,将靶细胞 (T) 与效应细胞 (E) 在 96 孔板中不同量的抗体存在下,在潮湿的 CO2 培养箱中于 37 °C 下孵育 6 小时。效应器:目标比率为 5:1 用于优化信号。例如,将 75,000 个效应细胞添加到 15,000 个靶细胞中。在孵育结束时,向每个孔中加入 Bio-Glo 荧光素酶测定试剂,孵育 30 分钟,并使用发光酶读数器测量发光(RLU,相对荧光素酶单位)。
该协议中的关键步骤是:(1) 效应细胞的处理。细胞瓶在解冻过程中不应倒置,不得轻轻摇晃,解冻后必须立即使用,以防止不必要的细胞死亡或影响生物检测的性能。(2). 使用底部透明、平坦的白色聚苯乙烯 96 孔微孔板进行发光测量非常重要,因为发光是从读数仪底部捕获的。
在这项研究中,我们观察到抗 EGFR 抗体西妥昔单抗的 ADCC 反应强度和强度,具体取决于靶细胞的量和抗体浓度。处理弱 ADCC 反应校准的一些原因:(1) ADCC 报告基因生物测定的读数来自效应细胞 (E),在本研究的 ADCC 反应系统中,每孔 75,000 个细胞的恒定数量。因此,优化靶细胞 (T) 的质量是可以改进的一个方面。本研究中的 E:T 比为 5:1,可调整至 20:1。(2) 抗体浓度也是影响 ADCC 反应的重要因素之一。可以通过连续稀释抗体进行调整,以探索最佳浓度范围,从而在 ADCC 报告中实现最大响应。(3) 抗体、靶细胞和效应细胞的孵育时间对实验结果也至关重要。在本研究中,我们孵育了 6 小时,可延长至 24 小时以实现最佳 ADCC 反应。(4) 此外,还需要探索用于 ADCC 测定的缓冲溶液(低 IgG)的浓度。ADCC 反应的最佳血清浓度可在 1% 至 10% 的范围内实现。
这种实验方法快速而直接,允许通过简单的 "add-mix-read" 方案在一天内完成。结果稳定且适合批量测试。然而,这种生物测定试剂盒不像使用 PBMC 或 NK 细胞作为效应细胞的常规 ADCC 方法那样检测细胞死亡12,13。相反,它使用 FcγRIIIa 受体表达的 Jurkat 细胞作为效应细胞,由于细胞是转基因的,因此成本更高。与传统的 ADCC 实验13,14 相比,它消除了健康个体献血的要求,避免了提取免疫细胞的复杂过程,从而减轻了可能影响结果的个体差异。检测到的发光信号来自效应细胞与靶细胞的结合,而不是来自靶细胞的实际死亡。因此,与标准 ADCC 检测方法相比,可能存在差异。此外,比胰蛋白酶更昂贵的细胞解离缓冲液用于分离贴壁细胞以维持膜的完整性。
ADCC 报告基因分析表现出优异的准确性和稳定性,可作为治疗性抗体药物质量检测的药效分析方法。它还可以作为治疗分子表征和工艺开发的关键分析方法15。
综上所述,ADCC 是一种重要的免疫机制,ADCC 的定量检测在免疫治疗领域具有重要意义。该实验方法为 ADCC15 的定量测量提供了一种有效的手段。
披露声明
所有作者均声明无利益冲突。
致谢
我们感谢 Zeng 教授 (IMCB, A*STAR) 对这项工作的支持。本研究得到了国家自然科学基金 (NSFC) 青年基金 (82202231) 和浙江省医疗健康科技项目 (2021KY110,2024KY824) 的支持。
材料
| Name | Company | Catalog Number | Comments |
| 0.5% Trypsin-EDTA | Gibco | 15400-054 | Dilute 10x in PBS to make 0.05% Trypsin |
| 1x Tris Buffer Saline (TBS) | 1st BASE | BUF-3030-1X1L | For membrane washing in western blotting |
| 1.5 M Tris Buffer, pH 8.8 | 1st BASE | BUF-1419-1L-pH8.8 | For SDS gel preparation |
| 2-Mercaptoethanol | Sigma Aldrich | M7522-100ML | For sample preparation of western blotting |
| 30% Acrylamide/Bis solution | Bio-Rad | #1610158 | For SDS gel preparation |
| 4x Laemmli Buffer | Bio-Rad | #1610747 | For sample preparation of western blotting |
| 96-well white polystyrene microplate with clear flat bottom | Corning Incorporated | 3610 | For ADCC assay |
| ADCC Bioassay Effector cells (0.65 mL) | Promega | G7011 | Includes in ADCC reporter bioassay core kit (Promega G7010), 1 x 1 vial |
| ADCC reporter bioassay core kit | Promega | G7010 | Mentioned as ADCC bioassay kit for ADCC assay in this experiment |
| Ammonium Persulfate | Sigma Aldrich | A3678-25G | For SDS gel preparation |
| Bevacizumab (Humanized Anti VEGF-antibody) | MVASI | - | Use as negative control antibody in ADCC asssay |
| BHT-101 | Leibniz Institute DSMZ | ACC279 | Human anaplastic papillary thyroid cancer cell line |
| Bio-Glo Luciferase Assay Buffer | Promega | G7941 | Includes in ADCC reporter bioassay core kit (Promega G7010), 1 x 10 mL |
| Bio-Glo Luciferase Assay Substrate (Lyophilized) | Promega | G7941 | Includes in ADCC reporter bioassay core kit (Promega G7010), 1 x 1 vial |
| Cell scraper | GenFollower | GD00235 | To remove cell from culture flask |
| Cetuximab (Chimeric anti-EGFR antibody) | ERBITUX | - | Use as therapeutic antibody in ADCC assay |
| Chemiluminescent HRP substrate | Merck Millipore | WBKLS0500 | For protein detection in western blotting |
| Distilled water | Gibco | 15230-162 | For SDS gel preparation |
| Fetal Bovine Serum (FBS) | Gibco | 10270-106 | Culture media supplement |
| iBright CL1500 imaging system | Thermo Scientific | 2462621100038 | For protein detection in western blotting |
| L-glutamine, 200 mM | Gibco | 25030-081 | Culture media supplement |
| Low IgG Serum | Promega | G7110 | Includes in ADCC reporter bioassay core kit (Promega G7010), 1 x 4 mL |
| Megafuge 8R | Thermo Scientific | 42876589 | Centrifuge |
| Mouse anti-EGFR monoclonal antibodies | BD Biosciences | 610016 | Primary antibody in western blotting |
| Mouse anti-VEGFR monoclonal antibodies | BD Biosciences | 571194 | Primary antibody in western blotting |
| non-enzymatic cell dissociation buffer | Sigma Aldrich | C5789-100ML | For cell harvesting from T75 flask |
| Penicillin-Streptomycin | PAN Biotech | P06-07100 | Antibacterial for culture media |
| Phosphate Buffered Saline (PBS), pH 7.2, Sterile filtered | 1st BASE | CUS-2048-1x1L | Use as washing solution for cells |
| Pierce BCA assay kit | Thermo Scientific | 23225 | To measure protein concentration |
| Protease and phosphatase inhibitor | Thermo Scientific | A32959 | For protein digestion in sample preparation for western blotting |
| PVDF membrane (Immobilin-P) | Merck Millipore | IPVH00010 | For protein transfer in western blotting |
| Rabbit anti-mouse IgG, Fcγ HRP-conjugated secondary antibody | Jackson ImmunoResearch | 315-035-046 | Secondary antibody in western blotting |
| Roswell Park Memorial Institute (RPMI) medium | Capricorn Scientific | RPMI-XA | Cell culture media |
| RPMI-1640 | Promega | G7080 | Includes in ADCC reporter bioassay core kit (Promega G7010), 1 x 36 mL |
| Skim milk powder | Merck Millipore | 70166-500G | For membrane blocking in western blotting |
| Sodium Dodecyl Sulfate | 1st BASE | BIO-2050-500g | For SDS gel preparation |
| SW-1736 | Cytion | 300453 | Human thyroid squamous cell cancer cell line |
| T75 culture flasks | SPL Lifesciences | 70075 | Cell culture flask |
| Tecan Multimode Reader model Spark 10M | Tecan | 1607000294 | for luminicence quantification |
| TEMED | Bio-Rad | #1610801 | For SDS gel preparation |
| Tween-20 | Promega | H5151 | For membrane washing in western blotting |
| Vi-cell XR cell viability analyzer | Beckman Coulter | AL15072 | Cell counter |
参考文献
- Zahavi, D., AlDeghaither, D., O'Connell, Enhancing antibody-dependent cell-mediated cytotoxicity: a strategy for improving antibody-based immunotherapy. Antib Ther. 1 (1), 7-12 (2018).
- Fenis, A., Demaria, O., Gauthier, L., Vivier, E. New immune cell engagers for cancer immunotherapy. Nat Rev Immunol. 24 (7), 471-486 (2024).
- Pinto, S., Pahl, J., Schottelius, A., Carter, P. J. Reimagining antibody-dependent cellular cytotoxicity in cancer: the potential of natural killer cell engagers. Trends Immunol. 43 (11), 932-946 (2022).
- Ochoa, M. C., et al. Antibody-dependent cell cytotoxicity: immunotherapy strategies enhancing effector NK cells. Immunol Cell Biol. 95 (4), 347-355 (2017).
- Wang, W., Erbe, A. K., Hank, J. A., Morris, Z. S. NK cell-mediated antibody-dependent cellular cytotoxicity in cancer immunotherapy. Front Immunol. 6, 368 (2015).
- Chung, S., et al. Characterization of in vitro antibody-dependent cell-mediated cytotoxicity activity of therapeutic antibodies - impact of effector cells. J Immunol Methods. 407, 63-75 (2014).
- Shimasaki, N., Jain, A., Campana, D. NK cells for cancer immunotherapy. Nat Rev Drug Discov. 19 (3), 200-218 (2020).
- Cheng, Z. J., et al. Development of a robust reporter-based ADCC assay with frozen, thaw-and-use cells to measure Fc effector function of therapeutic antibodies. J Immunol Methods. 414, 69-81 (2014).
- Parekh, B. S., et al. Development and validation of an antibody-dependent cell-mediated cytotoxicity-reporter gene assay. MAbs. 4 (3), 310-318 (2012).
- Hogarth, P. M., Pietersz, G. A. Fc receptor-targeted therapies for the treatment of inflammation, cancer and beyond. Nat Rev Drug Discov. 11 (4), 311-331 (2012).
- Chung, S., et al. Quantitative evaluation of fucose reducing effects in a humanized antibody on Fcgamma receptor binding and antibody-dependent cell-mediated cytotoxicity activities. MAbs. 4 (3), 326-340 (2012).
- . ADCC Reporter Bioassay Core Kit Technical Manual Available from: https://www.promega.sg/-/media/files/resources/protocols/technical-manuals/101/adcc-reporter-bioassay-core-kit-protocol.pdf?rev=bec36264c0b6470591ded081377d207d&sc_lang=en (2023)
- Miller, A. S., Tejada, M. L., Gazzano-Santoro, H. Methods for measuring antibody-dependent cell-mediated cytotoxicity in vitro. Methods Mol Biol. 1134, 59-65 (2014).
- Lo Nigro, C., et al. NK-mediated antibody-dependent cell-mediated cytotoxicity in solid tumors: biological evidence and clinical perspectives. Ann Transl Med. 7 (5), 105 (2019).
- Gómez Román, V. R., Murray, J. C., Weiner, L. M., Ackerman, M. E., Nimmerjahn, F. . Antibody Fc. , 1-27 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。