Method Article
Evaluación de la citotoxicidad mediada por células dependientes de anticuerpos en células cancerosas mediante el bioensayo reportero de citotoxicidad mediada por células dependiente de anticuerpos
* Estos autores han contribuido por igual
En este artículo
Resumen
Aquí, presentamos un protocolo para un ensayo de citotoxicidad mediada por células (ADCC) dependiente de anticuerpos utilizando un kit de bioensayo ADCC. Este método ofrece una valiosa herramienta para dilucidar el mecanismo ADCC y evaluar el potencial terapéutico de los anticuerpos en la inmunoterapia contra el cáncer.
Resumen
El método para la citotoxicidad mediada por células (ADCC, por sus siglas en inglés) dependiente de anticuerpos representa una herramienta importante para evaluar la eficacia de los anticuerpos terapéuticos en la inmunoterapia contra el cáncer. La evaluación de la actividad de ADCC en las células cancerosas es esencial para el desarrollo y la optimización de tratamientos basados en anticuerpos. Aquí, proponemos un enfoque metodológico de utilizar un kit de bioensayo ADCC para la evaluación cuantitativa de la reacción ADCC utilizando células de cáncer de tiroides como células efectoras. El protocolo consiste en el cocultivo de células efectoras con células cancerosas diana en diferentes proporciones en presencia de un anticuerpo terapéutico. El kit de bioensayo ADCC utilizado en este experimento incluye las células efectoras modificadas genéticamente que expresan un gen reportero de luciferasa bajo el control de los elementos de respuesta del factor nuclear de células T activadas (NFAT). Tras la unión del antígeno de superficie en las células diana con los anticuerpos y las células efectoras, las células efectoras liberan luciferasa, lo que permite la cuantificación de la citotoxicidad mediante la medición de la señal de luminiscencia. A diferencia de los ensayos ADCC convencionales, este método demostró la unión del antígeno diana con anticuerpos y células efectoras, lo que puede producir resultados fiables en un corto período de tiempo.
Introducción
La citotoxicidad celular dependiente de anticuerpos (ADCC) es un mecanismo importante por el cual los anticuerpos ejercenefectos de destrucción celular inmunomediados 1,2,3. Las células inmunitarias se activan uniéndose al anticuerpo terapéutico, que interactúa con los antígenos de superficie de las células diana para liberar granzimas, perforina, lo que provoca la muerte de la célula diana. Estas células inmunitarias incluyen las células asesinas naturales (NK) y los neutrófilos 2,3,4,5,6,7. El ensayo ADCC se ha convertido en una herramienta importante para evaluar la eficacia de los anticuerpos terapéuticos 8,9.
En el ensayo ADCC convencional, las células mononucleares de sangre periférica (PBMC) o las células asesinas naturales se utilizan como células efectoras para controlar la eficacia de un anticuerpo terapéutico mediante la cuantificación de la tasa de mortalidad celular del objetivo. Nuestro método utiliza un kit de bioensayo ADCC que incluye células efectoras modificadas genéticamente que expresan un gen reportero de luciferasa bajo el control de elementos de respuesta del factor nuclear de células T activadas (NFAT). A continuación, cuantificamos la unión del antígeno de superficie en las células diana con el anticuerpo y las células efectoras. Este método se basa en la reacción ADCC que ocurre en un corto período sin necesidad de células PBMC humanas. Los pasos experimentales incluyen el cocultivo de células efectoras con células diana en presencia de anticuerpos terapéuticos.
Durante la incubación, el anticuerpo terapéutico se une al antígeno diana en la superficie de las células diana, lo que conduce a la unión de las células efectoras y el fragmento Fc de un anticuerpo. Esto activa el elemento de respuesta NFAT y libera señales de luminiscencia para la evaluación cuantitativa de la reacción ADCC.
Antes de realizar el experimento, la expresión del antígeno diana en las células diana debe confirmarse mediante citometría de flujo o Western blot. Las células objetivo se cultivan y se introducen en placas de 96 pocillos durante 24 horas antes del experimento. Se suman diferentes concentraciones de un anticuerpo terapéutico junto con diferentes recuentos celulares de células efectoras para lograr la proporción calculada de células efectoras a células objetivo.
Los pasos clave de este método incluyen (1) la preparación de las células diana y las células efectoras, (2) la proporción de células efectoras a dianas, (3) la preparación de diferentes concentraciones del anticuerpo y (4) la duración variable de la incubación. Después de la incubación, las señales de luminiscencia se miden con un luminómetro, proporcionando una lectura cuantitativa de la actividad de ADCC. En comparación con otros métodos para medir ADCC, este método es relativamente simple de operar y los resultados son precisos.
El bioensayo indicador de ADCC indica la unión del antígeno diana, el anticuerpo terapéutico y las células inmunitarias en la activación de la vía ADCC. Esta unión activa la transcripción génica a través de la vía NFAT en las células Jurkat modificadas con células efectoras con un receptor FcγRIIIa que expresa de manera estable, la variante V158 (alta afinidad). El elemento de respuesta NFAT media la expresión de luciferasa en las células efectoras 10,11. La actividad biológica del anticuerpo en el Mecanismo de Acción (MOA) de ADCC se cuantifica a través de la señal de luciferasa producida a partir de la vía NFAT. La señal de luciferasa en las células efectoras (células Jurket que expresan el receptor FcγRIIIa) se cuantifica utilizando un lector de luminiscencia (Figura 1). La relación señal-ruido del ensayo es alta.
Protocolo
1. Detección de la expresión de EGFR y VEGFR en células diana
NOTA: Utilice la Western blot para detectar la expresión del antígeno diana en las células diana.
- Preparación de la muestra
- Cultivo de las células (líneas celulares de cáncer de tiroides humano BHT-101 y SW-1736) en frascos T75 utilizando medio Roswell Park Memorial Institute (RPMI) suplementado con 10% de suero fetal bovino (FBS), 1% L-glutamina y 1% de antibióticos (penicilina-estreptomicina).
- Coseche las células cuando estén confluentes en un 80% retirando los medios de cultivo y lavando las células con PBS. Agregue 5 mL de PBS y raspe las células con un raspador de células para eliminar las células del matraz de cultivo. Transfiera las células a un tubo cónico de 15 ml.
- Cuente las celdas con un contador de celdas.
- Alícuotas 5 × 106 de las células BHT-101 y SW-1736 en tubos cónicos de 15 mL.
- Centrifugar las celdas a 135 × g durante 5 min a temperatura ambiente. Retire el sobrenadante PBS.
- Lisear el pellet celular añadiendo 100 μL de tampón de lisis RIPA que contiene inhibidores de la proteasa-fosfatasa durante 5 min en hielo. Transfiera el lisado a un tubo de 2 mL, centrifugue a 15.000 × g durante 15 mL y transfiera el sobrenadante a un nuevo tubo de 2 mL.
- Mida la concentración de proteínas del lisado celular mediante el uso de un kit de ensayo de ácido bicinconínico (BCA).
- Alícuota 70 μg de proteína de lisado celular de cada muestra, añadir 2 veces tampón de muestra Laemmli suplementado con 2-mercaptoetanol al 10% y hervir las muestras a 100 °C durante 5 min para la desnaturalización de las muestras.
- Electroforesis en gel y transferencia de membrana
- Prepare el gel de poliacrilamida de dodecil sulfato de sodio (SDS) al 8% con agua destilada (4,7 mL), acrilamida al 30% (2,7 mL), tampón Tris 1,5 M, pH 8,8 (2,5 mL), dodecil sulfato de sodio al 10% (0,1 mL), persulfato de amonio al 10% (100 μL) y TEMED (10 μL).
- Ejecute 70 μg de las muestras desnaturalizadas en el gel de poliacrilamida SDS al 8% a 80 V durante 20 min y a 120 V durante 100 min.
- Transfiera la proteína del gel a una membrana de fluoruro de polivinilideno (PVDF) a 100 V durante 90 min.
- Después de la transferencia, bloquee la membrana con leche desnatada al 7% diluida en tampón TBS-T (20 mM Tris pH 7,6, 140 mM NaCl, 0,2% Tween-20) durante 1 h.
- Incubación de anticuerpos
- Incubar la membrana bloqueada con anticuerpos monoclonales anti-receptor del factor de crecimiento epidérmico (EGFR) y anti-receptor del factor de crecimiento endotelial vascular (VEGFR) de conejo (diluidos a 1:1.000 en leche desnatada al 7%) durante la noche a 4 °C.
- Después de la incubación, lave bien la membrana con tampón Tween de solución salina (TBS-T) (20 mM de Tris pH 7,6, 140 mM de NaCl, 0,2% de Tween-20) durante 7 min y repita 4 veces.
- Incubar la membrana con el anticuerpo secundario conjugado con HRP (diluido a 1:4.000 en leche desnatada al 7% (TBS-T)) durante 1 h.
- Después de la incubación, lave bien la membrana con tampón TBS-T durante 7 minutos y repita 4 veces.
- Detección de proteínas
- Incubar la membrana en un sustrato HRP quimioluminiscente preparado mezclando 1 mL de solución de peróxido de sustrato HRP con 1 mL de reactivo Luminol de sustrato HRP (ambos reactivos son del kit de sustrato quimioluminiscente) durante 2 min.
- Visualice la membrana mediante un sistema de imágenes.
2. Preparación de las células diana
- Cultivo exponencial de las células T diana, BHT-101 y SW-1736 hasta que confluenten al 80% en medios RPMI suplementados con 10% de FBS, 1% de L-glutamina y 1% de antibióticos (penicilina-estreptomicina) en matraces T-75.
- Después de retirar el medio, lave las celdas una vez con PBS. Incubar las células con 1 ml de tampón de disociación celular no enzimática durante 5 min para desalojar las células adherentes. Agregue PBS para detener la reacción del tampón de disociación celular no enzimática. Gire las células a 135 × g durante 5 minutos y agregue 5 ml de PBS.
NOTA: Aquí, utilizamos un tampón de disociación celular no enzimática para preservar la integridad de la proteína de la superficie de la membrana. - Cuente las células y siembrójelas en 15,000 celdas/pocillos en microplacas de poliestireno blanco de 96 pocillos con un fondo transparente y plano.
3. Preparación de concentraciones variables del anticuerpo terapéutico
- Para seguir este protocolo, use Cetuximab (anticuerpo quimérico anti-EGFR) para unirse al EGFR y use Bevacizumab (anticuerpo anti VEGF-A humanizado) como control negativo.
- Prepare el tampón de bioensayo ADCC agregando 1,4 mL de suero de IgG baja en 33,6 mL de RPMI-1640 (suministrado en el kit).
- Utilice el tampón de bioensayo ADCC para la dilución de anticuerpos. Prepare 400 μL de cada anticuerpo en tres concentraciones diferentes: 30 μg/mL, 3 μg/mL y 0,3 μg/mL (concentración 3x) para obtener la concentración final de 10 μg/mL, 1 μg/mL y 0,1 μg/mL para una cobertura de amplio espectro para detectar la dosis óptima.
NOTA: Las concentraciones finales de anticuerpos se basan en 25 μL de células diana cultivadas, 25 μL de células efectoras y 25 μL de anticuerpo en cada pocillo de una placa de 96 pocillos.
4. Preparación de las células efectoras
- Almacene las pilas efectoras a -80 °C antes de usarlas.
- Precaliente el tampón de bioensayo ADCC en un baño de agua a 37 °C durante al menos 30 minutos antes de su uso.
- Descongele las células efectoras de bioensayo ADCC de almacenamiento en frío a -80 °C colocándolas en un baño de agua a 37 °C (aproximadamente 2-3 min). Mecione suavemente e inspeccione visualmente el vial, pero no lo invierta durante el proceso de descongelación.
- Transfiera 630 ml de células efectoras a un tubo de 15 mL que contenga 3,6 mL de tampón de ensayo ADCC. Mezcle bien invirtiendo suavemente el tubo 2 veces.
5. Incubación de células efectoras con anticuerpos y células diana
- Después de la incubación durante la noche, retire el medio de las células objetivo (15.000 células cancerosas por pocillo) y agregue 25 μL del tampón de bioensayo ADCC y 25 μL de cetuximab (antagonista del EGFR) y bevacizumab (antagonista del VEGF) para obtener la concentración final de 0,1 μg/mL, 1 μg/mL o 10 μg/mL de las células objetivo en cada pocillo según la Figura 2.
- Añada 75.000 células efectoras en 25 μL de tampón de bioensayo ADCC por pocillo en la microplaca de 96 pocillos que contiene las células objetivo. Los pocillos marcados como Sin mAb actúan como ningún control de anticuerpos (Figura 2).
- Agregue tampón de bioensayo ADCC a los pocillos etiquetados como AB (tampón de bioensayo ADCC) para el control en blanco.
- Incubar la placa durante 6 h.
6. Lectura cuantitativa de la actividad de ADCC
- Prepare el reactivo de ensayo de luciferasa 4 h antes de la medición añadiendo tampón de ensayo de luciferasa al sustrato del ensayo de luciferasa (liofilizado).
- Después de 6 h de incubación de las células diana, el anticuerpo y las células efectoras, agregue 75 μL del reactivo de ensayo de luciferasa a cada pocillo e incube durante 30 minutos.
- Después del período de incubación, mida la señal de luminiscencia en cada pozo mediante el uso de un luminómetro, proporcionando una lectura cuantitativa de la actividad de ADCC.
- Para el análisis de datos, calcule la inducción de pliegue de la siguiente manera:
Inducción de pliegue = RLU (inducida por anticuerpos - antecedentes) / RLU (sin control de anticuerpos - antecedentes).
Donde RLU son unidades de luminiscencia relativas; Los anticuerpos inducidos son los pocillos B3 a B8 y C3 a C8; Sin control de anticuerpos = B2 y C2; Antecedentes = RLU promedio del pozo A2 al A5 (Figura 2).
Resultados
La expresión de EGFR y VEGFR en las células diana BHT-101 y SW-1736 se detectó mediante Western blot. Se detectó la expresión de EGFR en las células BHT-101 y SW-1736, pero no la expresión de VEGFR (Figura 3).
Utilizando el kit de bioensayo ADCC, detectamos la reacción ADCC del anticuerpo anti-EGFR, cetuximab, utilizando líneas celulares positivas para EGFR, BHT-101 y SW-1736, como células diana. El bevacizumab, un inactivador del VEGF, se utilizó como anticuerpo de control negativo. Se incubaron diferentes concentraciones de anticuerpos y células efectoras con las células diana. La señal de luminiscencia se detectó utilizando un lector de placas (Figura 2). Se encontró un mayor pliegue de inducción de actividad de ADCC en los grupos de Cetuximab (anticuerpo anti-EGFR), pero no se observó actividad de ADCC en Bevacizumab (antagonista de VEGF) para ambas líneas celulares. Esto demostró el efecto ADCC dirigido a los antígenos de membrana extracelular de EGFR para ambas líneas celulares. Mediante el uso de este método, se validó la reacción ADCC en presencia de Cetuximab en dos líneas celulares anaplásicas de cáncer de tiroides (BHT101 y SW1736) (Figura 4).
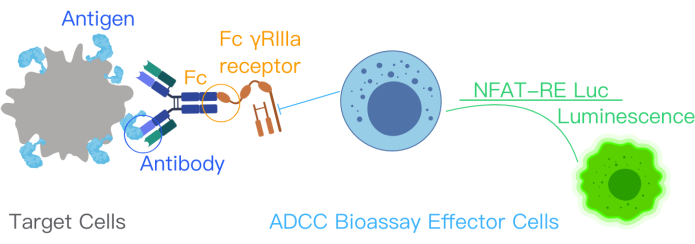
Figura 1: Diagrama esquemático que muestra la reacción de ADCC con el kit de bioensayo ADCC. Los sitios de unión a antígenos en el anticuerpo terapéutico se unen a los antígenos de superficie en las células diana. Esta unión conduce a la unión de la porción Fc del anticuerpo a los receptores FcƳRIIIa de las células efectoras, que han sido modificados genéticamente con NFAT-RE luc, produciendo una señal de luminiscencia en las células efectoras. Esta cifra fue modificada del manual del kit ADCC Reporter Bioassay Core con permiso12. Abreviaturas: ADCC = citotoxicidad mediada por células dependiente de anticuerpos; Fc = Región cristalizable del fragmento; NFAT = Factor Nuclear de la Célula T Activada; RE = Elemento de respuesta; luc = Luciferasa. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Lectura de luminiscencia y diagrama experimental del diseño de placa de 96 pocillos del sistema de cocultivo ADCC. Las señales de luminiscencia son leídas por un lector de luminiscencia. Fila A: Los pozos del 1al 9contienen tampón de bioensayo ADCC. Fila B: 3 pozos rd-8th contienen el sistema de reacción ADCC de BHT101 (células diana + anticuerpo + células efectoras). El2º pocillo está sin anticuerpos. El9º pozo contiene solo tampón de bioensayo ADCC. Fila C: Los pozos 3 rd-8th contienen el sistema de reacción ADCC de SW-1736 (célula diana + anticuerpo + células efectoras). El2º pocillo está sin anticuerpos. El9º pozo contiene solo tampón de bioensayo ADCC. Fila D: 1pozo-9 contiene tampón de ensayo. Abreviaturas: ADCC = citotoxicidad mediada por células dependiente de anticuerpos; AB = tampón de bioensayo ADCC; VEGFR = Receptor del Factor de Crecimiento Epitelial Vascular; EGFR = receptor del factor de crecimiento epidérmico; mAb = anticuerpo monoclonal. Haga clic aquí para ver una versión más grande de esta figura.
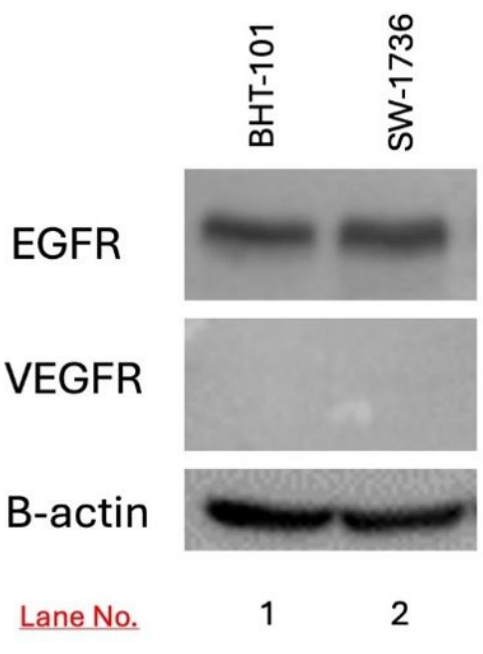
Figura 3: Detección de la expresión de EGFR y VEGFR en carcinoma de tiroides BHT-101 y SW-1736 mediante Western blot. Se detectó expresión de EGFR, pero no de VEGFR, en ambas líneas celulares. Se utilizó B-actina como control de carga. Abreviaturas: EGFR = receptor del factor de crecimiento epidérmico; VEGFR = factor de crecimiento epidérmico vascular. Haga clic aquí para ver una versión más grande de esta figura.
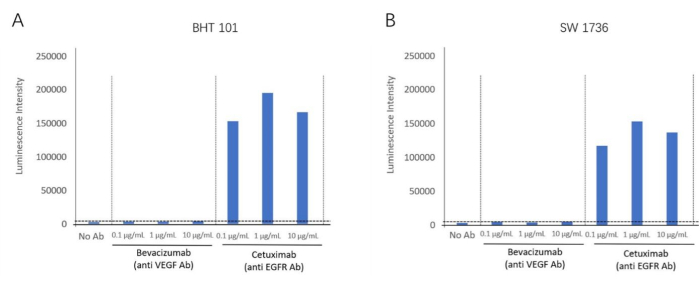
Figura 4: Inducción de pliegues de la actividad de ADCC. (A) La línea celular de cáncer de tiroides BHT-101 exhibe un efecto ADCC en presencia del anticuerpo anti-EGFR Cetuximab. (B) La línea celular de cáncer de tiroides SW-1736 exhibe un efecto ADCC en presencia del anticuerpo anti-EGFR Cetuximab. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Aquí, hemos presentado el método ADCC Bioassay para evaluar la reacción ADCC de un anticuerpo terapéutico. El método es sencillo y emplea un formato simple de "agregar-mezclar-leer" para la medición.
Antes de realizar el experimento, la expresión del antígeno diana en las células diana debe confirmarse mediante citometría de flujo o Western blot. La citometría de flujo será una mejor herramienta para detectar el antígeno de superficie. Sin embargo, el uso de la citometría de flujo puede estresar las células, causando apoptosis y afectando la viabilidad de la célula y, por lo tanto, el análisis general. Además, cuesta más que el Western blot. En este experimento, utilizamos el Western blot como un método más rápido y rentable porque los antígenos dirigidos son antígenos de superficie celular conocidos.
Se utilizaron células efectoras modificadas genéticamente para células Jurkat, que expresaron de manera estable el receptor FcγRIIIa, la variante V158 (alta afinidad) y un elemento de respuesta NFAT que impulsa la expresión de la luciferasa de luciferasa de luciérnaga de fuego. La activación de la vía NFAT da lugar a la producción de luciferasa, y su actividad se cuantifica en forma de lectura de luminiscencia. La señal también representa la actividad de ADCC.
En primer lugar, las células diana (T) se incuban con células efectoras (E) en presencia de cantidades variables de anticuerpo en placas de 96 pocillos durante 6 h a 37 °C en una incubadora de CO2 humidificada. La relación efector:objetivo de 5:1 se utiliza para optimizar la señal. Por ejemplo, se añadieron 75.000 células efectoras a 15.000 células diana. Al final de la incubación, se añade un reactivo de ensayo de luciferasa Bio-Glo a cada pocillo, se incuba durante 30 min, y la luminiscencia (RLU, unidades relativas de luciferasa) se mide mediante un lector de placas de luminiscencia.
Los pasos críticos clave en este protocolo son: (1) El manejo de las células efectoras. El vial de células no debe invertirse durante el proceso de descongelación, balancearse suavemente y debe usarse inmediatamente después de la descongelación para evitar la muerte celular no deseada o afectar el rendimiento de la detección biológica. (2). Es importante utilizar microplacas de poliestireno blanco de 96 pocillos con fondo claro y plano para las mediciones de luminiscencia porque la luminiscencia se captura desde la parte inferior del lector.
En este estudio, observamos las reacciones ADCC más fuertes y más débiles del anticuerpo anti-EGFR, cetuximab, dependiendo de la cantidad de células diana y la concentración de anticuerpos. Algunas razones para manejar la calibración de reacciones ADCC débiles: (1) Las lecturas del bioensayo reportero ADCC provienen de células efectoras (E), con un número constante de 75,000 celdas por pocillo en el sistema de reacción ADCC de este estudio. Por lo tanto, la optimización de la calidad de las células objetivo (T) es un aspecto que se puede mejorar. La relación E:T en este estudio fue de 5:1, que pudo ajustarse hasta 20:1. (2) La concentración de anticuerpos también es uno de los factores importantes que afectan la reacción ADCC. Los ajustes se pueden realizar a través de la dilución en serie de anticuerpos para explorar el rango de concentración óptimo, logrando así la máxima respuesta en el informe ADCC. (3) El tiempo de incubación de los anticuerpos, las células diana y las células efectoras también es crucial para los resultados experimentales. En este estudio, incubamos durante 6 h, que se pueden extender hasta 24 h para lograr la reacción óptima de ADCC. (4) Además, también es necesario explorar la concentración de la solución tampón (IgG baja) para el ensayo ADCC. La concentración sérica óptima para la respuesta de ADCC se puede lograr dentro del rango de 1% a 10%.
Este método experimental es rápido y sencillo, lo que permite completarlo en un día a través de un simple protocolo de "agregar-mezclar-leer". Los resultados son estables y susceptibles de pruebas por lotes. Sin embargo, este kit de bioensayo no detecta la muerte celular como los métodos convencionales de ADCC que utilizan células PBMC o NK como células efectoras12,13. En su lugar, utiliza células Jurkat expresadas por el receptor FcγRIIIa como células efectoras, lo que costará más porque las células están modificadas genéticamente. En comparación con los experimentos tradicionales de ADCC13,14, elimina la necesidad de donaciones de sangre de individuos sanos y evita el complejo proceso de extracción de células inmunitarias, mitigando así las variaciones individuales que podrían afectar los resultados. Las señales de luminiscencia detectadas provienen de la unión de las células efectoras a las células diana, no de la muerte real de las células diana. Por lo tanto, puede haber discrepancias en comparación con los métodos de detección estándar de ADCC. Además, el tampón de disociación celular, que es más caro que la tripsina, se utiliza para separar las células adherentes y mantener la integridad de la membrana.
El análisis de genes reporteros ADCC demuestra una excelente precisión y estabilidad, sirviendo como método de análisis de eficacia para la detección masiva de fármacos terapéuticos con anticuerpos. También puede funcionar como un método de análisis crítico para la caracterización de moléculas terapéuticas y el desarrollo de procesos15.
En resumen, la ADCC es un mecanismo inmunitario importante, y la detección cuantitativa de la ADCC tiene una gran importancia en el campo de la inmunoterapia. Este método experimental ofrece un medio eficaz para la medición cuantitativa de ADCC15.
Divulgaciones
Todos los autores declaran no tener conflictos de intereses.
Agradecimientos
Agradecemos al Prof. Zeng (IMCB, A*STAR) por apoyar este trabajo. Este estudio contó con el apoyo de la Fundación Juvenil de la Fundación Nacional de Ciencias Naturales de China (NSFC) (82202231) y el Proyecto de Ciencia y Tecnología Médica y de la Salud de la provincia de Zhejiang, China (2021KY110,2024KY824).
Materiales
| Name | Company | Catalog Number | Comments |
| 0.5% Trypsin-EDTA | Gibco | 15400-054 | Dilute 10x in PBS to make 0.05% Trypsin |
| 1x Tris Buffer Saline (TBS) | 1st BASE | BUF-3030-1X1L | For membrane washing in western blotting |
| 1.5 M Tris Buffer, pH 8.8 | 1st BASE | BUF-1419-1L-pH8.8 | For SDS gel preparation |
| 2-Mercaptoethanol | Sigma Aldrich | M7522-100ML | For sample preparation of western blotting |
| 30% Acrylamide/Bis solution | Bio-Rad | #1610158 | For SDS gel preparation |
| 4x Laemmli Buffer | Bio-Rad | #1610747 | For sample preparation of western blotting |
| 96-well white polystyrene microplate with clear flat bottom | Corning Incorporated | 3610 | For ADCC assay |
| ADCC Bioassay Effector cells (0.65 mL) | Promega | G7011 | Includes in ADCC reporter bioassay core kit (Promega G7010), 1 x 1 vial |
| ADCC reporter bioassay core kit | Promega | G7010 | Mentioned as ADCC bioassay kit for ADCC assay in this experiment |
| Ammonium Persulfate | Sigma Aldrich | A3678-25G | For SDS gel preparation |
| Bevacizumab (Humanized Anti VEGF-antibody) | MVASI | - | Use as negative control antibody in ADCC asssay |
| BHT-101 | Leibniz Institute DSMZ | ACC279 | Human anaplastic papillary thyroid cancer cell line |
| Bio-Glo Luciferase Assay Buffer | Promega | G7941 | Includes in ADCC reporter bioassay core kit (Promega G7010), 1 x 10 mL |
| Bio-Glo Luciferase Assay Substrate (Lyophilized) | Promega | G7941 | Includes in ADCC reporter bioassay core kit (Promega G7010), 1 x 1 vial |
| Cell scraper | GenFollower | GD00235 | To remove cell from culture flask |
| Cetuximab (Chimeric anti-EGFR antibody) | ERBITUX | - | Use as therapeutic antibody in ADCC assay |
| Chemiluminescent HRP substrate | Merck Millipore | WBKLS0500 | For protein detection in western blotting |
| Distilled water | Gibco | 15230-162 | For SDS gel preparation |
| Fetal Bovine Serum (FBS) | Gibco | 10270-106 | Culture media supplement |
| iBright CL1500 imaging system | Thermo Scientific | 2462621100038 | For protein detection in western blotting |
| L-glutamine, 200 mM | Gibco | 25030-081 | Culture media supplement |
| Low IgG Serum | Promega | G7110 | Includes in ADCC reporter bioassay core kit (Promega G7010), 1 x 4 mL |
| Megafuge 8R | Thermo Scientific | 42876589 | Centrifuge |
| Mouse anti-EGFR monoclonal antibodies | BD Biosciences | 610016 | Primary antibody in western blotting |
| Mouse anti-VEGFR monoclonal antibodies | BD Biosciences | 571194 | Primary antibody in western blotting |
| non-enzymatic cell dissociation buffer | Sigma Aldrich | C5789-100ML | For cell harvesting from T75 flask |
| Penicillin-Streptomycin | PAN Biotech | P06-07100 | Antibacterial for culture media |
| Phosphate Buffered Saline (PBS), pH 7.2, Sterile filtered | 1st BASE | CUS-2048-1x1L | Use as washing solution for cells |
| Pierce BCA assay kit | Thermo Scientific | 23225 | To measure protein concentration |
| Protease and phosphatase inhibitor | Thermo Scientific | A32959 | For protein digestion in sample preparation for western blotting |
| PVDF membrane (Immobilin-P) | Merck Millipore | IPVH00010 | For protein transfer in western blotting |
| Rabbit anti-mouse IgG, Fcγ HRP-conjugated secondary antibody | Jackson ImmunoResearch | 315-035-046 | Secondary antibody in western blotting |
| Roswell Park Memorial Institute (RPMI) medium | Capricorn Scientific | RPMI-XA | Cell culture media |
| RPMI-1640 | Promega | G7080 | Includes in ADCC reporter bioassay core kit (Promega G7010), 1 x 36 mL |
| Skim milk powder | Merck Millipore | 70166-500G | For membrane blocking in western blotting |
| Sodium Dodecyl Sulfate | 1st BASE | BIO-2050-500g | For SDS gel preparation |
| SW-1736 | Cytion | 300453 | Human thyroid squamous cell cancer cell line |
| T75 culture flasks | SPL Lifesciences | 70075 | Cell culture flask |
| Tecan Multimode Reader model Spark 10M | Tecan | 1607000294 | for luminicence quantification |
| TEMED | Bio-Rad | #1610801 | For SDS gel preparation |
| Tween-20 | Promega | H5151 | For membrane washing in western blotting |
| Vi-cell XR cell viability analyzer | Beckman Coulter | AL15072 | Cell counter |
Referencias
- Zahavi, D., AlDeghaither, D., O'Connell, Enhancing antibody-dependent cell-mediated cytotoxicity: a strategy for improving antibody-based immunotherapy. Antib Ther. 1 (1), 7-12 (2018).
- Fenis, A., Demaria, O., Gauthier, L., Vivier, E. New immune cell engagers for cancer immunotherapy. Nat Rev Immunol. 24 (7), 471-486 (2024).
- Pinto, S., Pahl, J., Schottelius, A., Carter, P. J. Reimagining antibody-dependent cellular cytotoxicity in cancer: the potential of natural killer cell engagers. Trends Immunol. 43 (11), 932-946 (2022).
- Ochoa, M. C., et al. Antibody-dependent cell cytotoxicity: immunotherapy strategies enhancing effector NK cells. Immunol Cell Biol. 95 (4), 347-355 (2017).
- Wang, W., Erbe, A. K., Hank, J. A., Morris, Z. S. NK cell-mediated antibody-dependent cellular cytotoxicity in cancer immunotherapy. Front Immunol. 6, 368 (2015).
- Chung, S., et al. Characterization of in vitro antibody-dependent cell-mediated cytotoxicity activity of therapeutic antibodies - impact of effector cells. J Immunol Methods. 407, 63-75 (2014).
- Shimasaki, N., Jain, A., Campana, D. NK cells for cancer immunotherapy. Nat Rev Drug Discov. 19 (3), 200-218 (2020).
- Cheng, Z. J., et al. Development of a robust reporter-based ADCC assay with frozen, thaw-and-use cells to measure Fc effector function of therapeutic antibodies. J Immunol Methods. 414, 69-81 (2014).
- Parekh, B. S., et al. Development and validation of an antibody-dependent cell-mediated cytotoxicity-reporter gene assay. MAbs. 4 (3), 310-318 (2012).
- Hogarth, P. M., Pietersz, G. A. Fc receptor-targeted therapies for the treatment of inflammation, cancer and beyond. Nat Rev Drug Discov. 11 (4), 311-331 (2012).
- Chung, S., et al. Quantitative evaluation of fucose reducing effects in a humanized antibody on Fcgamma receptor binding and antibody-dependent cell-mediated cytotoxicity activities. MAbs. 4 (3), 326-340 (2012).
- . ADCC Reporter Bioassay Core Kit Technical Manual Available from: https://www.promega.sg/-/media/files/resources/protocols/technical-manuals/101/adcc-reporter-bioassay-core-kit-protocol.pdf?rev=bec36264c0b6470591ded081377d207d&sc_lang=en (2023)
- Miller, A. S., Tejada, M. L., Gazzano-Santoro, H. Methods for measuring antibody-dependent cell-mediated cytotoxicity in vitro. Methods Mol Biol. 1134, 59-65 (2014).
- Lo Nigro, C., et al. NK-mediated antibody-dependent cell-mediated cytotoxicity in solid tumors: biological evidence and clinical perspectives. Ann Transl Med. 7 (5), 105 (2019).
- Gómez Román, V. R., Murray, J. C., Weiner, L. M., Ackerman, M. E., Nimmerjahn, F. . Antibody Fc. , 1-27 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados