Method Article
Bewertung der Antikörper-abhängigen, zellvermittelten Zytotoxizität in Krebszellen mit Hilfe des Antikörper-abhängigen zellvermittelten Zytotoxizitäts-Reporter-Bioassays
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
In dieser Arbeit stellen wir ein Protokoll für einen Antikörper-abhängigen, zellvermittelten Zytotoxizitäts-Assay (ADCC) unter Verwendung eines ADCC-Bioassay-Kits vor. Diese Methode bietet ein wertvolles Werkzeug, um den ADCC-Mechanismus aufzuklären und das therapeutische Potenzial von Antikörpern in der Krebsimmuntherapie zu bewerten.
Zusammenfassung
Die Methode zur antikörperabhängigen, zellvermittelten Zytotoxizität (ADCC) stellt ein wichtiges Instrument dar, um die Wirksamkeit therapeutischer Antikörper in der Krebsimmuntherapie zu beurteilen. Die Bewertung der ADCC-Aktivität in Krebszellen ist für die Entwicklung und Optimierung von Antikörper-basierten Behandlungen unerlässlich. In dieser Arbeit schlagen wir einen methodischen Ansatz vor, bei dem ein ADCC-Bioassay-Kit zur quantitativen Bewertung der ADCC-Reaktion mit Schilddrüsenkrebszellen als Effektorzellen verwendet wird. Das Protokoll beinhaltet die Co-Kultur von Effektorzellen mit Zielkrebszellen in unterschiedlichen Verhältnissen in Gegenwart eines therapeutischen Antikörpers. Das in diesem Experiment verwendete ADCC-Bioassay-Kit enthält die gentechnisch veränderten Effektorzellen, die ein Luciferase-Reportergen unter der Kontrolle von NFAT-Reaktionselementen (Nuclear Factor of Activated T-cell) exprimieren. Nach der Bindung des Oberflächenantigens an die Zielzellen mit den Antikörpern und Effektorzellen setzen die Effektorzellen Luciferase frei, was eine Quantifizierung der Zytotoxizität durch Messung des Lumineszenzsignals ermöglicht. Im Gegensatz zu herkömmlichen ADCC-Assays konnte bei dieser Methode die Bindung des Zielantigens an Antikörper und Effektorzellen nachgewiesen werden, was in kurzer Zeit zu zuverlässigen Ergebnissen führen kann.
Einleitung
Die Antikörper-abhängige, zellvermittelte Zytotoxizität (ADCC) ist ein wichtiger Mechanismus, durch den Antikörper immunvermittelte zellabtötende Wirkungen ausüben 1,2,3. Die Immunzellen werden durch Bindung an den therapeutischen Antikörper aktiviert, der mit Oberflächenantigenen der Zielzellen interagiert, um Granzyme, Perforin, freizusetzen, was zum Tod der Zielzellen führt. Zu diesen Immunzellen gehören die natürlichen Killerzellen (NK) und die Neutrophilen 2,3,4,5,6,7. Der ADCC-Assay hat sich zu einem wichtigen Instrument entwickelt, um die Wirksamkeit von therapeutischen Antikörpernzu bewerten 8,9.
Beim herkömmlichen ADCC-Assay werden mononukleäre Zellen des peripheren Blutes (PBMCs) oder natürliche Killerzellen als Effektorzellen verwendet, um die Wirksamkeit eines therapeutischen Antikörpers zu überwachen, indem die Zelltodrate des Ziels quantifiziert wird. Unsere Methode verwendet ein ADCC-Bioassay-Kit, das gentechnisch veränderte Effektorzellen enthält, die ein Luciferase-Reportergen unter der Kontrolle von NFAT-Reaktionselementen (Nuclear Factor of Activated T-cell) exprimieren. Anschließend quantifizieren wir die Bindung des Oberflächenantigens an die Zielzellen mit dem Antikörper und den Effektorzellen. Diese Methode basiert darauf, dass die ADCC-Reaktion in kurzer Zeit abläuft, ohne dass humane PBMC-Zellen benötigt werden. Zu den experimentellen Schritten gehört die Co-Kultur von Effektorzellen mit Zielzellen in Gegenwart von therapeutischen Antikörpern.
Während der Inkubation bindet der therapeutische Antikörper an das Zielantigen auf der Oberfläche der Zielzellen, was zur Bindung der Effektorzellen und des Fc-Fragments eines Antikörpers führt. Dadurch wird das NFAT-Response-Element aktiviert und Lumineszenzsignale für die quantitative Beurteilung der ADCC-Reaktion freigesetzt.
Vor der Durchführung des Experiments muss die Expression des Zielantigens in den Zielzellen entweder durch Durchflusszytometrie oder Western Blot bestätigt werden. Die Zielzellen werden kultiviert und vor dem Experiment 24 Stunden lang in 96-Well-Platten abgefüllt. Unterschiedliche Konzentrationen eines therapeutischen Antikörpers werden zusammen mit unterschiedlichen Zellzahlen von Effektorzellen addiert, um das berechnete Effektor-Zielzell-Verhältnis zu erreichen.
Zu den wichtigsten Schritten dieser Methode gehören (1) die Vorbereitung von Zielzellen und Effektorzellen, (2) das Verhältnis von Effektor zu Zielzelle, (3) die Herstellung unterschiedlicher Konzentrationen des Antikörpers und (4) die Variation der Inkubationsdauer. Nach der Inkubation werden die Lumineszenzsignale mit einem Luminometer gemessen, das eine quantitative Ablesung der ADCC-Aktivität ermöglicht. Im Vergleich zu anderen Methoden zur Messung der ADCC ist diese Methode relativ einfach zu bedienen und die Ergebnisse sind genau.
Der ADCC-Reporter-Bioassay zeigt die Bindung des Zielantigens, des therapeutischen Antikörpers und der Immunzellen an der Aktivierung des ADCC-Signalwegs an. Diese Bindung aktiviert die Gentranskription über den NFAT-Signalweg in den von Effektorzellen gezüchteten Jurkat-Zellen mit stabil exprimierendem FcγRIIIa-Rezeptor, der V158-Variante (High-affinity). Das NFAT-Response-Element vermittelt die Expression von Luciferase in den Effektorzellen 10,11. Die biologische Aktivität des Antikörpers im Wirkmechanismus (MOA) von ADCC wird durch das Luciferase-Signal quantifiziert, das über den NFAT-Signalweg erzeugt wird. Das Luziferase-Signal in den Effektorzellen - FcγRIIIa-Rezeptor-exprimierenden Jurket-Zellen - wird mit einem Lumineszenz-Reader quantifiziert (Abbildung 1). Das Signal-Rausch-Verhältnis des Assays ist hoch.
Protokoll
1. Nachweis der EGFR- und VEGFR-Expression in Zielzellen
HINWEIS: Verwenden Sie Western Blotting, um die Expression des Zielantigens in den Zielzellen nachzuweisen.
- Probenvorbereitung
- Kultivieren Sie die Zellen (humane Schilddrüsenkrebszelllinien BHT-101 und SW-1736) in T75-Kolben mit Medium des Roswell Park Memorial Institute (RPMI), das mit 10 % fötalem Rinderserum (FBS), 1 % L-Glutamin und 1 % Antibiotika (Penicillin-Streptomycin) ergänzt wurde.
- Ernten Sie die Zellen, wenn sie zu 80 % konfluent sind, indem Sie das Kulturmedium entfernen und die Zellen mit PBS waschen. Fügen Sie 5 ml PBS hinzu und verschrotten Sie die Zellen mit einem Zellschaber, um die Zellen aus dem Kulturkolben zu entfernen. Übertragen Sie die Zellen in ein konisches 15-ml-Röhrchen.
- Zählen Sie die Zellen mit einem Zellzähler.
- Aliquot 5 × 106 der BHT-101- und SW-1736-Zellen in konische 15-ml-Röhrchen.
- Schleudern Sie die Zellen bei 135 × g für 5 min bei Raumtemperatur herunter. Entfernen Sie den Überstand PBS.
- Lysieren Sie das Zellpellet, indem Sie 100 μl RIPA-Lysepuffer mit Protease-Phosphatase-Inhibitoren für 5 Minuten auf Eis hinzufügen. Das Lysat wird in ein 2-ml-Röhrchen überführt, 15 Minuten lang bei 15.000 × g zentrifugiert und der Überstand in ein neues 2-ml-Röhrchen überführt.
- Messen Sie die Proteinkonzentration des Zelllysats mit einem Bicinchoninsäure (BCA)-Assay-Kit.
- Aliquotieren Sie 70 μg Protein aus Zelllysat aus jeder Probe, fügen Sie 2x Laemmli-Probenpuffer hinzu, der mit 10 % 2-Mercaptoethanol ergänzt ist, und kochen Sie die Proben 5 min lang bei 100 °C zur Denaturierung der Proben.
- Gelelektrophorese und Membrantransfer
- Bereiten Sie 8 % Natriumdodecylsulfat (SDS) Polyacrylamid-Gel mit destilliertem Wasser (4,7 ml), 30 % Acrylamid (2,7 mL), 1,5 M Tris-Puffer, pH 8,8 (2,5 mL), 10 % Natriumdodecylsulfat (0,1 ml), 10 % Ammoniumpersulfat (100 μl) und TEMED (10 μl) vor.
- 70 μg der denaturierten Proben werden im 8%igen SDS-Polyacrylamid-Gel 20 min lang bei 80 V und 100 min bei 120 V geführt.
- Übertragen Sie das Protein auf dem Gel für 90 Minuten auf eine Membran aus Polyvinylidenfluorid (PVDF) bei 100 V.
- Nach dem Übertragen die Membran 1 h lang mit 7 % Magermilch verdünnt in TBS-T-Puffer (20 mM Tris pH 7,6, 140 mM NaCl, 0,2 % Tween-20) blockieren.
- Inkubation von Antikörpern
- Inkubieren Sie die blockierte Membran über Nacht bei 4 °C mit dem anti-epidermalen Wachstumsfaktor-Rezeptor (EGFR) der Maus und dem anti-vaskulären endothelialen Wachstumsfaktor-Rezeptor (VEGFR) des Kaninchens (verdünnt bei 1:1.000 in 7 % Magermilch).
- Waschen Sie die Membran nach der Inkubation gründlich mit Tris-gepuffertem Kochsalzlösungs-Tween (TBS-T) Puffer (20 mM Tris pH 7,6, 140 mM NaCl, 0,2% Tween-20) für 7 min und wiederholen Sie dies 4x.
- Inkubieren Sie die Membran mit dem HRP-konjugierten Sekundärantikörper (verdünnt bei 1:4.000 in 7%iger Magermilch (TBS-T)) für 1 h.
- Waschen Sie die Membran nach der Inkubation 7 Minuten lang gründlich mit TBS-T-Puffer und wiederholen Sie den Vorgang 4 Mal.
- Nachweis von Proteinen
- Inkubieren Sie die Membran in chemilumineszierendem HRP-Substrat, das hergestellt wurde, indem Sie 1 mL HRP-Substratperoxidlösung mit 1 mL HRP-Substrat Luminol-Reagenz (beide Reagenzien stammen aus dem Chemilumineszenz-Substrat-Kit) für 2 Minuten mischen.
- Visualisieren Sie die Membran mit einem bildgebenden System.
2. Vorbereitung der Zielzellen
- Kultivieren Sie die Ziel-T-Zellen, BHT-101- und SW-1736-Zellen exponentiell, bis 80 % konfluent in RPMI-Medien sind, ergänzt mit 10 % FBS, 1 % L-Glutamin und 1 % Antibiotika (Penicillin-Streptomycin) in T-75-Kolben.
- Waschen Sie die Zellen nach dem Entfernen des Mediums einmal mit PBS. Inkubieren Sie die Zellen 5 Minuten lang mit 1 ml nicht-enzymatischem Zelldissoziationspuffer, um die adhärenten Zellen zu entfernen. Fügen Sie PBS hinzu, um die Reaktion des nicht-enzymatischen Zelldissoziationspuffers zu stoppen. Schleudern Sie die Zellen 5 Minuten lang bei 135 × g herunter und fügen Sie 5 ml PBS hinzu.
HINWEIS: Hier verwenden wir einen nicht-enzymatischen Zelldissoziationspuffer, um die Integrität des Membranoberflächenproteins zu erhalten. - Zählen Sie die Zellen und säen Sie sie mit 15.000 Zellen/Wells in weißen 96-Well-Mikroplatten aus Polystyrol mit klarem, flachem Boden aus.
3. Herstellung unterschiedlicher Konzentrationen des therapeutischen Antikörpers
- Um diesem Protokoll zu folgen, verwenden Sie Cetuximab (chimärer Anti-EGFR-Antikörper), um EGFR zu binden, und verwenden Sie Bevacizumab (humanisierter Anti-VEGF-A-Antikörper) als Negativkontrolle.
- Bereiten Sie den ADCC-Bioassay-Puffer vor, indem Sie 1,4 ml Serum mit niedrigem IgG-Gehalt in 33,6 ml RPMI-1640 (im Kit enthalten) geben.
- Verwenden Sie ADCC Bioassay Puffer für die Verdünnung von Antikörpern. Bereiten Sie 400 μl jedes Antikörpers in drei verschiedenen Konzentrationen vor: 30 μg/ml, 3 μg/ml und 0,3 μg/ml (3x Konzentration), um die Endkonzentration von 10 μg/ml, 1 μg/ml und 0,1 μg/ml für eine Breitbandabdeckung zu erhalten und die optimale Dosis zu ermitteln.
HINWEIS: Die endgültigen Antikörperkonzentrationen basieren auf 25 μl kultivierten Zielzellen, 25 μl Effektorzellen und 25 μl Antikörper in jeder Vertiefung einer 96-Well-Platte.
4. Vorbereitung der Effektorzellen
- Lagern Sie die Effektorzellen vor Gebrauch bei -80 °C.
- Heizen Sie den ADCC Bioassay Puffer vor der Verwendung mindestens 30 min in einem 37 °C warmen Wasserbad vor.
- Tauen Sie die ADCC Bioassay Effektorzellen aus einer kalten Lagerung von -80 °C auf, indem Sie sie in ein 37 °C warmes Wasserbad legen (ca. 2-3 min). Schütteln Sie das Fläschchen vorsichtig und inspizieren Sie es visuell, aber drehen Sie es während des Auftauvorgangs nicht um.
- Übertragen Sie 630 μl Effektorzellen in ein 15-ml-Röhrchen mit 3,6 ml ADCC-Assay-Puffer. Gut mischen, indem Sie das Röhrchen 2x vorsichtig umdrehen.
5. Inkubation von Effektorzellen mit Antikörper- und Zielzellen
- Nach der Inkubation über Nacht entfernen Sie das Medium aus den Zielzellen (15.000 Krebszellen pro Vertiefung) und fügen Sie 25 μl des ADCC-Bioassay-Puffers und 25 μl Cetuximab (EGFR-Antagonist) und Bevacizumab (VEGF-Antagonist) hinzu, um die Endkonzentration von 0,1 μg/ml, 1 μg/ml oder 10 μg/ml der Zielzellen in jeder Vertiefung gemäß Abbildung 2 zu erhalten.
- Geben Sie 75.000 Effektorzellen in 25 μl ADCC-Bioassay-Puffer pro Well in die 96-Well-Mikroplatte mit den Zielzellen. Die Vertiefungen, die als No mAb gekennzeichnet sind, fungieren als No-Antikörper-Kontrolle (Abbildung 2).
- Geben Sie ADCC Bioassay-Puffer in die als AB gekennzeichneten Vertiefungen (ADCC Bioassay-Puffer) zur Blindkontrolle.
- Inkubieren Sie die Platte 6 Stunden lang.
6. Quantitative Auslesung der ADCC-Aktivität
- Bereiten Sie das Luciferase-Assay-Reagenz 4 h vor der Messung vor, indem Sie Luciferase Assay-Puffer zum Luciferase-Assay-Substrat (lyophilisiert) hinzufügen.
- Nach 6 Stunden Inkubation von Zielzellen, Antikörpern und Effektorzellen geben Sie 75 μl des Luciferase-Assay-Reagenzes in jede Vertiefung und inkubieren Sie 30 Minuten lang.
- Messen Sie nach der Inkubationszeit das Lumineszenzsignal in jeder Vertiefung mit einem Luminometer, das eine quantitative Anzeige der ADCC-Aktivität liefert.
- Berechnen Sie für die Datenanalyse die Faltinduktion wie folgt:
Falteninduktion = RLU (Antikörper-induziert - Hintergrund) / RLU (keine Antikörperkontrolle - Hintergrund).
Wobei RLU die relative Lumineszenzeinheit ist; Antikörper-induziert sind die Vertiefungen B3 bis B8 und C3 bis C8; Keine Antikörperkontrolle = B2 und C2; Hintergrund = Durchschnittliche RLU von Vertiefung A2 bis A5 (Abbildung 2).
Ergebnisse
Die Expression von EGFR und VEGFR in den Zielzellen BHT-101 und SW-1736 wurde mittels Western Blot nachgewiesen. Sowohl in BHT-101- als auch in SW-1736-Zellen wurde eine EGFR-Expression nachgewiesen, nicht jedoch eine VEGFR-Expression (Abbildung 3).
Mit dem ADCC-Bioassay-Kit konnten wir die ADCC-Reaktion des Anti-EGFR-Antikörpers Cetuximab unter Verwendung der EGFR-positiven Zelllinien BHT-101 und SW-1736 als Zielzellen nachweisen. Bevacizumab, ein VEGF-Inaktivator, wurde als negativer Kontrollantikörper verwendet. Unterschiedliche Konzentrationen von Antikörpern und Effektorzellen wurden mit den Zielzellen inkubiert. Das Lumineszenzsignal wurde mit einem Plattenleser detektiert (Abbildung 2). Eine höhere Faltung der ADCC-Aktivitätsinduktion wurde in Cetuximab-Gruppen (Anti-EGFR-Antikörper) gefunden, aber keine ADCC-Aktivität wurde in Bevacizumab (VEGF-Antagonist) für beide Zelllinien beobachtet. Dies zeigte den ADCC-Effekt, der auf EGFR-extrazelluläre Membranantigene für beide Zelllinien abzielt. Mit dieser Methode wurde die ADCC-Reaktion in Gegenwart von Cetuximab in zwei anaplastischen Schilddrüsenkrebszelllinien (BHT101 und SW1736) validiert (Abbildung 4).
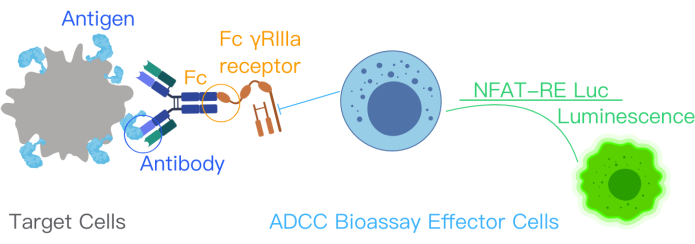
Abbildung 1: Ein schematisches Diagramm, das die ADCC-Reaktion mit dem ADCC-Bioassay-Kit zeigt. Antigen-Bindungsstellen im therapeutischen Antikörper binden an Oberflächenantigene in Zielzellen. Diese Bindung führt zur Bindung des Fc-Teils des Antikörpers an die FcƳRIIIa-Rezeptoren von Effektorzellen, die gentechnisch mit NFAT-RE luc verändert wurden, wodurch ein Lumineszenzsignal in den Effektorzellen erzeugt wird. Diese Zahl wurde aus dem Handbuch des ADCC Reporter Bioassay Core Kits mit Genehmigung12 geändert. Abkürzungen: ADCC = Antikörper-abhängige zellvermittelte Zytotoxizität; Fc = Kristallisierbarer Bereich des Fragments; NFAT = Kernfaktor der aktivierten T-Zelle; RE = Antwort-Element; luc = Luziferase. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Lumineszenzmessung und experimentelles Diagramm des 96-Well-Plattendesigns des ADCC-Cokultursystems. Lumineszenzsignale werden von einem Lumineszenz-Reader ausgelesen. Reihe A: 1bis 9. Wells enthalten ADCC-Bioassay-Puffer. Reihe B: Die3. bis 8. Wells enthalten das ADCC-Reaktionssystem von BHT101 (Zielzellen + Antikörper + Effektorzellen). Die 2. Vertiefung ist ohne Antikörper. Die 9. Vertiefung enthält nur ADCC-Bioassay-Puffer. Reihe C:Die 3. bis 8. Wells enthalten das ADCC-Reaktionssystem von SW-1736 (Zielzelle + Antikörper + Effektorzellen). Die 2. Vertiefung ist ohne Antikörper. Die 9. Vertiefung enthält nur ADCC-Bioassay-Puffer. Reihe D: 1bis 9. Wells enthalten Assay-Puffer. Abkürzungen: ADCC = Antikörper-abhängige zellvermittelte Zytotoxizität; AB = ADCC-Bioassay-Puffer; VEGFR = Rezeptor des vaskulären epithelialen Wachstumsfaktors; EGFR = Epidermaler Wachstumsfaktor-Rezeptor; mAb = monoklonaler Antikörper. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
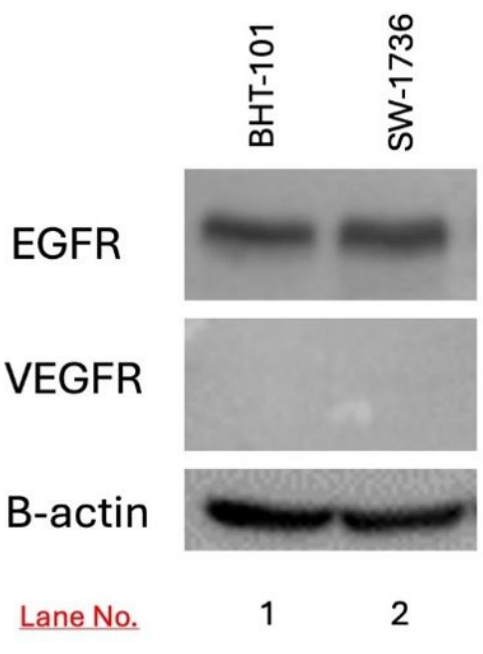
Abbildung 3: Nachweis der EGFR- und VEGFR-Expression bei BHT-101 und SW-1736 Schilddrüsenkarzinomen mittels Western Blotting. Die Expression von EGFR, aber nicht von VEGFR wurde in beiden Zelllinien nachgewiesen. Als Ladekontrolle wurde B-Aktin verwendet. Abkürzungen: EGFR = epidermaler Wachstumsfaktor-Rezeptor; VEGFR = vaskulärer epidermaler Wachstumsfaktor. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
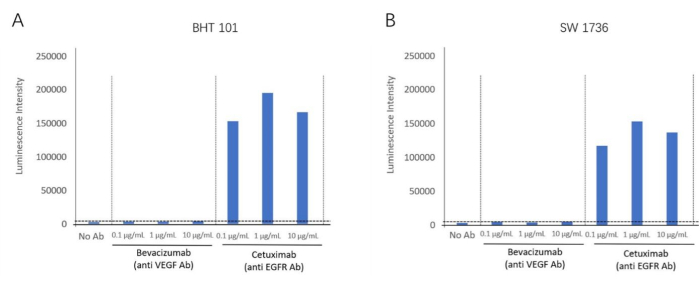
Abbildung 4: Falteninduktion der ADCC-Aktivität. (A) Die Schilddrüsenkrebszelllinie BHT-101 zeigt in Gegenwart des Anti-EGFR-Antikörpers Cetuximab einen ADCC-Effekt. (B) Die Schilddrüsenkrebszelllinie SW-1736 zeigt in Gegenwart des Anti-EGFR-Antikörpers Cetuximab einen ADCC-Effekt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
In dieser Arbeit haben wir die ADCC Bioassay-Methode zur Beurteilung der ADCC-Reaktion eines therapeutischen Antikörpers vorgestellt. Die Methode ist unkompliziert und verwendet ein einfaches "Add-Mix-Read"-Format für die Messung.
Vor der Durchführung des Experiments muss die Expression des Zielantigens in den Zielzellen entweder durch Durchflusszytometrie oder Western Blot bestätigt werden. Die Durchflusszytometrie ist ein besseres Werkzeug zum Nachweis des Oberflächenantigens. Der Einsatz der Durchflusszytometrie kann jedoch die Zellen belasten, was zu Apoptose führt und die Lebensfähigkeit der Zelle und damit die Gesamtanalyse beeinträchtigt. Außerdem kostet es mehr als Western Blotting. In diesem Experiment haben wir Western Blot als schnellere und kostengünstigere Methode verwendet, da es sich bei den Zielantigenen um bekannte Zelloberflächenantigene handelt.
Als Effektorzellen wurden manipulierte Jurkat-Zellen verwendet, die den FcγRIIIa-Rezeptor, die V158-Variante (hohe Affinität) und ein NFAT-Antwortelement, das die Expression der Glühwürmchen-Luziferase steuert, stabil exprimierten. Die Aktivierung des NFAT-Signalwegs führt zur Produktion von Luciferase, und ihre Aktivität wird in Form einer Lumineszenzauslesung quantifiziert. Das Signal stellt auch die Aktivität von ADCC dar.
Zunächst werden Zielzellen (T) mit Effektorzellen (E) in Gegenwart unterschiedlicher Mengen an Antikörpern in 96-Well-Platten für 6 h bei 37 °C in einem befeuchteten CO2 -Inkubator inkubiert. Zur Optimierung des Signals wird das Effektor:Soll-Verhältnis von 5:1 verwendet. Zum Beispiel wurden 75.000 Effektorzellen zu 15.000 Zielzellen hinzugefügt. Am Ende der Inkubation wird das Bio-Glo Luciferase-Assay-Reagenz in jede Vertiefung gegeben, 30 Minuten lang inkubiert, und die Lumineszenz (RLU, relative Luciferase-Einheiten) wird mit einem Lumineszenzplatten-Reader gemessen.
Die wichtigsten kritischen Schritte in diesem Protokoll sind: (1) Die Handhabung von Effektorzellen. Das Zellfläschchen sollte während des Auftauvorgangs nicht umgedreht werden, leicht schaukeln und muss unmittelbar nach dem Auftauen verwendet werden, um unerwünschten Zelltod zu verhindern oder die Leistung des biologischen Nachweises zu beeinträchtigen. (2). Es ist wichtig, weiße Polystyrol-96-Well-Mikroplatten mit klarem, flachem Boden für Lumineszenzmessungen zu verwenden, da die Lumineszenz von der Unterseite des Lesegeräts erfasst wird.
In dieser Studie beobachteten wir die stärkeren und schwächeren ADCC-Reaktionen des Anti-EGFR-Antikörpers Cetuximab, abhängig von der Anzahl der Zielzellen und der Antikörperkonzentration. Einige Gründe für die Kalibrierung schwacher ADCC-Reaktionen: (1) Die Messwerte des ADCC-Reporter-Bioassays stammen von Effektorzellen (E) mit einer konstanten Anzahl von 75.000 Zellen pro Well im ADCC-Reaktionssystem dieser Studie. Daher ist die Optimierung der Qualität der Zielzellen (T) ein Aspekt, der verbessert werden kann. Das E:T-Verhältnis in dieser Studie lag bei 5:1, das bis zu 20:1 angepasst werden konnte. (2) Die Antikörperkonzentration ist auch einer der wichtigen Faktoren, die die ADCC-Reaktion beeinflussen. Anpassungen können durch serielle Verdünnung von Antikörpern vorgenommen werden, um den optimalen Konzentrationsbereich zu erkunden und so ein maximales Ansprechen im ADCC-Bericht zu erreichen. (3) Die Inkubationszeit von Antikörpern, Zielzellen und Effektorzellen ist ebenfalls entscheidend für experimentelle Ergebnisse. In dieser Studie haben wir 6 Stunden lang inkubiert, die auf bis zu 24 Stunden verlängert werden können, um die optimale ADCC-Reaktion zu erreichen. (4) Zusätzlich muss auch die Konzentration der Pufferlösung (niedriges IgG) für den ADCC-Assay untersucht werden. Die optimale Serumkonzentration für das ADCC-Ansprechen kann im Bereich von 1 % bis 10 % erreicht werden.
Diese experimentelle Methode ist schnell und unkompliziert und ermöglicht die Fertigstellung innerhalb eines Tages durch ein einfaches "Add-Mix-Read"-Protokoll. Die Ergebnisse sind stabil und für Chargentests geeignet. Dieses Bioassay-Kit weist jedoch keinen Zelltod nach wie herkömmliche ADCC-Methoden, die PBMC- oder NK-Zellen als Effektorzellen verwenden12,13. Stattdessen werden FcγRIIIa-Rezeptor-exprimierte Jurkat-Zellen als Effektorzellen verwendet, die aufgrund der genetisch veränderten Zellen teurer werden. Im Vergleich zu herkömmlichen ADCC-Experimenten13,14 entfällt die Notwendigkeit von Blutspenden von gesunden Personen und der komplexe Prozess der Extraktion von Immunzellen, wodurch individuelle Variationen, die sich auf die Ergebnisse auswirken könnten, gemildert werden. Die detektierten Lumineszenzsignale stammen von der Bindung von Effektorzellen an Zielzellen, nicht vom tatsächlichen Tod der Zielzellen. Daher kann es zu Diskrepanzen im Vergleich zu Standard-ADCC-Nachweismethoden kommen. Darüber hinaus wird Zelldissoziationspuffer, der teurer als Trypsin ist, verwendet, um die adhärenten Zellen abzulösen und die Membranintegrität zu erhalten.
Die ADCC-Reportergenanalyse zeigt eine hervorragende Genauigkeit und Stabilität und dient als Methode zur Wirksamkeitsanalyse für den Massennachweis von therapeutischen Antikörpern. Es kann auch als kritische Analysemethode für die Charakterisierung therapeutischer Moleküle und die Prozessentwicklung fungieren15.
Zusammenfassend lässt sich sagen, dass ADCC ein wichtiger Immunmechanismus ist, und der quantitative Nachweis von ADCC hat im Bereich der Immuntherapie eine große Bedeutung. Diese experimentelle Methode bietet ein effektives Mittel zur quantitativen Messung von ADCC15.
Offenlegungen
Alle Autoren erklären, dass keine Interessenkonflikte bestehen.
Danksagungen
Wir danken Prof. Zeng (IMCB, A*STAR) für die Unterstützung dieser Arbeit. Diese Studie wurde von der Youth Foundation der National Natural Science Foundation of China (NSFC) (82202231) und dem Medical and Health Science and Technology Project der Provinz Zhejiang, China (2021KY110,2024KY824) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.5% Trypsin-EDTA | Gibco | 15400-054 | Dilute 10x in PBS to make 0.05% Trypsin |
| 1x Tris Buffer Saline (TBS) | 1st BASE | BUF-3030-1X1L | For membrane washing in western blotting |
| 1.5 M Tris Buffer, pH 8.8 | 1st BASE | BUF-1419-1L-pH8.8 | For SDS gel preparation |
| 2-Mercaptoethanol | Sigma Aldrich | M7522-100ML | For sample preparation of western blotting |
| 30% Acrylamide/Bis solution | Bio-Rad | #1610158 | For SDS gel preparation |
| 4x Laemmli Buffer | Bio-Rad | #1610747 | For sample preparation of western blotting |
| 96-well white polystyrene microplate with clear flat bottom | Corning Incorporated | 3610 | For ADCC assay |
| ADCC Bioassay Effector cells (0.65 mL) | Promega | G7011 | Includes in ADCC reporter bioassay core kit (Promega G7010), 1 x 1 vial |
| ADCC reporter bioassay core kit | Promega | G7010 | Mentioned as ADCC bioassay kit for ADCC assay in this experiment |
| Ammonium Persulfate | Sigma Aldrich | A3678-25G | For SDS gel preparation |
| Bevacizumab (Humanized Anti VEGF-antibody) | MVASI | - | Use as negative control antibody in ADCC asssay |
| BHT-101 | Leibniz Institute DSMZ | ACC279 | Human anaplastic papillary thyroid cancer cell line |
| Bio-Glo Luciferase Assay Buffer | Promega | G7941 | Includes in ADCC reporter bioassay core kit (Promega G7010), 1 x 10 mL |
| Bio-Glo Luciferase Assay Substrate (Lyophilized) | Promega | G7941 | Includes in ADCC reporter bioassay core kit (Promega G7010), 1 x 1 vial |
| Cell scraper | GenFollower | GD00235 | To remove cell from culture flask |
| Cetuximab (Chimeric anti-EGFR antibody) | ERBITUX | - | Use as therapeutic antibody in ADCC assay |
| Chemiluminescent HRP substrate | Merck Millipore | WBKLS0500 | For protein detection in western blotting |
| Distilled water | Gibco | 15230-162 | For SDS gel preparation |
| Fetal Bovine Serum (FBS) | Gibco | 10270-106 | Culture media supplement |
| iBright CL1500 imaging system | Thermo Scientific | 2462621100038 | For protein detection in western blotting |
| L-glutamine, 200 mM | Gibco | 25030-081 | Culture media supplement |
| Low IgG Serum | Promega | G7110 | Includes in ADCC reporter bioassay core kit (Promega G7010), 1 x 4 mL |
| Megafuge 8R | Thermo Scientific | 42876589 | Centrifuge |
| Mouse anti-EGFR monoclonal antibodies | BD Biosciences | 610016 | Primary antibody in western blotting |
| Mouse anti-VEGFR monoclonal antibodies | BD Biosciences | 571194 | Primary antibody in western blotting |
| non-enzymatic cell dissociation buffer | Sigma Aldrich | C5789-100ML | For cell harvesting from T75 flask |
| Penicillin-Streptomycin | PAN Biotech | P06-07100 | Antibacterial for culture media |
| Phosphate Buffered Saline (PBS), pH 7.2, Sterile filtered | 1st BASE | CUS-2048-1x1L | Use as washing solution for cells |
| Pierce BCA assay kit | Thermo Scientific | 23225 | To measure protein concentration |
| Protease and phosphatase inhibitor | Thermo Scientific | A32959 | For protein digestion in sample preparation for western blotting |
| PVDF membrane (Immobilin-P) | Merck Millipore | IPVH00010 | For protein transfer in western blotting |
| Rabbit anti-mouse IgG, Fcγ HRP-conjugated secondary antibody | Jackson ImmunoResearch | 315-035-046 | Secondary antibody in western blotting |
| Roswell Park Memorial Institute (RPMI) medium | Capricorn Scientific | RPMI-XA | Cell culture media |
| RPMI-1640 | Promega | G7080 | Includes in ADCC reporter bioassay core kit (Promega G7010), 1 x 36 mL |
| Skim milk powder | Merck Millipore | 70166-500G | For membrane blocking in western blotting |
| Sodium Dodecyl Sulfate | 1st BASE | BIO-2050-500g | For SDS gel preparation |
| SW-1736 | Cytion | 300453 | Human thyroid squamous cell cancer cell line |
| T75 culture flasks | SPL Lifesciences | 70075 | Cell culture flask |
| Tecan Multimode Reader model Spark 10M | Tecan | 1607000294 | for luminicence quantification |
| TEMED | Bio-Rad | #1610801 | For SDS gel preparation |
| Tween-20 | Promega | H5151 | For membrane washing in western blotting |
| Vi-cell XR cell viability analyzer | Beckman Coulter | AL15072 | Cell counter |
Referenzen
- Zahavi, D., AlDeghaither, D., O'Connell, Enhancing antibody-dependent cell-mediated cytotoxicity: a strategy for improving antibody-based immunotherapy. Antib Ther. 1 (1), 7-12 (2018).
- Fenis, A., Demaria, O., Gauthier, L., Vivier, E. New immune cell engagers for cancer immunotherapy. Nat Rev Immunol. 24 (7), 471-486 (2024).
- Pinto, S., Pahl, J., Schottelius, A., Carter, P. J. Reimagining antibody-dependent cellular cytotoxicity in cancer: the potential of natural killer cell engagers. Trends Immunol. 43 (11), 932-946 (2022).
- Ochoa, M. C., et al. Antibody-dependent cell cytotoxicity: immunotherapy strategies enhancing effector NK cells. Immunol Cell Biol. 95 (4), 347-355 (2017).
- Wang, W., Erbe, A. K., Hank, J. A., Morris, Z. S. NK cell-mediated antibody-dependent cellular cytotoxicity in cancer immunotherapy. Front Immunol. 6, 368 (2015).
- Chung, S., et al. Characterization of in vitro antibody-dependent cell-mediated cytotoxicity activity of therapeutic antibodies - impact of effector cells. J Immunol Methods. 407, 63-75 (2014).
- Shimasaki, N., Jain, A., Campana, D. NK cells for cancer immunotherapy. Nat Rev Drug Discov. 19 (3), 200-218 (2020).
- Cheng, Z. J., et al. Development of a robust reporter-based ADCC assay with frozen, thaw-and-use cells to measure Fc effector function of therapeutic antibodies. J Immunol Methods. 414, 69-81 (2014).
- Parekh, B. S., et al. Development and validation of an antibody-dependent cell-mediated cytotoxicity-reporter gene assay. MAbs. 4 (3), 310-318 (2012).
- Hogarth, P. M., Pietersz, G. A. Fc receptor-targeted therapies for the treatment of inflammation, cancer and beyond. Nat Rev Drug Discov. 11 (4), 311-331 (2012).
- Chung, S., et al. Quantitative evaluation of fucose reducing effects in a humanized antibody on Fcgamma receptor binding and antibody-dependent cell-mediated cytotoxicity activities. MAbs. 4 (3), 326-340 (2012).
- . ADCC Reporter Bioassay Core Kit Technical Manual Available from: https://www.promega.sg/-/media/files/resources/protocols/technical-manuals/101/adcc-reporter-bioassay-core-kit-protocol.pdf?rev=bec36264c0b6470591ded081377d207d&sc_lang=en (2023)
- Miller, A. S., Tejada, M. L., Gazzano-Santoro, H. Methods for measuring antibody-dependent cell-mediated cytotoxicity in vitro. Methods Mol Biol. 1134, 59-65 (2014).
- Lo Nigro, C., et al. NK-mediated antibody-dependent cell-mediated cytotoxicity in solid tumors: biological evidence and clinical perspectives. Ann Transl Med. 7 (5), 105 (2019).
- Gómez Román, V. R., Murray, J. C., Weiner, L. M., Ackerman, M. E., Nimmerjahn, F. . Antibody Fc. , 1-27 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten