Method Article
항체 의존성 세포 매개 세포 독성 리포터 생물학적 분석을 사용하여 암세포의 항체 의존성, 세포 매개 세포 독성 평가
* 이 저자들은 동등하게 기여했습니다
요약
여기에서는 ADCC bioassay kit를 사용하여 항체 의존성 세포 매개 세포 독성(ADCC) 분석을 위한 프로토콜을 제시합니다. 이 방법은 ADCC 메커니즘을 규명하고 암 면역 요법에서 항체의 치료 가능성을 평가하는 데 유용한 도구를 제공합니다.
초록
항체 의존성 세포 매개 세포독성(ADCC) 방법은 암 면역 요법에서 치료 항체의 효능을 평가하는 중요한 도구입니다. 암세포에서 ADCC 활성을 평가하는 것은 항체 기반 치료제의 개발 및 최적화에 필수적입니다. 여기에서는 갑상선 암세포를 effector cell로 사용하여 ADCC 반응의 정량적 평가를 위해 ADCC bioassay kit를 활용하는 방법론적 접근을 제안합니다. 이 프로토콜은 치료용 항체가 있는 상태에서 서로 다른 비율로 표적 암세포와 효과기 세포를 공동 배양하는 것을 포함합니다. 이 실험에 사용된 ADCC 생물 검정 키트에는 NFAT(Nuclear Factor of Activated T-cell) 반응 요소의 제어 하에 루시퍼라제 리포터 유전자를 발현하는 유전자 조작 효과기 세포가 포함되어 있습니다. 표적 세포의 표면 항원이 항체 및 효과기 세포와 결합하면 효과기 세포는 루시퍼라아제를 방출하여 발광 신호 측정을 통해 세포 독성을 정량화할 수 있습니다. 기존의 ADCC 분석법과 달리 이 방법은 표적 항원이 항체 및 효과기 세포와 결합하는 것을 입증하여 단기간에 신뢰할 수 있는 결과를 생성할 수 있습니다.
서문
항체 의존성, 세포 매개 세포 독성(ADCC)은 항체가 면역 매개 세포 사멸 효과를 발휘하는 중요한 메커니즘입니다 1,2,3. 면역 세포는 치료용 항체에 결합하여 활성화되며, 이 항체는 표적 세포의 표면 항원과 상호 작용하여 그랜자임, 퍼포린을 방출하여 표적 세포를 사멸시킵니다. 이러한 면역 세포에는 자연 살해(NK) 세포와 호중구 2,3,4,5,6,7이 포함됩니다. ADCC 분석은 치료용 항체 8,9의 효능을 평가하는 중요한 도구가 되었습니다.
기존 ADCC 분석에서는 말초혈액 단핵세포(PBMC) 또는 자연살해세포(natural killer cell)를 효과세포로 사용하여 표적의 세포 사멸률을 정량화하여 치료용 항체의 효능을 모니터링합니다. 당사의 방법은 NFAT(Nuclear Factor of Activated T-cell) 반응 요소의 제어 하에 루시페라제 리포터 유전자를 발현하는 유전자 조작 효과기 세포를 포함하는 ADCC 생물 검정 키트를 사용합니다. 그런 다음 표적 세포에 대한 표면 항원과 항체 및 효과기 세포의 결합을 정량화합니다. 이 방법은 인간 PBMC 세포를 필요로 하지 않고 단기간에 발생하는 ADCC 반응을 기반으로 합니다. 실험 단계에는 치료용 항체가 존재하는 상태에서 표적 세포와 효과기 세포의 공동 배양이 포함됩니다.
배양 과정에서 치료용 항체는 표적 세포 표면의 표적 항원에 결합하여 효과기 세포와 항체의 Fc 단편이 결합하게 됩니다. 이는 NFAT 반응 소자를 활성화하고 ADCC 반응의 정량적 평가를 위해 발광 신호를 방출합니다.
실험을 수행하기 전에 타겟 세포에서 타겟 항원의 발현을 유세포 분석 또는 웨스턴 블로팅으로 확인해야 합니다. 표적 세포를 배양하고 실험 전 24시간 동안 96웰 플레이트로 배양합니다. 계산된 효과기 대 표적 세포 비율을 달성하기 위해 서로 다른 농도의 치료용 항체를 효과기 세포의 서로 다른 세포 수와 함께 추가합니다.
이 방법의 주요 단계에는 (1) 표적 세포 및 효과기 세포의 준비, (2) 효과기 대 표적 세포 비율, (3) 다양한 농도의 항체 준비, (4) 다양한 배양 기간이 포함됩니다. 배양 후 발광 신호는 발광계를 사용하여 측정되어 ADCC 활성에 대한 정량적 판독값을 제공합니다. ADCC를 측정하는 다른 방법에 비해 이 방법은 작동이 비교적 간단하고 결과가 정확합니다.
ADCC 리포터 생물학적 분석은 ADCC 경로 활성화에서 표적 항원, 치료용 항체 및 면역 세포의 결합을 나타냅니다. 이 결합은 V158(고친화성) 변이체인 FcγRIIIa 수용체를 안정적으로 발현하는 effector 세포 공학 Jurkat 세포의 NFAT 경로를 통해 유전자 전사를 활성화합니다. NFAT 반응 요소는 effector cells10,11에서 luciferase의 발현을 매개합니다. ADCC의 작용 기전(MOA)에서 항체의 생물학적 활성은 NFAT 경로에서 생성된 루시퍼라제 신호를 통해 정량화됩니다. effector cells-FcγRIIIa receptor-expressing Jurket cells-의 Luciferase 신호는 발광 리더를 사용하여 정량화됩니다(그림 1). 분석법의 신호 대 잡음비가 높습니다.
프로토콜
1. 타겟 세포에서 EGFR 및 VEGFR 발현 검출
참고: 웨스턴 블로팅을 사용하여 표적 세포에서 표적 항원의 발현을 검출합니다.
- 시료 전처리
- 10% 소 태아 혈청(FBS), 1% L-글루타민 및 1% 항생제(페니실린-스트렙토마이신)가 보충된 RPMI(Roswell Park Memorial Institute) 배지를 사용하여 T75 플라스크에서 세포(BHT-101 및 SW-1736 인간 갑상선암 세포주)를 배양합니다.
- 세포가 80% 융합될 때 배양 배지를 제거하고 PBS로 세포를 세척하여 세포를 수확합니다. PBS 5mL를 첨가하고 세포 스크레이퍼를 사용하여 세포를 스크랩하여 배양 플라스크에서 세포를 제거합니다. 세포를 15mL 원뿔형 튜브로 옮깁니다.
- 셀 카운터가 있는 셀을 계산합니다.
- BHT-101 및 SW-1736 세포의 부분 표본 5 ×10 6 을 15mL 원뿔형 튜브로 만듭니다.
- 실온에서 135 × g 에서 5분 동안 셀을 스핀다운합니다. 상층액 PBS를 제거합니다.
- 프로테아제-포스파타제 억제제가 포함된 RIPA 용해 완충액 100μL를 얼음에서 5분 동안 첨가하여 세포 펠릿을 용해합니다. 용해액을 2mL 튜브로 옮기고 15,000× g 에서 15분 동안 원심분리한 다음 상층액을 새 2mL 튜브로 옮깁니다.
- bicinchoninic acid (BCA) 분석 키트를 사용하여 세포 용해물의 단백질 농도를 측정합니다.
- 각 샘플의 세포 용해물에서 단백질 70μg을 분취하고, 10% 2-메르캅토에탄올이 보충된 2x Laemmli 샘플 버퍼를 추가하고, 샘플의 변성을 위해 샘플을 100°C에서 5분 동안 끓입니다.
- 겔 전기영동 및 멤브레인 전달
- 증류수(4.7mL), 30% 아크릴아미드(2.7mL), 1.5M 트리스 버퍼, pH 8.8(2.5mL), 10% 도데실황산나트륨(0.1mL), 10% 과황산암모늄(100μL) 및 TEMED(10μL)를 사용하여 8% 도데실황산나트륨(SDS) 폴리아크릴아미드 겔을 준비합니다.
- 8% SDS-폴리아크릴아미드 겔에서 70μg의 변성 샘플을 80V에서 20분 동안, 120V에서 100분 동안 실행합니다.
- 겔의 단백질을 100V에서 90분 동안 폴리비닐리덴 플루오라이드(PVDF) 멤브레인으로 옮깁니다.
- 전사 후 TBS-T 완충액(20mM Tris pH 7.6, 140mM NaCl, 0.2% Tween-20)에 희석한 7% 탈지유로 멤브레인을 1시간 동안 막습니다.
- 항체 배양
- 마우스 anti-Epidermal Growth Factor Receptor(EGFR) 및 토끼 anti-Vascular Endothelial Growth Factor Receptor(VEGFR) 단클론 항체(7% 탈지유에 1:1,000으로 희석)로 막힌 멤브레인을 4°C에서 밤새 배양합니다.
- 배양 후 Tris-buffered saline-Tween(TBS-T) 완충액(20mM Tris pH 7.6, 140mM NaCl, 0.2% Tween-20)으로 멤브레인을 7분 동안 철저히 세척하고 4회 반복합니다.
- HRP 접합 2차 항체(7% 탈지유(TBS-T)에 1:4,000으로 희석)으로 멤브레인을 1시간 동안 배양합니다.
- 배양 후 TBS-T 완충액으로 멤브레인을 7분 동안 철저히 세척하고 4회 반복합니다.
- 단백질 검출
- HRP 기질 과산화물 용액 1mL와 HRP 기질 루미놀 시약 1mL(두 시약 모두 화학발광 기질 키트에서 제공)를 혼합하여 준비된 화학발광 HRP 기질에서 멤브레인을 2분 동안 배양합니다.
- 이미징 시스템을 사용하여 멤브레인을 시각화합니다.
2. 타겟 세포의 준비
- T-75 플라스크에서 10% FBS, 1% L-글루타민 및 1% 항생제(페니실린-스트렙토마이신)가 보충된 RPMI 배지에서 80%가 합류할 때까지 표적 T 세포, BHT-101 및 SW-1736 세포를 기하급수적으로 배양합니다.
- 매체를 제거한 후 PBS로 세포를 한 번 세척합니다. 1ml의 비효소 세포 해리 완충액으로 세포를 5분 동안 배양하여 부착 세포를 제거합니다. PBS를 첨가하여 비효소 세포 해리 완충액의 반응을 중지합니다. 135 × g 에서 5분 동안 세포를 스핀다운하고 PBS 5mL를 추가합니다.
참고: 여기에서는 멤브레인 표면 단백질의 무결성을 보존하기 위해 비효소 세포 해리 버퍼를 사용합니다. - 세포를 세고 바닥이 깨끗하고 평평한 96웰 백색 폴리스티렌 마이크로플레이트에 15,000개의 세포/웰에 파종합니다.
3. 치료용 항체의 다양한 농도의 준비
- 이 프로토콜을 따르기 위해 세툭시맙(키메라 항-EGFR 항체)을 사용하여 EGFR에 결합하고 베바시주맙(인간화 항 VEGF-A 항체)을 음성 대조군으로 사용합니다.
- 33.6mL의 RPMI-1640(키트에 제공됨)에 1.4mL의 저IgG 혈청을 첨가하여 ADCC Bioassay buffer를 준비합니다.
- 항체 희석을 위해 ADCC Bioassay buffer를 사용합니다. 각 항체 400 μL를 30 μg/mL, 3 μg/mL 및 0.3 μg/mL(3배 농도)의 세 가지 농도로 준비하여 10 μg/mL, 1 μg/mL 및 0.1 μg/mL의 최종 농도를 얻어 넓은 스펙트럼 범위를 확보하여 최적의 용량을 검출합니다.
참고: 최종 항체 농도는 96웰 플레이트의 각 웰에서 배양된 표적 세포 25μL, 효과기 세포 25μL, 항체 25μL를 기준으로 합니다.
4. effector cell의 제조
- 사용하기 전에 효과기 셀을 -80°C에서 보관하십시오.
- ADCC 생물학적 분석 버퍼를 사용하기 전에 37°C 수조에서 최소 30분 동안 예열하십시오.
- ADCC Bioassay Effector cell을 -80°C 냉장 보관에서 37°C 수조(약 2-3분)에 넣어 해동합니다. 바이알을 부드럽게 흔들어 육안으로 검사하되 해동 과정에서 바이알을 뒤집지 마십시오.
- 630ul의 Effector 세포를 3.6mL의 ADCC 분석 버퍼가 들어 있는 15mL 튜브로 옮깁니다. 튜브를 부드럽게 2번 뒤집어 잘 섞습니다.
5. 항체와 타겟 세포를 가진 effector 세포의 배양
- 하룻밤 배양 후 타겟 세포(웰당 15,000개의 암세포)에서 배지를 제거하고 ADCC Bioassay 완충액 25μL와 Cetuximab(EGFR 길항제) 및 Bevacizumab(VEGF 길항제) 25μL를 추가하여 각 웰에서 타겟 세포의 최종 농도 0.1μg/mL, 1μg/mL 또는 10μg/mL를 얻습니다.
- 웰당 25μL의 ADCC 생물 검정 완충액에 있는 75,000개의 effector 세포를 타겟 세포가 포함된 96웰 마이크로플레이트에 추가합니다. No mAb 로 표시된 웰은 항체 없음 대조군으로 작용합니다(그림 2).
- 블랭크 제어를 위해 AB(ADCC Bioassay buffer)로 표시된 웰에 ADCC Bioassay buffer를 추가합니다.
- 플레이트를 6시간 동안 배양합니다.
6. ADCC 활동의 정량적 판독
- Luciferase Assay Substrate(동결건조)에 Luciferase Assay 버퍼를 추가하여 측정 4시간 전에 Luciferase 분석 시약을 준비합니다.
- 표적 세포, 항체 및 효과기 세포를 6시간 배양한 후 각 웰에 75μL의 루시퍼라아제 분석 시약을 추가하고 30분 동안 배양합니다.
- 배양 기간이 끝나면 발광계를 사용하여 각 웰의 발광 신호를 측정하여 ADCC 활성에 대한 정량적 판독값을 제공합니다.
- 데이터 분석을 위해 다음과 같이 폴드 인덕션을 계산합니다.
폴드 유도 = RLU(항체 유도 - 배경) / RLU(항체 대조군 없음 - 배경).
여기서 RLU는 상대 발광 단위입니다. 유도 항체는 웰 B3 내지 B8 및 C3 내지 C8; 항체 대조군 없음 = B2 및 C2; 배경 = A2에서 A5까지의 평균 RLU(그림 2).
결과
타겟 BHT-101 및 SW-1736 세포에서 EGFR 및 VEGFR의 발현은 웨스턴 블로팅을 사용하여 검출되었습니다. EGFR 발현은 BHT-101 및 SW-1736 세포 모두에서 검출되었지만 VEGFR 발현은 검출되지 않았습니다(그림 3).
ADCC bioassay kit를 사용하여 EGFR 양성 세포주인 BHT-101 및 SW-1736을 타겟 세포로 사용하여 항 EGFR 항체인 cetuximab의 ADCC 반응을 검출했습니다. VEGF 비활성화제인 베바시주맙(Bevacizumab)이 음성 대조 항체로 사용되었습니다. 서로 다른 농도의 항체 및 효과기 세포를 표적 세포와 함께 배양했습니다. 발광 신호는 플레이트 리더를 사용하여 감지되었습니다(그림 2). 세툭시맙(항-EGFR 항체) 그룹에서 ADCC 활성 유도의 더 높은 폴드가 발견되었지만, 두 세포주 모두에 대해 베바시주맙(VEGF 길항제)에서 ADCC 활성은 관찰되지 않았다. 이는 두 세포주 모두에 대해 EGFR 세포외막 항원을 표적으로 하는 ADCC 효과를 입증했습니다. 이 방법을 사용하여 ADCC 반응은 두 개의 역형성 갑상선암 세포주(BHT101 및 SW1736)에서 Cetuximab이 존재할 때 검증되었습니다(그림 4).
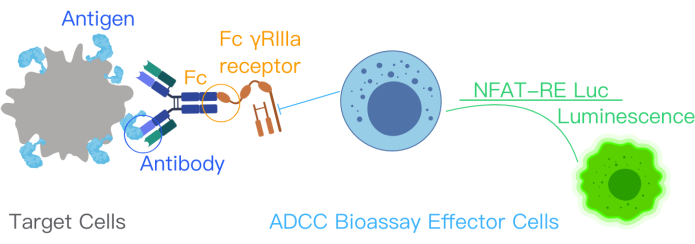
그림 1: ADCC 생물 검정 키트를 사용한 ADCC 반응을 보여주는 개략도. 치료용 항체의 항원 결합 부위는 표적 세포의 표면 항원에 결합합니다. 이 결합은 항체의 Fc 부분이 NFAT-RE luc로 유전적으로 조작된 이펙터 세포의 FcƳRIIIa 수용체에 결합하여 이펙터 세포에서 발광 신호를 생성하도록 합니다. 이 그림은 ADCC Reporter Bioassay Core kit 설명서에서 permission12에 따라 수정되었습니다. 약어: ADCC = 항체 의존성 세포 매개 세포 독성; Fc = 단편 결정화 영역; NFAT = 활성화된 T 세포의 핵 인자; RE = 응답 요소; luc = 루시퍼라아제. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: ADCC 공동 배양 시스템의 96웰 플레이트 설계에 대한 발광 판독 및 실험 다이어그램. 발광 신호는 발광 판독기에 의해 판독됩니다. 행 A: 1st-9 th wells에는 ADCC Bioassay Buffer가 포함되어 있습니다. 행 B:3rd-8 웰 에는 BHT101의 ADCC 반응 시스템(표적 세포 + 항체 + 효과기 세포)이 포함되어 있습니다. 2번째 웰은 항체가 없습니다. 9번째 웰에는 ADCC Bioassay 버퍼만 포함되어 있습니다. C 행:3rd-8 웰 에는 SW-1736의 ADCC 반응 시스템(표적 세포 + 항체 + 효과기 세포)이 포함되어 있습니다. 2번째 웰은 항체가 없습니다. 9번째 웰에는 ADCC Bioassay 버퍼만 포함되어 있습니다. 행 D: 1st-9 번째 우물에는 분석 버퍼가 포함되어 있습니다. 약어: ADCC = 항체 의존성 세포 매개 세포 독성; AB = ADCC 생물검정 완충액; VEGFR = 혈관 상피 성장 인자 수용체; EGFR = 표피 성장 인자 수용체; mAb = 단클론 항체. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
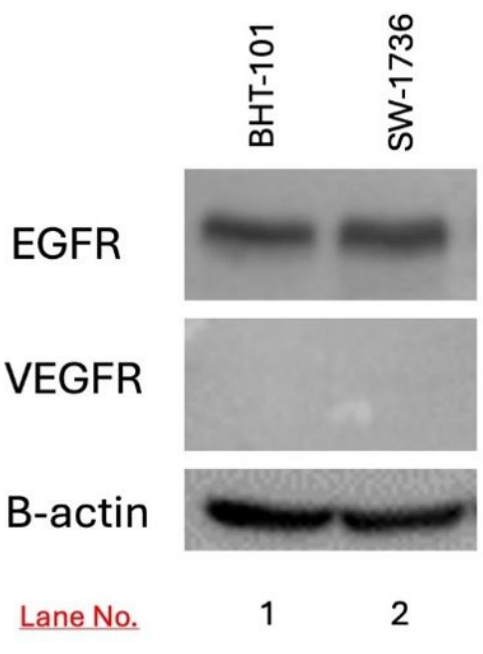
그림 3: 웨스턴 블로팅을 사용한 BHT-101 및 SW-1736 갑상선 암종에서 EGFR 및 VEGFR 발현 검출. VEGFR이 아닌 EGFR의 발현은 두 세포주 모두에서 검출되었습니다. B-actin은 적재 제어로 사용되었습니다. 약어: EGFR = 표피 성장 인자 수용체; VEGFR = 혈관 표피 성장 인자. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
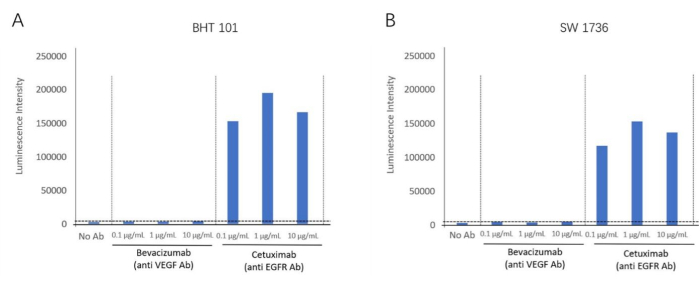
그림 4: ADCC 활성의 접힘 유도. (A) 갑상선암 세포주 BHT-101은 항-EGFR 항체 세툭시맙(Cetuximab)이 존재할 때 ADCC 효과를 나타냅니다. (B) 갑상선암 세포주 SW-1736은 항-EGFR 항체 세툭시맙(Cetuximab)이 존재할 때 ADCC 효과를 나타낸다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
여기에서는 치료용 항체의 ADCC 반응을 평가하기 위한 ADCC Bioassay 방법을 제시했습니다. 이 방법은 간단하며 측정을 위해 간단한 "추가-혼합-읽기" 형식을 사용합니다.
실험을 수행하기 전에 타겟 세포에서 타겟 항원의 발현을 유세포 분석 또는 웨스턴 블로팅으로 확인해야 합니다. 유세포 분석은 표면 항원을 검출하는 더 나은 도구가 될 것입니다. 그러나 유세포 분석을 사용하면 세포에 스트레스를 주어 세포사멸을 유발하고 세포의 생존력에 영향을 미치므로 전반적인 분석에 영향을 미칠 수 있습니다. 또한 웨스턴 블로팅보다 비용이 많이 듭니다. 이 실험에서는 표적 항원이 세포 표면 항원으로 알려져 있기 때문에 더 빠르고 비용 효율적인 방법으로 웨스턴 블로팅을 사용했습니다.
FcγRIIIa 수용체, V158(높은 친화력) 변이체, 반딧불이 루시퍼라아제의 발현을 유도하는 NFAT 반응 요소를 안정적으로 발현하는 공학적 Jurkat 세포를 이펙터 세포로 사용했습니다. NFAT 경로의 활성화는 루시퍼라아제의 생성을 초래하며, 그 활성은 발광 판독의 형태로 정량화됩니다. 이 신호는 ADCC의 활동도 나타냅니다.
먼저, 표적 세포(T)를 가습된CO2 인큐베이터에서 37°C에서 6시간 동안 96-웰 플레이트에 다양한 양의 항체가 존재하는 하에서 효과기 세포(E)와 함께 배양합니다. 5:1의 이펙터:목표 비율은 신호를 최적화하는 데 사용됩니다. 예를 들어, 75,000개의 effector cell이 15,000개의 타겟 cell에 추가되었습니다. 배양 종료 시 Bio-Glo luciferase 분석 시약을 각 웰에 첨가하고 30분 동안 배양한 후 발광 플레이트 리더를 사용하여 발광(RLU, 상대 루시페라제 단위)을 측정합니다.
이 프로토콜에서 핵심적으로 중요한 단계는 다음과 같습니다: (1) effector cell의 취급. 세포 바이알은 해동 과정에서 뒤집어서는 안 되며, 부드럽게 흔들리고, 원치 않는 세포 사멸을 방지하거나 생물학적 검출 성능에 영향을 미치지 않도록 해동 직후에 사용해야 합니다. (2). 발광은 리더 바닥에서 포착되기 때문에 발광 측정을 위해 바닥이 투명하고 평평한 백색 폴리스티렌 96웰 마이크로플레이트를 사용하는 것이 중요합니다.
본 연구에서는 표적 세포의 양과 항체 농도에 따라 항-EGFR 항체인 세툭시맙(cetuximab)의 ADCC 반응이 강하거나 약해지는 것을 관찰하였다. 약한 ADCC 반응의 보정을 처리하는 몇 가지 이유: (1) ADCC 리포터 생물학적 분석의 판독값은 이 연구의 ADCC 반응 시스템에서 웰당 75,000개의 일정한 수의 세포를 가진 효과기 세포(E)에서 가져옵니다. 따라서 타겟 셀(T)의 품질을 최적화하는 것은 개선할 수 있는 한 가지 측면입니다. 이 연구에서 E:T 비율은 5:1이었으며 최대 20:1까지 조정할 수 있습니다. (2) 항체 농도도 ADCC 반응에 영향을 미치는 중요한 요인 중 하나입니다. 최적의 농도 범위를 탐색하기 위해 항체의 연속 희석을 통해 조정할 수 있으므로 ADCC 보고서에서 최대 반응을 달성할 수 있습니다. (3) 항체, 표적 세포, 효과기 세포의 배양 시간도 실험 결과에 결정적인 역할을 합니다. 이 연구에서는 최적의 ADCC 반응을 달성하기 위해 최대 24시간까지 연장할 수 있는 6시간 동안 배양했습니다. (4) 또한 ADCC 분석을 위한 완충 용액(낮은 IgG)의 농도도 조사해야 합니다. ADCC 반응을 위한 최적의 혈청 농도는 1%에서 10% 범위 내에서 달성될 수 있습니다.
이 실험 방법은 빠르고 간단하여 간단한 "추가-혼합-읽기" 프로토콜을 통해 하루 이내에 완료할 수 있습니다. 결과는 안정적이며 배치 테스트에 적합합니다. 그러나 이 생물학적 분석 키트는 PBMC 또는 NK 세포를 effector cell로 사용하는 기존 ADCC 방법과 같이 세포 사멸을 감지하지 못합니다12,13. 대신, Jurkat 세포를 이펙터 세포로 발현된 FcγRIIIa 수용체를 사용하는데, 이 세포는 유전적으로 변형되었기 때문에 비용이 더 많이 듭니다. 전통적인 ADCC 실험13,14과 비교하여, 건강한 개인의 헌혈 필요성을 없애고 면역 세포를 추출하는 복잡한 과정을 피하여 결과에 영향을 미칠 수 있는 개인적 차이를 완화합니다. 감지된 발광 신호는 표적 세포의 실제 사멸이 아니라 효과기 세포가 표적 세포에 결합하는 과정에서 발생합니다. 따라서 표준 ADCC 검출 방법과 비교하여 불일치가 있을 수 있습니다. 또한, 트립신보다 비싼 세포 해리 완충액(cell dissociation buffer)은 막의 무결성을 유지하기 위해 부착 세포를 분리하는 데 사용됩니다.
ADCC 리포터 유전자 분석은 치료용 항체 약물의 대량 검출을 위한 효능 분석 방법으로 활용되어 정확도와 안정성이 우수합니다. 또한 치료 분자의 특성화 및 프로세스 개발을 위한 중요한 분석 방법으로 기능할 수 있습니다15.
요약하면, ADCC는 중요한 면역 기전이며, ADCC의 정량적 검출은 면역 요법 분야에서 매우 중요합니다. 이 실험 방법은 ADCC15의 정량적 측정을 위한 효과적인 수단을 제공합니다.
공개
모든 저자는 이해 상충이 없음을 선언합니다.
감사의 말
이 연구를 지원해 주신 Zeng 교수님(IMCB, A*STAR)님께 감사드립니다. 본 연구는 중국국립자연과학재단(NSFC) 청년재단(82202231)과 중국 저장성 의료보건과학기술프로젝트(2021KY110,2024KY824)의 지원을 받았다.
자료
| Name | Company | Catalog Number | Comments |
| 0.5% Trypsin-EDTA | Gibco | 15400-054 | Dilute 10x in PBS to make 0.05% Trypsin |
| 1x Tris Buffer Saline (TBS) | 1st BASE | BUF-3030-1X1L | For membrane washing in western blotting |
| 1.5 M Tris Buffer, pH 8.8 | 1st BASE | BUF-1419-1L-pH8.8 | For SDS gel preparation |
| 2-Mercaptoethanol | Sigma Aldrich | M7522-100ML | For sample preparation of western blotting |
| 30% Acrylamide/Bis solution | Bio-Rad | #1610158 | For SDS gel preparation |
| 4x Laemmli Buffer | Bio-Rad | #1610747 | For sample preparation of western blotting |
| 96-well white polystyrene microplate with clear flat bottom | Corning Incorporated | 3610 | For ADCC assay |
| ADCC Bioassay Effector cells (0.65 mL) | Promega | G7011 | Includes in ADCC reporter bioassay core kit (Promega G7010), 1 x 1 vial |
| ADCC reporter bioassay core kit | Promega | G7010 | Mentioned as ADCC bioassay kit for ADCC assay in this experiment |
| Ammonium Persulfate | Sigma Aldrich | A3678-25G | For SDS gel preparation |
| Bevacizumab (Humanized Anti VEGF-antibody) | MVASI | - | Use as negative control antibody in ADCC asssay |
| BHT-101 | Leibniz Institute DSMZ | ACC279 | Human anaplastic papillary thyroid cancer cell line |
| Bio-Glo Luciferase Assay Buffer | Promega | G7941 | Includes in ADCC reporter bioassay core kit (Promega G7010), 1 x 10 mL |
| Bio-Glo Luciferase Assay Substrate (Lyophilized) | Promega | G7941 | Includes in ADCC reporter bioassay core kit (Promega G7010), 1 x 1 vial |
| Cell scraper | GenFollower | GD00235 | To remove cell from culture flask |
| Cetuximab (Chimeric anti-EGFR antibody) | ERBITUX | - | Use as therapeutic antibody in ADCC assay |
| Chemiluminescent HRP substrate | Merck Millipore | WBKLS0500 | For protein detection in western blotting |
| Distilled water | Gibco | 15230-162 | For SDS gel preparation |
| Fetal Bovine Serum (FBS) | Gibco | 10270-106 | Culture media supplement |
| iBright CL1500 imaging system | Thermo Scientific | 2462621100038 | For protein detection in western blotting |
| L-glutamine, 200 mM | Gibco | 25030-081 | Culture media supplement |
| Low IgG Serum | Promega | G7110 | Includes in ADCC reporter bioassay core kit (Promega G7010), 1 x 4 mL |
| Megafuge 8R | Thermo Scientific | 42876589 | Centrifuge |
| Mouse anti-EGFR monoclonal antibodies | BD Biosciences | 610016 | Primary antibody in western blotting |
| Mouse anti-VEGFR monoclonal antibodies | BD Biosciences | 571194 | Primary antibody in western blotting |
| non-enzymatic cell dissociation buffer | Sigma Aldrich | C5789-100ML | For cell harvesting from T75 flask |
| Penicillin-Streptomycin | PAN Biotech | P06-07100 | Antibacterial for culture media |
| Phosphate Buffered Saline (PBS), pH 7.2, Sterile filtered | 1st BASE | CUS-2048-1x1L | Use as washing solution for cells |
| Pierce BCA assay kit | Thermo Scientific | 23225 | To measure protein concentration |
| Protease and phosphatase inhibitor | Thermo Scientific | A32959 | For protein digestion in sample preparation for western blotting |
| PVDF membrane (Immobilin-P) | Merck Millipore | IPVH00010 | For protein transfer in western blotting |
| Rabbit anti-mouse IgG, Fcγ HRP-conjugated secondary antibody | Jackson ImmunoResearch | 315-035-046 | Secondary antibody in western blotting |
| Roswell Park Memorial Institute (RPMI) medium | Capricorn Scientific | RPMI-XA | Cell culture media |
| RPMI-1640 | Promega | G7080 | Includes in ADCC reporter bioassay core kit (Promega G7010), 1 x 36 mL |
| Skim milk powder | Merck Millipore | 70166-500G | For membrane blocking in western blotting |
| Sodium Dodecyl Sulfate | 1st BASE | BIO-2050-500g | For SDS gel preparation |
| SW-1736 | Cytion | 300453 | Human thyroid squamous cell cancer cell line |
| T75 culture flasks | SPL Lifesciences | 70075 | Cell culture flask |
| Tecan Multimode Reader model Spark 10M | Tecan | 1607000294 | for luminicence quantification |
| TEMED | Bio-Rad | #1610801 | For SDS gel preparation |
| Tween-20 | Promega | H5151 | For membrane washing in western blotting |
| Vi-cell XR cell viability analyzer | Beckman Coulter | AL15072 | Cell counter |
참고문헌
- Zahavi, D., AlDeghaither, D., O'Connell, Enhancing antibody-dependent cell-mediated cytotoxicity: a strategy for improving antibody-based immunotherapy. Antib Ther. 1 (1), 7-12 (2018).
- Fenis, A., Demaria, O., Gauthier, L., Vivier, E. New immune cell engagers for cancer immunotherapy. Nat Rev Immunol. 24 (7), 471-486 (2024).
- Pinto, S., Pahl, J., Schottelius, A., Carter, P. J. Reimagining antibody-dependent cellular cytotoxicity in cancer: the potential of natural killer cell engagers. Trends Immunol. 43 (11), 932-946 (2022).
- Ochoa, M. C., et al. Antibody-dependent cell cytotoxicity: immunotherapy strategies enhancing effector NK cells. Immunol Cell Biol. 95 (4), 347-355 (2017).
- Wang, W., Erbe, A. K., Hank, J. A., Morris, Z. S. NK cell-mediated antibody-dependent cellular cytotoxicity in cancer immunotherapy. Front Immunol. 6, 368 (2015).
- Chung, S., et al. Characterization of in vitro antibody-dependent cell-mediated cytotoxicity activity of therapeutic antibodies - impact of effector cells. J Immunol Methods. 407, 63-75 (2014).
- Shimasaki, N., Jain, A., Campana, D. NK cells for cancer immunotherapy. Nat Rev Drug Discov. 19 (3), 200-218 (2020).
- Cheng, Z. J., et al. Development of a robust reporter-based ADCC assay with frozen, thaw-and-use cells to measure Fc effector function of therapeutic antibodies. J Immunol Methods. 414, 69-81 (2014).
- Parekh, B. S., et al. Development and validation of an antibody-dependent cell-mediated cytotoxicity-reporter gene assay. MAbs. 4 (3), 310-318 (2012).
- Hogarth, P. M., Pietersz, G. A. Fc receptor-targeted therapies for the treatment of inflammation, cancer and beyond. Nat Rev Drug Discov. 11 (4), 311-331 (2012).
- Chung, S., et al. Quantitative evaluation of fucose reducing effects in a humanized antibody on Fcgamma receptor binding and antibody-dependent cell-mediated cytotoxicity activities. MAbs. 4 (3), 326-340 (2012).
- . ADCC Reporter Bioassay Core Kit Technical Manual Available from: https://www.promega.sg/-/media/files/resources/protocols/technical-manuals/101/adcc-reporter-bioassay-core-kit-protocol.pdf?rev=bec36264c0b6470591ded081377d207d&sc_lang=en (2023)
- Miller, A. S., Tejada, M. L., Gazzano-Santoro, H. Methods for measuring antibody-dependent cell-mediated cytotoxicity in vitro. Methods Mol Biol. 1134, 59-65 (2014).
- Lo Nigro, C., et al. NK-mediated antibody-dependent cell-mediated cytotoxicity in solid tumors: biological evidence and clinical perspectives. Ann Transl Med. 7 (5), 105 (2019).
- Gómez Román, V. R., Murray, J. C., Weiner, L. M., Ackerman, M. E., Nimmerjahn, F. . Antibody Fc. , 1-27 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유