Method Article
Avaliação da citotoxicidade dependente de anticorpos e mediada por células em células cancerígenas usando bioensaio Reporter de citotoxicidade mediada por células dependente de anticorpos
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Aqui, apresentamos um protocolo para um ensaio de citotoxicidade mediada por células (ADCC) dependente de anticorpos usando um kit de bioensaio ADCC. Este método oferece uma ferramenta valiosa para elucidar o mecanismo ADCC e avaliar o potencial terapêutico dos anticorpos na imunoterapia contra o câncer.
Resumo
O método de citotoxicidade dependente de anticorpos e mediada por células (ADCC) representa uma ferramenta importante para avaliar a eficácia de anticorpos terapêuticos na imunoterapia contra o câncer. Avaliar a atividade do ADCC em células cancerígenas é essencial para o desenvolvimento e otimização de tratamentos baseados em anticorpos. Aqui, propomos uma abordagem metodológica de utilização de um kit de bioensaio ADCC para avaliação quantitativa da reação ADCC usando células de câncer de tireoide como células efetoras. O protocolo envolve a co-cultura de células efetoras com células-alvo cancerígenas em diferentes proporções na presença de um anticorpo terapêutico. O kit de bioensaio ADCC usado neste experimento inclui as células efetoras geneticamente modificadas que expressam um gene repórter de luciferase sob o controle de elementos de resposta do Fator Nuclear de Células T Ativadas (NFAT). Após a ligação do antígeno de superfície nas células-alvo com os anticorpos e células efetoras, as células efetoras liberam luciferase, permitindo a quantificação da citotoxicidade por meio da medição do sinal de luminescência. Em contraste com os ensaios convencionais de ADCC, este método provou a ligação do antígeno alvo com anticorpos e células efetoras, que podem produzir resultados confiáveis em um curto período.
Introdução
A citotoxicidade mediada por células dependente de anticorpos (ADCC) é um mecanismo importante pelo qual os anticorpos exercem efeitos de morte celular mediados imunologicamente 1,2,3. As células imunes são ativadas pela ligação ao anticorpo terapêutico, que interage com os antígenos de superfície das células-alvo para liberar granzimas, a perforina, levando à morte da célula-alvo. Essas células imunes incluem células natural killer (NK) e neutrófilos 2,3,4,5,6,7. O ensaio ADCC tornou-se uma importante ferramenta para avaliar a eficácia do anticorpo terapêutico 8,9.
No ensaio ADCC convencional, células mononucleares do sangue periférico (PBMCs) ou células assassinas naturais são usadas como células efetoras para monitorar a eficácia de um anticorpo terapêutico, quantificando a taxa de morte celular do alvo. Nosso método usa um kit de bioensaio ADCC que inclui células efetoras geneticamente modificadas que expressam um gene repórter de luciferase sob o controle de elementos de resposta do Fator Nuclear de Células T Ativadas (NFAT). Em seguida, quantificamos a ligação do antígeno de superfície nas células-alvo com o anticorpo e as células efetoras. Este método é baseado na reação ADCC que ocorre em um curto período sem a necessidade de células PBMC humanas. As etapas experimentais incluem a co-cultura de células efetoras com células-alvo na presença de anticorpos terapêuticos.
Durante a incubação, o anticorpo terapêutico se liga ao antígeno alvo na superfície das células-alvo, o que leva à ligação das células efetoras e do fragmento Fc de um anticorpo. Isso ativa o elemento de resposta NFAT e libera sinais de luminescência para a avaliação quantitativa da reação ADCC.
Antes de realizar o experimento, a expressão do antígeno-alvo nas células-alvo deve ser confirmada por citometria de fluxo ou western blotting. As células-alvo são cultivadas e passadas para placas de 96 poços por 24 horas antes do experimento. Diferentes concentrações de um anticorpo terapêutico são adicionadas junto com diferentes contagens de células efetoras para atingir a proporção calculada de células efetoras para células-alvo.
As principais etapas deste método incluem (1) preparação de células-alvo e células efetoras, (2) proporções de células efetoras para células-alvo, (3) preparação de diferentes concentrações do anticorpo e (4) duração variável da incubação. Após a incubação, os sinais de luminescência são medidos usando um luminômetro, fornecendo uma leitura quantitativa da atividade do ADCC. Comparado a outros métodos de medição do ADCC, este método é relativamente simples de operar e os resultados são precisos.
O bioensaio repórter do ADCC indica a ligação do antígeno alvo, anticorpo terapêutico e células imunes na ativação da via ADCC. Essa ligação ativa a transcrição gênica através da via NFAT nas células efetoras projetadas pelas células Jurkat com o receptor FcγRIIIa de expressão estável, a variante V158 (alta afinidade). O elemento de resposta NFAT medeia a expressão da luciferase nas células efetoras10,11. A atividade biológica do anticorpo no mecanismo de ação (MOA) do ADCC é quantificada através do sinal de luciferase produzido a partir da via NFAT. O sinal da luciferase nas células efetoras - células Jurket que expressam o receptor FcγRIIIa - é quantificado usando um leitor de luminescência (Figura 1). A relação sinal-ruído do ensaio é alta.
Protocolo
1. Detecção da expressão de EGFR e VEGFR em células-alvo
NOTA: Use western blotting para detectar a expressão do antígeno alvo nas células-alvo.
- Preparação da amostra
- Cultive as células (linhagens celulares de câncer de tireoide humano BHT-101 e SW-1736) em frascos T75 usando meio do Roswell Park Memorial Institute (RPMI) suplementado com 10% de soro fetal bovino (FBS), 1% de L-glutamina e 1% de antibióticos (penicilina-estreptomicina).
- Colha as células quando estiverem 80% confluentes, removendo os meios de cultura e lavando as células com PBS. Adicione 5 mL de PBS e descarte as células usando um raspador de células para remover as células do frasco de cultura. Transfira as células para um tubo cônico de 15 mL.
- Conte as células com um contador de células.
- Alíquota 5 × 106 de células BHT-101 e SW-1736 em tubos cônicos de 15 mL.
- Gire as células a 135 × g por 5 min em temperatura ambiente. Remova o sobrenadante PBS.
- Lisar o pellet celular adicionando 100 μL de tampão de lise RIPA contendo inibidores de protease-fosfatase por 5 min em gelo. Transfira o lisado para um tubo de 2 mL, centrifugue a 15.000 × g por 15 min e transfira o sobrenadante para um novo tubo de 2 mL.
- Meça a concentração de proteína do lisado celular usando um kit de ensaio de ácido bicinconínico (BCA).
- Alíquota de 70 μg de proteína do lisado celular de cada amostra, adicione 2x tampão de amostra Laemmli suplementado com 10% de 2-mercaptoetanol e ferva as amostras a 100 ° C por 5 min para desnaturação das amostras.
- Eletroforese em gel e transferência de membrana
- Prepare o gel de poliacrilamida dodecil sulfato de sódio (SDS) a 8% usando água destilada (4.7 mL), acrilamida a 30% (2.7 mL), tampão Tris 1.5 M, pH 8.8 (2.5 mL), dodecil sulfato de sódio a 10% (0.1 mL), persulfato de amônio a 10% (100 μL) e TEMED (10 μL).
- Execute 70 μg das amostras desnaturadas no gel de poliacrilamida SDS a 8% a 80 V por 20 min e a 120 V por 100 min.
- Transfira a proteína do gel para uma membrana de fluoreto de polivinilideno (PVDF) a 100 V por 90 min.
- Após a transferência, bloqueie a membrana com leite desnatado a 7% diluído em tampão TBS-T (20 mM Tris pH 7,6, 140 mM NaCl, 0,2% Tween-20) por 1 h.
- Incubação de anticorpos
- Incube a membrana bloqueada com anticorpos monoclonais anti-receptor do fator de crescimento epidérmico de camundongo (EGFR) e anti-receptor do fator de crescimento endotelial vascular (VEGFR) de coelho (diluídos a 1:1.000 em leite desnatado a 7%) durante a noite a 4 ° C.
- Após a incubação, lave bem a membrana com tampão Tween salino tamponada com Tris (TBS-T) (20 mM Tris pH 7,6, 140 mM NaCl, 0,2% Tween-20) por 7 min e repita 4x.
- Incube a membrana com o anticorpo secundário conjugado com HRP (diluído a 1:4.000 em leite desnatado a 7% (TBS-T)) por 1 h.
- Após a incubação, lave bem a membrana com tampão TBS-T por 7 min e repita 4 vezes.
- Detecção de proteínas
- Incube a membrana em substrato de HRP quimioluminescente preparado misturando 1 mL de solução de peróxido de substrato HRP com 1 mL de reagente de luminol de substrato HRP (ambos os reagentes são do kit de substrato quimioluminescente) por 2 min.
- Visualize a membrana usando um sistema de imagem.
2. Preparação das células-alvo
- Cultive as células T alvo, células BHT-101 e SW-1736 exponencialmente até 80% confluentes em meio RPMI suplementado com 10% de FBS, 1% de L-glutamina e 1% de antibióticos (penicilina-estreptomicina) em frascos T-75.
- Depois de remover a mídia, lave as células uma vez com PBS. Incube as células com 1 ml de tampão de dissociação celular não enzimático por 5 min para desalojar as células aderentes. Adicione PBS para interromper a reação do tampão de dissociação celular não enzimático. Gire as células a 135 × g por 5 min e adicione 5 mL de PBS.
NOTA: Aqui, usamos um tampão de dissociação celular não enzimático para preservar a integridade da proteína da superfície da membrana. - Conte as células e semeie-as em 15.000 células/poços em microplacas de poliestireno branco de 96 poços com fundo plano e transparente.
3. Preparação de concentrações variáveis do anticorpo terapêutico
- Para seguir este protocolo, use Cetuximab (anticorpo quimérico anti-EGFR) para ligar o EGFR e use Bevacizumab (anticorpo anti VEGF-A humanizado) como controle negativo.
- Prepare o tampão de bioensaio ADCC adicionando 1,4 mL de soro de baixa IgG em 33,6 mL de RPMI-1640 (fornecido no kit).
- Use o tampão de bioensaio ADCC para a diluição de anticorpos. Prepare 400 μL de cada anticorpo em três concentrações diferentes: 30 μg/mL, 3 μg/mL e 0,3 μg/mL (concentração 3x) para obter a concentração final de 10 μg/mL, 1 μg/mL e 0,1 μg/mL para cobertura de amplo espectro para detectar a dose ideal.
NOTA: As concentrações finais de anticorpos são baseadas em 25 μL de células-alvo cultivadas, 25 μL de células efetoras e 25 μL de anticorpo em cada poço de uma placa de 96 poços.
4. Preparação de células efetoras
- Conservar as células efetoras a -80 °C antes de utilizar.
- Pré-aqueça o tampão de bioensaio ADCC em banho-maria a 37 °C por pelo menos 30 minutos antes de usar.
- Descongele as células efetoras de bioensaio ADCC de armazenamento a frio a -80 °C, colocando-as em banho-maria a 37 °C (aproximadamente 2-3 min). Balance suavemente e inspecione visualmente o frasco, mas não o inverta durante o processo de descongelamento.
- Transfira 630ul de células efetoras para um tubo de 15 mL contendo 3,6 mL de tampão de ensaio ADCC. Misture bem invertendo suavemente o tubo 2x.
5. Incubação de células efetoras com anticorpos e células-alvo
- Após a incubação durante a noite, remova o meio das células-alvo (15.000 células cancerígenas por poço) e adicione 25 μL do tampão de bioensaio ADCC e 25 μL de cetuximabe (antagonista do EGFR) e bevacizumabe (antagonista do VEGF) para obter a concentração final de 0,1 μg/mL, 1 μg/mL ou 10 μg/mL das células-alvo em cada poço de acordo com a Figura 2.
- Adicione 75.000 células efetoras em 25 μL de tampão de bioensaio ADCC por poço na microplaca de 96 poços contendo células-alvo. Os poços rotulados como Sem mAb atuam como nenhum controle de anticorpos (Figura 2).
- Adicione o tampão de bioensaio ADCC aos poços rotulados como AB (tampão de bioensaio ADCC) para controle em branco.
- Incubar a placa durante 6 h.
6. Leitura quantitativa da atividade do ADCC
- Prepare o reagente do ensaio de luciferase 4 h antes da medição, adicionando tampão de ensaio de luciferase ao substrato de ensaio de luciferase (liofilizado).
- Após 6 h de incubação das células-alvo, anticorpos e células efetoras, adicione 75 μL do reagente do ensaio de luciferase a cada poço e incube por 30 min.
- Após o período de incubação, meça o sinal de luminescência em cada poço usando um luminômetro, fornecendo uma leitura quantitativa da atividade do ADCC.
- Para análise de dados, calcule a indução de dobra da seguinte maneira:
Indução de dobra = RLU (induzido por anticorpos - fundo) / RLU (sem controle de anticorpos - fundo).
Onde RLU são unidades de luminescência relativa; Os anticorpos induzidos são os poços B3 a B8 e C3 a C8; Sem controle de anticorpos = B2 e C2; Background = RLU médio do poço A2 a A5 (Figura 2).
Resultados
A expressão de EGFR e VEGFR nas células-alvo BHT-101 e SW-1736 foi detectada usando western blotting. A expressão de EGFR foi detectada em células BHT-101 e SW-1736, mas não a expressão de VEGFR (Figura 3).
Usando o kit de bioensaio ADCC, detectamos a reação ADCC do anticorpo anti-EGFR, cetuximabe, usando linhagens celulares positivas para EGFR, BHT-101 e SW-1736, como células-alvo. O bevacizumabe, um inativador do VEGF, foi usado como anticorpo de controle negativo. Diferentes concentrações de anticorpos e células efetoras foram incubadas com as células-alvo. O sinal de luminescência foi detectado por meio de um leitor de placas (Figura 2). Uma maior dobra de indução de atividade de ADCC foi encontrada em grupos de cetuximabe (anticorpo anti-EGFR), mas nenhuma atividade de ADCC foi observada em bevacizumabe (antagonista de VEGF) para ambas as linhagens celulares. Isso demonstrou o efeito ADCC direcionado aos antígenos da membrana extracelular do EGFR para ambas as linhagens celulares. Usando este método, a reação ADCC foi validada na presença de Cetuximabe em duas linhagens celulares anaplásicas de câncer de tireoide (BHT101 e SW1736) (Figura 4).
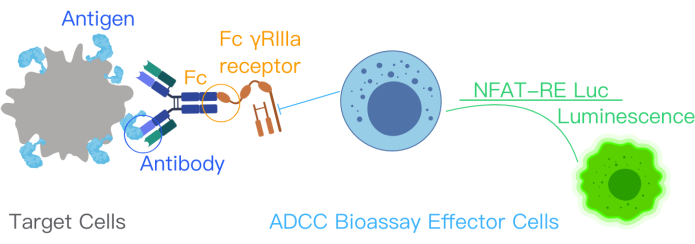
Figura 1: Um diagrama esquemático mostrando a reação do ADCC com o kit de bioensaio do ADCC. Os locais de ligação ao antígeno no anticorpo terapêutico se ligam aos antígenos de superfície nas células-alvo. Essa ligação leva à ligação da porção Fc do anticorpo aos receptores FcƳRIIIa das células efetoras, que foram geneticamente modificadas com NFAT-RE luc, produzindo um sinal de luminescência nas células efetoras. Esta figura foi modificada do manual do kit ADCC Reporter Bioassay Core com permissão12. Abreviaturas: ADCC = Citotoxicidade mediada por células dependente de anticorpos; Fc = Região cristalizável do fragmento; NFAT = Fator Nuclear de Célula T Ativada; RE = Elemento de resposta; luc = Luciferase. Clique aqui para ver uma versão maior desta figura.

Figura 2: Leitura de luminescência e diagrama experimental do projeto de placa de 96 poços do sistema de co-cultura ADCC. Os sinais de luminescência são lidos por um leitor de luminescência. Linha A: 1st-9 th poços contêm ADCC Bioassay Buffer. Linha B: 3rd-8 th poços contêm o sistema de reação ADCC do BHT101 (células-alvo + anticorpo + células efetoras). O2º poço está sem anticorpos. O9º poço contém apenas tampão de bioensaio ADCC. Linha C: 3poços rd-8 contêm o sistema de reação ADCC do SW-1736 (célula-alvo + anticorpo + células efetoras). O2º poço está sem anticorpos. O9º poço contém apenas tampão de bioensaio ADCC. Linha D: 1st-9 th poços contêm tampão de ensaio. Abreviaturas: ADCC = Citotoxicidade mediada por células dependente de anticorpos; AB = tampão de bioensaio ADCC; VEGFR = Receptor do Fator de Crescimento Epitelial Vascular; EGFR = Receptor do Fator de Crescimento Epidérmico; mAb = anticorpo monoclonal. Clique aqui para ver uma versão maior desta figura.
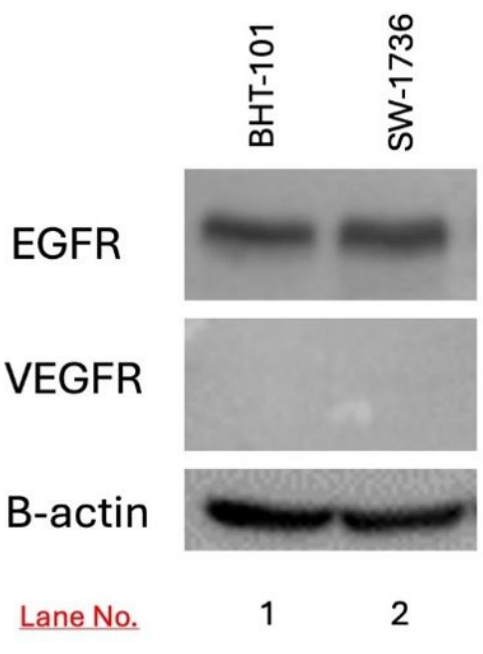
Figura 3: Detecção da expressão de EGFR e VEGFR no carcinoma de tireoide BHT-101 e SW-1736 usando western blotting. A expressão de EGFR, mas não de VEGFR, foi detectada em ambas as linhagens celulares. A B-actina foi usada como controle de carga. Abreviaturas: EGFR = receptor do fator de crescimento epidérmico; VEGFR = fator de crescimento epidérmico vascular. Clique aqui para ver uma versão maior desta figura.
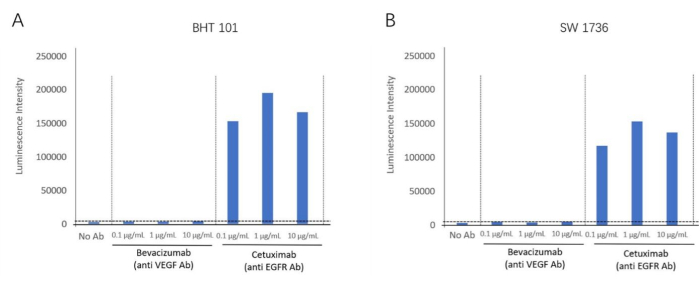
Figura 4: Indução de dobras da atividade do ADCC. (A) A linhagem celular de câncer de tireoide BHT-101 exibe um efeito ADCC na presença do anticorpo anti-EGFR Cetuximab. (B) A linha celular de câncer de tireoide SW-1736 exibe um efeito ADCC na presença do anticorpo anti-EGFR Cetuximab. Clique aqui para ver uma versão maior desta figura.
Discussão
Aqui, apresentamos o método de bioensaio ADCC para avaliar a reação ADCC de um anticorpo terapêutico. O método é direto e emprega um formato simples de "adicionar-misturar-ler" para medição.
Antes de fazer o experimento, a expressão do antígeno-alvo nas células-alvo deve ser confirmada por citometria de fluxo ou western blotting. A citometria de fluxo será uma ferramenta melhor para detectar o antígeno de superfície. No entanto, o uso da citometria de fluxo pode estressar as células, causando apoptose e afetando a viabilidade da célula e, portanto, a análise geral. Além disso, custa mais do que o western blotting. Neste experimento, usamos o western blotting como um método mais rápido e econômico porque os antígenos direcionados são antígenos de superfície celular conhecidos.
Células Jurkat projetadas, que expressaram de forma estável o receptor FcγRIIIa, a variante V158 (alta afinidade) e um elemento de resposta NFAT que impulsiona a expressão da luciferase do vaga-lume, foram usadas como células efetoras. A ativação da via NFAT resulta na produção de luciferase, e sua atividade é quantificada na forma de leitura de luminescência. O sinal também representa a atividade do ADCC.
Primeiro, as células-alvo (T) são incubadas com células efetoras (E) na presença de quantidades variáveis de anticorpos em placas de 96 poços por 6 h a 37 ° C em uma incubadora de CO2 umidificada. A proporção efetor:alvo de 5:1 é usada para otimizar o sinal. Por exemplo, 75.000 células efetoras foram adicionadas a 15.000 células-alvo. No final da incubação, o reagente de ensaio de luciferase Bio-Glo é adicionado a cada poço, incubado por 30 min, e a luminescência (RLU, unidades relativas de luciferase) é medida usando um leitor de placa de luminescência.
As principais etapas críticas neste protocolo são: (1) O manuseio de células efetoras. O frasco para injetáveis de células não deve ser invertido durante o processo de descongelamento, balançar suavemente e deve ser usado imediatamente após o descongelamento para evitar a morte celular indesejada ou afetar o desempenho da detecção biológica. (2). É importante usar microplacas de poliestireno branco de 96 poços com fundo plano e transparente para medições de luminescência porque a luminescência é capturada da parte inferior do leitor.
Neste estudo, observamos as reações de ADCC mais fortes e mais fracas do anticorpo anti-EGFR, cetuximabe, dependendo da quantidade de células-alvo e da concentração de anticorpos. Algumas razões para lidar com a calibração de reações fracas de ADCC: (1) As leituras do bioensaio repórter do ADCC vêm de células efetoras (E), com um número constante de 75.000 células por poço no sistema de reação ADCC deste estudo. Portanto, otimizar a qualidade das células-alvo (T) é um aspecto que pode ser melhorado. A relação E:T neste estudo foi de 5:1, podendo ser ajustada até 20:1. (2) A concentração de anticorpos também é um dos fatores importantes que afetam a reação do ADCC. Os ajustes podem ser feitos por meio de diluição seriada de anticorpos para explorar a faixa de concentração ideal, alcançando assim a resposta máxima no relatório do ADCC. (3) O tempo de incubação de anticorpos, células-alvo e células efetoras também é crucial para os resultados experimentais. Neste estudo, incubamos por 6 h, que pode ser estendido até 24 h para atingir a reação ideal do ADCC. (4) Além disso, a concentração da solução tampão (baixa IgG) para o ensaio de ADCC também precisa ser explorada. A concentração sérica ideal para a resposta ao ADCC pode ser alcançada na faixa de 1% a 10%.
Este método experimental é rápido e direto, permitindo a conclusão em um dia por meio de um protocolo simples de "adicionar-misturar-ler". Os resultados são estáveis e passíveis de testes em lote. No entanto, este kit de bioensaio não detecta a morte celular como os métodos convencionais de ADCC que usam células PBMC ou NK como células efetoras12,13. Em vez disso, ele usa células Jurkat expressas pelo receptor FcγRIIIa como células efetoras, o que custará mais porque as células são geneticamente modificadas. Em comparação com os experimentos tradicionais de ADCC13,14, elimina a necessidade de doações de sangue de indivíduos saudáveis e evita o complexo processo de extração de células imunes, mitigando variações individuais que poderiam impactar os resultados. Os sinais de luminescência detectados são da ligação das células efetoras às células-alvo, não da morte real das células-alvo. Portanto, pode haver discrepâncias em comparação com os métodos padrão de detecção de ADCC. Além disso, o tampão de dissociação celular, que é mais caro que a tripsina, é usado para separar as células aderentes para manter a integridade da membrana.
A análise do gene repórter do ADCC demonstra excelente precisão e estabilidade, servindo como um método de análise de eficácia para a detecção em massa de medicamentos de anticorpos terapêuticos. Também pode funcionar como um método de análise crítica para a caracterização de moléculas terapêuticas e desenvolvimento de processos15.
Em resumo, o ADCC é um importante mecanismo imunológico, e a detecção quantitativa do ADCC tem grande importância no campo da imunoterapia. Este método experimental oferece um meio eficaz para a medição quantitativa do ADCC15.
Divulgações
Todos os autores declaram não haver conflitos de interesse.
Agradecimentos
Somos gratos ao Prof. Zeng (IMCB, A*STAR) por apoiar este trabalho. Este estudo foi apoiado pela Fundação da Juventude da Fundação Nacional de Ciências Naturais da China (NSFC) (82202231) e pelo Projeto de Ciência e Tecnologia Médica e de Saúde da Província de Zhejiang, China (2021KY110,2024KY824).
Materiais
| Name | Company | Catalog Number | Comments |
| 0.5% Trypsin-EDTA | Gibco | 15400-054 | Dilute 10x in PBS to make 0.05% Trypsin |
| 1x Tris Buffer Saline (TBS) | 1st BASE | BUF-3030-1X1L | For membrane washing in western blotting |
| 1.5 M Tris Buffer, pH 8.8 | 1st BASE | BUF-1419-1L-pH8.8 | For SDS gel preparation |
| 2-Mercaptoethanol | Sigma Aldrich | M7522-100ML | For sample preparation of western blotting |
| 30% Acrylamide/Bis solution | Bio-Rad | #1610158 | For SDS gel preparation |
| 4x Laemmli Buffer | Bio-Rad | #1610747 | For sample preparation of western blotting |
| 96-well white polystyrene microplate with clear flat bottom | Corning Incorporated | 3610 | For ADCC assay |
| ADCC Bioassay Effector cells (0.65 mL) | Promega | G7011 | Includes in ADCC reporter bioassay core kit (Promega G7010), 1 x 1 vial |
| ADCC reporter bioassay core kit | Promega | G7010 | Mentioned as ADCC bioassay kit for ADCC assay in this experiment |
| Ammonium Persulfate | Sigma Aldrich | A3678-25G | For SDS gel preparation |
| Bevacizumab (Humanized Anti VEGF-antibody) | MVASI | - | Use as negative control antibody in ADCC asssay |
| BHT-101 | Leibniz Institute DSMZ | ACC279 | Human anaplastic papillary thyroid cancer cell line |
| Bio-Glo Luciferase Assay Buffer | Promega | G7941 | Includes in ADCC reporter bioassay core kit (Promega G7010), 1 x 10 mL |
| Bio-Glo Luciferase Assay Substrate (Lyophilized) | Promega | G7941 | Includes in ADCC reporter bioassay core kit (Promega G7010), 1 x 1 vial |
| Cell scraper | GenFollower | GD00235 | To remove cell from culture flask |
| Cetuximab (Chimeric anti-EGFR antibody) | ERBITUX | - | Use as therapeutic antibody in ADCC assay |
| Chemiluminescent HRP substrate | Merck Millipore | WBKLS0500 | For protein detection in western blotting |
| Distilled water | Gibco | 15230-162 | For SDS gel preparation |
| Fetal Bovine Serum (FBS) | Gibco | 10270-106 | Culture media supplement |
| iBright CL1500 imaging system | Thermo Scientific | 2462621100038 | For protein detection in western blotting |
| L-glutamine, 200 mM | Gibco | 25030-081 | Culture media supplement |
| Low IgG Serum | Promega | G7110 | Includes in ADCC reporter bioassay core kit (Promega G7010), 1 x 4 mL |
| Megafuge 8R | Thermo Scientific | 42876589 | Centrifuge |
| Mouse anti-EGFR monoclonal antibodies | BD Biosciences | 610016 | Primary antibody in western blotting |
| Mouse anti-VEGFR monoclonal antibodies | BD Biosciences | 571194 | Primary antibody in western blotting |
| non-enzymatic cell dissociation buffer | Sigma Aldrich | C5789-100ML | For cell harvesting from T75 flask |
| Penicillin-Streptomycin | PAN Biotech | P06-07100 | Antibacterial for culture media |
| Phosphate Buffered Saline (PBS), pH 7.2, Sterile filtered | 1st BASE | CUS-2048-1x1L | Use as washing solution for cells |
| Pierce BCA assay kit | Thermo Scientific | 23225 | To measure protein concentration |
| Protease and phosphatase inhibitor | Thermo Scientific | A32959 | For protein digestion in sample preparation for western blotting |
| PVDF membrane (Immobilin-P) | Merck Millipore | IPVH00010 | For protein transfer in western blotting |
| Rabbit anti-mouse IgG, Fcγ HRP-conjugated secondary antibody | Jackson ImmunoResearch | 315-035-046 | Secondary antibody in western blotting |
| Roswell Park Memorial Institute (RPMI) medium | Capricorn Scientific | RPMI-XA | Cell culture media |
| RPMI-1640 | Promega | G7080 | Includes in ADCC reporter bioassay core kit (Promega G7010), 1 x 36 mL |
| Skim milk powder | Merck Millipore | 70166-500G | For membrane blocking in western blotting |
| Sodium Dodecyl Sulfate | 1st BASE | BIO-2050-500g | For SDS gel preparation |
| SW-1736 | Cytion | 300453 | Human thyroid squamous cell cancer cell line |
| T75 culture flasks | SPL Lifesciences | 70075 | Cell culture flask |
| Tecan Multimode Reader model Spark 10M | Tecan | 1607000294 | for luminicence quantification |
| TEMED | Bio-Rad | #1610801 | For SDS gel preparation |
| Tween-20 | Promega | H5151 | For membrane washing in western blotting |
| Vi-cell XR cell viability analyzer | Beckman Coulter | AL15072 | Cell counter |
Referências
- Zahavi, D., AlDeghaither, D., O'Connell, Enhancing antibody-dependent cell-mediated cytotoxicity: a strategy for improving antibody-based immunotherapy. Antib Ther. 1 (1), 7-12 (2018).
- Fenis, A., Demaria, O., Gauthier, L., Vivier, E. New immune cell engagers for cancer immunotherapy. Nat Rev Immunol. 24 (7), 471-486 (2024).
- Pinto, S., Pahl, J., Schottelius, A., Carter, P. J. Reimagining antibody-dependent cellular cytotoxicity in cancer: the potential of natural killer cell engagers. Trends Immunol. 43 (11), 932-946 (2022).
- Ochoa, M. C., et al. Antibody-dependent cell cytotoxicity: immunotherapy strategies enhancing effector NK cells. Immunol Cell Biol. 95 (4), 347-355 (2017).
- Wang, W., Erbe, A. K., Hank, J. A., Morris, Z. S. NK cell-mediated antibody-dependent cellular cytotoxicity in cancer immunotherapy. Front Immunol. 6, 368 (2015).
- Chung, S., et al. Characterization of in vitro antibody-dependent cell-mediated cytotoxicity activity of therapeutic antibodies - impact of effector cells. J Immunol Methods. 407, 63-75 (2014).
- Shimasaki, N., Jain, A., Campana, D. NK cells for cancer immunotherapy. Nat Rev Drug Discov. 19 (3), 200-218 (2020).
- Cheng, Z. J., et al. Development of a robust reporter-based ADCC assay with frozen, thaw-and-use cells to measure Fc effector function of therapeutic antibodies. J Immunol Methods. 414, 69-81 (2014).
- Parekh, B. S., et al. Development and validation of an antibody-dependent cell-mediated cytotoxicity-reporter gene assay. MAbs. 4 (3), 310-318 (2012).
- Hogarth, P. M., Pietersz, G. A. Fc receptor-targeted therapies for the treatment of inflammation, cancer and beyond. Nat Rev Drug Discov. 11 (4), 311-331 (2012).
- Chung, S., et al. Quantitative evaluation of fucose reducing effects in a humanized antibody on Fcgamma receptor binding and antibody-dependent cell-mediated cytotoxicity activities. MAbs. 4 (3), 326-340 (2012).
- . ADCC Reporter Bioassay Core Kit Technical Manual Available from: https://www.promega.sg/-/media/files/resources/protocols/technical-manuals/101/adcc-reporter-bioassay-core-kit-protocol.pdf?rev=bec36264c0b6470591ded081377d207d&sc_lang=en (2023)
- Miller, A. S., Tejada, M. L., Gazzano-Santoro, H. Methods for measuring antibody-dependent cell-mediated cytotoxicity in vitro. Methods Mol Biol. 1134, 59-65 (2014).
- Lo Nigro, C., et al. NK-mediated antibody-dependent cell-mediated cytotoxicity in solid tumors: biological evidence and clinical perspectives. Ann Transl Med. 7 (5), 105 (2019).
- Gómez Román, V. R., Murray, J. C., Weiner, L. M., Ackerman, M. E., Nimmerjahn, F. . Antibody Fc. , 1-27 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados