Method Article
Fare Embriyonik Kalbinde Gen İletimi için Etkili Bir Transgenez Yaklaşımı
Bu Makalede
Özet
Bu protokol, gelişmekte olan fare kalplerinde kalp hücrelerinin elektroporasyona dayalı transgenezi için ayrıntılı bir metodolojik çerçeve sunar. Burada sağlanan video varlıkları, bu çok yönlü tekniğin öğrenilmesini kolaylaştıracaktır.
Özet
Memeli kalbi, gelişim sırasında çok çeşitli progenitör hücre popülasyonları yoluyla oluşan karmaşık bir organdır. Bu ataların kökeni, işe alınma zamanlaması ve kaderi, bu organın düzgün gelişimi için hayati önem taşır. Kalbin morfogenezini yöneten moleküler mekanizmalar, konjenital kalp hastalıklarının ve embriyonik kardiyak rejenerasyonun patogenezini anlamak için gereklidir. Bu mekanizmaları araştırmak için klasik yaklaşımlar, kardiyak gelişim sırasında spesifik genlerin işlevini değerlendirmek için transgenik farelerin neslini kullanmıştır. Bununla birlikte, fare transgenezi, kalp gelişimi sırasında belirli genlerin rolünü değerlendirmek için genellikle gerçekleştirilemeyen karmaşık, zaman alıcı bir süreçtir. Bunu ele almak için, fare embriyonik kalplerinin verimli elektroporasyonu ve kültürü için bir protokol geliştirdik ve geçici transgenezin kardiyak gelişimde yer alan genlerin fonksiyon kazanımı veya kaybının etkisini hızlı bir şekilde değerlendirmesini sağladık. Bu metodolojiyi kullanarak, epikardiyal hücre transfeksiyonu tercihi ile embriyonik kalpte Meis1'i başarılı bir şekilde aşırı eksprese ettik ve tekniğin yeteneklerini gösterdik.
Giriş
Kalp, embriyonik gelişim sırasında oluşan ilk organdır. Bu süreç, embriyonun farklı bölgelerinden çeşitli progenitör hücre popülasyonlarının uzay-zamansal koordinasyonunu içerir. Bütün bunlar, gelişmekte olan kalp atmaya ve çalışmaya devam ederken meydana gelir ve oluşumu için gereken olağanüstü koordinasyonu vurgular 1,2,3. Kalbin kritik rolü göz önüne alındığında, düzgün oluşumu için hücresel ve moleküler seviyelerde sıkı düzenleme şarttır 4,5. Kalp gelişimini kontrol eden mekanizmaların belirlenmesi, dünya çapında önemli sayıda hastayı etkileyen konjenital kalp bozukluklarının çözülmesi için çok önemli olduğu için büyük ilgi görmüştür6. Ayrıca, doğum sonrası memeli kalpleri yetişkinlikte kaybedilen veya engellenen bir rejeneratif kapasiteyi koruduğundan, kalp gelişimini anlamak kardiyak rejenerasyonun deşifre edilmesinde çok önemlidir 7,8. Sonuç olarak, konjenital kalp hastalığı ve kardiyak rejenerasyon ile ilgili araştırma çabalarını ilerletmek için kalp gelişiminin moleküler düzenleyicilerinin diseksiyonu zorunludur.
Bu amaç doğrultusunda, epikardiumun kardiyak gelişim ve rejenerasyondaki rolünü araştırmaya artan bir odaklanma olmuştur9. Epikardium, memeli kalbinin en dış tabakasını oluşturan ince bir mezotelyal doku tabakasıdır (Şekil 1). Son zamanlarda yapılan çalışmalar, kardiyak yaralanma sırasında epikardın önemini göstermiş ve bu dokunun hasarı hafifletmek için etkilenen bölgedeki kardiyomiyositlere proliferasyon sinyalleri gönderebildiğini ortaya koymuştur10,11. Epikardın önemine rağmen, daha fazla moleküler araştırma yapmak, muazzam heterojenliği nedeniyle sorgulanmıştır. Tek hücreli RNAseq deneyleri, farklı transkriptomik imzalara sahip çoklu hücre alt popülasyonlarını barındıran epikardın heterojenliğini ortaya çıkarmıştır 12,13,14,15,16. Bu nedenle, kardiyak gelişimin potansiyel düzenleyicilerini taramak için bir strateji, epikardiyal progenitör hücrelerin çeşitliliğini barındırmalıdır.
Bu anlamda, fare modelinin genetik modifikasyona yatkınlığı, kalp gelişimi için çok önemli olan çok sayıda genin tanımlanmasını kolaylaştırmış ve belirli genlerin işlev kazancı (GOF) veya işlev kaybı (LOF) ile mutant hatların oluşturulmasına izin vermiştir. Bununla birlikte, bu yaklaşımlar önemli bir zaman ve deneysel kaynak yatırımı anlamına gelir; bu nedenle, çok sayıda aday genin rollerini değerlendirirken pratik değildirler. Ayrıca, gelişimsel genler genellikle farklı dokularda pleiotropik işlevler gösterir veya erken embriyonik gelişim için gereklidir, bu da belirli bir süreçte gelişime katkılarının yorumlanmasını engeller. Gen fonksiyonunu belirli yapılarda veya gelişimsel zaman noktalarında hedeflemek mümkün olsa da, bu genellikle üretilmesi zor olabilen veya genellikle mevcut olmayan daha karmaşık genetik yapıların kullanılmasını gerektirir.
Bu sınırlamaların üstesinden gelmek için, geçici transgenez için fare embriyonik kalplerini elektropore etmek için bir metodoloji sunuyoruz (Şekil 2). Ex vivo kültür ve floresanla aktive edilen hücre sınıflandırması (FACS) ile eşleştirilen bu strateji, kalp gelişimi ve rejenerasyonunda rol oynayan iyi karakterize edilmiş bir gen olan Meis1'in geçici GOF yoluyla yeteneklerini gösterir 17,18,19. Bu makalede, bu metodolojinin diğer potansiyel uygulamaları da araştırılmakta ve avantajları ve sınırlamaları tartışılmakta ve ayrıca gen ekspresyonunu geçici olarak modüle etmek için mevcut protokollerle karşılaştırılmaktadır. Sunulan çerçeve ve görsel örneklerin, gelişim ve hastalık sırasında epikard biyolojisinin anlaşılmasını geliştireceğine inanıyoruz.
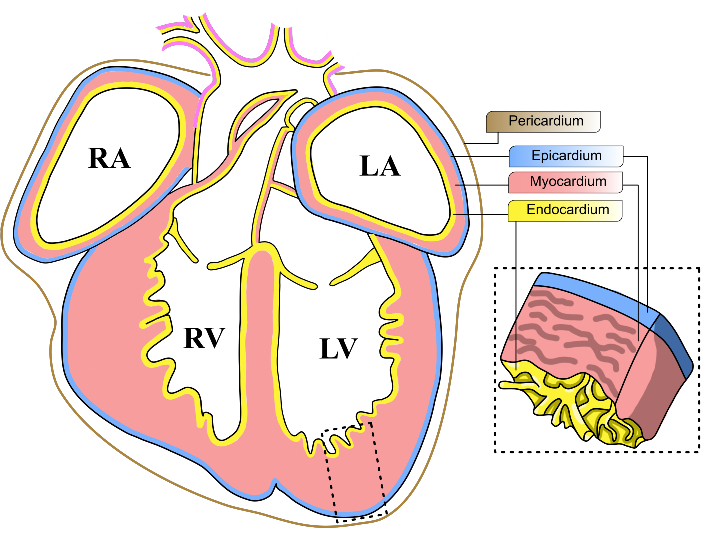
Resim 1: Fare embriyonik kalp katmanları. Bir E13-14 fare embriyonik kalbinin koronal görünümünün şematik diyagramı. Kalbin üç ana hücresel tabakası sarı (endokard), kırmızı (miyokard) ve mavi (epikard) ile temsil edilir. Perikard kahverengi bir çizgi ile temsil edilir. Kalbin dört odacığı LV, sol ventrikül olarak kısaltılır; RV, sağ ventrikül; LA, sol atriyum; RA, sağ atriyum. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Kalp elektroporasyon protokolüne şematik genel bakış. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Protokol
Tüm hayvan prosedürleri, CNIC Hayvan Deneyleri Etik Komitesi tarafından onaylandı ve 53/2013 sayılı Gerçek Kararname uyarınca İspanyol Yasası tarafından uygulanan AB Direktifi 2010/63EU ve 2007/526/EC sayılı Tavsiye Kararı dahil olmak üzere mevcut mevzuata uygun hale getirildi. Bu protokol için, 15-21 haftalık dişi vahşi tip CD-1 fareleri kullanıldı. Kullanılan hayvanlar, reaktifler ve ekipmanlarla ilgili ayrıntılar Malzeme Tablosunda listelenmiştir.
1. Plazmit ve alet hazırlama
- İlk olarak, istenen plazmit DNA'yı 1 μg/μL'lik bir nihai konsantrasyonda buza ekleyerek elektroporasyon karışımını hazırlayın. Daha sonra, %6 nihai konsantrasyonda (PBS içinde çözülmüş) sakaroz,% 0.01'de biyouyumlu bir boya ekleyerek karışımı tamamlayın ve 30 μL'lik bir son hacme kadar PBS ile tamamlayın.
NOT: Numune başına yaklaşık 1-2 μL elektroporasyon karışımı kullanılır. Elektroporasyon karışımının oranlarını deneydeki numune sayısına göre ölçeklendirin. Elektroporasyon için DNA'nın bakteri kültüründen saflaştırılması gerektiğini, optimum stabilite ve minimum kirletici madde sağladığını lütfen unutmayın. Bu çalışma için kullanılan plazmitler hakkında daha fazla ayrıntı için lütfen temsili sonuçlar bölümüne bakın. - Dulbecco'nun Modifiye Eagle Medium'unu (DMEM) %10 fetal sığır serumu (FBS), %2 Hepes tamponu ve %1 penisilin / streptomisin ile destekleyerek Büyüme Ortamı hazırlayın. Ortamı kullanana kadar 37 ° C'de bir inkübatörde tutun. Ek olarak, büyüme ortamı ile birlikte 1x PBS'yi 37 °C'de ısıtın.
- Aşağıdaki koşullara sahip bir pipet çektirme kullanarak 20 μm çapında bir cam kılcal damarı gererek iğneleri hazırlayın: ısı = 550; çekme = 100; hız = 250; zaman = 120. Çektikten sonraki son çap yaklaşık 5-8 μm arasında olmalıdır.
- Elektroporatör parametrelerini 900 ms aralıklarla 40 V'ta beş adet 50 ms'lik döngüye ayarlayın. Elektrotları, ağız pipetini ve künt iğneyi hazırlayın (Şekil 3A). DNA'yı yüklemek için pipeti iğne ile donatın (Şekil 3A).
2. Embriyo diseksiyonu ve kalp ekstraksiyonu
- Vahşi tip CD-1 fareleri arasında bir çaprazlama ayarlayın. Ertesi sabah, vajinal tıkaç sergileyen dişileri seçin ve bu zamanı embriyonik gün E0.5 olarak not edin. Hayvanları embriyonik gün E12-12.5'te servikal çıkık ile ötenazi yapın (kurumsal olarak onaylanmış protokolleri izleyerek).
- Uterusu fareden dikkatlice çıkarın ve kuru bir kağıt havluya koyun. Bunu takiben, makasın ucunu mezomiyal tarafa sokarak ve bıçağın kenarını tüm uzunluk boyunca yavaşça hareket ettirerek ince bir makas kullanarak uterusu kesin. Desiduae'yi açığa çıkarın ve onları büyüme ortamına aktarın. Daha fazla ayrıntı için lütfen Behringer ve ark.20'nin çalışmasına bakınız.
- Embriyoları çıkarmak için desiduaları inceleyin, ardından embriyoları ılık büyüme ortamına sahip 60 mm'lik bir Petri kabına yerleştirin. İnce forseps kullanarak, embriyonun kuyruğunu ve başını dikkatlice kesin, böylece sadece vücudun gövdesi kalır. Embriyoların evresi, Wong ve ark.21 tarafından tarif edildiği gibi anatomik özelliklerin değerlendirilmesiyle doğrulanabilir.
- Ardından, kalbe veya pulmoner ve aort arterlerine zarar vermeden embriyonun gövdesinden mümkün olduğunca fazla doku çıkarın. Kalp açığa çıktıktan sonra, hemen yeni, sıcak bir büyüme ortamına koyun ve elektroporasyona kadar 37 ° C'de bir inkübatörde tutun.
NOT: Kalbin sıcaklığını korumak, hayatta kalması için çok önemlidir. Ortamın her zaman sıcak olduğundan emin olun ve her 5-10 dakikada bir değiştirin. Öte yandan, prosedürün verimliliğini etkilemeyeceği için numuneler steriliteyi korumadan ele alınabilir. Büyüme ortamının antibiyotik içerdiğini lütfen unutmayın.
3. Kalp elektroporasyonu ve ex vivo kültür
- Yaklaşık 10 μL plazmit karışımını (adım 1.1'de hazırlanmıştır) ağız pipeti ile dikkatlice aspire ederek iğneye yükleyin.
- 37 °C'ye ısıtılmış steril 1x PBS ile temiz bir 60 mm Petri kabına yerleştirerek elektroporasyon için tek bir kalp hazırlayın. Çanağı diseksiyon mikroskobunun altına yerleştirin (Şekil 3A).
- Pozitif ve negatif kutuplar arasındaki mesafeyi yaklaşık 4 mm'ye ayarlayarak elektrotları hazırlayın (Şekil 3B).
NOT: 4 mm, bu çalışmada kullanılan elektrotlara E12.5 fare kalplerinin sığdığı açıklık mesafesidir. Lütfen bu mesafeyi farklı numune boyutlarına veya elektrot özelliklerine göre değiştirmeyi düşünün. - Ağız pipetindeki iğne ile kalbin en yüzeysel tabakasını nazikçe delin. Plazmit karışımının 1-2 μL'sini dikkatlice pipetleyin ve iğneyi çıkarın. Optimal penetrasyonu sağlamak ve ayrıca elektroporasyonlu hücrelerin sayısını artırmak için çoklu enjeksiyonlar yapılabilir.
- Elektrotları, kalp her iki kutup arasında yer alacak şekilde yerinde tutun (Şekil 3C). Ardından, kalbi yukarıda belirtilen koşullarla elektriklendirin.
NOT: Maksimum elektroporasyon verimliliğini sağlamak için, elektrotların polaritesini değiştirmek ve başka bir darbe vermek mümkündür. - Elektroporasyonlu kalbi 1 mL büyüme ortamı içeren 12 oyuklu yeni bir plakaya aktarın ve 37 ° C,% 5 CO2'ye yerleştirin.
- Deneydeki tüm numuneler elektroporasyonlu olana kadar 3.1 ila 3.6 arasındaki adımları tekrarlayın. Son olarak, tüm kalpleri bir inkübatörde 37 ° C,% 5 CO 2'de 24 saat veya analize kadar inkübe edin.
NOT: Ellerimizde, kalpler belirgin bir bozulma belirtisi olmadan 48 saate kadar kültürde bırakılabilir (Ek Film 1; Ek Film 2; Ek Şekil 1).
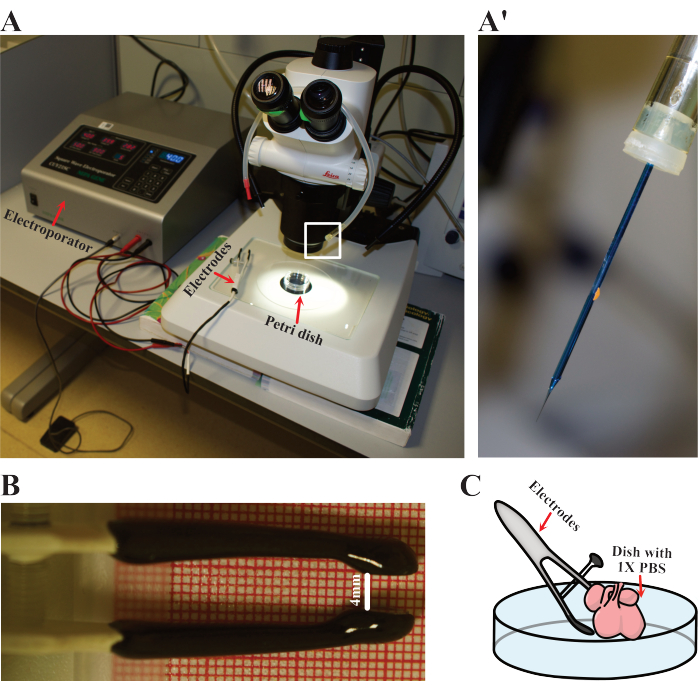
Şekil 3: Elektroporasyon kurulumu. (A) Elektroporasyon için kullanılan kurulum. Kırmızı oklar, kalplerin elektroporasyona tabi tutulduğu elektroporatörü, elektrotları ve Petri kabını gösterir. (Bir') Beyaz dikdörtgen ile (A)'da vurgulandığı gibi elektroporasyon iğnesinin yakın detayı. (B) E12.5 kalplerinde kullanılan elektrotların ayarlanmış mesafesinin detayı. (C) Elektroporasyonun şematik gösterimi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
4. Hücre sınıflandırma ve immünohistokimya analizi
- Örneklerin hücre sıralama analizi için, 400 μL liberaz (5 mg/ml), 300 μL dispas (0.1 g/mL), 4 μL CaCl2 (0.4 μM), 50 μL MgCl2 (5 μM) ile karıştırarak dokuyu ayırmak için bir sindirim ortamı hazırlayın ve 10 mL DMEM'e kadar tamamlayın. Kullanana kadar buz üzerinde tutun. Her kalbin yaklaşık 1 mL Sindirim Ortamına ihtiyacı vardır. Hacimleri numune sayısına göre ayarlayın.
NOT: İmmünohistokimya için, kalpleri RT'de 2 saat veya gece boyunca 4 ° C'de 1.5 mL% 4 PFA'da doğrudan sabitleyin. Ertesi gün, kalpleri 3 kez PBS ile yıkayın ve aşağı akış histolojik ve immün boyama prosedürlerine devam edin. Ayrıntılı bir immünohistokimya protokolü için Morris ve ark.22'ye bakınız. - Kültürdeki her kalbi 1 mL buz gibi soğuk sindirim ortamı içeren yeni bir tüpe aktarın.
- Ayrışmayı kolaylaştırmak için, bir şırınga ile 3-4 kez hafifçe uygulayarak dokuyu doğrayın ve hemen 37 ° C, 600 rpm'de 45 dakika boyunca sıcak bir plakada inkübe edin.
- Sindirim karışımını 70 μm'lik bir hücre süzgecinden geçirerek yeni bir tüpe süzün ve yerçekimi akışıyla boşalmasına izin verin. Ardından, geçiş hacmini kurtarın ve 40 μm'lik bir hücre süzgeci kullanarak 50 mL'lik yeni bir tüpe tekrar süzün.
- 500 μL fetal sığır serumu (FBS) ekleyin ve soğuk DMEM kullanarak 30 mL'ye kadar tamamlayın.
- Karışımı oda sıcaklığında 10 dakika boyunca 240 x g'da santrifüjleyin.
- Süpernatanı atın ve 50 mL'lik tüpü tamamen kuruması için bir kağıt havlunun üzerine baş aşağı yerleştirin.
NOT: Bu, hücre peletini dondurarak deneyi duraklatmak için uygun bir noktadır. Eğer öyleyse, hücreleri FBS'de% 10 DMSO ile yeniden süspanse edin ve -80 ° C'de saklayın. - Hücre sıralaması için, hücreleri 300 μL sıralama tamponunda (% 1 FBS,% 1 penisilin / streptomisin) yeniden süspanse edin ve 0.3 μL DAPI (1000x) ekleyin. Hücre sıralama işlemini gerçekleştirin.
Sonuçlar
Bu tekniğin, ilgili kalp gelişimsel düzenleyicileri için fonksiyon kazancı (GOF) deneyleri gerçekleştirmedeki etkinliğini göstermek için, Meis1 transkripsiyon faktörünü aşırı eksprese eden bir yapı elektroporasyona tabi tutuldu. Bunu başarmak için, E9.5 embriyolarından RNA ekstrakte edildi ve tamamlayıcı DNA (cDNA) elde etmek için ters transkripsiyon yapıldı. cDNA'yı bir şablon olarak kullanarak, Meis1 kodlama dizisi klonlandı (Ek Tablo 1) bir pCAG ekspresyon plazmidiline (bundan böyle pCAG::Meis1 olarak anılacaktır), kurucu bir GFP eksprese eden plazmit (pCAG::GFP) kontrol olarak kullanıldı. Kalpler daha sonra ya sadece pCAG::GFP ile ya da pCAG::Meis1 ile kombinasyon halinde elektroporasyona tabi tutuldu.
Elektroporasyondan (hpe) 24 saat sonra, kalpler atıyordu ve iyi durumda görünüyordu (Şekil 4A; Tamamlayıcı Film 1; Ek Film 2). Elektropore hücrelerin canlılığını değerlendirmek için, kaspaz 3'ün immünohistokimyasal boyanması yoluyla apoptoz analiz edildi. Kalpte bazı pozitif hücreler tespit edilmesine rağmen, ne miyokard ne de elektroporasyonlu hücrelerin çoğunluğunun bulunduğu epikardın apoptozdan etkilenmediği bulundu (Ek Şekil 1C). Floresan aktivitesi değerlendirildiğinde, kalbin hemen hemen dört odacıklı kısmında mozaik bir GFP sinyali gözlendi, bu da bu protokolün kalp yapılarının çoğuna ulaşabildiğini gösteriyor (Şekil 4A). Hangi kardiyak hücre tiplerinin elektroporasyonlu olduğunu belirlemek için, pCAG::GFP ile elektroporasyonlu kalpler, epikard, WT12 ve miyokard, MF2023 belirteçlerine karşı immün boyandı ve daha sonra konfokal bir mikroskop kullanılarak görüntülendi (Şekil 4B). GFP + hücrelerinin çoğu tercihen kalbin dış bölgesinde bulunuyordu, bu da büyük ölçüde WT1 sinyaline karşılık geliyordu, bu da bu yöntemin epikardiyal hücrelere ulaşmada en verimli olduğunu gösteriyor (Şekil 4B, beyaz ok uçları).
Öte yandan, pCAG::Meis1-elektroporasyonlu veya kontrol (yalnızca pCAG::GFP) kalpler ayrıştırıldı ve hücreler, protokolün 4. adımında açıklandığı gibi GFP + hücrelerini tüm organdan izole etmek için floresanla aktive edilen hücre sınıflandırmasına (FACS) tabi tutuldu. Sıralanan hücrelerden RNA ekstrakte edildi ve transfekte edilmiş hücrelerde Meis1'in ekspresyon seviyelerini değerlendirmek için ters transkripsiyon kantitatif PCR (RT-qPCR) yapıldı (Şekil 4C, Ek Tablo 1). Toplam Meis1 gen ekspresyonu, fare temizlik geni Eef224'ün ekspresyon seviyeleri kullanılarak normalize edildi ve nispi gen ekspresyonu ΔΔCt yöntemi25 kullanılarak hesaplandı. pCAG::Meis1 plazmidi ile elektropore edilen kalplerde, sadece pCAG::GFP plazmidi olanlara kıyasla Meis1 RNA seviyelerinde önemli bir artış gözlenmiştir (Şekil 4C). Bu nedenle, bu, tekniğin ilgilenilen genleri aşırı ifade etme ve moleküler sonucu ele alma potansiyelini göstermektedir.

Şekil 4: Elektroporasyonlu E12.5 kalplerinin moleküler analizi.(A) Bir CAG'nin GFP floresansı::Elektroporasyondan 24 saat sonra GFP-elektroporasyonlu kalp. Alttaki resim GFP floresansını gösterirken, üstteki resim GFP'nin birleşimini ve aynı kalbin parlak bir alanını göstermektedir. (B) Elektroporasyonlu E12.5 kalp histolojik bölümlerinin immünofloresansı. MF20 kardiyomiyositleri, WT1 ise epikardiyal hücreleri işaretler. Sağdaki görüntüler, beyaz dikdörtgenin yakınlaştırmalarına karşılık gelir. Beyaz ok uçları, epikardda bulunan ve kabaca noktalı beyaz bir çizgi ile sınırlandırılmış GFP + hücrelerini gösterir. (C) pCAG::Meis1 veya pCAG::GFP (kontrol) ile elektropore edilmiş kalplerin RT-qPCR analizi. Her nokta, üç kalbin bir araya getirilmesinden elde edilen biyolojik bir kopyayı temsil eder. Toplamda, qPCR analizi üç farklı biyolojik kopya ile üç kopya halinde gerçekleştirildi. İstatistiksel analiz Student t-testi (*P < 0.05) kullanılarak yapıldı. Ölçek çubukları: 200 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Şekil 1: Kalp elektroporasyon verimliliği ve hücre canlılığı. (A) Elektroporasyon sonrası (hpe) 24 saat veya 48 saat sonra kontrol plazmidi pCAG::GFP ile elektroporasyonlu iki farklı E12.5 kalpte GFP'nin ekspresyonu. GFP sinyal görüntüsü, aynı kalbin parlak bir alan görüntüsünün üzerine bindirildi. (B) 24 hpe ve 48 hpe kalplerde GFP+ hücre nicelemesi, pCAG::GFP kontrolü ile elektroporasyonlu. Noktalar farklı örnekleri gösterir; Düz çizgiler ortalamayı, hata çubukları ise standart sapmayı gösterir. Her iki durum arasında anlamlı fark gözlenmedi (parametrik olmayan t-testi; P > 0.9). (C) Bölünmüş kaspaz 3 ve MF20'ye karşı immün boyalı pCAG::GFP ile elektropore edilmiş bir E12.5 kalbinin konfokal görüntüsü. Noktalı çizgi, kalbin miyokard tabakasını temsil eder. Sağdaki görüntüler beyaz dikdörtgenden yakınlaştırılır. Ölçek çubukları: 100 μm. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Tablo 1: Primer özeti ve dizileri. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Film 1: pCAG::24 saat sonra GFP-elektroporasyonlu kalp. İşlemden 24 saat sonra pCAG::GFP kontrol plazmidi ile elektropore edilmiş bir kalbi yakalayan film. Kalp atmaya devam eder ve elektroporasyonlu hücreler GFP sinyallerini ifade eder. Bu filmi indirmek için lütfen buraya tıklayın.
Ek Film 2: pCAG::48 saat sonra GFP-elektroporasyonlu kalp. Elektroporasyondan 48 saat sonra pCAG::GFP kontrollü elektroporasyonlu bir kalbi gösteren film. Bu filmi indirmek için lütfen buraya tıklayın.
Tartışmalar
Genel olarak, burada açıklanan metodoloji, Meis1 aşırı ekspresyonu (Şekil 4C) ile gösterildiği gibi, gelişmekte olan epikarddaki transgenik yapıları ifade etmek için sağlam bir çerçeve sunar (Şekil 4B). Uygun yapılarla, bu protokol, belirli bir genin fonksiyon kazancının (GOF) veya fonksiyon kaybının (LOF) etkisini geçici olarak değerlendirmek için kullanılabilir. LOF, RNA interferansı26 yoluyla bir aday geni hedefleyen bir plazmitin transfekte edilmesiyle tekniğe uygulanabilir. GOF veya LOF geninin hızlı bir şekilde değerlendirilmesi, özellikle epikardiyal hücrelerin12 büyük transkriptomik heterojenliği göz önüne alındığında, her bir aday geni ayrı ayrı değerlendirmek için transgenik hayvanlar üretmeyi pratik hale getirme konusunda özellikle avantajlıdır.
Bu protokol ex vivo kültür kullandığından, temporal bir pencere içinde epikardiyal hücrelerin kaderini araştırma imkanı sunar. Gelişmekte olan epikardium, yetişkin kalbindeki farklı bölgelerin şekillenmesinde çok önemli bir rol oynar 13,27,28; Bu nedenle, kalp gelişimine katkılarını anlamak, konjenital kardiyak malformasyonların temelini incelemede etkilidir. Bu makale bu uygulamayı incelemese de, protokolde belirtilen yönergeler, epikardiumun gelecekteki kader haritalama çalışmaları için potansiyel olarak yardımcı olabilir
Mevcut yöntemin pratik faydasına rağmen, bazı sınırlamaların kabul edilmesi gerekmektedir. Bu metodoloji geçici transgeneze dayandığından, plazmit ekspresyonu zamanla kaybolabilir veya azalabilir, bu da protokolün belirli bir gelişimsel pencereyi incelemek için aralığını sınırlar29. Bununla birlikte, bu çalışmada, elektroporasyon sonrası kültürlerin tüm süresi boyunca (48 hpe) GFP aşırı ekspresyonu korunmuştur. Ek olarak, mevcut ex vivo kültür teknolojilerindeki potansiyel sınırlamalar, özellikle elektroporasyondan sonra ex vivo kültürün zorlu hale geldiği durumlarda, yöntemin geç embriyonik veya doğum sonrası gelişim aşamalarını değerlendirmek için uygulanabilirliğini engellemektedir30. Daha sofistike ex vivo embriyo kültürü yöntemleri mevcut olmasına rağmen31,32, araştırmacılar için daha az erişilebilir olan ekipmanların kullanılmasını gerektirebilir ve numunenin hayatta kalmasını garanti etmeyebilir.
Burada sunulan protokol, tekrarlanabilirliği artırmak için mümkün olduğunca basit olacak şekilde tasarlanmış olsa da, başarı için etkili olan kritik adımları içerir. İlk olarak, elektroporasyondan sonra organın hayatta kalmasını tehlikeye atabilecek kalp hasarını en aza indirmek için embriyo diseksiyonu dikkatli ve hızlı bir şekilde yapılmalıdır. Bu adım sırasında, optimal diseksiyon ekipmanının kullanılmasıyla birlikte özel dikkat gösterilmesi şiddetle tavsiye edilir. Protokolün bir diğer kritik yönü, yetersiz plazmit enjeksiyonu istenmeyen sonuçlara yol açabileceğinden, elektroporasyonun kendisinin gerçekleştirilmesidir. Bu nedenle, tek bir kalbe birden fazla enjeksiyon yapılması tavsiye edilir ve numunenin oldukça yüzeysel bir şekilde enjekte edilmesi organ sağkalımını artırmak için faydalı olabilir. Son olarak, kalp işleme sırasında hücre ayrışmasının, hücre canlılığını en üst düzeye çıkarmak için protokolde sağlanan sürelere bağlı kalarak titizlikle gerçekleştirilmesi gerekir.
Sonuç olarak, kalp oluşumunda anahtar genlerin belirlenmesi, kardiyak konjenital hastalıkların ve rejenerasyonun altında yatan mekanizmaların anlaşılmasında etkilidir. Burada oluşturulan metodoloji, gelişmekte olan kalpte gen fonksiyon kazancı (GOF) ve fonksiyon kaybı (LOF) etkilerinin hızlı bir şekilde taranmasına izin verir. Bazı sınırlamaları kabul etmekle birlikte, bu yöntem, gelişimin farklı aşamalarına ekstrapolasyon veya embriyonik epikardiyal hücrelerin kaderini haritalamak için önemli bir potansiyel sergiler. Bu makalede sağlanan görsel yönergeler aracılığıyla, gelişmekte olan epikardın muazzam karmaşıklığını ve potansiyelini değerlendirmek için değerli bir araç kutusu sunmayı amaçlıyoruz.
Açıklamalar
Yazarların açıklanacak herhangi bir çıkar çatışması yoktur.
Teşekkürler
Bu çalışma, İspanyol Ministerio de Ciencia e Innovación'dan RTI2018-097617-J-I00 ve Universidad de Jaén'den Acción 9'a hibe PGC2018-096486-B-I00, İspanyol Ministerio de Ciencia e Innovación'dan hibe -096486-B-I00 ve AB Horizon 2020 programından M.T.'ye H2020-MSCA-ITN-2016-722427 hibe ile desteklenmiştir. JMG, İspanya Bilim Bakanlığı ve Fundación Severo Ochoa'dan (PRE2022-101884) bir doktora bursu ile desteklenmiştir. Hem CNIC hem de CBMSO, İspanya Bilim Bakanlığı tarafından desteklenmektedir ve CNIC, ProCNIC Vakfı tarafından desteklenmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| #55 Forceps | Dumont | 11295-51 | |
| 12-well Clear Flat Bottom Multiwell Cell Culture Plate | BD Falcon | 353043 | |
| 35 mm vise table | Grandado | SKU 8798771617573 | |
| 40 µm Cell Strainer | Fischer Scientific | 08-771-1 | |
| 50 mL tubes | BD Falcon | 352070 | |
| 70 µm Cell Strainer | Corning | CLS431751 | |
| Anti-GFP Policlonal Antibody | Invitrogen | A10262 | 1:1000 dilution used |
| Anti-Myosin 4 (MF20) Monoclonal Antibody | Invitrogen | 14-6503-82 | 1:500 dilution used |
| CD1 Wild Type mice | Provided by Animalary Unit (CNIC) | ||
| Cleaved Caspase-3 (Asp175) Antibody | Cell Signalling Technologies | 9661 | 1:400 dilution used |
| DAPI | Cell Signalling Technologies | 4083 | 1:1000 dilution used |
| Dispase/collagenase | Roche | 10269638001 | |
| Distilled water | |||
| DMEM - Dulbecco's Modified Eagle Medium | Gibco | 10313021 | |
| Fetal Bovine Serum | Invitrogen | 10438-026 | |
| Heracell 150i CO2 Incubator | Thermo Scientific | 51032720 | |
| Leica Stereoscopic Microscope S8AP0 | Leica | 11524102 | |
| Liberase | Roche | 5401119001 | |
| Micropipette Puller Model P-97 | Sutter Instrument | SU-P-97 | |
| pCAG expression plasmid | Addgene | #89689 | |
| Penicillin-streptomycin | Invitrogen | 15070-063 | |
| Petri dishes 35 × 10 mm | BD Falcon | 351008 | |
| Petri dishes 60 × 15 mm | BD Falcon | 353002 | |
| Phenol Red | Merck | P3532 | |
| Pipette tips | Reused from old laboratory equipment | ||
| Rat Serum culture embryo, male rats SPRAGUE DAWLEY RjHan SD | Janvier Labs | 9979 | |
| Recombinant anti-Wilms Tumor Protein 1 (WT1) Antibody | Abcam | ab89901 | 1:300 dilution used |
| Square Wave Electroporator CUY21SC | Nepa Gene | CUY664-10X15 | |
| Sterile PBS | Provided and autoclaved by technical unit | ||
| Sucrose | Millipore | 84100 | |
| Tweezer electrodes with variable gap | Nepa Gene | CUY650P5 |
Referanslar
- Tyser, R. C., et al. Calcium handling precedes cardiac differentiation to initiate the first heartbeat. eLife. 5, e17113(2016).
- Tyser, R. C. V., et al. Characterization of a common progenitor pool of the epicardium and myocardium. Science. 371 (6533), 2986(2021).
- Sendra, M., Domínguez, J., Torres, M., Ocaña, O. Dissecting the complexity of early heart progenitor cells. J Cardiovasc Dev Dis. 9 (1), 5(2021).
- Ivanovitch, K., Temiño, S., Torres, M. Live imaging of heart tube development in mouse reveals alternating phases of cardiac differentiation and morphogenesis. eLife. 6, e30668(2017).
- Ai, D., et al. Canonical Wnt signaling functions in second heart field to promote right ventricular growth. PNAS. 104 (22), 9319-9324 (2007).
- Zimmerman, M. S., et al. regional, and national burden of congenital heart disease, 1990-2017: A systematic analysis for the Global Burden of Disease Study 2017. Lancet Chil Adolesc Heal. 4 (3), 185-200 (2020).
- Xin, M., Olson, E. N., Bassel-Duby, R. Mending broken hearts: Cardiac development as a basis for adult heart regeneration and repair. Nat Rev Mol Cell Biol. 14 (8), 529-541 (2013).
- Porrello, E. R., et al. Transient regenerative potential of the neonatal mouse heart. Science. 331 (6020), 1078-1080 (2011).
- Cao, J., Poss, K. D. The epicardium as a hub for heart regeneration. Nat Rev Cardiol. 15 (10), 631-647 (2018).
- Zhou, B., et al. Adult mouse epicardium modulates myocardial injury by secreting paracrine factors. JCI. 121 (5), 1894-1904 (2011).
- Van Wijk, B., Gunst, Q. D., Moorman, A. F. M., Van Den Hoff, M. J. B. Cardiac regeneration from activated epicardium. PLOS One. 7 (9), e44692(2012).
- Hesse, J., et al. Single-cell transcriptomics defines heterogeneity of epicardial cells and fibroblasts within the infarcted murine heart. eLife. 10, e65921(2021).
- Streef, T. J., Smits, A. M. Epicardial contribution to the developing and injured heart: Exploring the Cellular composition of the epicardium. Front Cardiovasc Med. 8, 750243(2021).
- Sanchez-Fernandez, C., et al. Understanding epicardial cell heterogeneity during cardiogenesis and heart regeneration. J Cardiovasc Dev Dis. 10 (9), 376(2023).
- Quijada, P., et al. Coordination of endothelial cell positioning and fate specification by the epicardium. Nat Commun. 12 (1), 4155(2021).
- Mantri, M., et al. Spatiotemporal single-cell RNA sequencing of developing chicken hearts identifies interplay between cellular differentiation and morphogenesis. Nat Commun. 12 (1), 1771(2021).
- Paul, S., Zhang, X., He, J. Q. Homeobox gene Meis1 modulates cardiovascular regeneration. Semin Cell Dev Biol. 100, 52-61 (2020).
- Stankunas, K., et al. Pbx/Meis deficiencies demonstrate multigenetic origins of congenital heart disease. Circ Res. 103 (7), 702-709 (2008).
- Liu, Y., et al. Transcription factor Meis1 act as a new regulator of ischemic arrhythmias in mice. J Adv Res. 39, 275-289 (2022).
- Behringer, R. Manipulating the mouse embryo: A laboratory manual. , Cold Spring Harbor Lab Press. Cold Spring Harbor, New York. (2014).
- Wong, M. D., et al. 4D atlas of the mouse embryo for precise morphological staging. Development. 142 (20), 3583-3591 (2015).
- Morris, L., Klanke, C., Lang, S., Lim, F. Y., Crombleholme, T. TdTomato and EGFP identification in histological sections: Insight and alternatives. Biotech Histochem. 85 (6), 379-387 (2010).
- Schiaffino, S., Rossi, A. C., Smerdu, V., Leinwand, L. A., Reggiani, C. Developmental myosins: expression patterns and functional significance. Skelet. Muscle. 5 (1), 22(2015).
- Eissa, N., et al. Stability of reference genes for messenger RNA quantification by real-time pcr in mouse dextran sodium sulfate experimental colitis. PLOS One. 11 (5), e0156289(2016).
- Livak, K. J., Schmittgen, T. D. Analysis of relative gene expression data using real-time quantitative PCR and the 2−ΔΔCT method. Methods. 25 (4), 402-408 (2001).
- Lai, S. R., Andrews, L. G., Tollefsbol, T. O. RNA interference using a plasmid construct expressing short-hairpin RNA. Methods Mol Biol. 405, 31-37 (2007).
- Carmona, R., Barrena, S., López Gambero, A. J., Rojas, A., Muñoz-Chápuli, R. Epicardial cell lineages and the origin of the coronary endothelium. FASEB J. 34 (4), 5223-5239 (2020).
- Gittenberger-de Groot, A. C., Vrancken Peeters, M. P. F. M., Mentink, M. M. T., Gourdie, R. G., Poelmann, R. E. Epicardium-derived cells contribute a novel population to the myocardial wall and the atrioventricular cushions. Circ Res. 82 (10), 1043-1052 (1998).
- Chong, Z. X., Yeap, S. K., Ho, W. Y. Transfection types, methods and strategies: A technical review. Peer J. 9, e11165(2021).
- Kałużna, E., Nadel, A., Zimna, A., Rozwadowska, N., Kolanowski, T. Modeling the human heart ex vivo-Current possibilities and strive for future applications. JTERM. 16 (10), 853-874 (2022).
- Aguilera-Castrejon, A., et al. Ex utero mouse embryogenesis from pre-gastrulation to late organogenesis. Nature. 593 (7857), 119-124 (2021).
- Dyer, L. A., Patterson, C. A novel ex vivo culture method for the embryonic mouse heart. J Vis Exp. (75), e50359(2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır