Method Article
마우스 배아 심장에서 유전자 전달을 위한 효율적인 transgenesis 접근법
요약
이 프로토콜은 발달 중인 마우스 심장에서 심장 세포의 전기천공법 기반 형질전환(transgenesis)을 위한 상세한 방법론적 프레임워크를 제시합니다. 여기에 제공된 비디오 자산은 이 다재다능한 기술을 쉽게 배울 수 있습니다.
초록
포유류의 심장은 매우 다양한 전구 세포 집단을 통해 발달 중에 형성되는 복잡한 기관입니다. 이 선조들의 기원, 모집 시기, 그리고 운명은 이 기관의 적절한 발달에 매우 중요하다. 심장의 형태 형성을 관장하는 분자 메커니즘은 선천성 심장 질환과 배아 심장 재생의 발병 기전을 이해하는 데 필수적입니다. 이러한 메커니즘을 조사하기 위한 고전적 접근법은 심장 발달 중 특정 유전자의 기능을 평가하기 위해 형질전환 마우스의 생성을 사용했습니다. 그러나 마우스의 유전자 변형은 복잡하고 시간이 많이 걸리는 과정으로, 심장 발달 중 특정 유전자의 역할을 평가하기 위해 수행할 수 없는 경우가 많습니다. 이 문제를 해결하기 위해 당사는 마우스 배아 심장의 효율적인 전기천공법 및 배양을 위한 프로토콜을 개발하여 일시적인 유전자 변형을 통해 심장 발달에 관여하는 유전자의 기능 향상 또는 상실 효과를 신속하게 평가할 수 있도록 했습니다. 이 방법론을 사용하여 배아 심장에서 Meis1을 성공적으로 과발현시켰으며, 심외막 세포 형질주입을 선호하여 이 기술의 능력을 입증했습니다.
서문
심장은 배아 발달 과정에서 형성되는 첫 번째 기관입니다. 이 과정에는 배아의 뚜렷한 영역에서 온 전구 세포의 다양한 집단의 시공간 조정이 포함됩니다. 이 모든 것은 발달 중인 심장이 계속 뛰고 기능하는 동안 발생하며, 심장 형성에 필요한 놀라운 조정이 강조됩니다 1,2,3. 심장의 중요한 역할을 감안할 때, 세포 및 분자 수준에서의 엄격한 조절은 심장의 적절한 형성을 위해 필수적입니다 4,5. 심장 발달을 조절하는 메커니즘을 규명하는 것은 전 세계적으로 상당한 수의 환자에게 영향을 미치는 선천성 심장 질환을 밝히는 데 중요하기 때문에 매우 흥미롭습니다6. 또한, 출생 후 포유류의 심장은 성인기에 상실되거나 방해받은 재생 능력을 유지하기 때문에 심장 발달을 이해하는 것은 심장 재생을 해독하는 데 중추적인 역할을 합니다 7,8. 따라서 심장 발달의 분자 조절 인자를 해부하는 것은 선천성 심장 질환 및 심장 재생에 대한 연구 노력을 발전시키는 데 필수적입니다.
이 목표를 달성하기 위해 심장 발달 및 재생에서 심외막의 역할을 조사하는 데 점점 더 많은 관심이 쏠리고 있다9. 심외막은 포유류 심장의 가장 바깥층을 구성하는 중피 조직의 얇은 층입니다(그림 1). 최근 연구에 따르면 심장 손상 중 심외막의 중요성이 밝혀졌으며, 이 조직이 영향을 받는 부위의 심근세포에 증식 신호를 보내 손상을 완화할 수 있음을 밝혔습니다10,11. 심외막의 중요성에도 불구하고 추가적인 분자 연구를 수행하는 것은 엄청난 이질성으로 인해 어려움을 겪고 있습니다. 단일 세포 RNAseq 실험은 뚜렷한 전사체 서명 12,13,14,15,16을 가진 여러 세포 하위 집단을 수용하는 심외막의 이질성을 밝혀냈습니다. 따라서, 심장 발달의 잠재적 조절자를 스크리닝하는 전략은 심외막 전구 세포의 다양성을 수용해야 합니다.
이러한 의미에서 유전자 변형에 대한 마우스 모델의 적합성은 심장 발달에 중요한 수많은 유전자의 식별을 용이하게 하여 특정 유전자의 GOF(Gain-of-Function) 또는 LOF(Loss-of-Function)를 가진 돌연변이 계통의 생성을 가능하게 했습니다. 그러나 이러한 접근 방식은 상당한 시간과 실험 자원의 투자를 의미합니다. 따라서 많은 수의 후보 유전자의 역할을 평가할 때 실용적이지 않습니다. 게다가, 발달 유전자는 종종 다른 조직에서 다원성 기능을 발휘하거나 초기 배아 발달에 필요하여 특정 과정에서 발달에 대한 기여도를 해석하는 데 어려움을 겪습니다. 특정 구조나 발달 시점에서 유전자 기능을 표적으로 삼는 것이 가능하지만, 이를 위해서는 일반적으로 생성하기 어렵거나 일반적으로 사용할 수 없는 더 복잡한 유전자 구조를 사용해야 합니다.
이러한 한계를 극복하기 위해 우리는 일시적인 유전자 변형을 위해 쥐 배아 심장을 전기화하는 방법론을 제시합니다(그림 2). 체외 배양 및 형광 활성화 세포 분류(FACS)와 결합된 이 전략은 심장 발달 및 재생에 관여하는 잘 특성화된 유전자인 Meis1의 일시적인 GOF를 통해 그 능력을 입증합니다 17,18,19. 이 기사에서는 이 방법론의 다른 잠재적 응용 분야도 살펴보고, 장점과 한계에 대해 논의하며, 유전자 발현을 일시적으로 조절하기 위한 기존 프로토콜과 비교합니다. 우리는 제시된 프레임워크와 시각적 예가 발달 및 질병 중 심외막 생물학에 대한 이해를 향상시킬 것이라고 믿습니다.
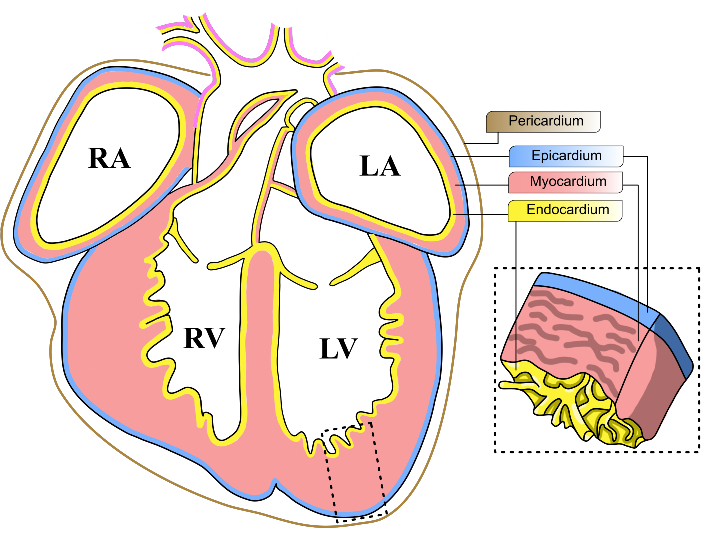
그림 1: 쥐의 배아 심장층. E13-14 쥐 배아 심장의 관상도 개략도. 심장의 세 가지 주요 세포층은 노란색(심내막), 빨간색(심근), 파란색(심외막)으로 표시됩니다. 심낭은 갈색 선으로 표시됩니다. 심장의 4 개의 방은 좌심실, LV 로 약칭됩니다. RV, 우심실; LA, 왼쪽 심방; RA, 우심방. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 심장 전기천공법 프로토콜의 개략도. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
프로토콜
모든 동물 시술은 CNIC 동물 실험 윤리 위원회의 승인을 받았으며 Real Decreto 53/2013에 따라 스페인 법에 의해 시행되는 EU 지침 2010/63EU 및 권고안 2007/526/EC를 포함한 현행 법률을 준수했습니다. 이 프로토콜을 위해 15-21주 된 암컷 야생형 CD-1 마우스를 사용하였다. 사용된 동물, 시약 및 장비에 대한 자세한 내용은 재료 표에 나열되어 있습니다.
1. 플라스미드 및 도구 준비
- 먼저 최종 농도 1μg/μL의 얼음에 원하는 플라스미드 DNA를 첨가하여 전기천공법 혼합물을 준비합니다. 그런 다음 6 % 최종 농도 (PBS에 용해)의 자당, 0.01 %의 생체 적합성 염료를 첨가하고 최종 부피가 30 μL가 될 때까지 PBS로 완성하여 혼합물을 완성합니다.
참고: 샘플당 약 1-2μL의 전기천공법 혼합물이 사용됩니다. 실험의 샘플 수에 따라 electroporation 혼합물의 비율을 조정합니다. 전기천공법용 DNA는 최적의 안정성과 최소한의 오염 물질을 보장하기 위해 박테리아 배양에서 정제해야 함을 기억하십시오. 본 연구에 사용된 plasmid에 대한 자세한 내용은 대표 결과 섹션을 참조하십시오. - Dulbecco's Modified Eagle Medium(DMEM)에 소 태아 혈청(FBS) 10%, Hepes 완충액 2%, 페니실린/스트렙토마이신 1%를 보충하여 성장 배지를 준비합니다. 사용할 때까지 배지를 37°C의 인큐베이터에 보관하십시오. 또한 성장 배지와 함께 37°C에서 1x PBS를 데웁니다.
- 다음 조건에서 피펫 풀러를 사용하여 20μm 직경의 유리 모세관을 늘려 바늘을 준비합니다: 열 = 550; 잡아당기기 = 100; 속도 = 250; 시간 = 120. 당김 후 최종 직경은 대략 5-8μm 사이여야 합니다.
- 900 ms 간격으로 40 V에서 50 ms 사이클로 electroporator 파라미터를 설정합니다. 전극, 구강 피펫 및 뭉툭한 바늘을 준비합니다(그림 3A). 피펫에 바늘을 장착하여 DNA를 로드합니다(그림 3A).
2. 배아 절개 및 심장 적출
- 야생형 CD-1 마우스 사이에 교배를 설정합니다. 다음날 아침, 질 마개를 보이는 암컷을 선택하고 이 시간을 배아일 E0.5로 기록합니다. 배아 일째 E12-12.5에 자궁 경부 탈구에 의해 동물을 안락사시킵니다(제도적으로 승인된 프로토콜에 따름).
- 마우스에서 자궁을 조심스럽게 추출하여 마른 종이 타월에 넣습니다. 그런 다음 가위를 사용하여 가위 끝을 중간 쪽에 삽입하고 칼날의 가장자리를 전체 길이로 천천히 통과시켜 자궁을 자릅니다. deciduae를 노출시키고 성장 매체로 옮깁니다. 자세한 내용은 Behringer et al.20의 작업을 참조하십시오.
- 배아를 추출하기 위해 deciduae를 해부한 다음 배아를 따뜻한 성장 매체가 있는 60mm 페트리 접시에 넣습니다. 가는 집게를 사용하여 배아의 꼬리와 머리를 조심스럽게 잘라 몸통만 남게 합니다. 배아의 단계는 Wong et al.21에 의해 설명된 바와 같이 해부학적 특징을 평가하여 확인할 수 있습니다.
- 그런 다음 심장이나 폐동맥 및 대동맥을 손상시키지 않고 배아의 몸통에서 가능한 한 많은 조직을 조심스럽게 제거하십시오. 심장이 노출되면 즉시 새롭고 따뜻한 성장 배지에 넣고 전기천공법까지 37°C의 인큐베이터에 보관합니다.
알림: 심장의 온도를 유지하는 것은 생존에 매우 중요합니다. 매체가 항상 따뜻한지 확인하고 5-10분마다 교체하십시오. 반면에, 샘플은 무균 상태를 유지하지 않고 취급할 수 있는데, 이는 절차의 효율성에 영향을 미치지 않기 때문입니다. 성장 배지에는 항생제가 포함되어 있습니다.
3. 심장 전기천공법 및 체외 배양
- 약 10 μL의 플라스미드 혼합물(1.1단계에서 준비)을 구강 피펫으로 조심스럽게 흡입하여 바늘에 로드합니다.
- 37°C로 데워진 멸균 1x PBS가 있는 깨끗한 60mm 페트리 접시에 넣어 전기천공법을 위한 단일 심장을 준비합니다. 접시를 해부 현미경 아래에 놓습니다(그림 3A).
- 양극과 음극 사이의 거리를 약 4mm로 조정하여 전극을 준비합니다(그림 3B).
참고: 4mm는 이 작업에 사용된 전극에 E12.5 마우스 하트가 들어가는 조리개 거리입니다. 다양한 표본 크기 또는 전극 사양에 따라 이 거리를 변경하는 것을 고려하십시오. - 입 피펫에 바늘을 넣어 심장의 가장 표층에 부드럽게 구멍을 뚫습니다. 플라스미드 혼합물 1-2 μL를 조심스럽게 피펫하고 바늘을 제거합니다. 최적의 침투를 보장하고 전기천공된 셀의 수를 확장하기 위해 여러 주입을 수행할 수 있습니다.
- 심장이 양쪽 극 사이에 위치하도록 전극을 제자리에 고정합니다(그림 3C). 그런 다음 위에 명시된 조건으로 심장을 전기시킵니다.
알림: 최대 electroporation 효율을 보장하기 위해 전극의 극성을 전환하고 다른 펄스를 제공할 수 있습니다. - 전기천공된 심장을 1mL의 성장 배지가 들어 있는 새로운 12웰 플레이트로 옮기고 37°C, 5% CO2에 놓습니다.
- 실험의 모든 샘플이 전기 천공될 때까지 3.1-3.6단계를 반복합니다. 마지막으로, 모든 심장을 37 ° C, 5 % CO2 의 인큐베이터에서 24 시간 동안 또는 분석 할 때까지 배양합니다.
참고: 우리 손에서 심장은 명백한 악화 징후 없이 최대 48시간 동안 배양 상태로 둘 수 있습니다(보충 영화 1; 보충 영화 2; 보충 그림 1).
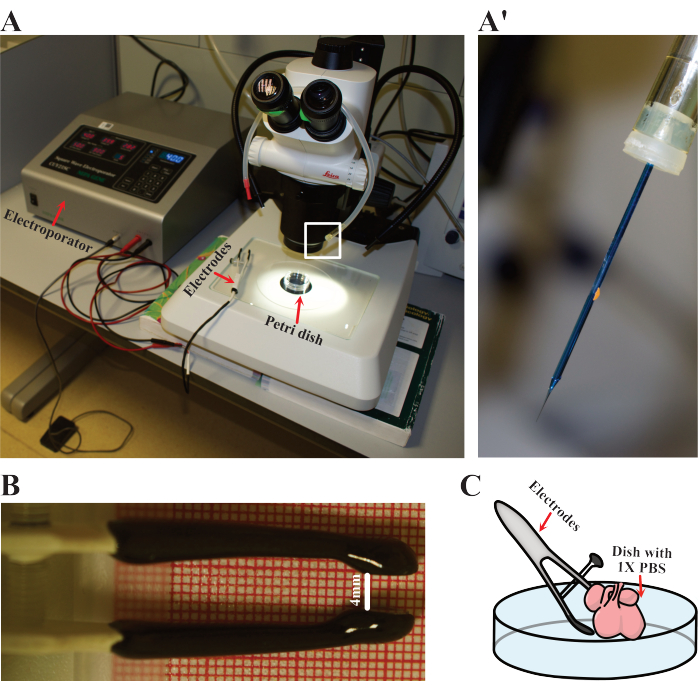
그림 3: Electroporation 설정. (A) electroporation에 사용되는 설정. 빨간색 화살표는 심장이 전기천공되는 전기포레이터, 전극 및 페트리 접시를 나타냅니다. (ᅡ') (A)에서 흰색 사각형으로 강조 표시된 electroporation 바늘의 세부 사항을 닫습니다. (B) E12.5 심장에 사용된 전극의 조정된 거리에 대한 세부 정보. (C) electroporation의 개략적인 표현. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
4. 세포 분류 및 면역조직화학 분석
- 샘플의 세포 분류 분석을 위해 400 μL의 liberase (5 mg/ml), 300 μL의 dispase (0.1 g/mL), 4 μL의 CaCl2 (0.4 μM), 50 μL의 MgCl2 (5 μM)를 혼합하여 조직을 해리시키고 10 mL의 DMEM까지 완료합니다. 사용할 때까지 얼음 위에 두십시오. 각 심장에는 약 1mL의 소화 배지가 필요합니다. 샘플의 수에 따라 부피를 조정합니다.
참고: 면역조직화학을 위해 4% PFA 1.5mL에 심장을 RT에서 2시간 동안 또는 4°C에서 밤새 직접 고정합니다. 다음 날, PBS로 심장을 3번 세척하고 다운스트림 조직학 및 면역염색 절차를 진행합니다. 자세한 면역조직화학 프로토콜은 Morris et al.22를 참조하십시오. - 배양 중인 각 심장을 얼음처럼 차가운 소화 배지 1mL가 들어 있는 새 튜브로 옮깁니다.
- 해리를 촉진하기 위해 주사기로 3-4 회 부드럽게 플레저를 적용하여 조직을 자르고 37 ° C, 600 rpm의 핫 플레이트에서 45 분 동안 즉시 배양합니다.
- 70μm 세포 여과기를 통해 분해 혼합물을 여과하여 새 튜브에 넣고 중력 흐름에 의해 비워집니다. 그런 다음 pass-through 부피를 구출하고 40μm 세포 여과기를 사용하여 새 50mL 튜브에 다시 여과합니다.
- 500 μL의 소 태아 혈청(FBS)을 추가하고 Cold DMEM을 사용하여 최대 30mL까지 완성합니다.
- 혼합물을 240 x g 에서 실온에서 10분 동안 원심분리합니다.
- 상층액을 버리고 50mL 튜브를 종이 타월에 거꾸로 올려 완전히 건조시킵니다.
참고: 이것은 세포 펠릿을 동결하여 실험을 일시 중지할 수 있는 편리한 포인트입니다. 그렇다면 FBS에서 10% DMSO로 세포를 재현탁하고 -80°C에서 보관하십시오. - 세포 분류를 위해 300μL의 선별 완충액(PBS에서 1% FBS, 1% 페니실린/스트렙토마이신)에 세포를 재현탁시키고 0.3μL의 DAPI(1000x)를 추가합니다. 셀 정렬을 수행합니다.
결과
관련 심장 발달 조절인자에 대한 GOF(gain-of-function) 실험을 수행하는 데 있어 이 기술의 효과를 입증하기 위해 Meis1 전사 인자를 과발현하는 구조체를 전기천공했습니다. 이를 위해 E9.5 배아에서 RNA를 추출하고 역전사를 수행하여 상보적 DNA(cDNA)를 얻었습니다. cDNA를 주형으로 사용하여 Meis1 코딩 서열을 pCAG 발현 플라스미드(이하 pCAG::Meis1)로 클로닝하고(보충 표 1) 구성적 GFP 발현 플라스미드(pCAG::GFP)를 대조군으로 사용하였다. 그런 다음 pCAG::GFP로만 또는 pCAG::Meis1과 함께 심장을 전기천공했습니다.
전기천공법(hpe) 후 24시간 후, 심장은 박동하고 양호한 상태로 보였다(그림 4A; 보충 영화 1; 보충 영화 2). 전기천공된 세포의 생존력을 평가하기 위해 caspase 3의 면역조직화학적 염색을 통해 세포사멸을 분석했습니다. 심장 내에서 일부 양성 세포가 검출되었지만, 전기천공된 세포의 대부분이 위치한 심근이나 심외막 모두 세포사멸의 영향을 받지 않는 것으로 밝혀졌습니다(보충 그림 1C). 형광 활성을 평가했을 때 심장의 거의 모든 4개 챔버에서 모자이크 GFP 신호가 관찰되었으며, 이는 이 프로토콜이 대부분의 심장 구조에 도달할 수 있음을 나타냅니다(그림 4A). 어떤 심장 세포 유형이 전기천공되었는지 확인하기 위해 pCAG::GFP-전기천공법 심장을 심외막, WT12 및 심근, MF2023의 마커에 대해 면역염색한 다음 컨포칼 현미경을 사용하여 이미지화했습니다(그림 4B). 대부분의 GFP+ 세포는 심장의 외부 영역에 우선적으로 위치했으며, 이는 주로 WT1 신호와 일치했으며, 이는 이 방법이 심외막 세포에 도달하는 데 가장 효율적임을 나타냅니다(그림 4B, 흰색 화살촉).
반면에, pCAG::Meis1-전기천공법 또는 대조군(pCAG::GFP만 해당) 심장을 해리하고, 프로토콜의 4단계에서 설명한 대로 전체 장기에서 GFP+ 세포를 분리하기 위해 세포를 형광 활성화 세포 분류(FACS)를 실시했습니다. 분류된 세포에서 RNA를 추출하고, 형질주입된 세포에서 Meis1의 발현 수준을 평가하기 위해 역전사 정량 PCR(RT-qPCR)을 수행했습니다(그림 4C, 보충 표 1). 총 Meis1 유전자 발현은 마우스 하우스키핑 유전자 Eef2(24)의 발현 수준을 사용하여 정규화하고, 상대 유전자 발현은 ΔΔCt 방법(25)을 사용하여 계산하였다. pCAG::Meis1 플라스미드로 전기천공된 심장에서 pCAG::GFP 플라스미드만 있는 심장에 비해 Meis1 RNA 수준의 상당한 상향 조절이 관찰되었습니다(그림 4C). 따라서 이는 관심 유전자를 과발현하고 분자 결과를 해결할 수 있는 기술의 잠재력을 보여줍니다.

그림 4: 전기천공된 E12.5 심장 의 분자 분석.(A) 전기천공법 후 24시간 후 하나의 CAG::GFP-전기천공법 심장의 GFP 형광. 아래 이미지는 GFP 형광을 보여주고, 위 이미지는 GFP와 동일한 심장의 밝은 시야가 합쳐진 것을 보여줍니다. (B) 전기천공된 E12.5 심장 조직학적 절편의 면역형광. MF20은 심근세포를 표시하고 WT1은 심외세포를 표시합니다. 오른쪽 이미지는 흰색 사각형의 확대에 해당합니다. 흰색 화살촉은 심외막에 위치한 GFP+ 세포를 나타내며 대략 흰색 점선으로 구분됩니다. (C) pCAG::Meis1 또는 pCAG::GFP(대조군)로 전기천공된 심장의 RT-qPCR 분석. 각 점은 세 개의 심장을 합쳐 얻은 생물학적 복제를 나타냅니다. 전체적으로 qPCR 분석은 3개의 뚜렷한 생물학적 복제로 3회에 걸쳐 수행되었습니다. 통계 분석은 스튜던트 t-검정(*P < 0.05)을 사용하여 수행하였다. 스케일 바: 200 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 그림 1: 심장 전기천공법 효율 및 세포 생존율. (A) 전기천공법 후 24시간 또는 48시간(hpe)에 대조군 플라스미드 pCAG::GFP로 전기천공된 두 개의 별개의 E12.5 심장에서 GFP의 발현. GFP 신호 이미지는 동일한 심장의 명시야 이미지 위에 중첩되었습니다. (B) control pCAG::GFP로 전기천공된 24 hpe 및 48 hpe 심장의 GFP+ 세포 정량화. 점은 뚜렷한 샘플을 나타냅니다. 실선은 평균을 나타내고 오차 막대는 표준 편차를 나타냅니다. 두 조건 간에 유의한 차이는 관찰되지 않았습니다(비모수 t-검정; P > 0.9)를 참조하십시오. (C) 절단된 카스파아제 3 및 MF20에 대해 면역염색된 pCAG::GFP로 전기천공된 E12.5 심장의 컨포칼 이미지. 점선은 심장의 심근층을 나타냅니다. 오른쪽 이미지는 흰색 사각형에서 확대된 것입니다. 스케일 바: 100 μm. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 표 1: Primer 요약 및 염기서열. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 동영상 1: pCAG::GFP-전기천공 심장 24시간 후. 시술 후 24시간 후에 pCAG::GFP control plasmid로 전기천공된 심장 하나를 촬영한 동영상. 심장은 계속 뛰고 전기천공된 세포는 GFP 신호를 발현합니다. 이 영화를 다운로드하려면 여기를 클릭하십시오.
보충 동영상 2 : pCAG :: GFP- 48 시간 후 심장 전기 천공. 제어 pCAG::GFP, 전기천공법 후 48시간 후에 전기천공법으로 된 심장을 보여주는 동영상. 이 영화를 다운로드하려면 여기를 클릭하십시오.
토론
전반적으로, 여기에 설명된 방법론은 Meis1 과발현(그림 4C)에 의해 입증된 바와 같이 발달 중인 심외막(그림 4B)에서 형질전환 구조를 발현하기 위한 강력한 프레임워크를 제공합니다. 적절한 구조를 통해 이 프로토콜은 특정 유전자의 GOF(Gain-of-Function) 또는 LOF(Loss-of-Function)의 영향을 일시적으로 평가하는 데 사용할 수 있습니다. LOF는 RNA 간섭26을 통해 후보 유전자를 표적으로 하는 플라스미드를 transfection하여 기술에 구현할 수 있습니다. 유전자 GOF 또는 LOF의 신속한 평가는 특히 심외막 세포(12)의 큰 전사체 이질성을 고려할 때 특히 유리하며, 이는 각 후보 유전자를 개별적으로 평가하기 위해 형질전환 동물을 생성하는 것을 비실용적으로 만든다.
이 프로토콜은 체외 배양을 활용하기 때문에 측두엽 창 내에서 심외막 세포의 운명을 조사할 수 있는 가능성을 제공합니다. 발달 중인 심외막은 성인의 심장 내에서 뚜렷한 영역을 형성하는 데 중추적인 역할을 합니다 13,27,28; 따라서 심장 발달에 대한 기여도를 이해하는 것은 선천성 심장 기형의 기초를 해부하는 데 중요합니다. 이 기사에서 이 응용 프로그램에 대해 자세히 설명하지는 않지만, 프로토콜에 설명된 지침은 심외막의 향후 운명 매핑 연구에 잠재적으로 도움이 될 수 있습니다
현재 방법의 실용적인 유용성에도 불구하고 특정 제한 사항을 인정해야 합니다. 이 방법론은 일시적인 형질전환(transient transgenesis)에 의존하기 때문에, 플라스미드 발현은 시간이 지남에 따라 손실되거나 감소될 수 있으며, 이는 특정 발달 창구를 연구하기 위한 프로토콜의 범위를 제한할 수 있다29. 그러나, 이 학문에서는, GFP 과발현은 post-electroporation 배양 (48 hpe)의 전체 내구 동안 유지되었다. 또한, 현재 생체 외 배양 기술의 잠재적 한계는 특히 전기천공법 후 생체 외 배양이 어려워지는 경우 후기 배아 또는 출생 후 발달 단계를 평가하기 위한 방법의 적용 가능성을 방해합니다30. 비록 보다 정교한 체외 배아 배양 방법이 존재하지만31,32 연구자가 접근하기 어려운 장비의 사용을 필요로 할 수 있고 샘플의 생존을 보장하지 않을 수 있다.
여기에 제시된 프로토콜은 재현성을 향상시키기 위해 가능한 한 단순하게 설계되었지만, 성공을 위한 중요한 단계가 포함되어 있습니다. 첫째, 배아 절제는 전기천공법 후 장기의 생존을 위협할 수 있는 심장 손상을 최소화하기 위해 신중하고 신속하게 수행되어야 합니다. 이 단계에서는 최적의 해부 장비를 사용하는 것과 함께 특별한 주의를 기울이는 것이 좋습니다. 프로토콜의 또 다른 중요한 측면은 부적절한 플라스미드 주입이 바람직하지 않은 결과를 초래할 수 있으므로 전기천공법 자체를 수행하는 것입니다. 따라서 하나의 심장에 여러 번 주사하는 것이 바람직하며, 다소 피상적인 방식으로 검체를 주입하는 것이 장기 생존율을 높이는 데 도움이 될 수 있습니다. 마지막으로, 심장 처리 중 세포 해리는 세포 생존력을 극대화하기 위해 프로토콜에 제공된 시간을 준수하여 엄격하게 수행되어야 합니다.
결론적으로, 심장 형성의 핵심 유전자를 식별하는 것은 심장 선천성 질환 및 재생의 기본 메커니즘을 이해하는 데 중요합니다. 여기에서 확립된 방법론을 통해 발달 중인 심장에서 유전자 GOF(Gain-of-Function) 및 LOF(Loss-of-Function) 효과를 신속하게 스크리닝할 수 있습니다. 특정 한계를 인정하면서도, 이 방법은 다양한 발달 단계에 대한 외삽 또는 배아 심외막 세포의 운명을 매핑할 수 있는 상당한 잠재력을 보여줍니다. 이 기사에서 제공하는 시각적 지침을 통해 우리는 발달 중인 심외막의 엄청난 복잡성과 잠재력을 평가하기 위한 귀중한 도구 상자를 제공하는 것을 목표로 합니다.
공개
저자는 공개할 이해 상충이 없습니다.
감사의 말
이 연구는 스페인 Ministerio de Ciencia e Innovación의 보조금 RTI2018-097617-J-I00 및 Universidad de Jaén의 Acción 9, O.H.O. 보조금 PGC2018-096486-B-I00, EU Horizon 2020 프로그램의 보조금 H2020-MSCA-ITN-2016-722427의 지원을 받았습니다. JMG는 스페인 과학부와 Fundación Severo Ochoa(PRE2022-101884)의 박사 펠로우십의 지원을 받았습니다. CNIC와 CBMSO는 모두 스페인 과학부의 지원을 받으며, CNIC는 ProCNIC 재단의 지원을 받습니다.
자료
| Name | Company | Catalog Number | Comments |
| #55 Forceps | Dumont | 11295-51 | |
| 12-well Clear Flat Bottom Multiwell Cell Culture Plate | BD Falcon | 353043 | |
| 35 mm vise table | Grandado | SKU 8798771617573 | |
| 40 µm Cell Strainer | Fischer Scientific | 08-771-1 | |
| 50 mL tubes | BD Falcon | 352070 | |
| 70 µm Cell Strainer | Corning | CLS431751 | |
| Anti-GFP Policlonal Antibody | Invitrogen | A10262 | 1:1000 dilution used |
| Anti-Myosin 4 (MF20) Monoclonal Antibody | Invitrogen | 14-6503-82 | 1:500 dilution used |
| CD1 Wild Type mice | Provided by Animalary Unit (CNIC) | ||
| Cleaved Caspase-3 (Asp175) Antibody | Cell Signalling Technologies | 9661 | 1:400 dilution used |
| DAPI | Cell Signalling Technologies | 4083 | 1:1000 dilution used |
| Dispase/collagenase | Roche | 10269638001 | |
| Distilled water | |||
| DMEM - Dulbecco's Modified Eagle Medium | Gibco | 10313021 | |
| Fetal Bovine Serum | Invitrogen | 10438-026 | |
| Heracell 150i CO2 Incubator | Thermo Scientific | 51032720 | |
| Leica Stereoscopic Microscope S8AP0 | Leica | 11524102 | |
| Liberase | Roche | 5401119001 | |
| Micropipette Puller Model P-97 | Sutter Instrument | SU-P-97 | |
| pCAG expression plasmid | Addgene | #89689 | |
| Penicillin-streptomycin | Invitrogen | 15070-063 | |
| Petri dishes 35 × 10 mm | BD Falcon | 351008 | |
| Petri dishes 60 × 15 mm | BD Falcon | 353002 | |
| Phenol Red | Merck | P3532 | |
| Pipette tips | Reused from old laboratory equipment | ||
| Rat Serum culture embryo, male rats SPRAGUE DAWLEY RjHan SD | Janvier Labs | 9979 | |
| Recombinant anti-Wilms Tumor Protein 1 (WT1) Antibody | Abcam | ab89901 | 1:300 dilution used |
| Square Wave Electroporator CUY21SC | Nepa Gene | CUY664-10X15 | |
| Sterile PBS | Provided and autoclaved by technical unit | ||
| Sucrose | Millipore | 84100 | |
| Tweezer electrodes with variable gap | Nepa Gene | CUY650P5 |
참고문헌
- Tyser, R. C., et al. Calcium handling precedes cardiac differentiation to initiate the first heartbeat. eLife. 5, e17113(2016).
- Tyser, R. C. V., et al. Characterization of a common progenitor pool of the epicardium and myocardium. Science. 371 (6533), 2986(2021).
- Sendra, M., Domínguez, J., Torres, M., Ocaña, O. Dissecting the complexity of early heart progenitor cells. J Cardiovasc Dev Dis. 9 (1), 5(2021).
- Ivanovitch, K., Temiño, S., Torres, M. Live imaging of heart tube development in mouse reveals alternating phases of cardiac differentiation and morphogenesis. eLife. 6, e30668(2017).
- Ai, D., et al. Canonical Wnt signaling functions in second heart field to promote right ventricular growth. PNAS. 104 (22), 9319-9324 (2007).
- Zimmerman, M. S., et al. regional, and national burden of congenital heart disease, 1990-2017: A systematic analysis for the Global Burden of Disease Study 2017. Lancet Chil Adolesc Heal. 4 (3), 185-200 (2020).
- Xin, M., Olson, E. N., Bassel-Duby, R. Mending broken hearts: Cardiac development as a basis for adult heart regeneration and repair. Nat Rev Mol Cell Biol. 14 (8), 529-541 (2013).
- Porrello, E. R., et al. Transient regenerative potential of the neonatal mouse heart. Science. 331 (6020), 1078-1080 (2011).
- Cao, J., Poss, K. D. The epicardium as a hub for heart regeneration. Nat Rev Cardiol. 15 (10), 631-647 (2018).
- Zhou, B., et al. Adult mouse epicardium modulates myocardial injury by secreting paracrine factors. JCI. 121 (5), 1894-1904 (2011).
- Van Wijk, B., Gunst, Q. D., Moorman, A. F. M., Van Den Hoff, M. J. B. Cardiac regeneration from activated epicardium. PLOS One. 7 (9), e44692(2012).
- Hesse, J., et al. Single-cell transcriptomics defines heterogeneity of epicardial cells and fibroblasts within the infarcted murine heart. eLife. 10, e65921(2021).
- Streef, T. J., Smits, A. M. Epicardial contribution to the developing and injured heart: Exploring the Cellular composition of the epicardium. Front Cardiovasc Med. 8, 750243(2021).
- Sanchez-Fernandez, C., et al. Understanding epicardial cell heterogeneity during cardiogenesis and heart regeneration. J Cardiovasc Dev Dis. 10 (9), 376(2023).
- Quijada, P., et al. Coordination of endothelial cell positioning and fate specification by the epicardium. Nat Commun. 12 (1), 4155(2021).
- Mantri, M., et al. Spatiotemporal single-cell RNA sequencing of developing chicken hearts identifies interplay between cellular differentiation and morphogenesis. Nat Commun. 12 (1), 1771(2021).
- Paul, S., Zhang, X., He, J. Q. Homeobox gene Meis1 modulates cardiovascular regeneration. Semin Cell Dev Biol. 100, 52-61 (2020).
- Stankunas, K., et al. Pbx/Meis deficiencies demonstrate multigenetic origins of congenital heart disease. Circ Res. 103 (7), 702-709 (2008).
- Liu, Y., et al. Transcription factor Meis1 act as a new regulator of ischemic arrhythmias in mice. J Adv Res. 39, 275-289 (2022).
- Behringer, R. Manipulating the mouse embryo: A laboratory manual. , Cold Spring Harbor Lab Press. Cold Spring Harbor, New York. (2014).
- Wong, M. D., et al. 4D atlas of the mouse embryo for precise morphological staging. Development. 142 (20), 3583-3591 (2015).
- Morris, L., Klanke, C., Lang, S., Lim, F. Y., Crombleholme, T. TdTomato and EGFP identification in histological sections: Insight and alternatives. Biotech Histochem. 85 (6), 379-387 (2010).
- Schiaffino, S., Rossi, A. C., Smerdu, V., Leinwand, L. A., Reggiani, C. Developmental myosins: expression patterns and functional significance. Skelet. Muscle. 5 (1), 22(2015).
- Eissa, N., et al. Stability of reference genes for messenger RNA quantification by real-time pcr in mouse dextran sodium sulfate experimental colitis. PLOS One. 11 (5), e0156289(2016).
- Livak, K. J., Schmittgen, T. D. Analysis of relative gene expression data using real-time quantitative PCR and the 2−ΔΔCT method. Methods. 25 (4), 402-408 (2001).
- Lai, S. R., Andrews, L. G., Tollefsbol, T. O. RNA interference using a plasmid construct expressing short-hairpin RNA. Methods Mol Biol. 405, 31-37 (2007).
- Carmona, R., Barrena, S., López Gambero, A. J., Rojas, A., Muñoz-Chápuli, R. Epicardial cell lineages and the origin of the coronary endothelium. FASEB J. 34 (4), 5223-5239 (2020).
- Gittenberger-de Groot, A. C., Vrancken Peeters, M. P. F. M., Mentink, M. M. T., Gourdie, R. G., Poelmann, R. E. Epicardium-derived cells contribute a novel population to the myocardial wall and the atrioventricular cushions. Circ Res. 82 (10), 1043-1052 (1998).
- Chong, Z. X., Yeap, S. K., Ho, W. Y. Transfection types, methods and strategies: A technical review. Peer J. 9, e11165(2021).
- Kałużna, E., Nadel, A., Zimna, A., Rozwadowska, N., Kolanowski, T. Modeling the human heart ex vivo-Current possibilities and strive for future applications. JTERM. 16 (10), 853-874 (2022).
- Aguilera-Castrejon, A., et al. Ex utero mouse embryogenesis from pre-gastrulation to late organogenesis. Nature. 593 (7857), 119-124 (2021).
- Dyer, L. A., Patterson, C. A novel ex vivo culture method for the embryonic mouse heart. J Vis Exp. (75), e50359(2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유