Method Article
גישת טרנסגנזה יעילה להעברת גנים בלב העוברי של העכבר
In This Article
Summary
פרוטוקול זה מציג מסגרת מתודולוגית מפורטת לטרנסגנזה מבוססת אלקטרופורציה של תאי לב בהתפתחות לבבות עכברים. נכסי הווידאו המסופקים כאן יקלו על למידה של טכניקה רב-תכליתית זו.
Abstract
לב היונקים הוא איבר מורכב שנוצר במהלך ההתפתחות באמצעות אוכלוסיות מגוונות מאוד של תאי אב. מקורם, עיתוי גיוסם וגורלם של אבות אלה חיוניים להתפתחותו התקינה של איבר זה. המנגנונים המולקולריים השולטים במורפוגנזה של הלב חיוניים להבנת הפתוגנזה של מחלות לב מולדות והתחדשות לב עוברית. גישות קלאסיות לחקר מנגנונים אלה השתמשו ביצירת עכברים טרנסגניים כדי להעריך את תפקודם של גנים ספציפיים במהלך התפתחות הלב. עם זאת, טרנסגנזה של עכברים היא תהליך מורכב, גוזל זמן שלעתים קרובות לא ניתן לבצע כדי להעריך את תפקידם של גנים ספציפיים במהלך התפתחות הלב. כדי להתמודד עם זה, פיתחנו פרוטוקול לאלקטרופורציה יעילה ולתרבית של לבבות עובריים של עכברים, המאפשר טרנסגנזה חולפת להעריך במהירות את ההשפעה של רווח או אובדן תפקוד של גנים המעורבים בהתפתחות הלב. באמצעות מתודולוגיה זו, ביטאנו בהצלחה את Meis1 בלב העוברי, עם העדפה להתמרה של תאים אפיקרדיאליים, תוך הדגמת יכולות הטכניקה.
Introduction
הלב הוא האיבר הראשון שנוצר במהלך ההתפתחות העוברית. תהליך זה כרוך בתיאום מרחבי-זמני של אוכלוסיות שונות של תאי אב מאזורים שונים של העובר. כל זה קורה בזמן שהלב המתפתח ממשיך לפעום ולתפקד, תוך הדגשת הקואורדינציה יוצאת הדופן הנדרשת להיווצרותו 1,2,3. בהתחשב בתפקיד המכריע של הלב, ויסות הדוק ברמה התאית והמולקולרית חיוני להיווצרותו התקינה 4,5. זיהוי המנגנונים השולטים בהתפתחות הלב מעורר עניין רב, שכן הם חיוניים לפענוח הפרעות לב מולדות, המשפיעות על מספר ניכר של חולים ברחבי העולם6. יתר על כן, הבנת התפתחות הלב היא חיונית בפענוח התחדשות הלב, שכן לבבות יונקים לאחר לידה שומרים על יכולת התחדשות שאובדת או מעוכבת בבגרות 7,8. כתוצאה מכך, ניתוח הרגולטורים המולקולריים של התפתחות הלב הוא הכרחי כדי לקדם את מאמצי המחקר על מחלות לב מולדות והתחדשות לב.
במרדף אחר מטרה זו, יש התמקדות הולכת וגוברת בחקירת תפקידו של האפיקרדיום בהתפתחות הלבוהתחדשות 9. האפיקרדיום הוא שכבה דקה של רקמה מזותלית שמהווה את השכבה החיצונית ביותר של לב היונקים (איור 1). מחקרים אחרונים הראו את חשיבותו של אפיקרדיום במהלך פגיעה לבבית, וחשפו כי רקמה זו מסוגלת לשלוח אותות התפשטות לקרדיומיוציטים באזור הפגוע כדי למתן את הנזק10,11. למרות חשיבותו של אפיקרדיום, ביצוע חקירות מולקולריות נוספות אותגר על ידי ההטרוגניות העצומה שלו. ניסויי RNAseq חד-תאיים חשפו את ההטרוגניות של האפיקרדיום, המאכלס תת-אוכלוסיות תאים מרובות עם חתימות שעתוק ברורות 12,13,14,15,16. לפיכך, אסטרטגיה לסינון רגולטורים פוטנציאליים של התפתחות הלב צריכה להתאים למגוון תאי האב האפיקרדיאליים.
במובן זה, ההתאמה של מודל העכבר לשינוי גנטי הקלה על זיהוי גנים רבים החיוניים להתפתחות הלב, ואפשרה יצירת קווים מוטנטיים עם רווח של תפקוד (GOF) או אובדן תפקוד (LOF) של גנים ספציפיים. עם זאת, גישות אלה מרמזות על השקעה ניכרת של זמן ומשאבים ניסיוניים; לכן, הם אינם מעשיים בעת הערכת תפקידיהם של מספר רב של גנים מועמדים. מלבד זאת, גנים התפתחותיים לעיתים קרובות מפעילים פונקציות פליוטרופיות ברקמות שונות או נדרשים להתפתחות עוברית מוקדמת, מה שפוגע בפרשנות תרומתם להתפתחות בתהליך מסוים. בעוד שניתן לכוון את תפקוד הגנים במבנים ספציפיים או בנקודות זמן התפתחותיות, זה בדרך כלל דורש שימוש במבנים גנטיים מורכבים יותר, אשר יכולים להיות קשים ליצירה או שאינם זמינים בדרך כלל.
כדי להתגבר על המגבלות האלה, אנו מציגים מתודולוגיה לאלקטרופורציה של לבבות עובריים של עכברים עבור טרנסגנזה חולפת (איור 2). בשילוב עם תרבית ex vivo ומיון תאים המופעלים על ידי פלואורסצנטיות (FACS), אסטרטגיה זו מדגימה את יכולותיה באמצעות GOF חולף של Meis1, גן מאופיין היטב המעורב בהתפתחות לבוהתחדשות 17,18,19. במאמר זה נחקרים גם יישומים פוטנציאליים אחרים של מתודולוגיה זו, ונדונים יתרונותיה ומגבלותיה, וכן בהשוואה לפרוטוקולים קיימים לוויסות זמני של ביטוי גנים. אנו מאמינים שהמסגרת והדוגמאות החזותיות שהוצגו ישפרו את ההבנה של ביולוגיה של אפיקרדיום במהלך התפתחות ומחלות.
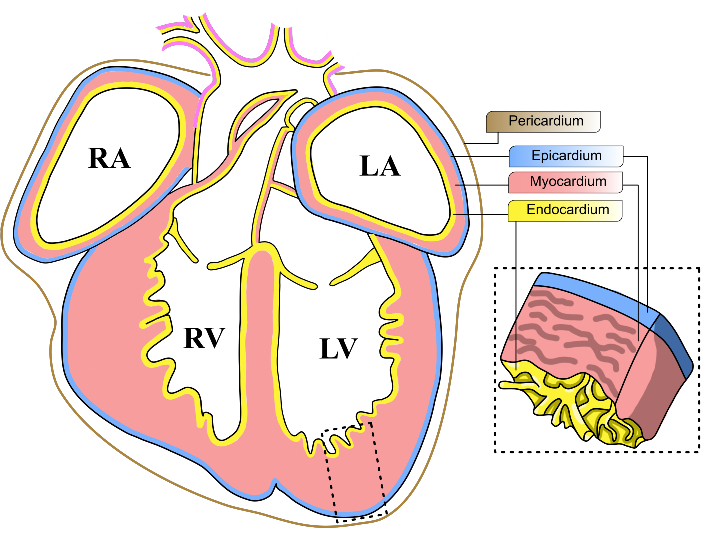
איור 1: שכבות לב עובריות של עכברים. תרשים סכמטי של תצוגה קורונלית של לב עוברי עכבר E13-14. שלוש השכבות התאיות העיקריות של הלב מיוצגות בצהוב (אנדוקרדיום), אדום (שריר הלב) וכחול (אפיקרדיום). קרום הלב מיוצג בקו חום. ארבעת חדרי הלב מקוצרים כ-LV, החדר השמאלי; RV, החדר הימני; לוס אנג'לס, אטריום שמאלי; RA, אטריום ימני. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 2: סקירה סכמטית של פרוטוקול אלקטרופורציה של הלב. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Protocol
כל הנהלים בבעלי חיים אושרו על ידי ועדת האתיקה של ניסויים בבעלי חיים של CNIC ותאמו את החקיקה הנוכחית, כולל הנחיית האיחוד האירופי 2010/63EU והמלצה 2007/526/EC, כפי שנאכפה על ידי החוק הספרדי תחת צו אמיתי 53/2013. עבור פרוטוקול זה, נקבות עכברי בר מסוג CD-1 בגילאי 15-21 שבועות הועסקו. פרטים על בעלי החיים, ריאגנטים וציוד בשימוש מפורטים בטבלת החומרים.
1. פלסמיד והכנת כלים
- ראשית, הכינו את תערובת האלקטרופורציה על ידי הוספת הדנ"א הפלסמיד הרצוי בקרח בריכוז סופי של 1 מיקרוגרם / μL. לאחר מכן, השלימו את התערובת על ידי הוספת סוכרוז בריכוז סופי של 6% (מומס ב-PBS), צבע תואם ביולוגית ב-0.01%, והשלימו עם PBS עד לנפח סופי של 30 מיקרוליטר.
הערה: בערך 1-2 μL של תערובת אלקטרופורציה משמש לכל דגימה. קנה מידה את הפרופורציות של תערובת האלקטרופורציה בהתאם למספר הדגימות בניסוי. יש לזכור כי יש לטהר DNA לאלקטרופורציה מתרבית חיידקים, תוך הבטחת יציבות אופטימלית ומינימום מזהמים. לפרטים נוספים על הפלסמידים ששימשו למחקר זה, עיין בסעיף התוצאות המייצגות. - הכינו מדיום גדילה על ידי תוספת מדיום הנשר המותאם של דולבקו (DMEM) עם 10% נסיוב בקר עוברי (FBS), 2% חיץ Hepes ו-1% פניצילין/סטרפטומיצין. שמור את המדיום באינקובטור ב 37 ° C עד לשימוש. בנוסף, חם 1x PBS ב 37 ° C, יחד עם מדיום הצמיחה.
- הכן את המחטים על ידי מתיחה נימי זכוכית בקוטר 20 מיקרומטר באמצעות מושך פיפטה בתנאים הבאים: חום = 550; משיכה = 100; מהירות = 250; זמן = 120. הקוטר הסופי לאחר המשיכה צריך להיות בערך בין 5-8 מיקרומטר.
- הגדר את פרמטרי האלקטרופורטור לחמישה מחזורים של 50 אלפיות השנייה ב- 40 וולט עם מרווחים של 900 אלפיות השנייה. הכינו את האלקטרודות, את פיפט הפה ואת המחט הקהה (איור 3A). ציידו את הצינור במחט כדי לטעון את הדנ"א (איור 3A).
2. דיסקציה של עוברים ושאיבת לב
- הגדר הכלאה בין עכברי CD-1 פראיים. למחרת בבוקר, בחר את הנקבות המציגות פקק נרתיקי וציין הפעם כיום E0.5 עוברי. יש להרדים את בעלי החיים ביום העוברי E12-12.5 על ידי פריקת צוואר הרחם (בהתאם לפרוטוקולים שאושרו במוסדות).
- בזהירות לחלץ את הרחם מן העכבר ומניחים אותו במגבת נייר יבש. לאחר מכן, חותכים את הרחם באמצעות מספריים עדינים על ידי החדרת קצה המספריים לצד המזומטריאלי ומעבירים לאט לאט את קצה הלהב לכל אורכו. לחשוף את המחליטים ולהעביר אותם למדיום הצמיחה. לפרטים נוספים, עיין בעבודתם של Behringer et al.20.
- לנתח את deciduae כדי לחלץ את העוברים, ולאחר מכן מניחים את העוברים בצלחת פטרי 60 מ"מ עם מדיום צמיחה חם. באמצעות מלקחיים עדינים, לחתוך בזהירות את הזנב ואת הראש של העובר, כך רק את תא המטען של הגוף נשאר. ניתן לאמת את שלב העוברים על ידי הערכת תכונות אנטומיות, כפי שתוארו על ידי וונג ואחרים.21.
- לאחר מכן, להסיר בזהירות רקמה רבה ככל האפשר מן תא המטען של העובר מבלי לפגוע בלב או את עורקי הריאה ואבי העורקים. לאחר שהלב נחשף, הניחו אותו מיד במדיום צמיחה חדש וחם ושמרו אותו באינקובטור בטמפרטורה של 37 מעלות צלזיוס עד להתחשמלות.
הערה: שמירה על חום הלב חיונית להישרדותו. ודא כי המדיום הוא תמיד חם ולהחליף אותו כל 5-10 דקות. מצד שני, ניתן לטפל בדגימות מבלי לשמור על סטריליות, שכן הדבר לא ישפיע על יעילות ההליך. יש לציין כי מדיום הגידול מכיל אנטיביוטיקה.
3. אלקטרופורציה בלב ותרבות ex vivo
- לטעון כ 10 μL של תערובת פלסמיד (מוכן בשלב 1.1) לתוך המחט על ידי שאיפה בזהירות עם פיפטה הפה.
- הכינו לב יחיד לאלקטרופורציה על ידי הנחתו בכלי פטרי נקי בקוטר 60 מ"מ עם PBS סטרילי 1x שחומם ל-37°C. הניחו את הצלחת מתחת למיקרוסקופ המנתח (איור 3A).
- הכינו את האלקטרודות על-ידי התאמת המרחק בין הקטבים החיוביים והשליליים לכ-4 מ"מ (איור 3B).
הערה: 4 מ"מ הוא מרחק הצמצם שבו לבבות עכבר E12.5 מתאימים לאלקטרודות המשמשות בעבודה זו. אנא שקול לשנות מרחק זה בהתבסס על גדלי דגימה שונים או מפרטי אלקטרודות שונים. - לנקב בעדינות את השכבה השטחית ביותר של הלב עם המחט בפיפט הפה. בזהירות צינור 1-2 μL של תערובת פלסמיד ולהסיר את המחט. ניתן לבצע זריקות מרובות כדי להבטיח חדירה אופטימלית, כמו גם להרחיב את מספר התאים האלקטרופורטים.
- החזיקו את האלקטרודות במקומן כך שהלב ממוקם בין שני הקטבים (איור 3C). לאחר מכן, אלקטרופורציה את הלב עם התנאים המפורטים לעיל.
הערה: כדי להבטיח יעילות אלקטרופורציה מקסימלית, ניתן להחליף את הקוטביות של האלקטרודות ולתת פולס נוסף. - מעבירים את הלב המחושל לצלחת חדשה בת 12 בארות המכילה 1 מ"ל של מדיום צמיחה ומניחים אותו על 37°C, 5% CO2.
- חזור על שלבים 3.1 עד 3.6 עד שכל הדגימות בניסוי יעברו אלקטרופורציה. לבסוף, לדגור על כל הלבבות באינקובטור ב 37 ° C, 5% CO2, במשך 24 שעות או עד ניתוח.
הערה: בידינו, ניתן להשאיר לבבות בתרבות עד 48 שעות ללא סימני הידרדרות נראים לעין (סרט משלים 1; סרט משלים 2; תרשים משלים 1).
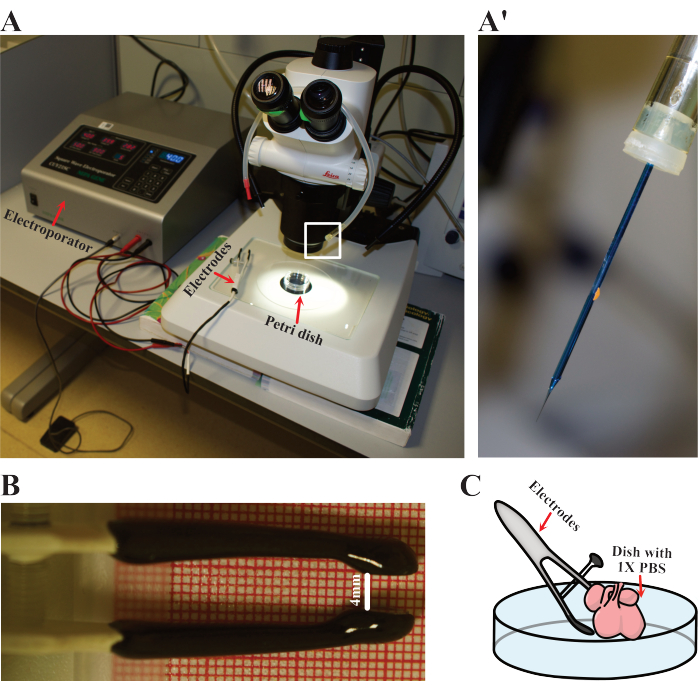
איור 3: מערך אלקטרופורציה. (A) התקנה המשמשת להתחשמלות. חיצים אדומים מציינים את האלקטרופורטור, האלקטרודות וצלוחית הפטרי שבה הלבבות מתחשמלים. (א') פירוט קרוב של מחט האלקטרופורציה כפי שמודגש ב-(A) על ידי המלבן הלבן. (B) פירוט המרחק המותאם של האלקטרודות המשמשות בלבבות E12.5. (C) ייצוג סכמטי של האלקטרופורציה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
4. מיון תאים וניתוח אימונוהיסטוכימיה
- לניתוח מיון התאים של הדגימות, הכינו מדיום עיכול כדי לנתק את הרקמה על ידי ערבוב יחד של 400 מיקרוליטר של ליבראז (5 מ"ג/מ"ל), 300 מיקרוליטר של דיספאס (0.1 גרם / מ"ל), 4 מיקרוליטר של CaCl2 (0.4 מיקרומטר), 50 מיקרוליטר של MgCl2 (5 מיקרומטר) והשלם עד 10 מ"ל של DMEM. יש לשמור על קרח עד לשימוש. כל לב זקוק לכ-1 מ"ל של מדיום עיכול. התאם את אמצעי האחסון בהתאם למספר הדגימות.
הערה: עבור אימונוהיסטוכימיה, קבע ישירות את הלבבות ב -1.5 מ"ל של 4% PFA למשך שעתיים ב- RT או לילה ב- 4 ° C. למחרת, שטפו את הלבבות 3x עם PBS והמשיכו להליכים היסטולוגיים וחיסוניים במורד הזרם. לקבלת פרוטוקול אימונוהיסטוכימיה מפורט, עיין במוריס ואחרים 22. - מעבירים כל לב בתרבית לצינור חדש המכיל 1 מ"ל של מדיום עיכול קר כקרח.
- כדי להקל על הדיסוציאציה, קוצצים את הרקמה על ידי החלת הנאה עדינה עם מזרק 3-4 פעמים ודגרים מיד בצלחת חמה ב 37 מעלות צלזיוס, 600 סל"ד במשך 45 דקות.
- סנן את תערובת העיכול דרך מסננת תאים של 70 מיקרומטר לתוך צינור חדש ותן לו להתרוקן על ידי זרימת כוח הכבידה. לאחר מכן, הצילו את נפח המעבר וסננו אותו שוב באמצעות מסננת תאים של 40 מיקרומטר לתוך צינור חדש של 50 מ"ל.
- הוסף 500 μL של סרום בקר עוברי (FBS) והשלם עד 30 מ"ל באמצעות DMEM קר.
- צנטריפוגה את התערובת ב 240 x גרם במשך 10 דקות בטמפרטורת החדר.
- השליכו את הסופרנאטנט והניחו את הצינור בנפח 50 מ"ל הפוך על מגבת נייר לייבוש מלא.
הערה: זוהי נקודה נוחה להשהות את הניסוי על ידי הקפאת גלולת התא. אם כן, להשעות מחדש את התאים עם 10% DMSO ב- FBS ולאחסן ב -80 ° C. - למיון תאים, השהה מחדש את התאים ב- 300 μL של מאגר מיון (1% FBS, 1% פניצילין/סטרפטומיצין ב- PBS) והוסף 0.3 μL של DAPI (1000x). בצע מיון תאים.
תוצאות
כדי להדגים את יעילותה של טכניקה זו בביצוע ניסויי רווח של תפקוד (GOF) עבור רגולטורים התפתחותיים רלוונטיים של הלב, התחשמל מבנה המבטא יתר על המידה את גורם השעתוק Meis1. כדי להשיג זאת, RNA הופק מעוברים E9.5, ושעתוק לאחור בוצע כדי לקבל DNA משלים (cDNA). באמצעות שימוש ב-cDNA כתבנית, רצף הקידוד Meis1 שוכפל (טבלה משלימה 1) לפלסמיד ביטוי pCAG (להלן pCAG::Meis1), בעוד שפלסמיד מכונן המבטא GFP (pCAG::GFP) שימש כבקרה. לאחר מכן הלבבות התחשמלו באמצעות pCAG::GFP בלבד או בשילוב עם pCAG::Meis1.
לאחר 24 שעות לאחר אלקטרופורציה (hpe), הלבבות פעמו ונראו במצב טוב (איור 4A; סרט משלים 1; סרט משלים 2). כדי להעריך את הכדאיות של התאים המחושמלים, אפופטוזיס נותח באמצעות צביעה אימונוהיסטוכימית של קספז 3. אף על פי שחלק מהתאים החיוביים התגלו בתוך הלב, לא שריר הלב ולא האפיקרדיום, שבו נמצאים רוב התאים המחושמלים, לא נמצאו מושפעים אפופטוזיס (איור משלים 1C). כאשר הפעילות הפלואורסצנטית הוערכה, נצפה אות פסיפס GFP כמעט בכל ארבעת חדרי הלב, מה שמצביע על כך שהפרוטוקול הזה מסוגל להגיע לרוב מבני הלב (איור 4A). כדי לקבוע אילו סוגי תאי לב עברו אלקטרופורציה, pCAG::GFP-electroporated hearts עברו הכתמה חיסונית כנגד סמנים של אפיקרדיום, WT12 ושריר הלב, MF2023, ולאחר מכן צולמו באמצעות מיקרוסקופ קונפוקלי (איור 4B). רוב תאי GFP+ היו ממוקמים באופן מועדף באזור החיצוני של הלב, אשר תאם במידה רבה עם אות WT1, מה שמצביע על כך ששיטה זו היא היעילה ביותר בהגעה לתאים אפיקרדיאליים (איור 4B, ראשי חץ לבנים).
מצד שני, לבבות pCAG::Meis1-electroporated או בקרה (pCAG::GFP בלבד) נותקו, והתאים היו נתונים למיון תאים המופעלים על ידי פלואורסצנטיות (FACS) כדי לבודד תאי GFP+ מהאיבר כולו, כמתואר בשלב 4 של הפרוטוקול. RNA הופק מהתאים הממוינים, ו-PCR כמותי של שעתוק לאחור (RT-qPCR) בוצע כדי להעריך את רמות הביטוי של Meis1 בתאים הנגועים (איור 4C, טבלה משלימה 1). ביטוי הגן הכולל Meis1 נורמל באמצעות רמות הביטוי של גן משק הבית של העכבר Eef224, וביטוי גנים יחסי חושב באמצעות שיטת ΔΔCt25. עלייה משמעותית ברמות הרנ"א של Meis1 נצפתה בלבבות שהתחשמלו עם פלסמיד pCAG::Meis1 בהשוואה ללבבות עם פלסמיד pCAG::GFP בלבד (איור 4C). לפיכך, זה מדגים את הפוטנציאל של הטכניקה לבטא יתר על המידה גנים של עניין ולטפל בתוצאות המולקולריות.

איור 4: אנליזה מולקולרית של לבבות E 12.5 מחושמלים.(A) פלואורסצנטיות GFP של CAG אחד::GFP-electroporated heart 24 שעות לאחר התחשמלות. התמונה התחתונה מציגה פלואורסצנטיות של GFP, ואילו התמונה העליונה מציגה מיזוג של GFP ושדה בהיר של אותו לב. (B) אימונופלואורסנציה של חתכים היסטולוגיים של לב E12.5 מחושמל. MF20 מסמן קרדיומיוציטים, בעוד WT1 מסמן תאים אפיקרדיאליים. התמונות מימין תואמות להתקרבויות של המלבן הלבן. ראשי חץ לבנים מציינים תאי GFP+ הממוקמים באפיקרדיום, כשהם מתוחמים בערך בקו לבן מקווקו. (C) ניתוח RT-qPCR של לבבות שהתחשמלו באמצעות pCAG::Meis1 או pCAG::GFP (בקרה). כל נקודה מייצגת העתק ביולוגי המתקבל מאיגום של שלושה לבבות יחד. בסך הכל, ניתוח qPCR בוצע בטריפליקטים עם שלושה שכפולים ביולוגיים נפרדים. הניתוח הסטטיסטי בוצע באמצעות מבחן t של סטודנט (*P < 0.05). פסי קנה מידה: 200 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
איור משלים 1: יעילות אלקטרופורציה של הלב וכדאיות התא. (A) ביטוי של GFP בשני לבבות E12.5 נפרדים שהתחשמלו עם פלסמיד הבקרה pCAG::GFP ב-24 שעות או 48 שעות לאחר אלקטרופורציה (hpe). תמונת האות GFP הונחה על גבי תמונת שדה בהיר של אותו לב. (B) כימות תאי GFP+ בלבבות 24 hpe ו-48 hpe שהתחשמלו עם pCAG בקרה::GFP. נקודות מציינות דגימות שונות; קווים מלאים מציינים את הממוצע, ואילו קווי שגיאה מציינים את סטיית התקן. לא נצפה הבדל משמעותי בין שני התנאים ( מבחן t לא פרמטרי; P > 0.9). (C) תמונה קונפוקלית של לב E12.5 שהתחשמל עם pCAG::GFP מוכתם חיסון כנגד קספז שסוע 3 ו-MF20. הקו המקווקו מייצג את שכבת שריר הלב של הלב. התמונות מימין מוגדלות מהמלבן הלבן. פסי קנה מידה: 100 מיקרומטר. אנא לחץ כאן להורדת קובץ זה.
טבלה משלימה 1: סיכום פריימר ורצפים. אנא לחץ כאן כדי להוריד קובץ זה.
סרט משלים 1: pCAG::GFP-electroporated לב לאחר 24 שעות. סרט לכידת לב אחד מחושמל עם pCAG::GFP בקרת פלסמיד 24 שעות לאחר ההליך. הלב ממשיך לפעום, ותאים מחושמלים מבטאים אותות GFP. אנא לחץ כאן כדי להוריד סרט זה.
סרט משלים 2: pCAG::GFP-electroporated לב לאחר 48 שעות. סרט המציג לב מחושמל עם pCAG בקרה::GFP, 48 שעות לאחר התחשמלות. אנא לחץ כאן כדי להוריד סרט זה.
Discussion
באופן כללי, המתודולוגיה המתוארת כאן מציעה מסגרת איתנה לביטוי מבנים טרנסגניים באפיקרדיום המתפתח (איור 4B), כפי שמודגם על-ידי ביטוי יתר של Meis1 (איור 4C). עם המבנים המתאימים, פרוטוקול זה יכול לשמש כדי להעריך באופן זמני את ההשפעה של רווח של תפקוד (GOF) או אובדן תפקוד (LOF) של גן מסוים. LOF יכול להיות מיושם בטכניקה על ידי הדבקת פלסמיד המכוון לגן מועמד באמצעות הפרעות RNA26. ההערכה המהירה של הגן GOF או LOF מועילה במיוחד, במיוחד בהתחשב בהטרוגניות התעתיק הגדולה של תאים אפיקרדיאליים12, מה שהופך את זה לבלתי מעשי ליצור בעלי חיים טרנסגניים כדי להעריך כל גן מועמד בנפרד.
מכיוון שפרוטוקול זה משתמש בתרבית ex vivo, הוא מציע את האפשרות לחקור את גורלם של תאים אפיקרדיאליים בתוך חלון זמן. האפיקרדיום המתפתח ממלא תפקיד מרכזי בעיצוב אזורים מובחנים בלב הבוגר 13,27,28; לפיכך, הבנת תרומתו להתפתחות הלב היא אינסטרומנטלית בניתוח הבסיס למומים מולדים בלב. בעוד מאמר זה אינו מתעמק ביישום זה, ההנחיות המתוארות בפרוטוקול עשויות להיות מועילות למחקרים עתידיים של מיפוי גורל של אפיקרדיום
למרות התועלת המעשית של השיטה הנוכחית, יש להכיר במגבלות מסוימות. מכיוון שמתודולוגיה זו מסתמכת על טרנסגנזה חולפת, ביטוי פלסמיד יכול ללכת לאיבוד או להצטמצם עם הזמן, מה שמגביל את טווח הפרוטוקול לחקר חלון התפתחותי ספציפי29. עם זאת, במחקר זה, ביטוי יתר של GFP נשמר לאורך כל תקופת התרביות שלאחר אלקטרופורציה (48 hpe). בנוסף, מגבלות פוטנציאליות בטכנולוגיות תרביות ex vivo הנוכחיות מעכבות את ישימות השיטה להערכת שלבי התפתחות עובריים מאוחרים או לאחר הלידה, במיוחד כאשר תרבית ex vivo לאחר אלקטרופורציה הופכת למאתגרת30. למרות שקיימות שיטות מתוחכמות יותר של תרבית עוברים ex vivo 31,32, הן עשויות לדרוש שימוש בציוד פחות נגיש לחוקרים וייתכן שלא יבטיח את הישרדות הדגימה.
בעוד שהפרוטוקול המוצג כאן נועד להיות פשוט ככל האפשר כדי לשפר את יכולת השחזור, הוא כולל צעדים קריטיים החיוניים להצלחה. ראשית, יש לבצע דיסקציה של העובר בזהירות ובמהירות כדי למזער את הנזק ללב, מה שעלול לסכן את הישרדות האיבר לאחר ההתחשמלות. טיפול מיוחד בשלב זה, יחד עם שימוש בציוד דיסקציה אופטימלי, מומלץ מאוד. היבט קריטי נוסף של הפרוטוקול הוא ביצוע האלקטרופורציה עצמה, שכן הזרקת פלסמיד לא מספקת עלולה לגרום לתוצאות לא רצויות. לכן, מומלץ לבצע זריקות מרובות על לב אחד, והזרקת הדגימה באופן שטחי למדי יכול להיות מועיל כדי לשפר את הישרדות האיברים. לבסוף, דיסוציאציה של תאים במהלך עיבוד הלב צריכה להתבצע בקפדנות, תוך הקפדה על הזמנים שנקבעו בפרוטוקול כדי למקסם את כדאיות התא.
לסיכום, זיהוי גנים מרכזיים בהיווצרות הלב חיוני להבנת המנגנונים הבסיסיים של מחלות לב מולדות והתחדשות. המתודולוגיה שנקבעה כאן מאפשרת סריקה מהירה של השפעות רווח של תפקוד גנטי (GOF) ואובדן תפקוד (LOF) בלב המתפתח. תוך הכרה במגבלות מסוימות, שיטה זו מציגה פוטנציאל רב לאקסטרפולציה לשלבי התפתחות שונים או למיפוי גורלם של תאים אפיקרדיאליים עובריים. באמצעות ההנחיות החזותיות המובאות במאמר זה, אנו שואפים להציע ארגז כלים רב ערך להערכת המורכבות והפוטנציאל העצומים של האפיקרדיום המתפתח.
Disclosures
למחברים אין ניגודי עניינים לחשוף.
Acknowledgements
מחקר זה נתמך על ידי מענק RTI2018-097617-J-I00 מ- Ministerio de Ciencia e Innovación הספרדי ו- Acción 9 מאוניברסיטת חאאן ל- O.H.O. Grant PGC2018-096486-B-I00 מה- Ministerio de Ciencia e Innovación הספרדי ומענק H2020-MSCA-ITN-2016-722427 מתוכנית Horizon 2020 של האיחוד האירופי ל- M.T. JMG נתמך על ידי מלגת דוקטורט ממשרד המדע הספרדי וקרן Severo Ochoa (PRE2022-101884). הן CNIC והן CBMSO נתמכים על ידי משרד המדע הספרדי, וה- CNIC נתמך על ידי קרן ProCNIC.
Materials
| Name | Company | Catalog Number | Comments |
| #55 Forceps | Dumont | 11295-51 | |
| 12-well Clear Flat Bottom Multiwell Cell Culture Plate | BD Falcon | 353043 | |
| 35 mm vise table | Grandado | SKU 8798771617573 | |
| 40 µm Cell Strainer | Fischer Scientific | 08-771-1 | |
| 50 mL tubes | BD Falcon | 352070 | |
| 70 µm Cell Strainer | Corning | CLS431751 | |
| Anti-GFP Policlonal Antibody | Invitrogen | A10262 | 1:1000 dilution used |
| Anti-Myosin 4 (MF20) Monoclonal Antibody | Invitrogen | 14-6503-82 | 1:500 dilution used |
| CD1 Wild Type mice | Provided by Animalary Unit (CNIC) | ||
| Cleaved Caspase-3 (Asp175) Antibody | Cell Signalling Technologies | 9661 | 1:400 dilution used |
| DAPI | Cell Signalling Technologies | 4083 | 1:1000 dilution used |
| Dispase/collagenase | Roche | 10269638001 | |
| Distilled water | |||
| DMEM - Dulbecco's Modified Eagle Medium | Gibco | 10313021 | |
| Fetal Bovine Serum | Invitrogen | 10438-026 | |
| Heracell 150i CO2 Incubator | Thermo Scientific | 51032720 | |
| Leica Stereoscopic Microscope S8AP0 | Leica | 11524102 | |
| Liberase | Roche | 5401119001 | |
| Micropipette Puller Model P-97 | Sutter Instrument | SU-P-97 | |
| pCAG expression plasmid | Addgene | #89689 | |
| Penicillin-streptomycin | Invitrogen | 15070-063 | |
| Petri dishes 35 × 10 mm | BD Falcon | 351008 | |
| Petri dishes 60 × 15 mm | BD Falcon | 353002 | |
| Phenol Red | Merck | P3532 | |
| Pipette tips | Reused from old laboratory equipment | ||
| Rat Serum culture embryo, male rats SPRAGUE DAWLEY RjHan SD | Janvier Labs | 9979 | |
| Recombinant anti-Wilms Tumor Protein 1 (WT1) Antibody | Abcam | ab89901 | 1:300 dilution used |
| Square Wave Electroporator CUY21SC | Nepa Gene | CUY664-10X15 | |
| Sterile PBS | Provided and autoclaved by technical unit | ||
| Sucrose | Millipore | 84100 | |
| Tweezer electrodes with variable gap | Nepa Gene | CUY650P5 |
References
- Tyser, R. C., et al. Calcium handling precedes cardiac differentiation to initiate the first heartbeat. eLife. 5, e17113(2016).
- Tyser, R. C. V., et al. Characterization of a common progenitor pool of the epicardium and myocardium. Science. 371 (6533), 2986(2021).
- Sendra, M., Domínguez, J., Torres, M., Ocaña, O. Dissecting the complexity of early heart progenitor cells. J Cardiovasc Dev Dis. 9 (1), 5(2021).
- Ivanovitch, K., Temiño, S., Torres, M. Live imaging of heart tube development in mouse reveals alternating phases of cardiac differentiation and morphogenesis. eLife. 6, e30668(2017).
- Ai, D., et al. Canonical Wnt signaling functions in second heart field to promote right ventricular growth. PNAS. 104 (22), 9319-9324 (2007).
- Zimmerman, M. S., et al. regional, and national burden of congenital heart disease, 1990-2017: A systematic analysis for the Global Burden of Disease Study 2017. Lancet Chil Adolesc Heal. 4 (3), 185-200 (2020).
- Xin, M., Olson, E. N., Bassel-Duby, R. Mending broken hearts: Cardiac development as a basis for adult heart regeneration and repair. Nat Rev Mol Cell Biol. 14 (8), 529-541 (2013).
- Porrello, E. R., et al. Transient regenerative potential of the neonatal mouse heart. Science. 331 (6020), 1078-1080 (2011).
- Cao, J., Poss, K. D. The epicardium as a hub for heart regeneration. Nat Rev Cardiol. 15 (10), 631-647 (2018).
- Zhou, B., et al. Adult mouse epicardium modulates myocardial injury by secreting paracrine factors. JCI. 121 (5), 1894-1904 (2011).
- Van Wijk, B., Gunst, Q. D., Moorman, A. F. M., Van Den Hoff, M. J. B. Cardiac regeneration from activated epicardium. PLOS One. 7 (9), e44692(2012).
- Hesse, J., et al. Single-cell transcriptomics defines heterogeneity of epicardial cells and fibroblasts within the infarcted murine heart. eLife. 10, e65921(2021).
- Streef, T. J., Smits, A. M. Epicardial contribution to the developing and injured heart: Exploring the Cellular composition of the epicardium. Front Cardiovasc Med. 8, 750243(2021).
- Sanchez-Fernandez, C., et al. Understanding epicardial cell heterogeneity during cardiogenesis and heart regeneration. J Cardiovasc Dev Dis. 10 (9), 376(2023).
- Quijada, P., et al. Coordination of endothelial cell positioning and fate specification by the epicardium. Nat Commun. 12 (1), 4155(2021).
- Mantri, M., et al. Spatiotemporal single-cell RNA sequencing of developing chicken hearts identifies interplay between cellular differentiation and morphogenesis. Nat Commun. 12 (1), 1771(2021).
- Paul, S., Zhang, X., He, J. Q. Homeobox gene Meis1 modulates cardiovascular regeneration. Semin Cell Dev Biol. 100, 52-61 (2020).
- Stankunas, K., et al. Pbx/Meis deficiencies demonstrate multigenetic origins of congenital heart disease. Circ Res. 103 (7), 702-709 (2008).
- Liu, Y., et al. Transcription factor Meis1 act as a new regulator of ischemic arrhythmias in mice. J Adv Res. 39, 275-289 (2022).
- Behringer, R. Manipulating the mouse embryo: A laboratory manual. , Cold Spring Harbor Lab Press. Cold Spring Harbor, New York. (2014).
- Wong, M. D., et al. 4D atlas of the mouse embryo for precise morphological staging. Development. 142 (20), 3583-3591 (2015).
- Morris, L., Klanke, C., Lang, S., Lim, F. Y., Crombleholme, T. TdTomato and EGFP identification in histological sections: Insight and alternatives. Biotech Histochem. 85 (6), 379-387 (2010).
- Schiaffino, S., Rossi, A. C., Smerdu, V., Leinwand, L. A., Reggiani, C. Developmental myosins: expression patterns and functional significance. Skelet. Muscle. 5 (1), 22(2015).
- Eissa, N., et al. Stability of reference genes for messenger RNA quantification by real-time pcr in mouse dextran sodium sulfate experimental colitis. PLOS One. 11 (5), e0156289(2016).
- Livak, K. J., Schmittgen, T. D. Analysis of relative gene expression data using real-time quantitative PCR and the 2−ΔΔCT method. Methods. 25 (4), 402-408 (2001).
- Lai, S. R., Andrews, L. G., Tollefsbol, T. O. RNA interference using a plasmid construct expressing short-hairpin RNA. Methods Mol Biol. 405, 31-37 (2007).
- Carmona, R., Barrena, S., López Gambero, A. J., Rojas, A., Muñoz-Chápuli, R. Epicardial cell lineages and the origin of the coronary endothelium. FASEB J. 34 (4), 5223-5239 (2020).
- Gittenberger-de Groot, A. C., Vrancken Peeters, M. P. F. M., Mentink, M. M. T., Gourdie, R. G., Poelmann, R. E. Epicardium-derived cells contribute a novel population to the myocardial wall and the atrioventricular cushions. Circ Res. 82 (10), 1043-1052 (1998).
- Chong, Z. X., Yeap, S. K., Ho, W. Y. Transfection types, methods and strategies: A technical review. Peer J. 9, e11165(2021).
- Kałużna, E., Nadel, A., Zimna, A., Rozwadowska, N., Kolanowski, T. Modeling the human heart ex vivo-Current possibilities and strive for future applications. JTERM. 16 (10), 853-874 (2022).
- Aguilera-Castrejon, A., et al. Ex utero mouse embryogenesis from pre-gastrulation to late organogenesis. Nature. 593 (7857), 119-124 (2021).
- Dyer, L. A., Patterson, C. A novel ex vivo culture method for the embryonic mouse heart. J Vis Exp. (75), e50359(2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved