Method Article
نهج فعال للجينات المعدلة لتوصيل الجينات في القلب الجنيني للفأر
In This Article
Summary
يقدم هذا البروتوكول إطارا منهجيا مفصلا للجينات المحورة القائمة على التثقيب الكهربائي لخلايا القلب في قلوب الفئران النامية. ستسهل أصول الفيديو المتوفرة هنا تعلم هذه التقنية متعددة الاستخدامات.
Abstract
قلب الثدييات هو عضو معقد يتكون أثناء التطور عبر مجموعات متنوعة للغاية من الخلايا السلفية. إن أصل هؤلاء الأسلاف وتوقيتهم ومصيرهم أمر حيوي للتطور السليم لهذا العضو. الآليات الجزيئية التي تحكم تشكل القلب ضرورية لفهم التسبب في أمراض القلب الخلقية وتجديد القلب الجنيني. استخدمت الأساليب الكلاسيكية للتحقيق في هذه الآليات توليد الفئران المعدلة وراثيا لتقييم وظيفة جينات معينة أثناء نمو القلب. ومع ذلك ، فإن الجينات المحورة للفأر هي عملية معقدة تستغرق وقتا طويلا ولا يمكن إجراؤها في كثير من الأحيان لتقييم دور جينات معينة أثناء نمو القلب. ولمعالجة هذا الأمر، قمنا بتطوير بروتوكول للتثقيب الكهربائي الفعال وزراعة القلوب الجنينية للفئران، مما يمكن الجينات المحورة العابرة من التقييم السريع لتأثير اكتساب أو فقدان وظيفة الجينات المشاركة في نمو القلب. باستخدام هذه المنهجية ، نجحنا في التعبير عن Meis1 في القلب الجنيني ، مع تفضيل نقل الخلايا النخابية ، مما يدل على قدرات التقنية.
Introduction
القلب هو أول عضو يتشكل أثناء التطور الجنيني. تتضمن هذه العملية التنسيق الزماني المكاني لمجموعات مختلفة من الخلايا السلفية من مناطق متميزة من الجنين. كل هذا يحدث بينما يستمر القلب النامي في النبض والعمل ، مع التركيز على التنسيق الرائع المطلوب لتكوينه1،2،3. نظرا للدور الحاسم للقلب ، فإن التنظيم الصارم على المستويين الخلوي والجزيئي ضروري لتكوينه بشكل صحيح 4,5. كان تحديد الآليات التي تتحكم في نمو القلب ذا أهمية كبيرة ، لأنها ضرورية لكشف اضطرابات القلب الخلقية ، والتي تؤثر على عدد كبير من المرضى في جميع أنحاء العالم6. علاوة على ذلك ، يعد فهم نمو القلب أمرا محوريا في فك رموز تجديد القلب ، حيث تحتفظ قلوب الثدييات بعد الولادة بقدرة متجددة تضيع أو تعوق في مرحلة البلوغ 7,8. وبالتالي ، فإن تشريح المنظمين الجزيئيين لنمو القلب أمر حتمي لتعزيز الجهود البحثية حول أمراض القلب الخلقية وتجديد القلب.
سعيا لتحقيق هذا الهدف ، كان هناك تركيز متزايد على التحقيق في دور النخاب في نمو القلب وتجديده9. النخاب هو طبقة رقيقة من النسيج الظهاري المتوسط الذي يتكون من الطبقة الخارجية لقلب الثدييات (الشكل 1). أظهرت الدراسات الحديثة أهمية النخاب أثناء إصابة القلب ، وكشفت أن هذا النسيج قادر على إرسال إشارات الانتشار إلى خلايا عضلة القلب في المنطقة المصابة للتخفيف من الضرر10,11. على الرغم من أهمية النخاب ، فقد واجه إجراء المزيد من التحقيقات الجزيئية تحديا بسبب عدم تجانسه الهائل. كشفت تجارب RNAseq أحادية الخلية عن عدم تجانس النخاب ، حيث تضم مجموعات فرعية متعددة من الخلايا مع توقيعات نسخية مميزة12،13،14،15،16. وبالتالي ، فإن استراتيجية فحص المنظمين المحتملين لتطور القلب يجب أن تستوعب تنوع الخلايا السلفية النخابية.
وبهذا المعنى ، سهلت قابلية نموذج الفأر للتعديل الجيني تحديد العديد من الجينات الحاسمة لنمو القلب ، مما سمح بتوليد خطوط متحولة مع اكتساب الوظيفة (GOF) أو فقدان الوظيفة (LOF) لجينات معينة. ومع ذلك ، فإن هذه النهج تنطوي على استثمار كبير للوقت والموارد التجريبية. لذلك ، فهي غير عملية عند تقييم أدوار عدد كبير من الجينات المرشحة. إلى جانب ذلك ، غالبا ما تمارس الجينات التنموية وظائف متعددة الاتجاهات في أنسجة مختلفة أو تكون مطلوبة للتطور الجنيني المبكر ، مما يعيق تفسير مساهمتها في التطور في عملية محددة. في حين أنه من الممكن استهداف وظيفة الجينات في هياكل محددة أو نقاط زمنية تنموية ، فإن هذا يتطلب عادة استخدام تركيبات جينية أكثر تعقيدا ، والتي قد يكون من الصعب توليدها أو غير متوفرة بشكل عام.
للتغلب على هذه القيود ، نقدم منهجية لإلكتروبور القلوب الجنينية للفأر من أجل الجينات المحورة العابرة (الشكل 2). بالاقتران مع الثقافة خارج الجسم الحي وفرز الخلايا المنشط بالتألق (FACS) ، توضح هذه الاستراتيجية قدراتها من خلال GOF العابر ل Meis1 ، وهو جين مميز جيدا متورط في نمو القلب وتجديده17،18،19. في هذه المقالة ، يتم أيضا استكشاف التطبيقات المحتملة الأخرى لهذه المنهجية ، وتناقش مزاياها وقيودها ، وكذلك مقارنتها بالبروتوكولات الحالية لتعديل التعبير الجيني بشكل عابر. نعتقد أن الإطار والأمثلة المرئية المقدمة ستعزز فهم بيولوجيا النخاب أثناء التطور والمرض.
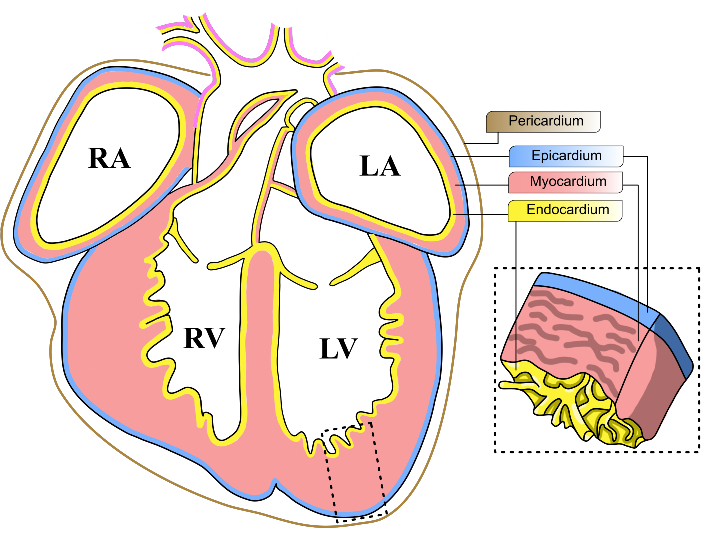
الشكل 1: طبقات القلب الجنينية للفأر. رسم تخطيطي لمنظر إكليلي لقلب جنيني للفأر E13-14. يتم تمثيل الطبقات الخلوية الرئيسية الثلاث للقلب باللون الأصفر (الشغاف) والأحمر (عضلة القلب) والأزرق (النخاب). يتم تمثيل التامور بخط بني. يتم اختصار غرف القلب الأربع باسم LV ، البطين الأيسر. RV ، البطين الأيمن. لوس أنجلوس ، الأذين الأيسر ؛ RA ، الأذين الأيمن. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: نظرة عامة تخطيطية على بروتوكول التثقيب الكهربائي للقلب. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
Protocol
تمت الموافقة على جميع الإجراءات الحيوانية من قبل لجنة أخلاقيات التجارب على CNIC وتتوافق مع التشريعات الحالية ، بما في ذلك توجيه الاتحاد الأوروبي 2010/63EU والتوصية 2007/526 / EC ، على النحو الذي يفرضه القانون الإسباني بموجب Real Decreto 53/2013. بالنسبة لهذا البروتوكول ، تم استخدام إناث الفئران من النوع البري CD-1 الذين تتراوح أعمارهم بين 15 و 21 أسبوعا. يتم سرد التفاصيل المتعلقة بالحيوانات والكواشف والمعدات المستخدمة في جدول المواد.
1. إعداد البلازميد والأداة
- أولا ، قم بإعداد مزيج التثقيب الكهربائي عن طريق إضافة الحمض النووي البلازميد المطلوب في الثلج بتركيز نهائي قدره 1 ميكروغرام / ميكرولتر. بعد ذلك ، أكمل المزيج بإضافة السكروز بتركيز نهائي 6٪ (مذاب في PBS) ، وصبغة متوافقة حيويا بنسبة 0.01٪ ، واستكماله ب PBS حتى الحجم النهائي 30 ميكرولتر.
ملاحظة: يتم استخدام ما يقرب من 1-2 ميكرولتر من مزيج التثقيب الكهربائي لكل عينة. قم بقياس نسب مزيج التثقيب الكهربائي وفقا لعدد العينات في التجربة. يرجى تذكر أنه يجب تنقية الحمض النووي للتثقيب الكهربائي من الثقافة البكتيرية ، مما يضمن الاستقرار الأمثل والحد الأدنى من الملوثات. لمزيد من التفاصيل حول البلازميدات المستخدمة في هذه الدراسة ، يرجى الرجوع إلى قسم النتائج التمثيلية. - قم بإعداد وسط النمو عن طريق استكمال وسط النسر المعدل من Dulbecco (DMEM) مع مصل بقري الجنين بنسبة 10٪ (FBS) ، و 2٪ عازل Hepes ، و 1٪ بنسلين / ستربتومايسين. احتفظ بالوسط في حاضنة عند 37 درجة مئوية حتى الاستخدام. بالإضافة إلى ذلك ، قم بتسخين 1x PBS عند 37 درجة مئوية ، جنبا إلى جنب مع وسط النمو.
- تحضير الإبر عن طريق تمديد شعرية زجاجية قطرها 20 ميكرومتر باستخدام مجتذب ماصة بالشروط التالية: الحرارة = 550 ؛ سحب = 100 ؛ السرعة = 250 ؛ الوقت = 120. يجب أن يكون القطر النهائي بعد السحب حوالي 5-8 ميكرومتر.
- قم بإعداد معلمات الكهربائي إلى خمس دورات 50 مللي ثانية عند 40 فولت بفواصل زمنية تبلغ 900 مللي ثانية. قم بإعداد الأقطاب الكهربائية وماصة الفم والإبرة الحادة (الشكل 3 أ). جهز الماصة بالإبرة لتحميل الحمض النووي (الشكل 3 أ).
2. تشريح الجنين واستخراج القلب
- قم بإعداد تقاطع بين الفئران CD-1 من النوع البري. في صباح اليوم التالي ، حدد الإناث التي تظهر سدادة مهبلية ولاحظ هذه المرة على أنها يوم جنيني E0.5. القتل الرحيم للحيوانات في اليوم الجنيني E12-12.5 عن طريق خلع عنق الرحم (باتباع البروتوكولات المعتمدة مؤسسيا).
- استخرج الرحم بعناية من الماوس وضعه في منشفة ورقية جافة. بعد ذلك ، قم بقص الرحم باستخدام مقص ناعم عن طريق إدخال طرف المقص في الجانب mesometrial وتشغيل حافة الشفرة ببطء طوال الطول. فضح deciduae ونقلها إلى وسط النمو. لمزيد من التفاصيل ، يرجى الاطلاع على عمل Behringer et al.20.
- تشريح deciduae لاستخراج الأجنة ، ثم وضع الأجنة في طبق بتري 60 مم مع وسط نمو دافئ. باستخدام ملقط دقيق ، قم بقص ذيل الجنين ورأسه بعناية بحيث يبقى جذع الجسم فقط. يمكن التحقق من مرحلة الأجنة من خلال تقييم السمات التشريحية ، كما وصفها Wong et al.21.
- ثم قم بإزالة أكبر قدر ممكن من الأنسجة من جذع الجنين بحذر دون الإضرار بالقلب أو الشرايين الرئوية والشريان الأورطي. بمجرد تعرض القلب ، ضعه على الفور في وسط نمو دافئ جديد واحتفظ به في حاضنة عند 37 درجة مئوية حتى التثقيب الكهربائي.
ملاحظة: الحفاظ على درجة حرارة القلب أمر بالغ الأهمية لبقائه. تأكد من أن الوسط دافئ دائما واستبدله كل 5-10 دقائق. من ناحية أخرى ، يمكن التعامل مع العينات دون الحفاظ على العقم ، لأن هذا لن يؤثر على كفاءة الإجراء. يرجى ملاحظة أن وسط النمو يحتوي على مضادات حيوية.
3. التثقيب الكهربائي للقلب والثقافة خارج الجسم الحي
- قم بتحميل ما يقرب من 10 ميكرولتر من مزيج البلازميد (المحضر في الخطوة 1.1) في الإبرة عن طريق الشفط بعناية باستخدام ماصة الفم.
- قم بإعداد قلب واحد للتثقيب الكهربائي عن طريق وضعه في طبق بتري نظيف 60 مم مع معقم 1x PBS دافئ إلى 37 درجة مئوية. ضع الطبق تحت مجهر التشريح (الشكل 3 أ).
- قم بإعداد الأقطاب الكهربائية عن طريق ضبط المسافة بين القطبين الموجب والسالب إلى حوالي 4 مم (الشكل 3 ب).
ملاحظة: 4 مم هي مسافة الفتحة التي تتناسب فيها قلوب الماوس E12.5 مع الأقطاب الكهربائية المستخدمة في هذا العمل. يرجى التفكير في تغيير هذه المسافة بناء على أحجام العينات المختلفة أو مواصفات القطب الكهربائي. - ثقب بلطف الطبقة الأكثر سطحية من القلب مع الإبرة في ماصة الفم. ماصة بعناية 1-2 ميكرولتر من مزيج البلازميد وإزالة الإبرة. يمكن إجراء حقن متعددة لضمان الاختراق الأمثل ، وكذلك لزيادة عدد الخلايا الكهربائية.
- ثبت الأقطاب الكهربائية في مكانها بحيث يقع القلب بين كلا القطبين (الشكل 3C). ثم ، كهربائي القلب مع الشروط المحددة أعلاه.
ملاحظة: لضمان أقصى قدر من كفاءة التثقيب الكهربائي ، من الممكن تبديل قطبية الأقطاب الكهربائية وإعطاء نبضة أخرى. - انقل القلب الكهربائي إلى صفيحة جديدة ذات 12 بئرا تحتوي على 1 مل من وسط النمو وضعها عند 37 درجة مئوية ، 5٪ CO2.
- كرر الخطوات من 3.1 إلى 3.6 حتى يتم ثقب جميع العينات في التجربة بالكهرباء. أخيرا ، احتضان جميع القلوب في حاضنة عند 37 درجة مئوية ، 5٪ CO2 ، لمدة 24 ساعة أو حتى التحليل.
ملاحظة: في أيدينا ، يمكن ترك القلوب في الثقافة لمدة تصل إلى 48 ساعة دون علامات تدهور واضحة (الفيلم التكميلي 1 ؛ الفيلم التكميلي 1 ؛ الفيلم التكميلي 1 ؛ الفيلم التكميلي 1 ؛ الفيلم التكميلي 1 ؛ الفيلم التكميلي 1 ؛ الفيلم التكميلي 1 ؛ الفيلم التكميلي 1 ؛ الفيلم التكميلي 1 ؛ الفيلم التكميلي 1 ؛ الفيلم التكميلي 1 ؛ الفيلم الت الفيلم التكميلي 2 ؛ الشكل التكميلي 1).
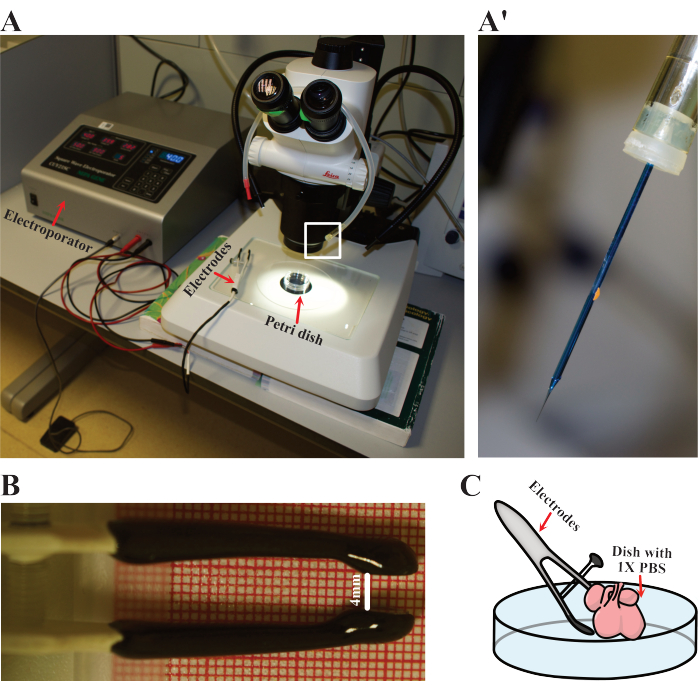
الشكل 3: إعداد التثقيب الكهربائي. (أ) الإعداد المستخدم للتثقيب الكهربائي. تشير الأسهم الحمراء إلى جهاز الحفر الكهربائي والأقطاب الكهربائية وطبق بتري حيث يتم حفر القلوب بالكهرباء. (أ') التفاصيل الدقيقة لإبرة التثقيب الكهربائي كما هو موضح في (A) بواسطة المستطيل الأبيض. (ب) تفاصيل المسافة المعدلة للأقطاب الكهربائية المستخدمة في قلوب E12.5. ج: تمثيل تخطيطي للتثقيب الكهربي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
4. فرز الخلايا وتحليل الكيمياء المناعية
- لتحليل فرز الخلايا للعينات ، قم بإعداد وسط هضم لفصل الأنسجة عن طريق خلط 400 ميكرولتر من الليبراز (5 مجم / مل) ، 300 ميكرولتر من ديسباز (0.1 جم / مل) ، 4 ميكرولتر من CaCl2 (0.4 ميكرومتر) ، 50 ميكرولتر من MgCl2 (5 ميكرومتر) وكاملة حتى 10 مل من DMEM. الحفاظ على الجليد حتى الاستخدام. يحتاج كل قلب إلى حوالي 1 مل من وسط الهضم. اضبط وحدات التخزين وفقا لعدد العينات.
ملاحظة: بالنسبة للكيمياء الهيستولوجية المناعية ، ثبت القلوب مباشرة في 1.5 مل من 4٪ PFA لمدة ساعتين عند RT أو طوال الليل عند 4 درجات مئوية. في اليوم التالي ، اغسل القلوب 3x باستخدام برنامج تلفزيوني وانتقل إلى الإجراءات النسيجية والمناعية. للحصول على بروتوكول مفصل للكيمياء المناعية ، راجع Morris et al.22. - نقل كل قلب في الثقافة إلى أنبوب جديد يحتوي على 1 مل من وسط الهضم المثلج.
- لتسهيل التفكك ، يقطع المنديل عن طريق تطبيق المتعة بلطف باستخدام حقنة 3-4 مرات واحتضانها على الفور في طبق ساخن عند 37 درجة مئوية ، 600 دورة في الدقيقة لمدة 45 دقيقة.
- قم بتصفية مزيج الهضم من خلال مصفاة خلية 70 ميكرومتر في أنبوب جديد واتركه فارغا عن طريق تدفق الجاذبية. بعد ذلك ، قم بإنقاذ حجم التمرير وترشيحه مرة أخرى باستخدام مصفاة خلية 40 ميكرومتر في أنبوب جديد سعة 50 مل.
- أضف 500 ميكرولتر من مصل بقري الجنين (FBS) واستكمل ما يصل إلى 30 مل باستخدام DMEM البارد.
- جهاز طرد مركزي المزيج عند 240 × جم لمدة 10 دقائق في درجة حرارة الغرفة.
- تخلص من المادة الطافية وضع الأنبوب سعة 50 مل رأسا على عقب على منشفة ورقية حتى يجف تماما.
ملاحظة: هذه نقطة ملائمة لإيقاف التجربة مؤقتا عن طريق تجميد حبيبات الخلية. إذا كان الأمر كذلك ، فأعد تعليق الخلايا التي تحتوي على 10٪ DMSO في FBS وتخزينها عند -80 درجة مئوية. - لفرز الخلايا ، أعد تعليق الخلايا في 300 ميكرولتر من المخزن المؤقت للفرز (1٪ FBS ، 1٪ بنسلين / ستربتومايسين في PBS) وأضف 0.3 ميكرولتر من DAPI (1000x). إجراء فرز الخلايا.
النتائج
لإثبات فعالية هذه التقنية في إجراء تجارب كسب الوظيفة (GOF) لمنظمات نمو القلب ذات الصلة ، تم بناء كهربائي مفرط في التعبير عن عامل النسخ Meis1. لتحقيق ذلك ، تم استخراج الحمض النووي الريبي من أجنة E9.5 ، وتم إجراء النسخ العكسي للحصول على الحمض النووي التكميلي (cDNA). باستخدام cDNA كقالب ، تم استنساخ تسلسل ترميز Meis1 (الجدول التكميلي 1) في بلازميد تعبير pCAG (يشار إليه فيما يلي باسم pCAG :: Meis1) ، بينما تم استخدام البلازميد التأسيسي المعبر عن GFP (pCAG :: GFP) كعنصر تحكم. ثم تم كهربية القلوب إما باستخدام pCAG :: GFP فقط أو بالاشتراك مع pCAG :: Meis1.
بعد 24 ساعة بعد التثقيب الكهربائي (hpe) ، كانت القلوب تنبض وبدت في حالة جيدة (الشكل 4 أ ؛ الفيلم التكميلي 1 ؛ الفيلم التكميلي 2). لتقييم صلاحية الخلايا المكهربة ، تم تحليل موت الخلايا المبرمج من خلال تلطيخ كيميائي مناعي للكاسباز 3. على الرغم من اكتشاف بعض الخلايا الإيجابية داخل القلب ، لم يتم العثور على عضلة القلب ولا النخاب ، حيث توجد غالبية الخلايا الكهربائية ، تتأثر بموت الخلايا المبرمج (الشكل التكميلي 1ج). عندما تم تقييم نشاط التألق ، لوحظت إشارة GFP فسيفساء في جميع غرف القلب الأربع تقريبا ، مما يشير إلى أن هذا البروتوكول قادر على الوصول إلى غالبية هياكل القلب (الشكل 4 أ). لتحديد أنواع الخلايا القلبية التي تم تثقيبها بالكهرباء ، تم تلطيخ القلوب المثقوبة بالكهرباء pCAG :: GFP ضد علامات النخاب ، WT12 ، وعضلة القلب ، MF2023 ، ثم تم تصويرها باستخدام مجهر متحد البؤر (الشكل 4B). كانت معظم خلايا GFP + موجودة بشكل تفضيلي في المنطقة الخارجية للقلب ، والتي تتوافق إلى حد كبير مع إشارة WT1 ، مما يشير إلى أن هذه الطريقة هي الأكثر كفاءة في الوصول إلى خلايا النخاب (الشكل 4B ، رؤوس الأسهم البيضاء).
من ناحية أخرى ، تم فصل قلوب pCAG :: Meis1 الكهربائية أو التحكم (pCAG :: GFP فقط) ، وتعرضت الخلايا لفرز الخلايا المنشط بالفلورة (FACS) لعزل خلايا GFP + من العضو بأكمله ، كما هو موضح في الخطوة 4 من البروتوكول. تم استخراج الحمض النووي الريبي من الخلايا التي تم فرزها ، وتم إجراء تفاعل البوليميراز المتسلسل الكمي للنسخ العكسي (RT-qPCR) لتقييم مستويات التعبير عن Meis1 في الخلايا المنقولة (الشكل 4C ، الجدول التكميلي 1). تم تطبيع التعبير الجيني الكلي Meis1 باستخدام مستويات التعبير لجين التدبير المنزلي للفأر Eef224 ، وتم حساب التعبير الجيني النسبي باستخدام طريقة ΔΔCt25. لوحظ تنظيم كبير لمستويات الحمض النووي الريبي Meis1 في القلوب المكهربة باستخدام بلازميد pCAG :: Meis1 مقارنة بتلك التي تحتوي فقط على بلازميد pCAG :: GFP (الشكل 4C). وبالتالي ، فإن هذا يوضح إمكانات التقنية للإفراط في التعبير عن الجينات ذات الأهمية ومعالجة النتيجة الجزيئية.

الشكل 4: التحليل الجزيئي للقلوب E12.5 الكهربية. (أ) مضان GFP لقلب CAG واحد :: GFP بعد 24 ساعة من التثقيب الكهربائي. تظهر الصورة السفلية مضان GFP ، بينما تظهر الصورة العلوية اندماجا ل GFP ومجالا ساطعا لنفس القلب. ب: التألق المناعي للأقسام النسيجية للقلب E12.5 المكهربة. يميز MF20 خلايا عضلة القلب ، بينما يشير WT1 إلى الخلايا النخابية. تتوافق الصور الموجودة على اليمين مع تكبير المستطيل الأبيض. تشير رؤوس الأسهم البيضاء إلى خلايا GFP + الموجودة في النخاب ، محددة تقريبا بخط أبيض منقط. (C) تحليل RT-qPCR للقلوب المثقوبة بالكهرباء باستخدام pCAG :: Meis1 أو pCAG :: GFP (التحكم). تمثل كل نقطة تكرارا بيولوجيا تم الحصول عليه من تجميع ثلاثة قلوب معا. في المجموع ، تم إجراء تحليل qPCR في ثلاث نسخ مع ثلاث نسخ بيولوجية متميزة. تم إجراء التحليل الإحصائي باستخدام اختبار t للطالب (* P < 0.05). قضبان المقياس: 200 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل التكميلي 1: كفاءة التثقيب الكهربائي للقلب وصلاحية الخلية. (أ) التعبير عن GFP في قلبين متميزين E12.5 مكهربين باستخدام بلازميد التحكم pCAG::GFP عند 24 ساعة أو 48 ساعة بعد التثقيب الكهربائي (hpe). تم تركيب صورة إشارة GFP على صورة حقل ساطع لنفس القلب. (ب) القياس الكمي للخلايا GFP + في قلوب 24 hpe و 48 hpe بالكهرباء باستخدام التحكم pCAG :: GFP. تشير النقاط إلى عينات متميزة. تشير الخطوط الصلبة إلى المتوسط ، بينما تشير أشرطة الخطأ إلى الانحراف المعياري. ولم يلاحظ وجود فرق يعتد به كثيرا بين الحالتين ( اختبار t غير المعلمي؛ و P > 0.9). (ج) صورة متحدة البؤر لقلب E12.5 مكهرب بالكهرباء باستخدام pCAG::GFP مناعي ضد الكاسباز المشقوق 3 و MF20. يمثل الخط المنقط طبقة عضلة القلب في القلب. يتم تكبير الصور الموجودة على اليمين من المستطيل الأبيض. قضبان المقياس: 100 ميكرومتر. الرجاء الضغط هنا لتنزيل هذا الملف.
الجدول التكميلي 1: ملخص التمهيدي والتسلسل. الرجاء الضغط هنا لتنزيل هذا الملف.
الفيلم التكميلي 1: pCAG :: GFP - القلب الكهربائي بعد 24 ساعة. فيلم يلتقط قلبا واحدا كهربائيا باستخدام pCAG :: GFP التحكم في البلازميد بعد 24 ساعة من العملية. يستمر القلب في النبض ، وتعبر الخلايا الكهربائية عن إشارات GFP. الرجاء الضغط هنا لتنزيل هذا الفيلم.
الفيلم التكميلي 2: pCAG :: GFP - القلب الكهربائي بعد 48 ساعة. فيلم يظهر قلبا مكهربا مع التحكم pCAG :: GFP ، بعد 48 ساعة من التثقيب الكهربائي. الرجاء الضغط هنا لتنزيل هذا الفيلم.
Discussion
بشكل عام ، تقدم المنهجية الموصوفة هنا إطارا قويا للتعبير عن التركيبات المعدلة وراثيا في النخاب النامي (الشكل 4 ب) ، كما يتضح من التعبير المفرط ل Meis1 (الشكل 4C). مع التركيبات المناسبة ، يمكن استخدام هذا البروتوكول لتقييم تأثير إما كسب الوظيفة (GOF) أو فقدان الوظيفة (LOF) لجين معين. يمكن تنفيذ LOF في هذه التقنية عن طريق نقل البلازميد الذي يستهدف الجين المرشح من خلال تداخل الحمض النوويالريبي 26. يعد التقييم السريع للجين GOF أو LOF مفيدا بشكل خاص ، لا سيما بالنظر إلى عدم التجانس النسخي الكبير للخلايا النخابية12 ، مما يجعل من غير العملي توليد محورة وراثيا لتقييم كل جين مرشح على حدة.
نظرا لأن هذا البروتوكول يستخدم الثقافة خارج الجسم الحي ، فإنه يوفر إمكانية التحقيق في مصير الخلايا النخابية داخل نافذة زمنية. يلعب النخاب النامي دورا محوريا في تشكيل مناطق متميزة داخل قلب البالغين13،27،28 ؛ وبالتالي ، فإن فهم مساهماته في نمو القلب مفيد في تشريح أساس تشوهات القلب الخلقية. على الرغم من أن هذه المقالة لا تتعمق في هذا التطبيق ، إلا أن الإرشادات الموضحة في البروتوكول يمكن أن تكون مفيدة لدراسات رسم خرائط المصير المستقبلية ل epicardium
على الرغم من الفائدة العملية للطريقة الحالية ، يجب الاعتراف ببعض القيود. نظرا لأن هذه المنهجية تعتمد على الجينات المحورة العابرة ، يمكن فقدان تعبير البلازميد أو تضاؤله بمرور الوقت ، مما يحد من نطاق البروتوكول لدراسة نافذة تنموية محددة29. ومع ذلك ، في هذه الدراسة ، تم الحفاظ على التعبير المفرط ل GFP طوال مدة ثقافات ما بعد التثقيب الكهربائي (48 hpe). بالإضافة إلى ذلك ، فإن القيود المحتملة في تقنيات الاستزراع خارج الجسم الحي الحالية تعيق قابلية تطبيق الطريقة لتقييم مراحل النمو الجنينية المتأخرة أو ما بعد الولادة ، خاصة عندما تصبح الزراعة خارج الجسم الحي بعد التثقيب الكهربائي صعبة30. على الرغم من وجود طرق أكثر تطورا لزراعة الأجنة خارج الجسم الحي 31,32 ، إلا أنها قد تتطلب استخدام معدات يصعب على الباحثين الوصول إليها وقد لا تضمن بقاء العينة.
في حين أن البروتوكول المقدم هنا مصمم ليكون بسيطا قدر الإمكان لتعزيز قابلية التكرار ، إلا أنه يتضمن خطوات حاسمة مفيدة للنجاح. أولا ، يجب إجراء تشريح الجنين بعناية وسرعة لتقليل تلف القلب ، مما قد يضر ببقاء العضو بعد التثقيب الكهربائي. يوصى بشدة بالعناية الخاصة خلال هذه الخطوة ، إلى جانب استخدام معدات التشريح المثلى. جانب آخر مهم من البروتوكول هو إجراء التثقيب الكهربائي نفسه ، لأن حقن البلازميد غير الكافي قد يؤدي إلى نتائج غير مرغوب فيها. لذلك ، ينصح بإجراء حقن متعددة على قلب واحد ، وقد يكون حقن العينة بطريقة سطحية إلى حد ما مفيدا لتعزيز بقاء الأعضاء. أخيرا ، يجب إجراء تفكك الخلايا أثناء معالجة القلب بدقة ، مع الالتزام بالأوقات المنصوص عليها في البروتوكول لزيادة صلاحية الخلية إلى أقصى حد.
في الختام ، يعد تحديد الجينات الرئيسية في تكوين القلب مفيدا في فهم الآليات الأساسية للأمراض الخلقية القلبية وتجديدها. تسمح المنهجية الموضوعة هنا بالفحص السريع لتأثيرات اكتساب الوظيفة الجينية (GOF) وفقدان الوظيفة (LOF) في القلب النامي. مع الاعتراف ببعض القيود ، تظهر هذه الطريقة إمكانات كبيرة للاستقراء لمراحل مختلفة من التطور أو لرسم خرائط مصير الخلايا النخابية الجنينية. من خلال الإرشادات المرئية الواردة في هذه المقالة ، نهدف إلى تقديم مجموعة أدوات قيمة لتقييم التعقيد الهائل وإمكانات النخاب النامي.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للكشف عنه.
Acknowledgements
تم دعم هذه الدراسة من خلال منحة RTI2018-097617-J-I00 من وزارة العلوم والابتكار الإسبانية و Acción 9 من جامعة جيان إلى O.H.O. Grant PGC2018-096486-B-I00 من وزارة العلوم والابتكار الإسبانية ومنحة H2020-MSCA-ITN-2016-722427 من برنامج EU Horizon 2020 إلى MT. تم دعم JMG بزمالة دكتوراه من وزارة العلوم الإسبانية ومؤسسة Severo Ochoa (PRE2022-101884). يتم دعم كل من CNIC و CBMSO من قبل وزارة العلوم الإسبانية ، ويتم دعم CNIC من قبل مؤسسة ProCNIC.
Materials
| Name | Company | Catalog Number | Comments |
| #55 Forceps | Dumont | 11295-51 | |
| 12-well Clear Flat Bottom Multiwell Cell Culture Plate | BD Falcon | 353043 | |
| 35 mm vise table | Grandado | SKU 8798771617573 | |
| 40 µm Cell Strainer | Fischer Scientific | 08-771-1 | |
| 50 mL tubes | BD Falcon | 352070 | |
| 70 µm Cell Strainer | Corning | CLS431751 | |
| Anti-GFP Policlonal Antibody | Invitrogen | A10262 | 1:1000 dilution used |
| Anti-Myosin 4 (MF20) Monoclonal Antibody | Invitrogen | 14-6503-82 | 1:500 dilution used |
| CD1 Wild Type mice | Provided by Animalary Unit (CNIC) | ||
| Cleaved Caspase-3 (Asp175) Antibody | Cell Signalling Technologies | 9661 | 1:400 dilution used |
| DAPI | Cell Signalling Technologies | 4083 | 1:1000 dilution used |
| Dispase/collagenase | Roche | 10269638001 | |
| Distilled water | |||
| DMEM - Dulbecco's Modified Eagle Medium | Gibco | 10313021 | |
| Fetal Bovine Serum | Invitrogen | 10438-026 | |
| Heracell 150i CO2 Incubator | Thermo Scientific | 51032720 | |
| Leica Stereoscopic Microscope S8AP0 | Leica | 11524102 | |
| Liberase | Roche | 5401119001 | |
| Micropipette Puller Model P-97 | Sutter Instrument | SU-P-97 | |
| pCAG expression plasmid | Addgene | #89689 | |
| Penicillin-streptomycin | Invitrogen | 15070-063 | |
| Petri dishes 35 × 10 mm | BD Falcon | 351008 | |
| Petri dishes 60 × 15 mm | BD Falcon | 353002 | |
| Phenol Red | Merck | P3532 | |
| Pipette tips | Reused from old laboratory equipment | ||
| Rat Serum culture embryo, male rats SPRAGUE DAWLEY RjHan SD | Janvier Labs | 9979 | |
| Recombinant anti-Wilms Tumor Protein 1 (WT1) Antibody | Abcam | ab89901 | 1:300 dilution used |
| Square Wave Electroporator CUY21SC | Nepa Gene | CUY664-10X15 | |
| Sterile PBS | Provided and autoclaved by technical unit | ||
| Sucrose | Millipore | 84100 | |
| Tweezer electrodes with variable gap | Nepa Gene | CUY650P5 |
References
- Tyser, R. C., et al. Calcium handling precedes cardiac differentiation to initiate the first heartbeat. eLife. 5, e17113(2016).
- Tyser, R. C. V., et al. Characterization of a common progenitor pool of the epicardium and myocardium. Science. 371 (6533), 2986(2021).
- Sendra, M., Domínguez, J., Torres, M., Ocaña, O. Dissecting the complexity of early heart progenitor cells. J Cardiovasc Dev Dis. 9 (1), 5(2021).
- Ivanovitch, K., Temiño, S., Torres, M. Live imaging of heart tube development in mouse reveals alternating phases of cardiac differentiation and morphogenesis. eLife. 6, e30668(2017).
- Ai, D., et al. Canonical Wnt signaling functions in second heart field to promote right ventricular growth. PNAS. 104 (22), 9319-9324 (2007).
- Zimmerman, M. S., et al. regional, and national burden of congenital heart disease, 1990-2017: A systematic analysis for the Global Burden of Disease Study 2017. Lancet Chil Adolesc Heal. 4 (3), 185-200 (2020).
- Xin, M., Olson, E. N., Bassel-Duby, R. Mending broken hearts: Cardiac development as a basis for adult heart regeneration and repair. Nat Rev Mol Cell Biol. 14 (8), 529-541 (2013).
- Porrello, E. R., et al. Transient regenerative potential of the neonatal mouse heart. Science. 331 (6020), 1078-1080 (2011).
- Cao, J., Poss, K. D. The epicardium as a hub for heart regeneration. Nat Rev Cardiol. 15 (10), 631-647 (2018).
- Zhou, B., et al. Adult mouse epicardium modulates myocardial injury by secreting paracrine factors. JCI. 121 (5), 1894-1904 (2011).
- Van Wijk, B., Gunst, Q. D., Moorman, A. F. M., Van Den Hoff, M. J. B. Cardiac regeneration from activated epicardium. PLOS One. 7 (9), e44692(2012).
- Hesse, J., et al. Single-cell transcriptomics defines heterogeneity of epicardial cells and fibroblasts within the infarcted murine heart. eLife. 10, e65921(2021).
- Streef, T. J., Smits, A. M. Epicardial contribution to the developing and injured heart: Exploring the Cellular composition of the epicardium. Front Cardiovasc Med. 8, 750243(2021).
- Sanchez-Fernandez, C., et al. Understanding epicardial cell heterogeneity during cardiogenesis and heart regeneration. J Cardiovasc Dev Dis. 10 (9), 376(2023).
- Quijada, P., et al. Coordination of endothelial cell positioning and fate specification by the epicardium. Nat Commun. 12 (1), 4155(2021).
- Mantri, M., et al. Spatiotemporal single-cell RNA sequencing of developing chicken hearts identifies interplay between cellular differentiation and morphogenesis. Nat Commun. 12 (1), 1771(2021).
- Paul, S., Zhang, X., He, J. Q. Homeobox gene Meis1 modulates cardiovascular regeneration. Semin Cell Dev Biol. 100, 52-61 (2020).
- Stankunas, K., et al. Pbx/Meis deficiencies demonstrate multigenetic origins of congenital heart disease. Circ Res. 103 (7), 702-709 (2008).
- Liu, Y., et al. Transcription factor Meis1 act as a new regulator of ischemic arrhythmias in mice. J Adv Res. 39, 275-289 (2022).
- Behringer, R. Manipulating the mouse embryo: A laboratory manual. , Cold Spring Harbor Lab Press. Cold Spring Harbor, New York. (2014).
- Wong, M. D., et al. 4D atlas of the mouse embryo for precise morphological staging. Development. 142 (20), 3583-3591 (2015).
- Morris, L., Klanke, C., Lang, S., Lim, F. Y., Crombleholme, T. TdTomato and EGFP identification in histological sections: Insight and alternatives. Biotech Histochem. 85 (6), 379-387 (2010).
- Schiaffino, S., Rossi, A. C., Smerdu, V., Leinwand, L. A., Reggiani, C. Developmental myosins: expression patterns and functional significance. Skelet. Muscle. 5 (1), 22(2015).
- Eissa, N., et al. Stability of reference genes for messenger RNA quantification by real-time pcr in mouse dextran sodium sulfate experimental colitis. PLOS One. 11 (5), e0156289(2016).
- Livak, K. J., Schmittgen, T. D. Analysis of relative gene expression data using real-time quantitative PCR and the 2−ΔΔCT method. Methods. 25 (4), 402-408 (2001).
- Lai, S. R., Andrews, L. G., Tollefsbol, T. O. RNA interference using a plasmid construct expressing short-hairpin RNA. Methods Mol Biol. 405, 31-37 (2007).
- Carmona, R., Barrena, S., López Gambero, A. J., Rojas, A., Muñoz-Chápuli, R. Epicardial cell lineages and the origin of the coronary endothelium. FASEB J. 34 (4), 5223-5239 (2020).
- Gittenberger-de Groot, A. C., Vrancken Peeters, M. P. F. M., Mentink, M. M. T., Gourdie, R. G., Poelmann, R. E. Epicardium-derived cells contribute a novel population to the myocardial wall and the atrioventricular cushions. Circ Res. 82 (10), 1043-1052 (1998).
- Chong, Z. X., Yeap, S. K., Ho, W. Y. Transfection types, methods and strategies: A technical review. Peer J. 9, e11165(2021).
- Kałużna, E., Nadel, A., Zimna, A., Rozwadowska, N., Kolanowski, T. Modeling the human heart ex vivo-Current possibilities and strive for future applications. JTERM. 16 (10), 853-874 (2022).
- Aguilera-Castrejon, A., et al. Ex utero mouse embryogenesis from pre-gastrulation to late organogenesis. Nature. 593 (7857), 119-124 (2021).
- Dyer, L. A., Patterson, C. A novel ex vivo culture method for the embryonic mouse heart. J Vis Exp. (75), e50359(2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved