Method Article
マウス胚性心臓における遺伝子導入のための効率的なトランスジェネシスアプローチ
要約
このプロトコルは、マウスの心臓の発達における心臓細胞のエレクトロポレーションベースのトランスジェネシスのための詳細な方法論的フレームワークを示しています。ここで提供されるビデオアセットは、この汎用性の高い手法の学習を容易にします。
要約
哺乳類の心臓は、非常に多様な前駆細胞集団 を介して 発生中に形成される複雑な器官です。これらの先駆者の起源、加入のタイミング、および運命は、この器官の適切な発達にとって重要です。心臓の形態形成を支配する分子機構は、先天性心疾患の病因や胚性心臓再生の理解に不可欠です。これらのメカニズムを調査するための古典的なアプローチでは、トランスジェニックマウスの作製を使用して、心臓発生中の特定の遺伝子の機能を評価しました。しかし、マウスのトランスジェネシスは複雑で時間のかかるプロセスであり、心臓の発達における特定の遺伝子の役割を評価するために実行できないことがよくあります。これに対処するために、マウス胚の心臓の効率的なエレクトロポレーションと培養のためのプロトコルを開発し、一過性トランスジェネシスが心臓の発生に関与する遺伝子の機能獲得または機能喪失の影響を迅速に評価できるようにしました。この方法論を用いて、心外膜細胞トランスフェクションを好む胚性心臓におけるMeis1の過剰発現に成功し、この技術の能力を実証しました。
概要
心臓は、胚発生中に形成される最初の器官です。このプロセスには、胚の異なる領域から得られる前駆細胞のさまざまな集団の時空間的な調整が含まれます。これらはすべて、発達中の心臓が鼓動し、機能し続ける間に起こり、その形成に必要な顕著な協調性が強調されています1,2,3。心臓の重要な役割を考えると、細胞レベルおよび分子レベルでの厳密な制御は、その適切な形成に不可欠です4,5。心臓の発達を制御するメカニズムを特定することは、世界中のかなりの数の患者に影響を与える先天性心疾患の解明に不可欠であるため、非常に興味深いものでした6。さらに、出生後の哺乳類の心臓は、成人期に失われたり妨げられたりする再生能力を保持しているため、心臓の発達を理解することは心臓の再生を解読する上で極めて重要です7,8。したがって、先天性心疾患と心臓再生に関する研究を進めるためには、心臓発生の分子調節因子を解剖することが不可欠です。
この目的を追求するために、心臓の発達と再生における心外膜の役割を調査することにますます注目が集まっています9。心外膜は、哺乳類の心臓の最外層を構成する中皮組織の薄い層です(図1)。最近の研究では、心臓損傷時の心外膜の重要性が示されており、この組織が患部の心筋細胞に増殖シグナルを送信して損傷を軽減できることが明らかになっています10,11。心外膜の重要性にもかかわらず、さらなる分子研究を行うことは、その巨大な不均一性によって課題とされてきました。シングルセルRNAseq実験により、心外膜の不均一性が明らかになり、異なるトランスクリプトームシグネチャ12,13,14,15,16を持つ複数の細胞亜集団が収容されています。したがって、心臓発生の潜在的な調節因子をスクリーニングする戦略は、心外膜前駆細胞の多様性に対応する必要があります。
この意味で、マウスモデルの遺伝子改変に対する適合性は、心臓の発達に不可欠な多数の遺伝子の同定を容易にし、特定の遺伝子の機能獲得(GOF)または機能喪失(LOF)を持つ変異株の生成を可能にしました。ただし、これらのアプローチは、時間と実験リソースのかなりの投資を意味します。したがって、多数の候補遺伝子の役割を評価する際には実用的ではありません。さらに、発生遺伝子は、多くの場合、さまざまな組織で多面的な機能を発揮したり、初期の胚発生に必要とされたりするため、特定のプロセスでの発生への貢献の解釈を妨げます。特定の構造や発生時点で遺伝子機能を標的とすることは可能ですが、これには通常、より複雑な遺伝子構造の使用が必要であり、生成が困難であったり、一般的に利用できなかったりします。
これらの制限を克服するために、一過性トランスジェネシスのためにマウス胚の心臓をエレクトロポレートする方法を提示します(図2)。ex vivo培養および蛍光活性化セルソーティング(FACS)と組み合わせることで、この戦略は、心臓の発生と再生に関与する十分に特徴付けられた遺伝子であるMeis1の一過性GOFを通じてその能力を実証します17,18,19。この記事では、この方法論の他の潜在的なアプリケーションについても検討し、その利点と限界、および遺伝子発現を一過性に調節するための既存のプロトコルとの比較について説明します。提示されたフレームワークと視覚的な例は、発生および疾患中の心外膜生物学の理解を深めると信じています。
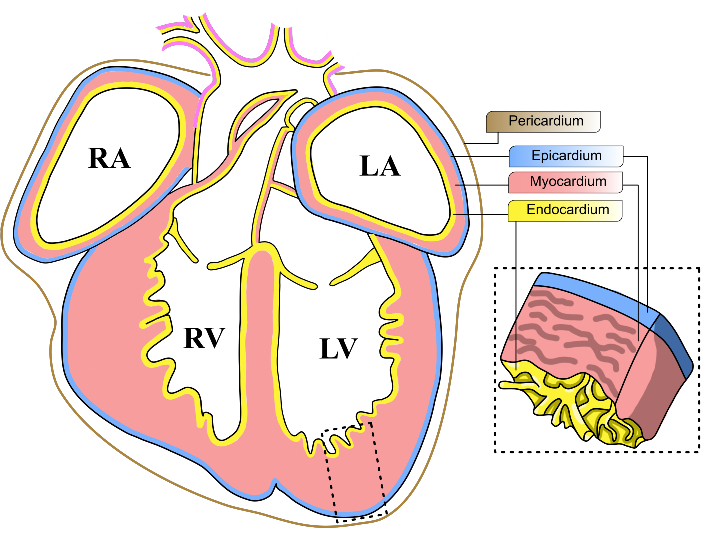
図1:マウスの胚の心臓層。 E13-14マウス胚の心臓の冠状図の概略図。心臓の3つの主要な細胞層は、黄色(心内膜)、赤(心筋)、青(心外膜)で表されます。心膜は茶色の線で表されます。心臓の4つの心室は 、LV、 左心室と略されます。 RV、 右心室; LA、 左心房; RA、 右心房。 この図の拡大版を表示するには、ここをクリックしてください。

図2:心臓エレクトロポレーションプロトコルの概略図の概要。この図の拡大版を見るには、ここをクリックしてください。
プロトコル
すべての動物実験は、CNIC動物実験倫理委員会によって承認され、EU指令2010/63EUおよび勧告2007/526/ECを含む現行の法律に準拠しており、Real Decreto 53/2013に基づくスペインの法律によって施行されています。このプロトコルのために、15〜21週齢の雌の野生型CD-1マウスを用いた。使用した動物、試薬、機器の詳細については、 資料表に記載しています。
1. プラスミドとツールの準備
- まず、目的のプラスミドDNAを最終濃度1 μg/μLの氷に添加して、エレクトロポレーションミックスを調製します。次に、スクロースを最終濃度6%(PBSに溶解)、生体適合性色素を0.01%で添加して混合物を完成させ、最終容量が30 μLになるまでPBSで完成させます。
注:サンプルあたり約1〜2μLのエレクトロポレーションミックスが使用されます。エレクトロポレーションミックスの比率を、実験のサンプル数に応じてスケールします。エレクトロポレーション用のDNAは、最適な安定性と最小限の汚染物質を確保するために、細菌培養物から精製する必要があることを忘れないでください。本試験で使用したプラスミドの詳細については、代表的な結果のセクションをご覧ください。 - Dulbecco's Modified Eagle Medium(DMEM)に10%ウシ胎児血清(FBS)、2%Hepes緩衝液、および1%ペニシリン/ストレプトマイシンを添加して、増殖培地を調製します。使用するまで、培地をインキュベーターに37°Cで保管してください。さらに、1x PBSを37°Cで温め、増殖培地と一緒に温めます。
- ピペットプーラーを使用して直径20μmのガラスキャピラリーを伸ばし、次の条件で針を準備します:熱= 550;プル= 100;速度 = 250;時間 = 120。引っ張った後の最終的な直径は、約5〜8μmである必要があります。
- エレクトロポレーターのパラメータを、40 V で 5 つの 50 ms サイクルに 900 ms の間隔で設定します。電極、マウスピペット、および鈍針を準備します(図3A)。ピペットに針を装備してDNAをロードします(図3A)。
2.胚解剖と心臓摘出
- 野生型CD-1マウス間の交配を設定します。翌朝、膣栓を示す女性を選択し、今回は胚の日E0.5として記録します。胚の日 E12-12.5 で動物を子宮頸部脱臼により安楽死させます (施設で承認されたプロトコルに従います)。
- マウスから子宮を慎重に抽出し、乾いたペーパータオルに入れます。これに続いて、ハサミの先端を中心側に挿入し、刃の端を全長にわたってゆっくりと走らせることにより、細いハサミを使用して子宮を切断します。脱落膜を露出させ、それらを成長培地に移します。詳細については、Behringer et al.20の論文をご覧ください。
- 脱落膜を解剖して胚を抽出し、次に胚を温かい成長培地を入れた60mmのシャーレに胚を置きます。細い鉗子を使用して、体の体幹だけが残るように胚の尾と頭を慎重に切ります。胚の病期は、Wongら21によって記述されているように、解剖学的特徴を評価することによって検証することができる。
- 次に、心臓や肺動脈、大動脈に損傷を与えることなく、胚の幹からできるだけ多くの組織を慎重に取り除きます。心臓が露出したら、すぐに新しい温かい成長培地に入れ、エレクトロポレーションまで37°Cのインキュベーターに保管します。
注:心臓の温度を維持することは、心臓が生き残るために非常に重要です。メディウムが常に暖かいことを確認し、5〜10分ごとに交換します。一方、サンプルは無菌性を維持せずに取り扱うことができますが、これは手順の効率に影響を与えません。増殖培地には抗生物質が含まれていることに注意してください。
3. 心臓エレクトロポレーションと ex vivo 培養
- 約10 μLのプラスミドミックス(ステップ1.1で調製)をマウスピペットで慎重に吸引して針にロードします。
- エレクトロポレーション用のシングルハートを、37°Cに温めた滅菌済みの1x PBSを入れた清潔な60mmペトリ皿に入れて準備します。 皿を解剖顕微鏡の下に置きます(図3A)。
- 正極と負極の間の距離を約4mmに調整して、電極を準備します(図3B)。
注意: 4 mmは、この作業で使用する電極にE12.5マウスハートが収まる絞り距離です。この距離は、サンプルサイズや電極の仕様によって異なるため、変更することを検討してください。 - 口のピペットの針で心臓の最も表面的な層を優しく穿刺します。プラスミドミックス1〜2μLを慎重にピペットで取り、針を取り出します。最適な浸透を確保し、エレクトロポレーション細胞の数を拡大するために、複数回の注入を行うことができます。
- 心臓が両極の間にくるように電極を所定の位置に保持します(図3C)。次に、上記の条件で心臓をエレクトロポレーションします。
注:エレクトロポレーション効率を最大限に高めるために、電極の極性を切り替えて別のパルスを与えることができます。 - エレクトロポレーションした心臓を、1 mLの増殖培地を含む新しい12ウェルプレートに移し、37°C、5%CO2に置きます。
- 実験のすべてのサンプルがエレクトロポレーションされるまで、ステップ3.1から3.6を繰り返します。最後に、すべての心臓をインキュベーター内で37°C、5%CO2で24 時間または分析するまでインキュベートします。
注:私たちの手の中で、心臓は最大48時間培養中に放置され、明らかな劣化の兆候は見られません(補足動画1;補足ムービー2;補足図1)。
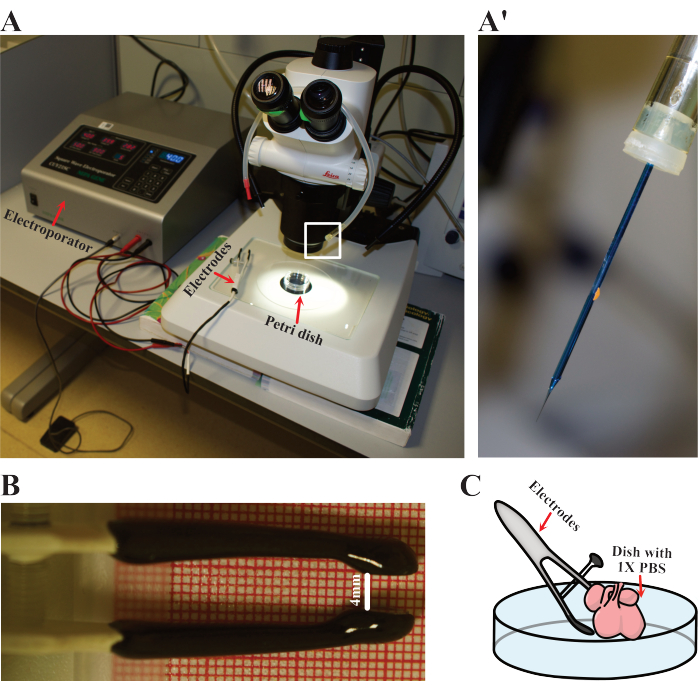
図3:エレクトロポレーションのセットアップ。 (A)エレクトロポレーションに使用されるセットアップ。赤い矢印は、心臓がエレクトロポレーションされるエレクトロポレーター、電極、シャーレを示しています。(A')(A)で白い長方形で強調表示されているエレクトロポレーション針の細部。(B)E12.5ハートに使用されている電極の調整距離の詳細。(C)エレクトロポレーションの概略図。 この図の拡大版を表示するには、ここをクリックしてください。
4. 細胞選別および免疫組織化学解析
- サンプルのセルソーティング分析では、400 μL のリベラーゼ (5 mg/mL)、300 μL のディスパーゼ (0.1 g/mL)、4 μL の CaCl2 (0.4 μM)、50 μL の MgCl2 (5 μM) を混合して組織を解離するための消化培地を調製し、10 mL の DMEM まで完了します。使用するまで氷の上に置いてください。各心臓には約1mLの消化培地が必要です。サンプル数に応じてボリュームを調整します。
注:免疫組織化学では、心臓を1.5mLの4%PFAに直接固定し、室温で2時間、または4°Cで一晩固定します。 翌日、PBSで心臓を3回洗浄し、下流の組織学的および免疫染色手順に進みます。詳細な免疫組織化学プロトコルについては、Morris et al.22を参照してください。 - 培養中の各心臓を、1 mLの氷冷消化培地を含む新しいチューブに移します。
- 解離を促進するために、シリンジでプレジャーを3〜4回穏やかに適用して組織をチョップし、すぐに37°C、600rpmのホットプレートで45分間インキュベートします。
- 消化ミックスを70 μmのセルストレーナーで新しいチューブにろ過し、重力流で空にします。次に、パススルーボリュームをレスキューし、40 μmセルストレーナーを使用して新しい50 mLチューブに再度ろ過します。
- 500 μL のウシ胎児血清 (FBS) を添加し、コールド DMEM を使用して最大 30 mL で完成させます。
- 混合物を240 x g で室温で10分間遠心分離します。
- 上清を捨て、50mLのチューブを逆さまにしてペーパータオルの上に置き、完全に乾かします。
注:これは、細胞ペレットを凍結して実験を一時停止するのに便利なポイントです。その場合は、細胞を10% DMSOでFBSに再懸濁し、-80°Cで保存します。 - 細胞ソーティングの場合は、細胞を300 μLのソーティングバッファー(1% FBS、1%ペニシリン/ストレプトマイシン含有PBS)に再懸濁し、0.3 μLのDAPI(1000x)を添加します。セルソーティングを実行します。
結果
関連する心臓発達調節因子の機能獲得(GOF)実験の実施におけるこの技術の有効性を実証するために、Meis1転写因子を過剰発現するコンストラクトをエレクトロポレーションしました。これを達成するために、E9.5胚からRNAを抽出し、逆転写を行って相補的DNA(cDNA)を得ました。cDNAをテンプレートとして使用して、Meis1コード配列をpCAG発現プラスミド(以下、pCAG::Meis1と呼ぶ)にクローニング(補足表 1)し、構成的GFP発現プラスミド(pCAG::GFP)をコントロールとして使用しました。次に、心臓をpCAG::GFPのみ、またはpCAG::Meis1と組み合わせてエレクトロポレーションしました。
エレクトロポレーション後24時間後(hpe)、心臓は鼓動しており、良好な状態にあるように見えました(図4A;補足ムービー1;補足ムービー2)。エレクトロポレーション細胞の生存率を評価するために、カスパーゼ3の免疫組織化学的染色を通じてアポトーシスを分析しました。心臓内では陽性細胞がいくつか検出されたが、心筋もエレクトロポレーション細胞の大部分が位置する心外膜も、アポトーシスの影響を受けていないことが判明した(補足図1C)。蛍光活性を評価したところ、心臓のほぼすべての4つの心室でモザイクGFPシグナルが観察され、このプロトコルが心臓構造の大部分に到達できることが示されました(図4A)。エレクトロポレーションされた心臓細胞の種類を決定するために、pCAG::GFPエレクトロポレーションされた心臓を心外膜WT12および心筋MF2023のマーカーに対して免疫染色し、次に共焦点顕微鏡を使用してイメージングしました(図4B)。GFP+細胞の大部分は心臓の外部領域に優先的に位置しており、これはWT1シグナルとほぼ一致しており、この方法が心外膜細胞に到達するのに最も効率的であることを示しています(図4B、白い矢印)。
一方、pCAG::Meis1-エレクトロポレーションまたはコントロール(pCAG::GFPのみ)の心臓を解離し、プロトコルのステップ4に記載されているように、細胞を蛍光活性化セルソーティング(FACS)して、GFP+細胞を全臓器から単離した。選別した細胞からRNAを抽出し、逆転写定量PCR(RT-qPCR)を実施して、トランスフェクションした細胞におけるMeis1の発現レベルを評価しました(図4C、補足表1)。マウスハウスキーピング遺伝子Eef224の発現レベルを用いて総Meis1遺伝子発現を正規化し、ΔΔCt法25を用いて相対的遺伝子発現を計算した。pCAG::Meis1プラスミドを投与した心臓では、pCAG::GFPプラスミドのみを投与した心臓と比較して、Meis1 RNAレベルの有意なアップレギュレーションが観察されました(図4C)。したがって、これは、目的の遺伝子を過剰発現し、分子結果に対処する技術の可能性を示しています。

図4:エレクトロポレーションE12.5 心臓 の分子解析。(A)エレクトロポレーションの24時間後における1つのCAG::GFPエレクトロポレーション心臓のGFP蛍光。下の画像はGFPの蛍光を示し、上の画像はGFPと同じ心臓の明るい視野の融合を示しています。(B)エレクトロポレーションされたE12.5心臓組織切片の免疫蛍光。MF20は心筋細胞をマークし、WT1は心筋細胞をマークします。右側の画像は、白い四角形の拡大に対応しています。白い矢印は心外膜に位置するGFP+細胞を示し、おおよそ白い点線で区切られています。(C)pCAG::Meis1またはpCAG::GFPでエレクトロポレーションした心臓のRT-qPCR解析(コントロール)。各ドットは、3つの心臓を一緒にプールして得られる生物学的複製を表しています。合計で、qPCR解析は3つの異なる生物学的複製で3回に分けて行われました。統計解析は、スチューデントのt検定(*P < 0.05)を用いて行いました。スケールバー:200μmこの 図の拡大版を表示するには、ここをクリックしてください。
補足図1:心臓エレクトロポレーションの効率と細胞生存率。 (A)エレクトロポレーション後24時間または48時間後(hpe)にコントロールプラスミドpCAG::GFPを使用してエレクトロポレーションした2つの異なるE12.5心臓におけるGFPの発現。GFP信号像は、同じ心臓の明視野像に重ね合わせました。(B)コントロールpCAG::GFPでエレクトロポレーションした24 hpeおよび48 hpe心臓におけるGFP+細胞定量。ドットは個別のサンプルを示します。実線は平均を示し、エラーバーは標準偏差を示します。両方の条件間で有意差は観察されませんでした(ノンパラメトリック t検定; P > 0.9)。(C)切断されたカスパーゼ3およびMF20に対して免疫染色されたpCAG::GFPでエレクトロポレーションされたE12.5心臓の共焦点画像。点線は心臓の心筋層を表しています。右側の画像は、白い長方形から拡大されています。スケールバー:100μm. このファイルをダウンロードするには、ここをクリックしてください。
補足表1:プライマーの要約と配列。このファイルをダウンロードするには、ここをクリックしてください。
補足動画1:24時間後のpCAG::GFPエレクトロポレーション心臓。 施術後24時間後にpCAG::GFPコントロールプラスミドでエレクトロポレーションした1つの心臓を捉えた動画。心臓は鼓動し続け、エレクトロポレーション細胞はGFPシグナルを発現します。 この映画をダウンロードするには、ここをクリックしてください。
補足動画2:48時間後のpCAG::GFPエレクトロポレーション心臓。 エレクトロポレーションの48時間後、コントロールpCAG::GFPでエレクトロポレーションされた心臓を示す動画。 この映画をダウンロードするには、ここをクリックしてください。
ディスカッション
全体として、ここで説明する方法論は、Meis1の過剰発現(図4C)で示されているように、発生中の心外膜(図4B)でトランスジェニックコンストラクトを発現するための堅牢なフレームワークを提供します。適切なコンストラクトを使用すると、このプロトコルを使用して、特定の遺伝子の機能獲得(GOF)または機能喪失(LOF)の影響を一過性に評価できます。LOFは、RNA干渉26を介して候補遺伝子を標的とするプラスミドをトランスフェクトすることにより、この技術に実装することができる。遺伝子GOFまたはLOFの迅速な評価は、特に心外膜細胞の大きなトランスクリプトームの不均一性を考慮すると、特に有利であり12、各候補遺伝子を個別に評価するためのトランスジェニック動物を作製することは非現実的である。
このプロトコルはex vivo培養を利用しているため、時間ウィンドウ内の心外膜細胞の運命を調査する可能性を提供します。発達中の心外膜は、成人の心臓内の異なる領域を形成する上で極めて重要な役割を果たします13,27,28;したがって、心臓の発達へのその寄与を理解することは、先天性心奇形の基礎を解剖するのに役立ちます。この記事ではこのアプリケーションについては詳しく説明しませんが、プロトコルで概説されているガイドラインは、心外膜の将来の運命マッピング研究に役立つ可能性があります
現在の方法の実用的な有用性にもかかわらず、特定の制限を認識する必要があります。この方法論は一過性トランスジェネシスに依存しているため、プラスミドの発現は時間の経過とともに失われるかまたは減少する可能性があり、特定の発生ウィンドウを研究するためのプロトコルの範囲を制限する29。しかし、この研究では、エレクトロポレーション後の培養の全期間を通じてGFPの過剰発現が維持されました(48 hpe)。さらに、現在のex vivo培養技術の潜在的な制限は、特にエレクトロポレーション後のex vivo培養が困難になる場合、後期胚または出生後の発生段階を評価するためのこの方法の適用性を妨げます30。ex vivo胚培養のより洗練された方法が存在するが31,32、研究者にとってアクセスしにくい機器の使用が必要になる場合があり、サンプルの生存が保証されない場合がある。
ここで紹介するプロトコルは、再現性を高めるためにできるだけシンプルになるように設計されていますが、成功に役立つ重要なステップが含まれています。まず、胚の解剖は、エレクトロポレーション後の臓器の生存を損なう可能性のある心臓の損傷を最小限に抑えるために、慎重かつ迅速に実施する必要があります。このステップでは、最適な解剖装置の使用とともに、特別なケアを行うことを強くお勧めします。このプロトコルのもう一つの重要な側面は、エレクトロポレーション自体を行うことであり、プラスミド注入が不十分な場合、望ましくない結果が生じる可能性があります。したがって、1つの心臓に複数回の注射を行うことが推奨され、サンプルをかなり表面的な方法で注入することは、臓器の生存率を高めるのに有益である可能性があります。最後に、心臓処理中の細胞解離は、細胞生存率を最大化するために、プロトコルで規定された時間を遵守して厳密に実行する必要があります。
結論として、心臓形成における主要な遺伝子を特定することは、心先天性疾患と再生の根本的なメカニズムを理解するのに役立ちます。ここで確立された方法論により、発達中の心臓における遺伝子の機能獲得(GOF)および機能喪失(LOF)の影響を迅速にスクリーニングすることができます。特定の制限を認識しながら、この方法は、発生のさまざまな段階への外挿または胚性心外膜細胞の運命のマッピングにかなりの可能性を示しています。この記事で提供されている視覚的なガイドラインを通じて、発生中の心外膜の計り知れない複雑さと可能性を評価するための貴重なツールボックスを提供することを目指しています。
開示事項
著者には、開示すべき利益相反はありません。
謝辞
この研究は、スペインのMinisterio de Ciencia e InnovaciónおよびUniversidad de JaénのAcción 9からの助成金RTI2018-097617-J-I00から、スペインのMinisterio de Ciencia e InnovaciónからのO.H.O. 助成金PGC2018-096486-B-I00、EU Horizon 2020プログラムからM.T.への助成金H2020-MSCA-ITN-2016-722427の支援PRE2022を受けました。CNICとCBMSOはどちらもスペイン科学省の支援を受けており、CNICはProCNIC財団の支援を受けています。
資料
| Name | Company | Catalog Number | Comments |
| #55 Forceps | Dumont | 11295-51 | |
| 12-well Clear Flat Bottom Multiwell Cell Culture Plate | BD Falcon | 353043 | |
| 35 mm vise table | Grandado | SKU 8798771617573 | |
| 40 µm Cell Strainer | Fischer Scientific | 08-771-1 | |
| 50 mL tubes | BD Falcon | 352070 | |
| 70 µm Cell Strainer | Corning | CLS431751 | |
| Anti-GFP Policlonal Antibody | Invitrogen | A10262 | 1:1000 dilution used |
| Anti-Myosin 4 (MF20) Monoclonal Antibody | Invitrogen | 14-6503-82 | 1:500 dilution used |
| CD1 Wild Type mice | Provided by Animalary Unit (CNIC) | ||
| Cleaved Caspase-3 (Asp175) Antibody | Cell Signalling Technologies | 9661 | 1:400 dilution used |
| DAPI | Cell Signalling Technologies | 4083 | 1:1000 dilution used |
| Dispase/collagenase | Roche | 10269638001 | |
| Distilled water | |||
| DMEM - Dulbecco's Modified Eagle Medium | Gibco | 10313021 | |
| Fetal Bovine Serum | Invitrogen | 10438-026 | |
| Heracell 150i CO2 Incubator | Thermo Scientific | 51032720 | |
| Leica Stereoscopic Microscope S8AP0 | Leica | 11524102 | |
| Liberase | Roche | 5401119001 | |
| Micropipette Puller Model P-97 | Sutter Instrument | SU-P-97 | |
| pCAG expression plasmid | Addgene | #89689 | |
| Penicillin-streptomycin | Invitrogen | 15070-063 | |
| Petri dishes 35 × 10 mm | BD Falcon | 351008 | |
| Petri dishes 60 × 15 mm | BD Falcon | 353002 | |
| Phenol Red | Merck | P3532 | |
| Pipette tips | Reused from old laboratory equipment | ||
| Rat Serum culture embryo, male rats SPRAGUE DAWLEY RjHan SD | Janvier Labs | 9979 | |
| Recombinant anti-Wilms Tumor Protein 1 (WT1) Antibody | Abcam | ab89901 | 1:300 dilution used |
| Square Wave Electroporator CUY21SC | Nepa Gene | CUY664-10X15 | |
| Sterile PBS | Provided and autoclaved by technical unit | ||
| Sucrose | Millipore | 84100 | |
| Tweezer electrodes with variable gap | Nepa Gene | CUY650P5 |
参考文献
- Tyser, R. C., et al. Calcium handling precedes cardiac differentiation to initiate the first heartbeat. eLife. 5, e17113(2016).
- Tyser, R. C. V., et al. Characterization of a common progenitor pool of the epicardium and myocardium. Science. 371 (6533), 2986(2021).
- Sendra, M., Domínguez, J., Torres, M., Ocaña, O. Dissecting the complexity of early heart progenitor cells. J Cardiovasc Dev Dis. 9 (1), 5(2021).
- Ivanovitch, K., Temiño, S., Torres, M. Live imaging of heart tube development in mouse reveals alternating phases of cardiac differentiation and morphogenesis. eLife. 6, e30668(2017).
- Ai, D., et al. Canonical Wnt signaling functions in second heart field to promote right ventricular growth. PNAS. 104 (22), 9319-9324 (2007).
- Zimmerman, M. S., et al. regional, and national burden of congenital heart disease, 1990-2017: A systematic analysis for the Global Burden of Disease Study 2017. Lancet Chil Adolesc Heal. 4 (3), 185-200 (2020).
- Xin, M., Olson, E. N., Bassel-Duby, R. Mending broken hearts: Cardiac development as a basis for adult heart regeneration and repair. Nat Rev Mol Cell Biol. 14 (8), 529-541 (2013).
- Porrello, E. R., et al. Transient regenerative potential of the neonatal mouse heart. Science. 331 (6020), 1078-1080 (2011).
- Cao, J., Poss, K. D. The epicardium as a hub for heart regeneration. Nat Rev Cardiol. 15 (10), 631-647 (2018).
- Zhou, B., et al. Adult mouse epicardium modulates myocardial injury by secreting paracrine factors. JCI. 121 (5), 1894-1904 (2011).
- Van Wijk, B., Gunst, Q. D., Moorman, A. F. M., Van Den Hoff, M. J. B. Cardiac regeneration from activated epicardium. PLOS One. 7 (9), e44692(2012).
- Hesse, J., et al. Single-cell transcriptomics defines heterogeneity of epicardial cells and fibroblasts within the infarcted murine heart. eLife. 10, e65921(2021).
- Streef, T. J., Smits, A. M. Epicardial contribution to the developing and injured heart: Exploring the Cellular composition of the epicardium. Front Cardiovasc Med. 8, 750243(2021).
- Sanchez-Fernandez, C., et al. Understanding epicardial cell heterogeneity during cardiogenesis and heart regeneration. J Cardiovasc Dev Dis. 10 (9), 376(2023).
- Quijada, P., et al. Coordination of endothelial cell positioning and fate specification by the epicardium. Nat Commun. 12 (1), 4155(2021).
- Mantri, M., et al. Spatiotemporal single-cell RNA sequencing of developing chicken hearts identifies interplay between cellular differentiation and morphogenesis. Nat Commun. 12 (1), 1771(2021).
- Paul, S., Zhang, X., He, J. Q. Homeobox gene Meis1 modulates cardiovascular regeneration. Semin Cell Dev Biol. 100, 52-61 (2020).
- Stankunas, K., et al. Pbx/Meis deficiencies demonstrate multigenetic origins of congenital heart disease. Circ Res. 103 (7), 702-709 (2008).
- Liu, Y., et al. Transcription factor Meis1 act as a new regulator of ischemic arrhythmias in mice. J Adv Res. 39, 275-289 (2022).
- Behringer, R. Manipulating the mouse embryo: A laboratory manual. , Cold Spring Harbor Lab Press. Cold Spring Harbor, New York. (2014).
- Wong, M. D., et al. 4D atlas of the mouse embryo for precise morphological staging. Development. 142 (20), 3583-3591 (2015).
- Morris, L., Klanke, C., Lang, S., Lim, F. Y., Crombleholme, T. TdTomato and EGFP identification in histological sections: Insight and alternatives. Biotech Histochem. 85 (6), 379-387 (2010).
- Schiaffino, S., Rossi, A. C., Smerdu, V., Leinwand, L. A., Reggiani, C. Developmental myosins: expression patterns and functional significance. Skelet. Muscle. 5 (1), 22(2015).
- Eissa, N., et al. Stability of reference genes for messenger RNA quantification by real-time pcr in mouse dextran sodium sulfate experimental colitis. PLOS One. 11 (5), e0156289(2016).
- Livak, K. J., Schmittgen, T. D. Analysis of relative gene expression data using real-time quantitative PCR and the 2−ΔΔCT method. Methods. 25 (4), 402-408 (2001).
- Lai, S. R., Andrews, L. G., Tollefsbol, T. O. RNA interference using a plasmid construct expressing short-hairpin RNA. Methods Mol Biol. 405, 31-37 (2007).
- Carmona, R., Barrena, S., López Gambero, A. J., Rojas, A., Muñoz-Chápuli, R. Epicardial cell lineages and the origin of the coronary endothelium. FASEB J. 34 (4), 5223-5239 (2020).
- Gittenberger-de Groot, A. C., Vrancken Peeters, M. P. F. M., Mentink, M. M. T., Gourdie, R. G., Poelmann, R. E. Epicardium-derived cells contribute a novel population to the myocardial wall and the atrioventricular cushions. Circ Res. 82 (10), 1043-1052 (1998).
- Chong, Z. X., Yeap, S. K., Ho, W. Y. Transfection types, methods and strategies: A technical review. Peer J. 9, e11165(2021).
- Kałużna, E., Nadel, A., Zimna, A., Rozwadowska, N., Kolanowski, T. Modeling the human heart ex vivo-Current possibilities and strive for future applications. JTERM. 16 (10), 853-874 (2022).
- Aguilera-Castrejon, A., et al. Ex utero mouse embryogenesis from pre-gastrulation to late organogenesis. Nature. 593 (7857), 119-124 (2021).
- Dyer, L. A., Patterson, C. A novel ex vivo culture method for the embryonic mouse heart. J Vis Exp. (75), e50359(2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved