Method Article
Эффективный подход к трансгенезу для доставки генов в эмбриональное сердце мыши
В этой статье
Резюме
В этом протоколе представлена подробная методологическая основа для основанного на электропорации трансгенеза сердечных клеток в развивающихся сердцах мышей. Представленные здесь видеоматериалы облегчат изучение этой универсальной техники.
Аннотация
Сердце млекопитающих — сложный орган, формирующийся в процессе развития с помощью очень разнообразных популяций клеток-предшественников. Происхождение, сроки пополнения и судьба этих прародителей имеют жизненно важное значение для правильного развития этого органа. Молекулярные механизмы, которые управляют морфогенезом сердца, имеют важное значение для понимания патогенеза врожденных пороков сердца и эмбриональной регенерации сердца. Классические подходы к исследованию этих механизмов использовали создание трансгенных мышей для оценки функции конкретных генов во время развития сердца. Тем не менее, трансгенез у мышей является сложным, трудоемким процессом, который часто не может быть выполнен для оценки роли конкретных генов в развитии сердца. Чтобы решить эту проблему, мы разработали протокол эффективной электропорации и культивирования эмбриональных сердец мышей, что позволяет с помощью транзиторного трансгенеза быстро оценить влияние усиления или потери функции генов, участвующих в развитии сердца. Используя эту методологию, мы успешно сверхэкспрессировали Meis1 в эмбриональном сердце, отдавая предпочтение трансфекции эпикардиальных клеток, демонстрируя возможности метода.
Введение
Сердце – это первый орган, который формируется во время эмбрионального развития. Этот процесс включает в себя пространственно-временную координацию различных популяций клеток-предшественников из различных областей эмбриона. Все это происходит в то время, когда развивающееся сердце продолжает биться и функционировать, подчеркивая замечательную координацию, необходимую для его формирования 1,2,3. Учитывая решающую роль сердца, строгая регуляция на клеточном и молекулярном уровнях имеет важное значение для его правильного формирования 4,5. Выявление механизмов, контролирующих развитие сердца, представляет большой интерес, поскольку они имеют решающее значение для раскрытия врожденных пороков сердца, которые поражают значительное числопациентов во всем мире. Кроме того, понимание развития сердца имеет решающее значение для расшифровки регенерации сердца, поскольку послеродовое сердце млекопитающих сохраняет регенеративную способность, которая теряется или затрудняется во взрослом возрасте. Следовательно, препарирование молекулярных регуляторов развития сердца является обязательным условием для продвижения исследований врожденных пороков сердца и регенерации сердца.
В стремлении к достижению этой цели все большее внимание уделяется исследованию роли эпикарда в развитии и регенерации сердца9. Эпикард представляет собой тонкий слой мезотелиальной ткани, который составляет самый внешний слой сердца млекопитающих (Рисунок 1). Недавние исследования показали важность эпикарда при повреждении сердца, показав, что эта ткань способна посылать сигналы пролиферации кардиомиоцитам в пораженной области, чтобы смягчить повреждение10,11. Несмотря на важность эпикарда, проведение дальнейших молекулярных исследований было затруднено из-за его огромной гетерогенности. Эксперименты с РНК одиночных клеток выявили гетерогенность эпикарда, содержащего несколько клеточных субпопуляций с различными транскриптомными сигнатурами 12,13,14,15,16. Таким образом, стратегия скрининга потенциальных регуляторов сердечного развития должна учитывать разнообразие эпикардиальных клеток-предшественников.
В этом смысле способность мышиной модели к генетической модификации способствовала идентификации многочисленных генов, имеющих решающее значение для развития сердца, что позволило создать мутантные линии с усилением функции (GOF) или потерей функции (LOF) определенных генов. Однако такие подходы предполагают значительные вложения времени и экспериментальных ресурсов; Поэтому они непрактичны при оценке роли большого числа генов-кандидатов. Кроме того, гены развития часто проявляют плейотропные функции в различных тканях или необходимы для раннего эмбрионального развития, что затрудняет интерпретацию их вклада в развитие в конкретном процессе. Несмотря на то, что можно нацелить функцию гена на определенные структуры или временные точки развития, это обычно требует использования более сложных генетических конструкций, которые может быть трудно создать или которые вообще недоступны.
Чтобы преодолеть эти ограничения, мы представляем методологию электропорации эмбриональных сердец мышей для транзиторного трансгенеза (рис. 2). В сочетании с культурой ex vivo и флуоресцентно-активируемой сортировкой клеток (FACS) эта стратегия демонстрирует свои возможности через транзиторный GOF Meis1, хорошо охарактеризованный ген, участвующий в развитии и регенерации сердца 17,18,19. В данной статье также исследуются другие потенциальные применения этой методологии, а также обсуждаются ее преимущества и ограничения, а также сравнение с существующими протоколами для транзиторной модуляции экспрессии генов. Мы считаем, что представленная структура и наглядные примеры улучшат понимание биологии эпикарда во время развития и болезни.
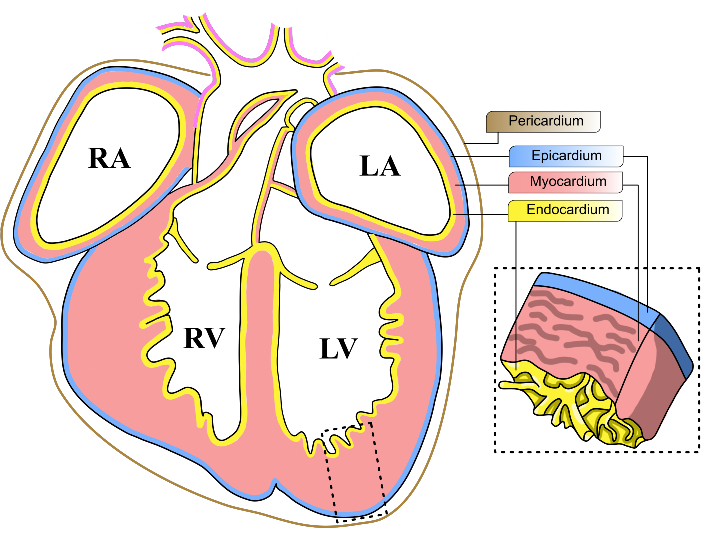
Рисунок 1: Эмбриональные слои сердца мыши. Принципиальная схема коронального изображения эмбрионального сердца мыши E13-14. Три основных клеточных слоя сердца представлены желтым (эндокард), красным (миокард) и синим (эпикардом) цветом. Перикард представлен коричневой линией. Четыре камеры сердца сокращенно обозначаются как ЛЖ – левый желудочек; ПЖ, правый желудочек; Лос-Анджелес, левое предсердие; РА, правое предсердие. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Схематический обзор протокола электропорации сердца. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
протокол
Все процедуры на животных были одобрены Комитетом по этике экспериментов на животных CNIC и соответствуют действующему законодательству, включая Директиву ЕС 2010/63EU и Рекомендацию 2007/526/EC, как это предусмотрено испанским законодательством в соответствии с Real Decreto 53/2013. Для этого протокола использовались самки мышей дикого типа CD-1 в возрасте 15-21 недели. Подробная информация об используемых животных, реагентах и оборудовании приведена в Таблице материалов.
1. Плазмида и подготовка инструмента
- Сначала приготовьте смесь для электропорации, добавив желаемую плазмидную ДНК в лед в конечной концентрации 1 г/л. Затем завершите смесь, добавив сахарозу в конечную концентрацию 6% (растворенную в PBS), биосовместимый краситель в дозе 0,01% и добавьте PBS до конечного объема 30 мкл.
ПРИМЕЧАНИЕ: На один образец используется примерно 1-2 мкл электропорационной смеси. Масштабируйте пропорции электропорационной смеси в соответствии с количеством образцов в эксперименте. Помните, что ДНК для электропорации должна быть очищена от бактериальной культуры, обеспечивая оптимальную стабильность и минимальное количество загрязнений. Для получения более подробной информации о плазмидах, использованных в этом исследовании, обратитесь к разделу репрезентативных результатов. - Приготовьте питательную среду, добавив модифицированную среду Dulbecco Modified Eagle Medium (DMEM) с 10% фетальной бычьей сывороткой (FBS), 2% буфером Hepes и 1% пенициллином/стрептомицином. Выдерживайте среду в инкубаторе при температуре 37 °C до использования. Кроме того, нагрейте 1x PBS при 37 °C вместе со средой для выращивания.
- Подготовьте иглы, растянув стеклянный капилляр диаметром 20 мкм с помощью съемника пипетки при следующих условиях: нагрев = 550; pull = 100; скорость = 250; время = 120. Конечный диаметр после вытягивания должен составлять примерно 5-8 мкм.
- Установите параметры электропоратора на пять циклов по 50 мс при напряжении 40 В с интервалом 900 мс. Подготовьте электроды, ротовую пипетку и тупую иглу (рисунок 3A). Вооружите пипетку иглой для загрузки ДНК (рисунок 3А).
2. Вскрытие эмбрионов и экстракция сердца
- Установите нечто среднее между мышами дикого типа CD-1. На следующее утро выберите самок с вагинальной пробкой и отметьте это время как эмбриональный день E0,5. Усыпить животных на эмбриональные сутки Е12-12,5 путем вывиха шейки матки (в соответствии с утвержденными в учреждении протоколами).
- Аккуратно извлеките матку из мышки и поместите ее в сухое бумажное полотенце. После этого разрежьте матку с помощью тонких ножниц, вставив кончик ножниц в мезометрическую сторону и медленно проведя краем лезвия по всей длине. Выдержите децидуаны и перенесите их в питательную среду. Более подробную информацию можно найти в работе Behringer et al.20.
- Препарируйте децидуаи для извлечения эмбрионов, затем поместите эмбрионы в чашку Петри диаметром 60 мм с теплой питательной средой. С помощью тонких щипцов аккуратно разрежьте хвост и голову эмбриона так, чтобы от тела остался только ствол. Стадия эмбрионов может быть проверена путем оценки анатомических особенностей, как описано Wong et al.21.
- Затем с осторожностью удалите как можно больше ткани из ствола эмбриона, не повреждая сердце или легочные артерии и артерии аорты. Как только сердце будет обнажено, немедленно поместите его в новую, теплую среду для выращивания и держите в инкубаторе при температуре 37 °C до электропорации.
ПРИМЕЧАНИЕ: Поддержание температуры сердца имеет решающее значение для его выживания. Следите за тем, чтобы среда всегда была теплой, и меняйте ее каждые 5-10 минут. С другой стороны, с образцами можно работать без сохранения стерильности, так как это не повлияет на эффективность процедуры. Обратите внимание, что питательная среда содержит антибиотики.
3. Электропорация сердца и культивирование ex vivo
- Загрузите примерно 10 μл плазмидной смеси (приготовленной на шаге 1.1) в иглу, осторожно отсасывая вверх с помощью ротовой пипетки.
- Подготовьте одно сердце для электропорации, поместив его в чистую чашку Петри диаметром 60 мм со стерильным 1x PBS, нагретым до 37 °C. Поместите чашку под препарирующий микроскоп (рисунок 3A).
- Подготовьте электроды, отрегулировав расстояние между положительным и отрицательным полюсами примерно до 4 мм (Рисунок 3B).
ПРИМЕЧАНИЕ: 4 мм — это расстояние до апертуры, на котором сердечки мыши E12.5 помещаются в электроды, используемые в этой работе. Рассмотрите возможность изменения этого расстояния в зависимости от размера образца или спецификаций электродов. - Аккуратно проколите самый поверхностный слой сердца иглой в ротовой пипетке. Осторожно нанесите пипеткой 1-2 мкл плазмидной смеси и извлеките иглу. Многократные инъекции могут быть выполнены для обеспечения оптимального проникновения, а также для увеличения количества электропорированных ячеек.
- Удерживайте электроды на месте так, чтобы сердце находилось между обоими полюсами (рисунок 3C). Затем проводят электропорацию сердца при указанных выше условиях.
ПРИМЕЧАНИЕ: Для обеспечения максимальной эффективности электропорации имеется возможность переключения полярности электродов и подачи еще одного импульса. - Перенесите электропорированное сердце в новую 12-луночную пластину, содержащую 1 мл питательной среды, и поместите ее при температуре 37 °C, 5%CO2.
- Повторяйте шаги с 3.1 по 3.6 до тех пор, пока все образцы в эксперименте не будут подвергнуты электропоре. Наконец, инкубируйте все сердца в инкубаторе при температуре 37 °C, 5%CO2, в течение 24 ч или до анализа.
ПРИМЕЧАНИЕ: В наших руках сердца могут быть оставлены в культуре на срок до 48 часов без видимых признаков разрушения (Дополнительный фильм 1; Дополнительный фильм 2; Дополнительный рисунок 1).
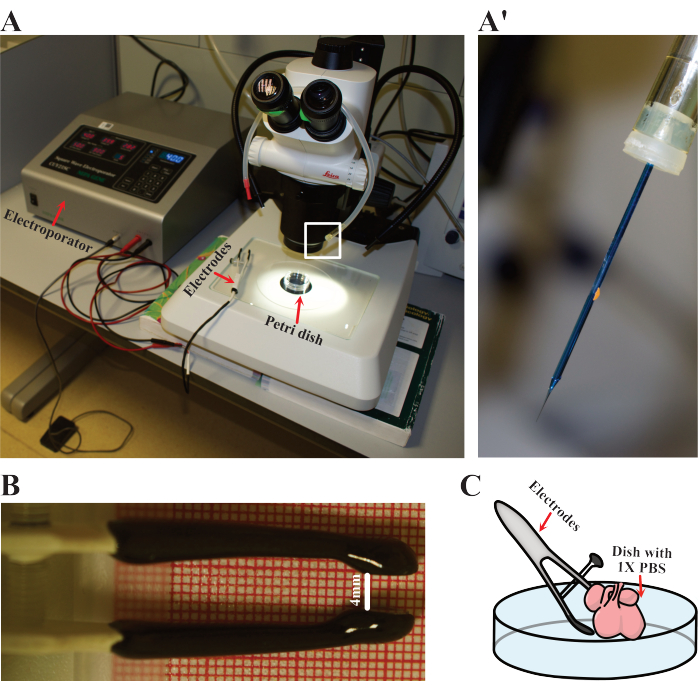
Рисунок 3: Установка электропорации. (А) Установка, используемая для электропорации. Красными стрелками обозначены электропоратор, электроды и чашка Петри, в которую электропорируются сердца. (А') Деталь иглы электропорации, как показано на рисунке (A) белым прямоугольником. (B) Подробная информация о скорректированном расстоянии до электродов, используемых в сердцах E12.5. (В) Схематическое изображение электропорации. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
4. Сортировка клеток и иммуногистохимический анализ
- Для анализа образцов с помощью сортировки клеток приготовьте среду для расщепления ткани, смешав 400 мкл либеразы (5 мг/мл), 300 мкл диспазы (0,1 г/мл), 4 мкл CaCl2 (0,4 мкМ), 50 мкл MgCl2 (5 мкМ) и доведите до 10 мл DMEM. Держите на льду до использования. Каждому сердцу требуется примерно 1 мл пищеварительной среды. Отрегулируйте объемы в соответствии с количеством образцов.
ПРИМЕЧАНИЕ: Для иммуногистохимии непосредственно зафиксируйте сердце в 1,5 мл 4% PFA в течение 2 ч при ЛТ или на ночь при 4 °C. На следующий день промойте сердца 3 раза с помощью PBS и приступайте к последующим гистологическим процедурам и процедурам иммуноокрашивания. Подробный протокол иммуногистохимии см. в Morris et al.22. - Переложите каждое сердце в культуре в новую пробирку, содержащую 1 мл ледяной среды для разложения.
- Чтобы облегчить диссоциацию, измельчите ткань, аккуратно прикладывая удовольствие шприцем 3-4 раза, и немедленно инкубируйте в горячей плите при температуре 37 °C, 600 об/мин в течение 45 минут.
- Отфильтруйте смесь для разложения через сетчатое фильтр 70 μм в новую пробирку и дайте ей опорожниться под действием силы тяжести. Затем отключите сквозной объем и снова отфильтруйте его с помощью клеточного сетчатого фильтра 40 мкм в новую пробирку объемом 50 мл.
- Добавьте 500 мкл фетальной бычьей сыворотки (FBS) и доведите до 30 мл с помощью холодного DMEM.
- Центрифугируйте смесь при плотности 240 х г в течение 10 минут при комнатной температуре.
- Выбросьте надосадочную жидкость и положите пробирку объемом 50 мл вверх дном на бумажное полотенце для полного высыхания.
ПРИМЕЧАНИЕ: Это удобный момент для приостановки эксперимента, заморозив клеточную гранулу. Если это так, ресуспендируйте клетки с 10% ДМСО в FBS и храните при -80 °C. - Для сортировки клеток ресуспендируйте клетки в 300 мкл сортировочного буфера (1% FBS, 1% пенициллин/стрептомицин в PBS) и добавьте 0,3 мкл DAPI (1000x). Выполните сортировку ячеек.
Результаты
Чтобы продемонстрировать эффективность этого метода при проведении экспериментов по усилению функции (GOF) для соответствующих регуляторов развития сердца, была проведена электропорация с гиперэкспрессией транскрипционного фактора Meis1. Для этого из эмбрионов E9.5 была выделена РНК, а для получения комплементарной ДНК (кДНК) была проведена обратная транскрипция. Используя кДНК в качестве матрицы, кодирующую последовательность Meis1 клонировали (Дополнительная таблица 1) в экспрессирующую pCAG плазмиду (далее именуемую pCAG::Meis1), в то время как в качестве контроля использовали конститутивную GFP-экспрессирующую плазмиду (pCAG::GFP). Затем сердца подвергали электропорации либо только pCAG::GFP, либо в комбинации с pCAG::Meis1.
Через 24 ч после электропорации (ГЭП) сердца начали биться и казались в хорошем состоянии (Рисунок 4A; Дополнительный фильм 1; Дополнительный фильм 2). Для оценки жизнеспособности электропорированных клеток анализировали апоптоз с помощью иммуногистохимического окрашивания каспазы 3. Несмотря на то, что некоторые положительные клетки были обнаружены в сердце, ни миокард, ни эпикард, где расположено большинство электропорированных клеток, не были поражены апоптозом (дополнительный рисунок 1C). При оценке флуоресцентной активности почти во всех четырех камерах сердца наблюдался мозаичный сигнал GFP, что указывает на то, что этот протокол способен достигать большинства сердечных структур (рис. 4А). Чтобы определить, какие типы сердечных клеток были электропорированы, pCAG::GFP-электропорированные сердца иммуноокрашивали против маркеров эпикарда, WT12, и миокарда, MF2023, а затем визуализировали с помощью конфокального микроскопа (рис. 4B). Большинство клеток GFP+ были преимущественно расположены во внешней области сердца, что в значительной степени соответствовало сигналу WT1, что указывает на то, что этот метод наиболее эффективен при достижении эпикардиальных клеток (рис. 4B, белые стрелки).
С другой стороны, pCAG::Meis1-электропорированное или контрольное (только pCAG::GFP) сердце диссоциировали, и клетки подвергали флуоресцентно-активируемой сортировке клеток (FACS) для выделения клеток GFP+ из всего органа, как описано на шаге 4 протокола. Из отсортированных клеток экстрагировали РНК и проводили количественную ПЦР с обратной транскрипцией (ОТ-кПЦР) для оценки уровней экспрессии Meis1 в трансфицированных клетках (рис. 4C, дополнительная таблица 1). Общую экспрессию гена Meis1 нормализовали с использованием уровней экспрессии гена Eef224 мышиного хозяйства, а относительную экспрессию гена рассчитывали с помощью метода ΔΔCt25. Значительное повышение уровня РНК Meis1 наблюдалось в сердцах, электропорированных плазмидой pCAG::Meis1, по сравнению с сердцами, получавшими только плазмиду pCAG::GFP (рис. 4C). Таким образом, это демонстрирует потенциал метода для сверхэкспрессии генов, представляющих интерес, и решения молекулярного результата.

Рисунок 4: Молекулярный анализ электропорированных сердец E 12.5.(A) Флуоресценция GFP одного CAG::GFP - электропорированное сердце через 24 ч после электропорации. Нижнее изображение показывает флуоресценцию GFP, в то время как верхнее изображение показывает слияние GFP и яркого поля одного сердца. (B) Иммунофлюоресценция электропорированных гистологических срезов сердца E12.5. MF20 маркирует кардиомиоциты, в то время как WT1 помечает эпикардиальные клетки. Изображения справа соответствуют увеличенному белому прямоугольнику. Белыми стрелками обозначены клетки GFP+, расположенные в эпикарде, примерно ограниченные пунктирной белой линией. (C) ОТ-кПЦР анализ сердца, электропорированного с помощью pCAG::Meis1 или pCAG::GFP (контроль). Каждая точка представляет собой биологическую реплику, полученную в результате объединения трех сердец. В общей сложности анализ количественной ПЦР был проведен в трех экземплярах с тремя различными биологическими репликациями. Статистический анализ проводили с помощью t-критерия Стьюдента (*P < 0,05). Масштабные линейки: 200 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительный рисунок 1: Эффективность электропорации сердца и жизнеспособность клеток. (A) Экспрессия GFP в двух различных сердцах E12.5, электропорированных с помощью контрольной плазмиды pCAG::GFP через 24 ч или 48 ч после электропорации (hpe). Изображение сигнала GFP было наложено на яркое изображение того же сердца. (B) Количественное определение клеток GFP+ в сердцах 24 hpe и 48 hpe с электропорацией с контролем pCAG::GFP. Точками обозначены отдельные образцы; Сплошными линиями обозначено среднее значение, а полосы погрешности — стандартное отклонение. Существенной разницы между обоими условиями не наблюдалось (непараметрический t-критерий; P > 0,9). (C) Конфокальная фотография сердца E12.5, электропорированного с помощью pCAG::GFP, иммуноокрашенного против расщепленных каспаз 3 и MF20. Пунктирная линия представляет собой слой миокарда сердца. Изображения справа увеличены от белого прямоугольника. Масштабные линейки: 100 μм. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Дополнительная таблица 1: Краткое изложение праймера и последовательности. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный фильм 1: pCAG::GFP - электропорированное сердце через 24 ч. Видеосъемка одного сердца, электропорированного с помощью контрольной плазмиды pCAG::GFP через 24 часа после процедуры. Сердце продолжает биться, а электропорированные клетки экспрессируют сигналы GFP. Пожалуйста, нажмите здесь, чтобы скачать этот фильм.
Дополнительный фильм 2: pCAG::GFP - электропорированное сердце через 48 ч. Фильм, показывающий электропорированное сердце с контролем pCAG::GFP, через 48 часов после электропорации. Пожалуйста, нажмите здесь, чтобы скачать этот фильм.
Обсуждение
В целом, описанная здесь методология предлагает надежную основу для экспрессии трансгенных конструкций в развивающемся эпикарде (рисунок 4B), как показано на примере сверхэкспрессии Meis1 (рисунок 4C). При наличии соответствующих конструкций этот протокол может быть использован для временной оценки влияния либо усиления функции (GOF), либо потери функции (LOF) конкретного гена. LOF может быть реализован в методике путем трансфекции плазмиды, нацеленной на ген-кандидат посредством РНК-интерференции26. Быстрая оценка гена GOF или LOF особенно выгодна, особенно учитывая большую транскриптомную гетерогенность эпикардиальных клеток12, что делает нецелесообразным создание трансгенных животных для оценки каждого гена-кандидата в отдельности.
Поскольку в этом протоколе используется культура ex vivo, он дает возможность исследовать судьбу клеток эпикарда в пределах временного окна. Развивающийся эпикард играет ключевую роль в формировании различных областей в сердце взрослого человека 13,27,28; Таким образом, понимание его вклада в развитие сердца играет важную роль в анализе основы врожденных пороков развития сердца. Хотя в этой статье не рассматривается это применение, рекомендации, изложенные в протоколе, потенциально могут быть полезны для будущих исследований по картированию судьбы эпикарда
Несмотря на практическую полезность текущего метода, необходимо признать некоторые ограничения. Поскольку эта методология основана на транзиторном трансгенезе, экспрессия плазмид может быть утрачена или уменьшена с течением времени, что ограничивает диапазон протокола для изучения конкретного окна развития29. Тем не менее, в этом исследовании сверхэкспрессия GFP сохранялась на протяжении всей длительности постэлектропорационных культур (48 hpe). Кроме того, потенциальные ограничения в современных технологиях культивирования ex vivo препятствуют применению метода для оценки поздних эмбриональных или постнатальных стадий развития, особенно в тех случаях, когда культура ex vivo после электропорациистановится сложной задачей. Несмотря на то, что существуют более сложные методы культивирования эмбрионов ex vivo, они могут потребовать использования оборудования, которое менее доступно для исследователей и может не гарантировать выживание образца.
Несмотря на то, что представленный здесь протокол разработан таким образом, чтобы быть максимально простым для повышения воспроизводимости, он включает в себя важнейшие шаги, которые играют важную роль в успехе. Во-первых, вскрытие эмбриона должно быть проведено осторожно и быстро, чтобы свести к минимуму повреждение сердца, которое может поставить под угрозу выживание органа после электропорации. Настоятельно рекомендуется соблюдать особую осторожность на этом этапе, наряду с использованием оптимального оборудования для вскрытия. Еще одним важным аспектом протокола является проведение самой электропорации, так как неадекватная инъекция плазмиды может привести к нежелательным результатам. Поэтому рекомендуется выполнять несколько инъекций в одно сердце, и введение образца довольно поверхностным способом может быть полезным для повышения выживаемости органов. Наконец, диссоциация клеток во время обработки сердечной информации должна быть строго выполнена, соблюдая время, указанное в протоколе, чтобы максимизировать жизнеспособность клеток.
В заключение следует отметить, что идентификация ключевых генов в формировании сердца играет важную роль в понимании основных механизмов врожденных заболеваний сердца и регенерации. Разработанная здесь методология позволяет проводить быстрый скрининг эффектов усиления функции гена (GOF) и потери функции (LOF) в развивающемся сердце. Признавая определенные ограничения, этот метод демонстрирует значительный потенциал для экстраполяции на различные стадии развития или для картирования судьбы эмбриональных эпикардиальных клеток. С помощью визуальных рекомендаций, представленных в этой статье, мы стремимся предложить ценный набор инструментов для оценки огромной сложности и потенциала развивающегося эпикарда.
Раскрытие информации
У авторов нет конфликта интересов, который можно было бы раскрыть.
Благодарности
Это исследование было поддержано грантом RTI2018-097617-J-I00 от испанского Ministerio de Ciencia e Innovación и Acción 9 от Universidad de Jaén до O.H.O. Grant PGC2018-096486-B-I00 от испанского Ministerio de Ciencia e Innovación и грантом H2020-MSCA-ITN-2016-722427 от программы EU Horizon 2020 для M.T. JMG был поддержан стипендией PhD от Министерства науки Испании и Fundación Severo Ochoa (PRE2022-101884). Как CNIC, так и CBMSO поддерживаются Министерством науки Испании, а CNIC поддерживается Фондом ProCNIC.
Материалы
| Name | Company | Catalog Number | Comments |
| #55 Forceps | Dumont | 11295-51 | |
| 12-well Clear Flat Bottom Multiwell Cell Culture Plate | BD Falcon | 353043 | |
| 35 mm vise table | Grandado | SKU 8798771617573 | |
| 40 µm Cell Strainer | Fischer Scientific | 08-771-1 | |
| 50 mL tubes | BD Falcon | 352070 | |
| 70 µm Cell Strainer | Corning | CLS431751 | |
| Anti-GFP Policlonal Antibody | Invitrogen | A10262 | 1:1000 dilution used |
| Anti-Myosin 4 (MF20) Monoclonal Antibody | Invitrogen | 14-6503-82 | 1:500 dilution used |
| CD1 Wild Type mice | Provided by Animalary Unit (CNIC) | ||
| Cleaved Caspase-3 (Asp175) Antibody | Cell Signalling Technologies | 9661 | 1:400 dilution used |
| DAPI | Cell Signalling Technologies | 4083 | 1:1000 dilution used |
| Dispase/collagenase | Roche | 10269638001 | |
| Distilled water | |||
| DMEM - Dulbecco's Modified Eagle Medium | Gibco | 10313021 | |
| Fetal Bovine Serum | Invitrogen | 10438-026 | |
| Heracell 150i CO2 Incubator | Thermo Scientific | 51032720 | |
| Leica Stereoscopic Microscope S8AP0 | Leica | 11524102 | |
| Liberase | Roche | 5401119001 | |
| Micropipette Puller Model P-97 | Sutter Instrument | SU-P-97 | |
| pCAG expression plasmid | Addgene | #89689 | |
| Penicillin-streptomycin | Invitrogen | 15070-063 | |
| Petri dishes 35 × 10 mm | BD Falcon | 351008 | |
| Petri dishes 60 × 15 mm | BD Falcon | 353002 | |
| Phenol Red | Merck | P3532 | |
| Pipette tips | Reused from old laboratory equipment | ||
| Rat Serum culture embryo, male rats SPRAGUE DAWLEY RjHan SD | Janvier Labs | 9979 | |
| Recombinant anti-Wilms Tumor Protein 1 (WT1) Antibody | Abcam | ab89901 | 1:300 dilution used |
| Square Wave Electroporator CUY21SC | Nepa Gene | CUY664-10X15 | |
| Sterile PBS | Provided and autoclaved by technical unit | ||
| Sucrose | Millipore | 84100 | |
| Tweezer electrodes with variable gap | Nepa Gene | CUY650P5 |
Ссылки
- Tyser, R. C., et al. Calcium handling precedes cardiac differentiation to initiate the first heartbeat. eLife. 5, e17113(2016).
- Tyser, R. C. V., et al. Characterization of a common progenitor pool of the epicardium and myocardium. Science. 371 (6533), 2986(2021).
- Sendra, M., Domínguez, J., Torres, M., Ocaña, O. Dissecting the complexity of early heart progenitor cells. J Cardiovasc Dev Dis. 9 (1), 5(2021).
- Ivanovitch, K., Temiño, S., Torres, M. Live imaging of heart tube development in mouse reveals alternating phases of cardiac differentiation and morphogenesis. eLife. 6, e30668(2017).
- Ai, D., et al. Canonical Wnt signaling functions in second heart field to promote right ventricular growth. PNAS. 104 (22), 9319-9324 (2007).
- Zimmerman, M. S., et al. regional, and national burden of congenital heart disease, 1990-2017: A systematic analysis for the Global Burden of Disease Study 2017. Lancet Chil Adolesc Heal. 4 (3), 185-200 (2020).
- Xin, M., Olson, E. N., Bassel-Duby, R. Mending broken hearts: Cardiac development as a basis for adult heart regeneration and repair. Nat Rev Mol Cell Biol. 14 (8), 529-541 (2013).
- Porrello, E. R., et al. Transient regenerative potential of the neonatal mouse heart. Science. 331 (6020), 1078-1080 (2011).
- Cao, J., Poss, K. D. The epicardium as a hub for heart regeneration. Nat Rev Cardiol. 15 (10), 631-647 (2018).
- Zhou, B., et al. Adult mouse epicardium modulates myocardial injury by secreting paracrine factors. JCI. 121 (5), 1894-1904 (2011).
- Van Wijk, B., Gunst, Q. D., Moorman, A. F. M., Van Den Hoff, M. J. B. Cardiac regeneration from activated epicardium. PLOS One. 7 (9), e44692(2012).
- Hesse, J., et al. Single-cell transcriptomics defines heterogeneity of epicardial cells and fibroblasts within the infarcted murine heart. eLife. 10, e65921(2021).
- Streef, T. J., Smits, A. M. Epicardial contribution to the developing and injured heart: Exploring the Cellular composition of the epicardium. Front Cardiovasc Med. 8, 750243(2021).
- Sanchez-Fernandez, C., et al. Understanding epicardial cell heterogeneity during cardiogenesis and heart regeneration. J Cardiovasc Dev Dis. 10 (9), 376(2023).
- Quijada, P., et al. Coordination of endothelial cell positioning and fate specification by the epicardium. Nat Commun. 12 (1), 4155(2021).
- Mantri, M., et al. Spatiotemporal single-cell RNA sequencing of developing chicken hearts identifies interplay between cellular differentiation and morphogenesis. Nat Commun. 12 (1), 1771(2021).
- Paul, S., Zhang, X., He, J. Q. Homeobox gene Meis1 modulates cardiovascular regeneration. Semin Cell Dev Biol. 100, 52-61 (2020).
- Stankunas, K., et al. Pbx/Meis deficiencies demonstrate multigenetic origins of congenital heart disease. Circ Res. 103 (7), 702-709 (2008).
- Liu, Y., et al. Transcription factor Meis1 act as a new regulator of ischemic arrhythmias in mice. J Adv Res. 39, 275-289 (2022).
- Behringer, R. Manipulating the mouse embryo: A laboratory manual. , Cold Spring Harbor Lab Press. Cold Spring Harbor, New York. (2014).
- Wong, M. D., et al. 4D atlas of the mouse embryo for precise morphological staging. Development. 142 (20), 3583-3591 (2015).
- Morris, L., Klanke, C., Lang, S., Lim, F. Y., Crombleholme, T. TdTomato and EGFP identification in histological sections: Insight and alternatives. Biotech Histochem. 85 (6), 379-387 (2010).
- Schiaffino, S., Rossi, A. C., Smerdu, V., Leinwand, L. A., Reggiani, C. Developmental myosins: expression patterns and functional significance. Skelet. Muscle. 5 (1), 22(2015).
- Eissa, N., et al. Stability of reference genes for messenger RNA quantification by real-time pcr in mouse dextran sodium sulfate experimental colitis. PLOS One. 11 (5), e0156289(2016).
- Livak, K. J., Schmittgen, T. D. Analysis of relative gene expression data using real-time quantitative PCR and the 2−ΔΔCT method. Methods. 25 (4), 402-408 (2001).
- Lai, S. R., Andrews, L. G., Tollefsbol, T. O. RNA interference using a plasmid construct expressing short-hairpin RNA. Methods Mol Biol. 405, 31-37 (2007).
- Carmona, R., Barrena, S., López Gambero, A. J., Rojas, A., Muñoz-Chápuli, R. Epicardial cell lineages and the origin of the coronary endothelium. FASEB J. 34 (4), 5223-5239 (2020).
- Gittenberger-de Groot, A. C., Vrancken Peeters, M. P. F. M., Mentink, M. M. T., Gourdie, R. G., Poelmann, R. E. Epicardium-derived cells contribute a novel population to the myocardial wall and the atrioventricular cushions. Circ Res. 82 (10), 1043-1052 (1998).
- Chong, Z. X., Yeap, S. K., Ho, W. Y. Transfection types, methods and strategies: A technical review. Peer J. 9, e11165(2021).
- Kałużna, E., Nadel, A., Zimna, A., Rozwadowska, N., Kolanowski, T. Modeling the human heart ex vivo-Current possibilities and strive for future applications. JTERM. 16 (10), 853-874 (2022).
- Aguilera-Castrejon, A., et al. Ex utero mouse embryogenesis from pre-gastrulation to late organogenesis. Nature. 593 (7857), 119-124 (2021).
- Dyer, L. A., Patterson, C. A novel ex vivo culture method for the embryonic mouse heart. J Vis Exp. (75), e50359(2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены