Method Article
Dekstran sülfat sodyum kullanılarak proktokolektomi ve ileal poş-anal anastomoz sonrası bir sıçan kroşe modeli
Bu Makalede
Özet
Bu protokol, bir sıçan poşit modeli oluşturma yöntemini açıklar. İleal poş modeli, mikrocerrahi teknikler kullanılarak ileal poş-anal anastomoz (IPAA) ameliyatı yapılarak oluşturuldu. Ameliyattan sonra, sıçan 4 gün boyunca% 4 dekstran sülfat sodyum (DSS) ile tedavi edildi.
Özet
Ülseratif kolit (ÜK), tüm kolon ve rektumu etkileyen, nüks ve düzelme şeklinde seyreden, yaşam boyu morbiditeye neden olan kronik immün aracılı bir hastalıktır. Tıbbi tedavi etkisiz olduğunda, özellikle masif gastrointestinal kanama, perforasyon, toksik megakolon veya karsinogenez vakalarında, cerrahi UC'yi tedavi etmek için son savunma hattı haline gelir. Total kolorektal rezeksiyon ve ileal poş-anal anastomoz (IPAA) uzun süreli tedavi için en iyi şansı sunar. Pouchitis ameliyat sonrası en sık görülen ve en sıkıntılı komplikasyondur. Bu araştırmada, IPAA cerrahisi ile deneysel sıçanlarda bir ileal poş modeli oluşturmak için mikrocerrahi kullanılmıştır. Daha sonra, ileal kesenin dekstran sülfat sodyum (DSS) ile iltihaplanmasını indükleyerek sürekli bir sıçan poşit modeli oluşturulur. Sıçan poşitinin başarılı bir şekilde kurulması, postoperatif genel durum, kilo, yiyecek ve su alımı, dışkı verilerinin yanı sıra kese dokusu patolojisi, immünohistokimya ve inflamatuar faktör analizi ile doğrulanmıştır. Bu deneysel hayvan poşeit modeli, durumun patogenezini ve tedavisini incelemek için bir temel sağlar.
Giriş
Torba iti, ileal poşu etkileyen spesifik olmayan bir iltihaptır ve ülseratif kolitli (UC) bireylerde total proktokolektomi ve ileal poş-anal anastomoz (IPAA) sonrası yaygın bir komplikasyondur1,2,3. Bu durum% 50'ye kadar nispeten yüksek bir görülme oranına sahiptir ve ishal, karın ağrısı, dışkı kan kaybı ve ateş gibi çeşitli klinik belirtilere neden olabilir. Bazı araştırmacılar kese florasındaki bir değişimin bağışıklık aktivasyonunu ve ardından iltihabı tetikleyebileceğine inansa da, pouchitis'in kesin nedeni belirsizliğini korumaktadır 4,5,6,7.
Torba iltihabı ile ilgili klinik deneylerin yürütülmesiyle ilgili zorluklar nedeniyle, hayvan modelleri torba iltihabı ilaçlarını ve mekanizmalarını incelemek için değerli araçlar olarak hizmet edebilir. Sıçan ileal keselerinin oluşturulmasıyla ilgili artan endişeler vardır ve raporlar olası iltihabı göstermektedir8. Bununla birlikte, bu alandaki araştırmalar, net yönergelerden yoksun olan üretim sürecinin karmaşık doğası nedeniyle seyrek kalmaktadır 9,10. 1998'de Lichtman, total kolektomi11 gerçekleştirerek Lewis sıçanlarında ve Sprague-Dawley (SD) sıçanlarında bir ileal kese modeli kuran ilk kişi oldu. Bu sıçanların bağırsaklarında makrofaj infiltrasyonu, mukozal ülserasyon ve anaerobik bakteri florasında bir artış gözlemlediler ve ileal kese iltihabı hakkında daha fazla araştırma için sağlam bir temel sağladılar. Bu deneysel sıçan poşiti modeli, insan poşitinde gözlenen fiziksel belirtileri ve altta yatan mekanizmaları yakından taklit eder.
Yaygın olarak uygulanan preklinik ülseratif kolit modelleri arasında DSS ve TNBS modelleri yer almaktadır. İndükleyici kimyasal 2,4,6-trinitrobenzen sülfonik asit (TNBS) tipik olarak Crohn hastalığınısimüle eder 12. Etkinliği, güvenlik profili ve satın alınabilirliği ile saygı duyulan DSS modeli, gözlemlenen belirgin semptomlar nedeniyle genellikle UC indüksiyonu için güvenilir bir araç olarak kullanılır. Kese dokusunun kolonizasyonu göz önüne alındığında, DSS13,14 kullanarak başarılı bir şekilde bir kese iltihabı modeli indükledik.
Bu çalışmada, IPAA cerrahisi ile deneysel sıçanlarda başarılı bir ileal poş modeli oluşturmak için mikrocerrahi kullanıldı. Daha sonra, DSS ile ileal poşun inflamasyonunu indükleyerek sürekli bir sıçan poşit modeli oluşturuldu. Başarılı bir model oluşumu için ameliyat sırasındaki doğruluk esastır ve ameliyat sonrası bakım da çok önemlidir. Bu model, poşitin patogenezini araştırmak, potansiyel terapötik ajanları değerlendirmek ve bu karmaşık durumu daha iyi anlamak için kullanılabilir. Çalışma, ileal poş üretim prosedürünü düzene sokuyor, operasyon süresini kısaltıyor ve verimliliği artırıyor, böylece cerrahi sonrası poş bozukluklarına yönelik temel araştırmalar için sağlam bir temel oluşturuyor.
Protokol
Tüm hayvan deneyleri, Tianjin Tıp Üniversitesi Genel Hastanesi etik kurullarının politikalarına uygun olarak gerçekleştirildi. Bu çalışma için 9 ila 12 haftalık yaşları arasında, yaklaşık 320-360 g ağırlığında erkek Sprague-Dawley sıçanları kullanıldı. Kullanılan reaktiflerin ve ekipmanın ayrıntıları Malzeme Tablosunda listelenmiştir.
1. Hayvan seçimi ve bakımı
- Sağlıklı bir hayvan seçin (vücut ağırlığı ~ 220-240 g).
- Spesifik patojen içermeyen (SPF)15 seviye kriterlerini karşıladıklarından ve yeterli havalandırma (saatte 8 ila 12 hava değişimi), rahat bir sıcaklık (20-25 °C), uygun nem (%40-%70), minimum gürültü (70 desibelin altında) ve doğal ışık döngüsü (12 saat aydınlık ve 12 saat karanlık) olan bir ortamda en az 2 hafta boyunca uyarlanabilir şekilde yetiştirildiklerinden emin olun.
- Bu süre zarfında, onları kafes başına üç ila beş yoğunlukta standart temiz kafeslere koyun ve yatak takımlarını haftada iki kez değiştirin. Laboratuvar fareleri için standart bakım beslemesinin yanı sıra yiyecek ve suya ad libitum erişimi sağlayın.
2. Ameliyat öncesi hazırlık
- Yaklaşık vücut ağırlığı 320 g ila 360 g arasında olan sağlıklı bir sıçan seçin. Ameliyattan önce fareyi 8-12 saat aç bırakın ve gönüllü tüketim için 1: 1 oranında fizyolojik salin ve% 5 glikoz çözeltisine erişim sağlayın.
- Otoklavlanmış mikrocerrahi aletlerini hazırlayın (ameliyat öncesi 1 saat alkole batırma), mikroskop, sıçan diseksiyon masası, 8-0 Emilmeyen yüksek moleküler sütür, 4-0 emilmeyen sütür, steril gazlı bez, steril pamuklu çubuklar vb.
3. Sıçan ileal kese modelinin kurulması
- İntraperitoneal olarak 6 mL / kg'lık bir dozda% 1'lik bir pentobarbital sodyum çözeltisi enjekte edin ve sıçanı uyuşturmak için% 0.5 ropivakain ile lokal anestezinin insizyonel infiltrasyonunu enjekte edin. Anestezi sırasında fareyi bir elektrik lambası ile rahat bir sıcaklıkta tutun.
- Aşağıdaki adımları izleyerek total kolorektal rezeksiyon yapın:
- Tatmin edici bir anestezi protokolünü takiben fareyi anatomik bir tezgah üzerinde dorsal yaslanma pozisyonunda sabitleyin. Anestezi derinliğini bir ayak parmağı tutamıyla onaylayın. Saç kalıntılarını gidermek için tıraş makası kullanın ve cerrahi alan sterilizasyonu için iki kez iyodofor solüsyonu uygulayın.
- Karın boşluğuna giriş sağlayan cilt, beyaz çizgi fasyası ve peritondan diseksiyon yapmak için yaklaşık 6 cm uzunluğunda bir orta hat kesisi yapın. Periton yüzeyini açığa çıkarmak için bir ekartör kullanın ve bakteriyostatik tuzlu suya batırılmış steril gazlı bezle örtün.
- Terminal jejunumun vasküler akışını izole edin, kökenini 8-0 kullanarak bağlayın dikiş ipliği ve daha sonra kesin. İleoçekal kapaktan 1-2 cm uzakta bulunan çekal kütüğü dinlendirin ve ardından kesin.
- Sağ hemikolon rezeksiyonuna başlayın, sağ hemikolon ve orta kolik veni konservatif olarak bağlayın.
- İnferior mezenterik arteri daha da ayırın ve inferior rektal arteri izole edin. Anal kenardan iki santimetreye eşit bir aralığa kadar rektumdan aşağı doğru izolasyona devam edin. Postoperatif stenozu önlemek için distal rektumu yaklaşık 45 derecede eğik olarak rezeke edin.
- J kese yapımını gerçekleştirin.
- Terminal ileumun enine bölümünü, yaklaşık 6-7 cm ölçmesi gereken mezenterli bağırsaktan ayırmak için bir mikrotom neşteri kullanın.
- İleum için bir kese oluşturmak için terminal ileumu J şeklinde katlayın. Birbirine kenetlenen bir dikişle arka duvar anastomozu yapın. Modifiye edilmiş bir Connell dikişi kullanarak ön duvarı büyütün ve distal rektal kütüğün kesit boyutuna uyacak şekilde uygun bir bağırsak tutun.
- J şeklindeki keseyi 8-0 ile güçlendirin gerekirse dikiş. J torbasının uzunluğu 2,5 cm ila 3,5 cm arasında olmalıdır.
- İleal poş-anal anastomoz, IPAA gerçekleştirin.
- Mezenterde torsiyon olmadığını onaylayın ve kesenin açıklığının karınca yan duvarlarını ve rektal kütüğün yan duvarını aralıklarla 8-0 ile dikin çekiş için dikiş ipliği.
- Son olarak, hem ön hem de arka duvarlara tam kat sürekli bir kilit sütür uygulayın.
- Aktif kanama olmadığını doğrulayın ve karın boşluğunu normal tuzlu su ile fizyolojik olarak temizleyin. Karın kası fasyasını ve cildini 4-0 dikişlerle sırayla kapatın.
- Ameliyat sonrası yönetimi gerçekleştirin.
- Abdominal kapanmadan sonra tüm sıçanlara postoperatif analjezi olarak ketoprofen uygulayın (deri altından 40 mg / kg). Restorasyon gerçekleşene kadar farenin bir elektrik lambası kullanılarak ısıtıldığından emin olun.
- Bağırsak tıkanıklığı riskini azaltmak için hayvanın ameliyat sonrası en az 72 saat boyunca gıda tüketimini kısıtlayın. Enerji ve vücut sıvılarını hızlı bir şekilde yenilemek için %5 glikoz ad libitum diyetine erişime izin verin ve beslenme sıklığını dışkılama modellerine göre ayarlayın.
- Ameliyattan bir hafta sonra, sınırlı beslenmeyle başlayın ve tüketilen miktarı kademeli olarak artırın. Ardından, diyet alımlarının, su alımlarının ve vücut ağırlıklarının günlük kaydını tutarken, farelere serbestçe tüketmeleri için düzenli kemirgen yemi sağlayın.
4. DSS ile sıçan ileal poşit modelinin oluşturulması
- Deneysel gruplamayı gerçekleştirin.
- Total kolorektal rezeksiyon ve IPAA cerrahisi geçiren 12 sıçanı rastgele IPAA grubuna (Grup A, n = 6) ve poşit grubuna (Grup B, n = 6) atayın.
- Her gün taze hazırlanmış 100 mL saf suya 4 g DSS ekleyerek %4'lük bir DSS çözeltisi hazırlayın.
- IPAA grubunu ve poşit grubunu ameliyat sonrası 31. günden 35. güne kadar saf su veya% 4 DSS ile uygulayın. Sıçanların, uygulamanın ardışık dört günü boyunca serbestçe sıçan yiyecekleri içmesine ve yemesine izin verin.
- Torba örneklemesini gerçekleştirin.
- 35. günün sabahı, ameliyattan sonra, sıçanları% 1 pentobarbital sodyum çözeltisinin intraperitoneal enjeksiyonu ile uyuşturun ve 6 mL / kg'lık bir doz uygulayın (kurumsal olarak onaylanmış protokolleri izleyerek).
- Torbayı, torbanın stomasından her gruptaki giriş ve çıkış torbalarının birleşim yerine dik olarak kesin. Torba örneğini alın.
- Poşu ön duvar dikiş hattı boyunca açın ve bağırsak kanalını tuzlu su ile yıkayın.
- Bir torba dokusu parçasını bir mikrosantrifüj tüpüne yerleştirin ve hemen -80 °C'de soğutun. Enflamatuar göstergelerin ELISA tespiti için bu bölümü kullanın. Histopatolojik skorlama ve immünohistokimyasal boyama için kalan kese bölümünü %10 formaldehit ile sabitleyin.
- Son olarak, fareyi derin anestezi altında hava embolisi ile ötenazi yapın (kurumsal olarak onaylanmış protokolleri izleyerek).
5. Histolojik analiz
- Sıçandan kese dokusu aldıktan sonra, 24 saat boyunca% 4 paraformaldehite daldırın. Ardından, dehidrasyon ve gömme protokolleri ile devam edin. Histolojik inceleme için işlenmiş dokuyu bölümlere ayırın16.
- Gruplar arasındaki histopatolojik farklılıkları belirlemek için hematoksilen ve eozin boyaması uygulayın. Numuneleri mikroskobik olarak inceleyin ve dokümantasyon için fotoğraf çekin.
6. İmmünohistokimyasal test
- Doku bölümlerini dikkatlice dewax ve dehidre edin. Daha sonra, bölümleri sodyum sitrat çözeltisi içinde soğutarak ve 20 dakika boyunca bloke edici serum ile bloke ederek antijen alımını gerçekleştirin.
- Daha sonra, dilimleri birincil anti-oklüdin antikoruna maruz bırakın ve gece boyunca 4 ° C'de inkübe edin. Daha sonra, hematoksilen karşı boyama16'dan önce 30 dakika boyunca ikincil antikorlarla tedavi edin.
- Dilimler kuruduktan sonra, onları ışık mikroskobu altında gözlemleyin ve fotoğraflayın.
7. ELISA testi
- 7.1 Tam homojenizasyonu sağlamak için sonikasyon kullanarak doku parçalarını lizis tamponunda kıyın ve homojenize edin. Tespit için elde edilen süpernatanı kullanın.
- Grup başına boşluklar, numuneler ve kopyalar için kuyucuklar ayırın. 450 nm'de (OD değeri) absorbansı okuyarak ve doğrusal regresyon analizi16 yaparak protein konsantrasyonunu belirleyin.
Sonuçlar
İleal poş modeli sıçanların kuruluş sonrası genel durum değerlendirmesi
Operatör IPAA cerrahi öğrenme eğrisini geçtikten sonra, sıçanlar ameliyatı iyi tolere etti, cerrahi süre 192.94 dakika ± 27.15 dakika idi ve daha az postoperatif komplikasyon meydana geldi. Ameliyat sonrası erken dönemde, sıçanlar diyet alımında bir azalma yaşadılar, ancak ameliyat öncesi iştahları ameliyattan 10 gün ila 14 gün sonra geri geldi. Ameliyat sonrası erken aktivite biraz azaldı ve gözlerden ve burundan belirgin sekresyon yoktu. Ameliyat öncesi ve sonrası kilo kaybı 21.17 g ± 1.59 g idi. Ameliyat sonrası ilk ağırlık, maksimum 69.58 g ± 33.19 g azalma ile azalma eğilimi gösterdi. Ameliyattan 8.25. gün ± 2.53 gün sonra stabil büyüme başladı ve ameliyattan sonraki 31. günde kilo , ameliyattan sonraki gün kilonun %9.35'i ± %4.7'sini aştı. Sıçanlar ameliyattan 24 saat sonra dışkılama yapabildiler, gevşek dışkı vardı, ancak kanlı dışkı yoktu. Yumuşak dışkı oluşumu ameliyattan sonraki 9. ila 12. günlerde meydana geldi.
İleal poşta telafi edici artış
Ameliyattan sonraki 35. günde , sıçanın karın boşluğu anestezi altında açıldı ve ileal poş ile pelvik boşluk arasında ciddi bir yapışma ortaya çıktı. Kese ile çevre dokular arasındaki yapışıklık dikkatli bir şekilde ayrıldıktan sonra, ileal poşta telafi edici genişleme, bağırsak duvarında kalınlaşma ve distal ince bağırsakta hafif genişleme gözlendi (Şekil 1). Ameliyat sırasında ileal poşun uzunluğu 2.89 cm ± 0.28 cm iken, ameliyat sonrası 35. günde 3.86 cm ± 0.87 cm olarak ölçüldü ve istatistiksel olarak P = 0.000 arasında anlamlı bir fark gösterdi. İleal poşun mukozal alanı (cm2) da cerrahi ölçüme göre anlamlı olarak artmıştı (6.46 ± 0.85'e karşı 17.02 ± 4.61, P = 0.000). İPAA grubu ile ileal poşit grubu arasında anlamlı fark yoktu (P > 0.05).
İleal poşitli sıçanların genel durum değerlendirmesi ve dışkı skoru
Ameliyat sonrası 31. günde ileal poşit grubuna DSS uygulandı. Uygulamanın başlangıcında, hem IPAA grubu hem de ileal poşit grubu eşit vücut ağırlığına sahipti (352.00 g ± 30.03 g vs. 352.00 g ± 25.92 g, P = 1) ve genellikle iyi durumdaydı. Bununla birlikte, ileal poşit grubunda tüketilen gıda ve su miktarı azalmış, bu da zihinsel yorgunluk, cansız saçlar, göz ve burunda salgı, hareket kabiliyeti azalmış ve IPAA grubunda önemli bir değişiklik gözlenmemiştir. Ameliyat sonrası 35. günde , ileal poşit grubunun ağırlığı IPAA grubundan anlamlı olarak düşüktü (322.83 g ± 29.24 g vs. 364.83 g ± 30.13 g, P = 0.028) (Şekil 2).
İleal poşit grubu, DSS uygulamasından sonraki ilk gün belirgin ishal yaşadı ve DSS uygulamasından sonraki ikinci günde mukus, irin ve kanlı dışkı vardı (Şekil 3). Ameliyattan sonraki 35. günde , IPAA grubunun11'i ve ileal poşit grubunun dışkı skorları sırasıyla (4.33 ± 0.82'ye karşı 2.17 ± 0.75, P = 0.001) idi. IPAA grubu sıçanlarda temiz ve kirlilik içermeyen bir anüs bulunurken, ileal poşit sıçanlarında mukus, irin ve kanlı dışkı bağlanmasının eşlik ettiği anüs şişmesi vardı.
İleal poşun histopatolojik değişiklikleri
İleal poş örneklerinin makroskopik olarak izlenmesi
İPAA grubunda ileal poşun barsak duvarı kalınlaştı ve erozyon, ülser veya kanama noktası gözlenmedi. İleal poşit grubunda, saklama torbası mezenterindeki kan damarları kalınlaşır ve ileal poşun mukozası yaygın veya lokal olarak iltihaplanır, görünür erozyon, ülserler ve kanama noktaları görülür ve bunların bazılarına belirgin distal ince barsak genişlemesi eşlik eder (Şekil 4).
İleal poş dokusunun mikroskobik olarak izlenmesi
IPAA grubu sıçanlarda, kese dokusundaki bazı bağırsak villuslarının ucu, az miktarda nötrofil infiltrasyonu ile birlikte küntleşti ve bazen mukozal yüzeyde az miktarda eksüdasyon gözlendi.
Buna karşılık, ileal poşit grubundaki sıçanların ileal kese dokusundaki bağırsak villusunun düzenlenmesi son derece düzensizdi. Bazı bağırsak villusları eksikti ve kas tabakasını tutmadan geniş erozyon ve çok sayıda yamalı ülser görülebiliyordu. Buna çok sayıda nötrofil ve lenfosit infiltrasyonu, aşırı eksüdasyon ve görünür kript iltihabı eşlik etti. İleal poşit grubunda ileal poş dokusunun patolojik skoru İPAA grubundakinden anlamlı olarak yüksekti ve istatistiksel olarak anlamlı bir fark gözlendi (8.50 ± 1.76'ya karşı 1.33 ± 0.52, P = 0.000) (Şekil 5).
Bağırsak bariyeri fonksiyonel protein oklüdininin ekspresyon seviyesi
Bağırsak bariyerinin önemli bir fonksiyonel proteini olan okludin, sıçanların hem IPAA hem de ileal poşit gruplarında ileal kese dokusunun hücre zarında eksprese edilir11. Bununla birlikte, ileal poşit grubundaki oklüdin proteininin ekspresyon seviyesi, IPAA grubundakinden anlamlı olarak daha düşüktü (0.25 ± 0.03'e karşı 0.15 ± 0.02, P = 0.000) (Şekil 6).
İleal poşta inflamatuar faktörlerin saptanması
İleal poşit grubundaki sıçanların ileal kese dokusunda IL-6, IL-17, TNF-α ve INF-γ ekspresyon seviyeleri, IPAA grubundakilerden anlamlı derecede yüksekti (ELISA testi16 ile belirlendiği gibi). Tersine, IL-10 tam tersi sonuçlar gösterdi ve istatistiksel farklılıklar gözlendi (P = 0.000) (Tablo 1).
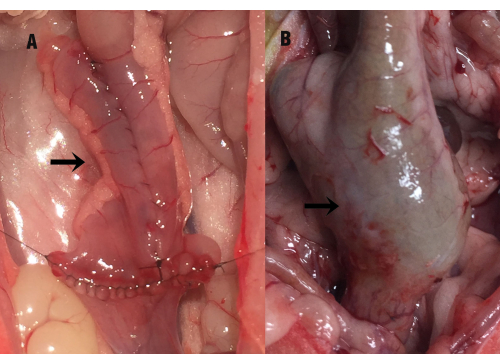
Şekil 1: İleal poşun durumu. Ok, (A) ameliyat sırasındaki ileal poşu ve (B) ameliyattan sonraki 35. günde ( örnek toplama sırasında) ileal poşun telafi edici genişlemesini gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: IPAA cerrahisi sonrası sıçanlarda vücut ağırlığı değişikliklerinin eğilimi. Hata çubuğu, her grupta n = 6 olan standart sapma ile ilgilidir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Sıçan dışkısının fotoğrafı. (A) IPAA grubu. (B) İleal poşit grubu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
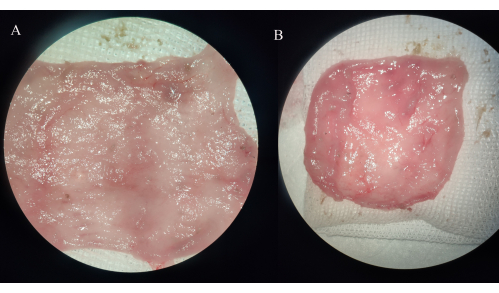
Şekil 4: İleal poş örneklerinin makroskopik gözlemi. (A) IPAA grubu. (B) İleal poşit grubu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: Sıçan ileal kese dokusunun patolojik değişiklikleri. (A) IPAA grubu. (B) İleal poşit grubu. Ölçek çubukları: 60 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 6: Sıçan ileal kese dokusunda oklüdin protein ekspresyonunun immünohistokimyasal tespiti. (A) IPAA grubu. (B) İleal poşit grubu. Ölçek çubukları: 60 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Grup | n | IL-6 | IL-10 | IL-17 Zırhlı Uçaklar | TNF-α | INF-γ |
| IPAA grubu | 6 | 2,60 ± 0,36 | 5,81 ± 0,66 | 17,48 ± 4,81 | 86,94 ± 24,06 | 4,08 ± 0,56 |
| Torba iltihabı grubu | 6 | 6,94 ± 1,18 | 2,77 ± 0,60 | 34,82 ± 2,41 | 213.00 ± 26.11 | 9,67 ± 1,70 |
| P | 0 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 |
Tablo 1: Sıçan ileal kese dokusunda inflamatuar faktörlerin ekspresyon seviyesi (pg/mL).
Tartışmalar
Ülseratif kolit (ÜK), tekrarlayan epigastrik ağrı, ishal ve mukuslu kanlı dışkı ile karakterize kronik bir bağırsak iltihabıdır. Öncelikle rektumu etkiler ve ilerleyen kolonu değişen derecelerde tutabilir. Cerrahi, UC 17,18,19'un yönetiminde çok önemli bir rol oynar. Parks ve ark.20'nin 1978 yılında altere olmuş dokuyu çıkarmak ve barsak sürekliliğini sağlamak için ileal poş-anal anastomoz (IPAA) prosedürü ile total kolektomiyi başlatmasından bu yana, bu operasyon ÜK'nin cerrahi tedavisinde uluslararası standart haline gelmiştir. Poşun inflamatuar bozuklukları IPAA cerrahisini takiben en sık görülen komplikasyonlardır.
Torba ile ilgili klinik araştırmaların yürütülmesinde karşılaşılan zorluklar nedeniyle, hayvan modelleri torba iltihabı ile ilgili ilaçları ve mekanizmaları incelemek için tamamlayıcı deneyler olarak kullanılmıştır. 1998 yılında, Lichtman ve ark.11 , kalın bağırsağın tamamen çıkarılmasını ve poşun rektuma yeniden bağlanmasını içeren bir sıçan modeli geliştirdi. Bu model, ameliyattan sonraki dört hafta içinde mononükleer hücre infiltrasyonu, luminal eksüdasyon, mukozal ülserasyon ve serozal inflamasyon gibi iltihaplanma belirtileri gösterdi. Enflamasyon seviyesi, kesedeki artmış bakteri sayısı ile korele edildi ve belirgin konak genetik duyarlılığı gözlenebildi. 2002 yılında, Shebani ve ark.21 , SDD aracılığıyla etkili bir şekilde poşit indükleyen bir IPAA cerrahi sıçan modelini başarıyla oluşturdu. Bu model, poşitin patogenezini incelemek için hayvanları kullanmanın etkinliğini doğruladı ve poşit ile ilgili temel araştırmalar için sağlam bir deneysel platform sağladı. Ayrıca, hem insan hem de kemirgen rezervuarlarında benzer bol miktarda bakteri üremesi modellerini belirlediler, bu da bağırsak bakteriyel dengesizliğini araştırmada ve kese ile ilgili potansiyel patojenleri tanımlamada yararlılığını doğruladı.
Fare besleme ve IPAA cerrahisi modellemesinde önceki deneyimlerle, öğrenme eğrisini yaklaşık on deneğe sıkıştırmak mümkündür. Bu süreçteki kritik bir adım, J poşunun yapımı ve anastomozudur. Farelerin bağırsak yolunun nispeten ince olduğu göz önüne alındığında, 8-0 Dikişler için dikiş kullanıldı. Poşun arka duvarı ve ön duvarı için ayrı ayrı sürekli kilitli sütürler ve bir Connel dikişi uygulandı. Kese ve anal kanal anastomozu sırasında, eğimli bir yüzey oluşturmak, rektal güdük örnek alınarak anastomoz bölgesindeki darlığı etkili bir şekilde azaltabilir. Başlangıçta anastomoz bölgesinin her iki tarafında ikişer dikiş atılması, daha sonra sürekli kilitlenen dikişlerle ilerleyerek arka ve ön duvarlara ayrı ayrı dikiş atılması anastomozun bütünlüğünü sağlar ve ameliyat süresini kısaltır.
Ameliyat sonrası yönetim de başarılı modellemede çok önemli bir rol oynar. Ameliyat sonrası 72 saatlik bir açlık süresi, bağırsak tıkanıklığının oluşumunu etkili bir şekilde azaltabilir. Öte yandan, erken ılımlı bir sıvı diyet, farelerin beslenme ve sıvı gereksinimlerini sağlayabilir. Öğrenme eğrisine hakim olduktan sonra, cerrahlar model oluşturmada daha verimli ve tutarlı bir başarı oranı elde edebilirler.
Bu çalışma bu temel üzerine inşa edilmiştir ve ön keşif ve iyileştirme yoluyla, mikrocerrahi kullanarak bir sıçan ileal poş modelini başarıyla oluşturmuştur. Bu model daha sonra kese iltihabının durumunu ve bağırsak bariyer göstergelerini incelemek için kullanıldı. Sonuçlar, sıçanların DSS'ye maruz kaldıktan sonra kanlı dışkı, ishal ve kilo kaybı gibi önemli semptomlar sergilediğini gösterdi. Bu, kese mukozası ödemi ve erozyonuna, histopatolojik skorlama ile belirtildiği gibi iltihaplanmaya ve interlökin-6 (IL-6), IL-17, tümör nekroz faktörü-alfa (TNF-α) ve interferon-gama (INF-γ) dahil olmak üzere proinflamatuar faktörlerin artmasına ve ayrıca anti-inflamatuar faktör interlökin-10 (IL-10) seviyelerinin azalmasına neden oldu. Ayrıca, bağırsak bariyeri indikatörü okludinin protein ekspresyonu azaldı. Bu bulgular önceki çalışmalarla11 uyumludur ve sonraki ilaç ve mekanizma araştırmaları için sağlam bir platform sağlayarak sıçan poşit modelinin başarılı bir şekilde kurulduğunu doğrulamaktadır.
Açıklamalar
Hiç kimse.
Teşekkürler
Hiç kimse
Malzemeler
| Name | Company | Catalog Number | Comments |
| Anhydrous ethanol | Tianjin Fengchuan Chemical Reagent Technology Co., Ltd | China | Hematoxin-eosin Staining |
| Dextran Sulfate Sodium | Yeasen | 60316ES76 | Used to induce pouch inflammation |
| Formaldehyde solution | Tianjin Zhiyuan Reagent Company | China | Hematoxin-eosin Staining |
| Gauze | Jiangxi Zhonggan Medical Equipment Company | China | Used for animal microsurgery |
| Hematoxylin | Beijing Zhongshan Jinqiao Company | China | Hematoxin-eosin Staining |
| Interferon γ Detection reagent kit | Cloud-clone | SEA049Ra | Detecting inflammatory factors |
| Interleukin-10 detection kit | Cloud-clone | SEA056Ra | Detecting inflammatory factors |
| Interleukin-17 detection kit | Cloud-clone | SEA063Ra | Detecting inflammatory factors |
| Interleukin-6 detection kit | Cloud-clone | SEA079Ra | Detecting inflammatory factors |
| Iodophor | Tangpai Medical Equipment Co., Ltd | China | Used for animal microsurgery |
| Microscopic manipulation instruments | Aesculap | Germany | Used for animal microsurgery |
| Occludin | abcam | ab216327 | Immunohistochemical testing |
| Sewing needle | Yangzhou Fuda Medical Equipment Co., Ltd | China | Used for animal microsurgery |
| tumor necrosis factor α Detection reagent kit | Cloud-clone | SEA133Ra | Detecting inflammatory factors |
| Two person binocular surgical microscope | OPTON | Germany | Used for animal microsurgery |
| Xylene | Tianjin Yingda Rare and Precious Reagent Factory | China | Hematoxin-eosin Staining |
Referanslar
- Yang, M. L., Brar, M. S., Kennedy, E. D., De Buck Van Overstraeten, A. Laparoscopic versus transanal IPAA for ulcerative colitis: A patient-centered treatment trade-off study. Dis Colon Rectum. 67 (1), 107-113 (2024).
- Aktas, M. K., et al. Current status and surgical technique for restorative proctocolectomy with ileal pouch-anal anastomosis. Balkan Med J. 40 (4), 236-243 (2023).
- Zhao, L., et al. Microbiota DNA translocation into mesentery lymph nodes is associated with early development of pouchitis after ipaa for ulcerative colitis. Diseases of the Colon & Rectum. 66 (11), e1107-e1118 (2022).
- Ng, S. C., et al. Worldwide incidence and prevalence of inflammatory bowel disease in the 21st century: A systematic review of population-based studies. Lancet. 390 (10114), 2769-2778 (2017).
- Pardi, D. S., D'haens, G., Shen, B., Campbell, S., Gionchetti, P. Clinical guidelines for the management of pouchitis. Inflamm Bowel Dis. 15 (9), 1424-1431 (2009).
- Shen, B., et al. Treatment of pouchitis, Crohn's disease, cuffitis, and other inflammatory disorders of the pouch: Consensus guidelines from the international ileal pouch consortium. Lancet Gastroenterol Hepatol. 7 (1), 69-95 (2022).
- Dalal, R. L., Shen, B., Schwartz, D. A. Management of pouchitis and other common complications of the pouch. Inflamm Bowel Dis. 24 (5), 989-996 (2018).
- Li, K. Y., et al. A new rat model of pouchitis after proctocolectomy and ileal pouch-anal anastomosis using 2,4,6-trinitrobenzene sulfonic acid. J Gastrointest Surg. 25 (6), 1524-1533 (2021).
- Drzymala-Czyz, S., et al. Discrepancy between clinical and histological effects of dha supplementation in a rat model of pouchitis. Folia Histochem Cytobiol. 50 (1), 125-129 (2012).
- Santiago, P., Barnes, E. L., Raffals, L. E. Classification and management of disorders of the J pouch. Am J Gastroenterol. 118 (11), 1931-1939 (2023).
- Lichtman, S. N., Wang, J., Hummel, B., Lacey, S., Sartor, R. B. A rat model of ileal pouch-rectal anastomosis. Inflamm Bowel Dis. 4 (3), 187-195 (1998).
- Guarner, F. Inulin and oligofructose: Impact on intestinal diseases and disorders. Br J Nutr. 93, Suppl 1 S61-S65 (2005).
- Kim, C. J., et al. L-tryptophan exhibits therapeutic function in a porcine model of dextran sodium sulfate (DSS)-induced colitis. J Nutr Biochem. 21 (6), 468-475 (2010).
- Valatas, V., Bamias, G., Kolios, G. Experimental colitis models: Insights into the pathogenesis of inflammatory bowel disease and translational issues. Eur J Pharmacol. 759, 253-264 (2015).
- Letson, H. L., Morris, J., Biros, E., Dobson, G. P. Conventional and specific-pathogen free rats respond differently to anesthesia and surgical trauma. Sci Rep. 9 (1), 9399(2019).
- Gu, Y., et al. Saccharomyces boulardii, a yeast probiotic, inhibits gut motility through upregulating intestinal serotonin transporter and modulating gut microbiota. Pharmacol Res. 181, 106291(2022).
- Akiyama, S., et al. Endoscopic phenotype of the j pouch in patients with inflammatory bowel disease: A new classification for pouch outcomes. Clin Gastroenterol Hepatol. 20 (2), 293-302 (2022).
- Hata, K., et al. Pouchitis after ileal pouch-anal anastomosis in ulcerative colitis: Diagnosis, management, risk factors, and incidence. Dig Endosc. 29 (1), 26-34 (2017).
- Gallo, G., Kotze, P. G., Spinelli, A. Surgery in ulcerative colitis: When? How. Best Pract Res Clin Gastroenterol. 32-33, 71-78 (2018).
- Parks, A. Proctocolectomy without ileostomy for ulcerative colitis. BMJ. 2, 85-88 (1978).
- Shebani, K. O., et al. Pouchitis in a rat model of ileal J pouch-anal anastomosis. Inflamm Bowel Dis. 8 (1), 23-34 (2002).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır