Method Article
Модель резервуарного илеита у крыс после проктоколэктомии и подвздошно-анального анастомоза с использованием декстрана сульфата натрия
В этой статье
Резюме
В этом протоколе описан метод создания крысиной модели резервуарного илеита. Модель подвздошного мешка была создана путем проведения операции подвздошно-анального анастомоза (IPAA) с использованием микрохирургических методов. После операции крысу обрабатывали 4% декстрана сульфатом натрия (ДСС) в течение 4 дней.
Аннотация
Язвенный колит (ЯК) – это хроническое иммуноопосредованное заболевание, поражающее всю толстую и прямую кишку с рецидивирующим и ремиттирующим течением, вызывая пожизненную заболеваемость. Когда медикаментозное лечение неэффективно, особенно в случаях массивного желудочно-кишечного кровотечения, перфорации, токсического мегаколона или канцерогенеза, хирургическое вмешательство становится последней линией обороны для лечения ЯК. Тотальная колоректальная резекция и анальный анастомоз подвздошной кишки (IPAA) дают наилучшие шансы на долгосрочное лечение. Резервуарный илеит является наиболее распространенным и проблемным послеоперационным осложнением. В этом исследовании микрохирургия используется для создания модели подвздошного мешка у экспериментальных крыс с помощью хирургии IPAA. Впоследствии была создана устойчивая модель резервуарного илеита на крысах путем индуцирования воспаления подвздошной кишки декстрансульфатом натрия (DSS). Успешное установление яленого мешка у крыс подтверждается анализом послеоперационного общего состояния, веса, потребления пищи и воды, данных кала, а также патологии тканей мешка, иммуногистохимии и анализа факторов воспаления. Эта экспериментальная животная модель резервуарного илеита обеспечивает основу для изучения патогенеза и лечения этого состояния.
Введение
Резервуарный илеит является неспецифическим воспалением, которое поражает подвздошный мешок и является распространенным осложнением после тотальной проктоколэктомии и анального анастомоза подвздошной кишки (ИПХА) у лиц с язвенным колитом (ЯК)1,2,3. Это состояние имеет относительно высокую частоту встречаемости до 50% и может вызывать различные клинические проявления, включая диарею, боли в животе, потерю каловой крови и лихорадку. Точная причина резервуарного илеита остается неясной, хотя некоторые исследователи считают, что сдвиг в флоре мешочек может вызвать иммунную активацию и последующее воспаление.
Из-за сложностей, связанных с проведением клинических испытаний резервуарного илеита, животные модели могут служить ценными инструментами для изучения лекарств и механизмов лечения резервуарного илеита. Растут опасения по поводу создания подвздошных мешочков крыс, при этом поступают сообщения о возможном воспалении8. Тем не менее, исследования в этой области остаются скудными из-за сложного характера производственного процесса, в котором отсутствуют четкие руководящие принципы. В 1998 году Лихтман был первым, кто создал модель подвздошного мешка у крыс Льюиса и крыс Спрага-Доули (SD), выполнив тотальную колэктомию11. Они наблюдали инфильтрацию макрофагов, изъязвление слизистых оболочек и увеличение анаэробной бактериальной флоры в кишечнике этих крыс, что обеспечило прочную основу для дальнейших исследований воспаления подвздошной кишки. Эта экспериментальная модель крысиного резервуарного илеита в точности имитирует физические признаки и основные механизмы, наблюдаемые при человеческом резервуарном резервуаре.
Обычно применяемые доклинические модели язвенного колита включают модели DSS и TNBS. Индуцирующее химическое вещество 2,4,6-тринитробензолсульфоновая кислота (ТНБС) обычно имитирует болезнь Крона12. Модель DSS, уважаемая за свою эффективность, профиль безопасности и доступность, часто используется в качестве надежного инструмента для индукции ЯК из-за наблюдаемых симптомов. Учитывая колонизацию ткани мешочка, мы успешно индуцировали модель резервуарного илеита с использованием DSS13,14.
В настоящем исследовании микрохирургия была использована для успешного создания модели подвздошного мешка у экспериментальных крыс с помощью хирургии IPAA. Впоследствии была создана устойчивая модель крысиного резервуарного илеита путем индукции воспаления подвздошного мешка с помощью DSS. Точность во время операции имеет важное значение для успешного формирования модели, а послеоперационный уход также имеет решающее значение. Эта модель может быть использована для исследования патогенеза резервуарного илеита, оценки потенциальных терапевтических агентов и углубления нашего понимания этого сложного состояния. Исследование оптимизирует процедуру изготовления подвздошного мешка, сокращая продолжительность операции и повышая эффективность, тем самым создавая прочную основу для фундаментальных исследований послеоперационных заболеваний подвздошного мешка.
протокол
Все эксперименты на животных проводились в соответствии с политикой этических комитетов Больницы общего профиля Тяньцзиньского медицинского университета. Для этого исследования были использованы самцы крыс Sprague-Dawley в возрасте от 9 до 12 недель и весом примерно 320-360 г. Подробная информация об используемых реагентах и оборудовании приведена в Таблице материалов.
1. Отбор и содержание животных
- Выберите здоровое животное (масса тела ~220-240 г).
- Убедитесь, что они соответствуют критериям специфического уровня отсутствия патогенов (SPF)15 и адаптивно выращиваются в течение как минимум 2 недель в среде с достаточной вентиляцией (от 8 до 12 воздухообменов в час), комфортной температурой (20-25 °C), соответствующей влажностью (40%-70%), минимальным шумом (ниже 70 децибел) и естественным световым циклом (12 часов света и 12 часов темноты).
- В течение этого периода размещайте их в стандартных чистых клетках с плотностью от трех до пяти клеток на клетку и меняйте подстилку два раза в неделю. Обеспечьте неограниченный доступ к пище и воде, а также к стандартному корму для лабораторных крыс.
2. Предоперационная подготовка
- Выберите здоровую крысу с примерной массой тела от 320 г до 360 г. Голодайте крысу за 8-12 ч до операции и обеспечьте доступ к раствору физиологического раствора и 5% глюкозы в соотношении 1:1 для добровольного потребления.
- Подготовьте автоклавные микрохирургические инструменты (предоперационное замачивание в спирте на 1 ч), микроскоп, стол для препарирования крыс, 8-0 нерассасывающийся высокомолекулярный шовный материал, нерассасывающийся шовный материал 4-0, стерильная марля, стерильные ватные палочки и т.д.
3. Создание модели подвздошной кишки крысы
- Внутрибрюшинное введение 1% раствора пентобарбитала натрия в дозе 6 мл/кг и внутрибрюшинное введение местной анестезии с 0,5% ропивакаином для обезболивания крысы. Поддерживайте комфортную температуру крысы во время анестезии с помощью электрической лампы.
- Выполните тотальную колоректальную резекцию, выполнив следующие действия:
- Закрепите крысу в положении лежа на анатомической скамье в соответствии с удовлетворительным протоколом анестезии. Подтвердите глубину анестезии с помощью зажима пальца ноги. Используйте машинки для стрижки для бритья, чтобы удалить остатки волос, и дважды нанесите раствор йодофора для стерилизации хирургических полей.
- Сделайте разрез по средней линии, длиной примерно 6 см, чтобы рассечь через кожу, белую линию фасции и брюшину, обеспечивая вход в брюшную полость. С помощью ретрактора обнажите поверхность брюшины и накройте ее стерильной марлей, пропитанной бактериостатическим раствором.
- Изолировать сосудистый поток терминальной тощей кишки, перевязать его начало с помощью 8-0 Наложите шов нитью, а впоследствии разорвите ее. Установите культю слепой кишки, расположенную в 1-2 см от илеоцекального клапана, в состояние покоя, а затем разрежьте ее.
- Начните резекцию правого гемиколона, консервативно перевязывая правый гемиколон и среднюю коликовую вену.
- Далее отделите нижнюю брыжеечную артерию и изолируйте нижнюю ректальную артерию. Продолжайте изоляцию вниз по прямой кишке до интервала, равного двум сантиметрам от анального края. Косо резекцию дистального отдела прямой кишки под углом около 45 градусов во избежание послеоперационного стеноза.
- Выполните конструкцию J-образного мешка.
- С помощью микротомного скальпеля отделите поперечный срез терминальной подвздошной кишки от брыжеечной кишки, которая должна составлять около 6-7 см.
- Сложите терминальную подвздошную кишку в J-образную форму, чтобы получился мешочек для подвздошной кишки. Выполните анастомоз задней стенки с помощью блокирующего шва. Увеличьте переднюю стенку с помощью модифицированного шва Коннелла и сохраните соответствующую кишку, чтобы она соответствовала размеру поперечного сечения дистального отдела культи прямой кишки.
- Укрепите J-образный мешочек с помощью 8-0 сшивание при необходимости. Длина J-подсумка должна находиться в диапазоне от 2,5 см до 3,5 см.
- Выполняют подвздошно-анальный анастомоз, IPAA.
- Подтвердите отсутствие перекрута в брыжейке и зашите муравьиные боковые стенки отверстия мешочка и боковую стенку культи прямой кишки с интервалом 8-0 Сшивающая нить для вытяжения.
- В конечном итоге, наложите полнослойный непрерывный замковый шов как на переднюю, так и на заднюю стенки.
- Убедитесь в отсутствии активных кровотечений и физиологически очистите брюшную полость обычным физиологическим раствором. Последовательно закройте фасцию мышц живота и кожу швами 4-0.
- Выполняйте послеоперационное лечение.
- Вводите кетопрофен в качестве послеоперационной анальгезии (40 мг/кг, подкожно) всем крысам после закрытия брюшной полости. Следите за тем, чтобы крыса согревалась с помощью электрической лампы до тех пор, пока не произойдет восстановление.
- Ограничьте употребление пищи животным в течение как минимум 72 ч после операции, чтобы снизить риск кишечной непроходимости. Обеспечьте доступ к диете с содержанием 5% глюкозы в неограниченном количестве, чтобы быстро восполнить энергию и жидкости в организме, а также отрегулируйте частоту кормления в соответствии с режимом дефекации.
- Через неделю после операции начните с ограниченного питания и постепенно увеличивайте его количество. Затем обеспечьте крыс регулярным кормом для грызунов, чтобы они могли свободно потреблять, ведя ежедневный учет их рациона, потребления воды и массы тела.
4. Создание модели подвздошного резервуарного илеита крыс с помощью DSS
- Выполните экспериментальную группировку.
- Случайным образом распределите 12 крыс, перенесших тотальную колоректальную резекцию и операцию IPAA, в группу IPAA (группа A, n = 6) и группу резервуарного илеита (группа B, n = 6).
- Приготовьте 4% раствор DSS, добавив 4 г DSS в 100 мл чистой воды, только что приготовленной ежедневно.
- В группе IPAA и группе резервуарного илеита вводят чистую воду или 4% DSS на 31-й день после операции и на 35-й день соответственно. Позвольте крысам свободно пить и есть корм для крыс в течение четырех дней подряд.
- Выполните отбор проб из мешка.
- Утром 35-го дня, после операции, обезболить крыс внутрибрюшинной инъекцией 1% раствора пентобарбитала натрия, введя дозу 6 мл/кг (в соответствии с утвержденными в учреждении протоколами).
- Разрежьте стомный мешок перпендикулярно от устьица мешка до места соединения входного и выходного мешков в каждой группе. Получите образец из мешочка.
- Откройте мешочек по линии шва передней стенки и промойте кишечный канал физиологическим раствором.
- Поместите фрагмент ткани мешка в микроцентрифужную пробирку и быстро охладите его при температуре -80 °C. Используйте эту часть для выявления признаков воспаления с помощью ИФА. Зафиксируйте оставшуюся часть мешка 10% формальдегидом для гистопатологического скоринга и иммуногистохимического окрашивания.
- Наконец, усыпить крысу путем воздушной эмболии под глубокой анестезией (в соответствии с утвержденными в учреждении протоколами).
5. Гистологический анализ
- После получения мешочной ткани от крысы погрузите ее в 4% параформальдегид на 24 ч. Затем приступайте к протоколам обезвоживания и внедрения. Срез обработанной ткани для гистологического исследования16.
- Применяйте окрашивание гематоксилином и эозином для выявления гистопатологических различий между группами. Изучите образцы под микроскопом и сделайте фотографии для документирования.
6. Иммуногистохимический анализ
- Тщательно обеспылите и обезвожьте участки тканей. Затем проводят забор антигена, охлаждая участки в растворе цитрата натрия и блокируя их блокирующей сывороткой в течение 20 мин.
- Затем подвергнуть срезы воздействию первичного антиокклюдинового антитела и инкубировать их в течение ночи при 4 °C. После этого обработайте их вторичными антителами в течение 30 минут перед противодействием гематоксилину16.
- Как только срезы высохнут, понаблюдайте и сфотографируйте их под световым микроскопом.
7. ИФА-тест
- 7.1 Измельчить и гомогенизировать фрагменты ткани в буфере для лизиса с использованием ультразвука для обеспечения тщательной гомогенизации. Используйте полученный надосадочный слой для обнаружения.
- Выделяйте лунки для заготовок, образцов и реплик для каждой группы. Определение концентрации белка путем считывания коэффициента поглощения при длине волны 450 нм (значение OD) и проведения линейного регрессионного анализа16.
Результаты
Общая оценка состояния крыс с модельным подвздошным мешком после приживления
После того, как оператор прошел кривую хирургического обучения IPAA, крысы хорошо переносили операцию, продолжительность операции составила 192,94 мин ± 27,15 мин, и возникло меньше послеоперационных осложнений. В раннем послеоперационном периоде у крыс наблюдалось снижение потребления пищи, но их предоперационный аппетит восстанавливался в течение от 10 до 14 дней после операции. Ранняя послеоперационная активность несколько снизилась, явных выделений из глаз и носа не было. Потеря веса до и после операции составила 21,17 г ± 1,59 г. Исходная послеоперационная масса тела имела тенденцию к снижению, при этом максимальное снижение составило 69,58 г ± 33,19 г. Стабильный рост начался на 8,25 день ± 2,53 дня после операции, а к31-му дню после операции вес превысил 9,35% ± 4,7% от массы тела на следующий день после операции. Крысы смогли испражняться в течение 24 часов после операции, с жидким стулом, но без кровавого стула. Образование мягкого стула произошло на9-12-е сутки после операции.
Компенсаторное увеличение подвздошного мешка
На 35-е сутки после операции брюшная полость крысы была вскрыта под наркозом, что выявило выраженную спайку между подвздошным мешочком и полостью малого таза. После тщательного отделения спайки между мешочком и окружающими тканями наблюдалось компенсаторное увеличение подвздошного мешка, утолщение стенки кишечника и легкое расширение дистального отдела тонкой кишки (рис. 1). Длина подвздошного мешка составляла 2,89 см ± 0,28 см на момент операции, в то время как на35-й день после операции она составляла 3,86 см ± 0,87 см, показав значимую статистическую разницу P = 0,000). Площадь слизистой оболочки (см2) подвздошного мешка также была значительно увеличена по сравнению с хирургическим измерением (6,46 ± 0,85 против 17,02 ± 4,61, P = 0,000). Не было существенной разницы между группой IPAA и группой подвздошного резервуарного илеита (P > 0,05).
Оценка общего состояния и кала крыс с подвздошным резервуарным илеитом
На31-е сутки после операции группе подвздошного резервуарного илеита был введен ДСС. В начале приема пациенты в группе IPAA и группе подвздошного резервуарного илеита имели одинаковую массу тела (352,00 г ± 30,03 г против 352,00 г ± 25,92 г, P = 1) и в целом находились в хорошем состоянии. Тем не менее, количество потребляемой пищи и воды в группе подвздошного резервуарного илеита уменьшилось, что привело к умственной усталости, тусклым волосам, секреции в глазах и носу, снижению подвижности, и в группе IPAA не наблюдалось существенных изменений. На35-е сутки после операции масса группы подвздошного резервуарного илеита была достоверно ниже, чем в группе ИПСА (322,83 г ± 29,24 г против 364,83 г ± 30,13 г, P = 0,028) (рис. 2).
В группу подвздошного резервуарного илеита наблюдалась значительная диарея в первый день после введения DSS, а на второй день после введения DSS у них наблюдалась слизь, гной и кровавый стул (рис. 3). На35-е сутки после операции показатели каласоставили 11 баллов в группе IPAA и в группе подвздошного резервуарного илеита (4,33 ± 0,82 против 2,17 ± 0,75, P = 0,001) соответственно. У крыс группы IPAA был чистый и не загрязняющий анус, в то время как у крыс с подвздошным ячерезом наблюдался отек заднего прохода, сопровождающийся слизью, гноем и кровавым прикреплением стула.
Гистопатологические изменения подвздошного мешка
Макроскопическое наблюдение образцов подвздошной кишки
В группе IPAA стенка кишечной кишки подвздошной кишки утолщалась, и эрозии, язвы или точки кровотечения не наблюдалось. В группе подвздошного яченого ялея кровеносные сосуды в мешочке для хранения становятся толще, а слизистая оболочка подвздошной кишки широко или локально воспаляется, с видимыми эрозиями, язвами и точками кровотечения, некоторые из которых сопровождаются значительным дистальным расширением тонкой кишки (Рисунок 4).
Микроскопическое исследование тканей подвздошного мешка
В группе крыс IPAA кончик некоторых кишечных ворсинок в ткани мешочка становился тупым, что сопровождалось небольшим количеством инфильтрации нейтрофилов, а иногда наблюдалось небольшое количество экссудации на поверхности слизистой оболочки.
Напротив, расположение кишечных ворсинок в ткани подвздошного мешка у крыс в группе подвздошного якотеля было крайне нарушено. Некоторые кишечные ворсинки отсутствовали, а обширные эрозии и множественные пятнистые язвы были видны без вовлечения мышечного слоя. Это сопровождалось инфильтрацией большого количества нейтрофилов и лимфоцитов, чрезмерной экссудацией и видимым воспалением крипты. Оценка патологии ткани подвздошного мешка в группе подвздошного ячества была значительно выше, чем в группе IPAA, при этом наблюдалась значительная статистическая разница (8,50 ± 1,76 против 1,33 ± 0,52, P = 0,000) (рис. 5).
Уровень экспрессии функционального белка кишечного барьера окклюдина
Окклюдин, важный функциональный белок кишечного барьера, экспрессируется на клеточной мембране ткани подвздошного мешка у крыс с IPAA и подвздошной кишкой11. Тем не менее, уровень экспрессии белка окклюдина в группе подвздошного резервуарного илеита был значительно ниже, чем в группе IPAA (0,25 ± 0,03 против 0,15 ± 0,02, P = 0,000) (рис. 6).
Выявление воспалительных факторов в подвздошном мешочке
Уровни экспрессии IL-6, IL-17, TNF-α и INF-γ в ткани подвздошного мешка крыс в группе подвздошного ячества были значительно выше, чем в группе IPAA (по данным теста ELISA16). И наоборот, IL-10 показал противоположные результаты, со статистическими различиями (P = 0,000) (табл. 1).
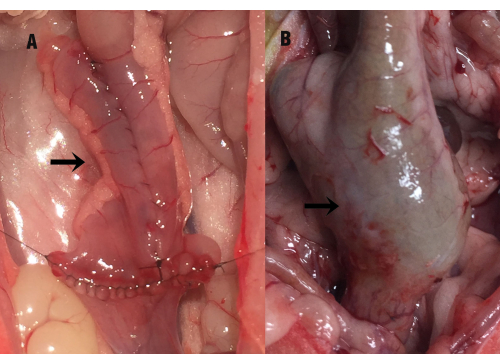
Рисунок 1: Состояние подвздошного мешка. Стрелкой обозначен подвздошный мешок (А) в момент операции и (В) компенсаторное увеличение подвздошного мешка на35-й день после операции (во время забора образца). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Тенденция изменения массы тела у крыс после операции IPAA. Планка погрешности связана со стандартным отклонением, n = 6 в каждой группе. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Фотография фекалий крыс. (A) Группа IPAA. (Б) Группа подвздошного резервуарного илеита. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
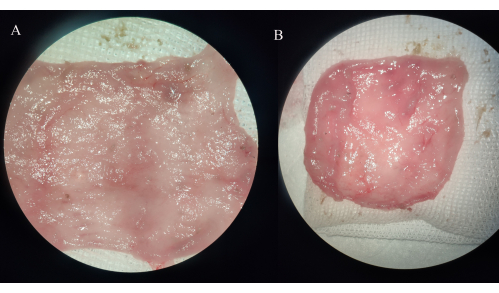
Рисунок 4: Макроскопическое наблюдение образцов подвздошной кишки. (A) Группа IPAA. (Б) Группа подвздошного резервуарного илеита. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 5: Патологические изменения ткани подвздошной кишки крысы. (A) Группа IPAA. (Б) Группа подвздошного резервуарного илеита. Масштабные линейки: 60 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 6: Иммуногистохимическое обнаружение экспрессии белка окклюдина в ткани подвздошной кишки крысы. (A) Группа IPAA. (Б) Группа подвздошного резервуарного илеита. Масштабные линейки: 60 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Группа | n | Ил-6 | Ил-10 | Ил-17 | ФНО-α | INF-γ |
| Группа IPAA | 6 | 2,60 ± 0,36 | 5,81 ± 0,66 | 17.48 ± 4.81 | 86.94 ± 24.06 | 4,08 ± 0,56 |
| Группа резервуарного илеита | 6 | 6.94 ± 1.18 | 2,77 ± 0,60 | 34.82 ± 2.41 | 213.00 ± 26.11 | 9.67 ± 1.70 |
| P | 0 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 |
Таблица 1: Уровень экспрессии воспалительных факторов в ткани подвздошной кишки крысы (пг/мл).
Обсуждение
Язвенный колит (ЯК) – это хроническое воспаление кишечника, характеризующееся периодическими болями в эпигастрии, диареей и кровавым стулом со слизью. В первую очередь он поражает прямую кишку и может поражать прогрессирующую толстую кишку в разной степени. Хирургическое вмешательство играет решающую роль в лечении ЯК 17,18,19. С тех пор, как в 1978 году Parks et al.20 ввели процедуру тотальной колэктомии с использованием подвздошно-анального анастомоза (IPAA) для удаления измененной ткани и восстановления непрерывности кишечника, эта операция стала международным стандартом хирургического лечения ЯК. Воспалительные заболевания мешочка являются наиболее распространенными осложнениями после операции IPAA.
Из-за проблем, возникших при проведении клинических испытаний резервуарного илеита, животные модели использовались в качестве дополнительных экспериментов для изучения лекарств и механизмов, связанных с резервуарным илеитом. В 1998 году Lichtman et al.11 разработали модель на крысе, включающую полное удаление толстой кишки и повторное соединение мешочка с прямой кишкой. Эта модель показала признаки воспаления, такие как инфильтрация мононуклеарных клеток, экссудация просвета, изъязвление слизистой оболочки и воспаление серозов в течение четырех недель после операции. Уровень воспаления коррелировал с повышенным количеством бактерий в сумке, и могла наблюдаться отчетливая генетическая восприимчивость хозяина. В 2002 году Шебани и др.21 успешно сконструировали хирургическую модель крысы IPAA с помощью SDD, которая эффективно индуцировала резервуарный резервуар. Эта модель подтвердила эффективность использования животных для изучения патогенеза резервуарного илеита и обеспечила надежную экспериментальную платформу для фундаментальных исследований резервуарного илеита. Они также выявили схожие закономерности обильного роста бактерий как у человека, так и у грызунов, подтвердив его полезность в исследовании кишечного бактериального дисбаланса и выявлении потенциальных патогенов, связанных с резервуарным илеитом.
Учитывая предыдущий опыт кормления мышей и моделирования хирургии IPAA, можно сократить кривую обучения примерно до десяти субъектов. Важным этапом в этом процессе является построение и анастомоз J-образного мешка. Учитывая, что кишечный тракт мышей относительно тонкий, 8-0 Для наложения швов использовался шов. Непрерывные блокирующие швы и шов Коннеля применялись отдельно для наложения швов задней стенки и передней стенки мешка. Во время анастомоза мешочка и анального канала создание наклонной поверхности может эффективно уменьшить стеноз в месте анастомоза, взяв на примере культи прямой кишки. Первоначально наложение двух швов с каждой стороны участка анастомоза, а затем непрерывное наложение фиксирующих швов на заднюю и переднюю стенки по отдельности обеспечивает целостность анастомоза и сокращает время операции.
Послеоперационное ведение также играет ключевую роль в успешном моделировании. 72-часовой период голодания после операции может эффективно снизить возникновение кишечной непроходимости. С другой стороны, ранняя умеренная жидкая диета может обеспечить потребности мышей в питательных веществах и жидкости. После освоения кривой обучения хирурги могут достичь более эффективного и стабильного показателя успеха в создании модели.
Данное исследование было основано на этом фундаменте и, путем предварительного изучения и уточнения, позволило успешно создать модель подвздошного мешка крысы с помощью микрохирургии. Затем эта модель была использована для изучения состояния воспаления мешочного мешка и показателей кишечного барьера. Результаты показали, что у крыс проявлялись заметные симптомы, такие как кровавый стул, диарея и потеря веса после воздействия DSS. Это привело к отеку и эрозии слизистой оболочки мешочка, воспалению, о чем свидетельствует гистопатологическая оценка, и повышению уровня провоспалительных факторов, включая интерлейкин-6 (IL-6), IL-17, фактор некроза опухоли-альфа (TNF-α) и интерферон-гамма (INF-γ), а также снижение уровня противовоспалительного фактора интерлейкина-10 (IL-10). Кроме того, экспрессия белка индикатора кишечного барьера окклюдина снизилась. Эти результаты согласуются с предыдущими исследованиями11 и подтверждают успешное создание модели илеита у крыс, обеспечивая прочную платформу для последующих исследований лекарств и механизмов.
Раскрытие информации
Никакой.
Благодарности
Никакой
Материалы
| Name | Company | Catalog Number | Comments |
| Anhydrous ethanol | Tianjin Fengchuan Chemical Reagent Technology Co., Ltd | China | Hematoxin-eosin Staining |
| Dextran Sulfate Sodium | Yeasen | 60316ES76 | Used to induce pouch inflammation |
| Formaldehyde solution | Tianjin Zhiyuan Reagent Company | China | Hematoxin-eosin Staining |
| Gauze | Jiangxi Zhonggan Medical Equipment Company | China | Used for animal microsurgery |
| Hematoxylin | Beijing Zhongshan Jinqiao Company | China | Hematoxin-eosin Staining |
| Interferon γ Detection reagent kit | Cloud-clone | SEA049Ra | Detecting inflammatory factors |
| Interleukin-10 detection kit | Cloud-clone | SEA056Ra | Detecting inflammatory factors |
| Interleukin-17 detection kit | Cloud-clone | SEA063Ra | Detecting inflammatory factors |
| Interleukin-6 detection kit | Cloud-clone | SEA079Ra | Detecting inflammatory factors |
| Iodophor | Tangpai Medical Equipment Co., Ltd | China | Used for animal microsurgery |
| Microscopic manipulation instruments | Aesculap | Germany | Used for animal microsurgery |
| Occludin | abcam | ab216327 | Immunohistochemical testing |
| Sewing needle | Yangzhou Fuda Medical Equipment Co., Ltd | China | Used for animal microsurgery |
| tumor necrosis factor α Detection reagent kit | Cloud-clone | SEA133Ra | Detecting inflammatory factors |
| Two person binocular surgical microscope | OPTON | Germany | Used for animal microsurgery |
| Xylene | Tianjin Yingda Rare and Precious Reagent Factory | China | Hematoxin-eosin Staining |
Ссылки
- Yang, M. L., Brar, M. S., Kennedy, E. D., De Buck Van Overstraeten, A. Laparoscopic versus transanal IPAA for ulcerative colitis: A patient-centered treatment trade-off study. Dis Colon Rectum. 67 (1), 107-113 (2024).
- Aktas, M. K., et al. Current status and surgical technique for restorative proctocolectomy with ileal pouch-anal anastomosis. Balkan Med J. 40 (4), 236-243 (2023).
- Zhao, L., et al. Microbiota DNA translocation into mesentery lymph nodes is associated with early development of pouchitis after ipaa for ulcerative colitis. Diseases of the Colon & Rectum. 66 (11), e1107-e1118 (2022).
- Ng, S. C., et al. Worldwide incidence and prevalence of inflammatory bowel disease in the 21st century: A systematic review of population-based studies. Lancet. 390 (10114), 2769-2778 (2017).
- Pardi, D. S., D'haens, G., Shen, B., Campbell, S., Gionchetti, P. Clinical guidelines for the management of pouchitis. Inflamm Bowel Dis. 15 (9), 1424-1431 (2009).
- Shen, B., et al. Treatment of pouchitis, Crohn's disease, cuffitis, and other inflammatory disorders of the pouch: Consensus guidelines from the international ileal pouch consortium. Lancet Gastroenterol Hepatol. 7 (1), 69-95 (2022).
- Dalal, R. L., Shen, B., Schwartz, D. A. Management of pouchitis and other common complications of the pouch. Inflamm Bowel Dis. 24 (5), 989-996 (2018).
- Li, K. Y., et al. A new rat model of pouchitis after proctocolectomy and ileal pouch-anal anastomosis using 2,4,6-trinitrobenzene sulfonic acid. J Gastrointest Surg. 25 (6), 1524-1533 (2021).
- Drzymala-Czyz, S., et al. Discrepancy between clinical and histological effects of dha supplementation in a rat model of pouchitis. Folia Histochem Cytobiol. 50 (1), 125-129 (2012).
- Santiago, P., Barnes, E. L., Raffals, L. E. Classification and management of disorders of the J pouch. Am J Gastroenterol. 118 (11), 1931-1939 (2023).
- Lichtman, S. N., Wang, J., Hummel, B., Lacey, S., Sartor, R. B. A rat model of ileal pouch-rectal anastomosis. Inflamm Bowel Dis. 4 (3), 187-195 (1998).
- Guarner, F. Inulin and oligofructose: Impact on intestinal diseases and disorders. Br J Nutr. 93, Suppl 1 S61-S65 (2005).
- Kim, C. J., et al. L-tryptophan exhibits therapeutic function in a porcine model of dextran sodium sulfate (DSS)-induced colitis. J Nutr Biochem. 21 (6), 468-475 (2010).
- Valatas, V., Bamias, G., Kolios, G. Experimental colitis models: Insights into the pathogenesis of inflammatory bowel disease and translational issues. Eur J Pharmacol. 759, 253-264 (2015).
- Letson, H. L., Morris, J., Biros, E., Dobson, G. P. Conventional and specific-pathogen free rats respond differently to anesthesia and surgical trauma. Sci Rep. 9 (1), 9399(2019).
- Gu, Y., et al. Saccharomyces boulardii, a yeast probiotic, inhibits gut motility through upregulating intestinal serotonin transporter and modulating gut microbiota. Pharmacol Res. 181, 106291(2022).
- Akiyama, S., et al. Endoscopic phenotype of the j pouch in patients with inflammatory bowel disease: A new classification for pouch outcomes. Clin Gastroenterol Hepatol. 20 (2), 293-302 (2022).
- Hata, K., et al. Pouchitis after ileal pouch-anal anastomosis in ulcerative colitis: Diagnosis, management, risk factors, and incidence. Dig Endosc. 29 (1), 26-34 (2017).
- Gallo, G., Kotze, P. G., Spinelli, A. Surgery in ulcerative colitis: When? How. Best Pract Res Clin Gastroenterol. 32-33, 71-78 (2018).
- Parks, A. Proctocolectomy without ileostomy for ulcerative colitis. BMJ. 2, 85-88 (1978).
- Shebani, K. O., et al. Pouchitis in a rat model of ileal J pouch-anal anastomosis. Inflamm Bowel Dis. 8 (1), 23-34 (2002).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены