Method Article
Un modello di ratto di pouchite dopo proctocolectomia e anastomosi anale con destrano solfato
In questo articolo
Riepilogo
Questo protocollo descrive il metodo per stabilire un modello di acacite nel ratto. Il modello della sacca ileale è stato creato eseguendo un intervento chirurgico di anastomosi anale della sacca ileale (IPAA) utilizzando tecniche microchirurgiche. Dopo l'intervento chirurgico, il ratto è stato trattato con destrano solfato di sodio (DSS) al 4% per 4 giorni.
Abstract
La colite ulcerosa (CU) è una malattia cronica immuno-mediata che colpisce l'intero colon e il retto con un decorso recidivante e recessivo, causando morbilità per tutta la vita. Quando il trattamento medico è inefficace, soprattutto in caso di sanguinamento gastrointestinale massivo, perforazione, megacolon tossico o cancerogenesi, la chirurgia diventa l'ultima linea di difesa per curare la colite ulcerosa. La resezione totale del colon-retto e l'anastomosi ileale-tasca (IPAA) offrono le migliori possibilità di trattamento a lungo termine. La bachite è la complicanza postoperatoria più comune e problematica. In questa indagine, la microchirurgia viene impiegata per creare un modello di sacca ileale in ratti sperimentali tramite chirurgia IPAA. Successivamente, viene stabilito un modello di pouchite di ratto sostenuto inducendo l'infiammazione della sacca ileale con destrano solfato di sodio (DSS). Il successo dell'instaurazione della pouchite di ratto è convalidato dall'analisi dello stato generale postoperatorio, del peso, dell'assunzione di cibo e acqua, dei dati fecali, nonché della patologia tissutale della sacca, dell'immunoistochimica e dell'analisi dei fattori infiammatori. Questo modello animale sperimentale di pouchite fornisce una base per lo studio della patogenesi e del trattamento della condizione.
Introduzione
La pouchite è un'infiammazione aspecifica che colpisce la sacca ileale ed è una complicanza prevalente dopo proctocolectomia totale e anastomosi ileale-anale (IPAA) in individui con colite ulcerosa (UC)1,2,3. Questa condizione ha un tasso di occorrenza relativamente alto, fino al 50%, e può causare varie manifestazioni cliniche, tra cui diarrea, dolore addominale, perdita di sangue fecale e febbre. La causa esatta della pouchite rimane sfuggente, anche se alcuni ricercatori ritengono che un cambiamento nella flora della pouch possa innescare l'attivazione immunitaria e la conseguente infiammazione 4,5,6,7.
A causa delle sfide associate alla conduzione di studi clinici sulla pouchite, i modelli animali possono fungere da strumenti preziosi per lo studio dei farmaci e dei meccanismi della pouchite. Ci sono crescenti preoccupazioni per quanto riguarda la creazione di sacche ileali di ratto, con rapporti che indicano una possibile infiammazione8. Tuttavia, la ricerca in questo campo rimane scarsa a causa della natura complessa del processo di produzione, che manca di linee guida chiare 9,10. Nel 1998, Lichtman è stato il primo a stabilire un modello di sacca ileale nei ratti Lewis e nei ratti Sprague-Dawley (SD) eseguendo la colectomia totale11. Hanno osservato l'infiltrazione di macrofagi, l'ulcerazione della mucosa e un aumento della flora batterica anaerobica all'interno dell'intestino di questi ratti, fornendo una solida base per ulteriori ricerche sull'infiammazione della sacca ileale. Questo modello sperimentale di pouchite di ratto imita da vicino i segni fisici e i meccanismi sottostanti osservati nella pouchite umana.
I modelli preclinici di colite ulcerosa comunemente applicati includono i modelli DSS e TNBS. L'acido chimico 2,4,6-trinitrobenzensolfonato (TNBS) simula tipicamente la malattia di Crohn12. Il modello DSS, rispettato per la sua efficacia, profilo di sicurezza e convenienza, è spesso utilizzato come strumento affidabile per l'induzione della CU a causa degli evidenti sintomi osservati. Data la colonizzazione del tessuto della sacca, abbiamo indotto con successo un modello di pouchite utilizzando DSS13,14.
Nel presente studio, la microchirurgia è stata utilizzata per creare con successo un modello di sacca ileale in ratti sperimentali tramite chirurgia IPAA. Successivamente, è stato stabilito un modello di pouchite di ratto sostenuta inducendo l'infiammazione della sacca ileale con DSS. L'accuratezza durante l'intervento chirurgico è essenziale per il successo della formazione del modello e anche l'assistenza postoperatoria è fondamentale. Questo modello può essere utilizzato per studiare la patogenesi della pouchite, valutare potenziali agenti terapeutici e approfondire la nostra comprensione di questa complessa condizione. Lo studio semplifica la procedura di produzione della sacca ileale, riducendo la durata dell'operazione e aumentando l'efficienza, stabilendo così una solida base per la ricerca fondamentale sui disturbi post-chirurgici della sacca.
Protocollo
Tutti gli esperimenti sugli animali sono stati eseguiti in conformità con le politiche dei comitati etici dell'Ospedale Generale dell'Università di Medicina di Tianjin. Per questo studio sono stati utilizzati ratti maschi di Sprague-Dawley di età compresa tra 9 e 12 settimane, del peso di circa 320-360 g. I dettagli dei reagenti e delle attrezzature utilizzate sono elencati nella Tabella dei Materiali.
1. Selezione e mantenimento degli animali
- Seleziona un animale sano (peso corporeo di ~220-240 g).
- Assicurarsi che soddisfino i criteri del livello di assenza di agenti patogeni specifici (SPF)15 e che siano allevati in modo adattivo per un minimo di 2 settimane in un ambiente con ventilazione adeguata (da 8 a 12 ricambi d'aria all'ora), una temperatura confortevole (20-25 °C), un'umidità adeguata (40%-70%), un rumore minimo (inferiore a 70 decibel) e un ciclo di luce naturale (12 ore di luce e 12 ore di buio).
- Durante questo periodo, alloggiali in gabbie pulite standard a una densità da tre a cinque per gabbia e cambia la lettiera due volte alla settimana. Fornire l'accesso ad libitum a cibo e acqua, nonché mangimi di manutenzione standard per ratti da laboratorio.
2. Preparazione preoperatoria
- Seleziona un ratto sano con un peso corporeo approssimativo compreso tra 320 g e 360 g. Digiunare il ratto per 8-12 ore prima dell'operazione e fornire l'accesso a una soluzione di soluzione fisiologica salina e glucosio al 5% in un rapporto 1:1 per il consumo volontario.
- Preparare gli strumenti microchirurgici autoclavati (immersione preoperatoria in alcool per 1 ora), un microscopio, un tavolo da dissezione per ratti, 8-0 sutura ad alto peso molecolare non assorbibile, sutura 4-0 non assorbibile, garza sterile, tamponi di cotone sterili, ecc.
3. Istituzione del modello di sacca ileale per ratti
- Iniettare intraperitonealmente una soluzione di pentobarbital sodico all'1% alla dose di 6 ml/kg e l'infiltrazione incisionale dell'anestesia locale con ropivacaina allo 0,5% per anestetizzare il ratto. Mantenere il ratto a una temperatura confortevole durante l'anestesia con una lampada elettrica.
- Eseguire la resezione colorettale totale seguendo i passaggi seguenti:
- Fissare il ratto in decubito dorsale su un banco anatomico seguendo un protocollo anestetico soddisfacente. Confermare la profondità dell'anestesia con un pizzico di dito del piede. Utilizzare un tagliacapelli da barba per eliminare i detriti di capelli e applicare due volte la soluzione di iodoforo per la sterilizzazione sul campo chirurgico.
- Praticare un'incisione sulla linea mediana, lunga circa 6 cm, per sezionare la pelle, la fascia bianca e il peritoneo, fornendo l'ingresso nella cavità addominale. Utilizzare un divaricatore per esporre la superficie peritoneale e coprirla con una garza sterile imbevuta di soluzione fisiologica batteriostatica.
- Isolare il flusso vascolare del digiuno terminale, legare la sua origine utilizzando un 8-0 filo di sutura e successivamente reciderlo. Posizionare il moncone cecale, situato a 1-2 cm dalla valvola ileocecale, a riposo, quindi recidirlo.
- Iniziare la resezione dell'emicolo destro, legando conservativamente l'emicolo destro e la vena colica media.
- Segregare ulteriormente l'arteria mesenterica inferiore e isolare l'arteria rettale inferiore. Continuare l'isolamento lungo il retto fino a un intervallo pari a due centimetri dal bordo anale. Resecare obliquamente il retto distale a circa 45 gradi per evitare la stenosi postoperatoria.
- Eseguire la costruzione della sacca a J.
- Utilizzare un bisturi al microtomo per separare la sezione trasversale dell'ileo terminale dall'intestino del mesentere, che dovrebbe misurare circa 6-7 cm.
- Piega l'ileo terminale a forma di J per creare una sacca per l'ileo. Eseguire l'anastomosi della parete posteriore tramite un punto ad incastro. Aumentare la parete anteriore utilizzando un punto di Connell modificato e mantenere un intestino appropriato per corrispondere alle dimensioni della sezione trasversale del moncone rettale distale.
- Rinforza la sacca a forma di J con 8-0 cucitura se necessario. La lunghezza della sacca J deve essere compresa tra 2,5 cm e 3,5 cm.
- Eseguire l'anastomosi anale della sacca ileale, IPAA.
- Confermare l'assenza di torsione nel mesentere e suturare le pareti laterali della formica dell'apertura della sacca e la parete laterale del moncone rettale a intervalli con un 8-0 filo di sutura per trazione.
- Infine, applicare una sutura a blocco continuo a strato intero sia sulla parete anteriore che su quella posteriore.
- Verificare l'assenza di sanguinamento attivo e detergere fisiologicamente la cavità addominale con soluzione fisiologica. Chiudere in sequenza la fascia muscolare addominale e la pelle con suture 4-0.
- Eseguire la gestione postoperatoria.
- Somministrare ketoprofene come analgesia postoperatoria (40 mg/kg, per via sottocutanea) a tutti i ratti dopo la chiusura addominale. Assicurarsi che il ratto sia riscaldato utilizzando una lampada elettrica fino a quando non si verifica il ripristino.
- Limitare il consumo di cibo all'animale per un periodo minimo di 72 ore dopo l'intervento per ridurre il rischio di ostruzione intestinale. Consentire l'accesso a una dieta a base di glucosio al 5% ad libitum per reintegrare rapidamente energia e liquidi corporei e regolare la frequenza di alimentazione in base ai modelli di defecazione.
- Una settimana dopo l'intervento, iniziare con un'alimentazione limitata e aumentare gradualmente la quantità consumata. Quindi, fornisci ai ratti mangime regolare per roditori da consumare liberamente, tenendo un registro giornaliero della loro assunzione alimentare, dell'assunzione di acqua e del peso corporeo.
4. Definizione del modello di pouchite ileale di ratto con DSS
- Eseguire il raggruppamento sperimentale.
- Assegnare in modo casuale 12 ratti che sono stati sottoposti a resezione colorettale totale e chirurgia IPAA al gruppo IPAA (Gruppo A, n = 6) e al gruppo pouchite (Gruppo B, n = 6).
- Preparare una soluzione di DSS al 4% aggiungendo 4 g di DSS a 100 ml di acqua pura, preparata al momento ogni giorno.
- Somministrare il gruppo IPAA e il gruppo pouchite con acqua pura o DSS al 4% rispettivamente dal giorno 31 al giorno 35 postoperatorio. Consentire ai ratti di bere e mangiare liberamente cibo per topi durante i quattro giorni consecutivi di somministrazione.
- Eseguire il campionamento della busta.
- La mattina del giorno 35, dopo l'operazione, anestetizzare i ratti con un'iniezione intraperitoneale di soluzione di pentobarbital sodico all'1%, somministrando una dose di 6 ml/kg (seguendo i protocolli istituzionalmente approvati).
- Recidere la sacca perpendicolarmente dallo stoma della sacca alla giunzione delle sacche di ingresso e di uscita in ciascun gruppo. Procurarsi il campione della sacca.
- Aprire la sacca lungo la linea di sutura della parete anteriore e lavare il canale intestinale con soluzione fisiologica.
- Mettere un frammento di tessuto pouch in una provetta da microcentrifuga e refrigerarlo prontamente a -80 °C. Utilizzare questa parte per il rilevamento ELISA di indicatori infiammatori. Fissare la sezione rimanente della busta con il 10% di formaldeide per il punteggio istopatologico e la colorazione immunoistochimica.
- Infine, sopprimere il ratto mediante embolia aerea in anestesia profonda (seguendo protocolli istituzionalmente approvati).
5. Analisi istologica
- Dopo aver acquisito il tessuto della sacca dal ratto, immergerlo in paraformaldeide al 4% per 24 ore. Successivamente, procedere con i protocolli di disidratazione e incorporamento. Sezione del tessuto processato per l'esame istologico16.
- Applicare la colorazione con ematossilina ed eosina per identificare le differenze istopatologiche tra i gruppi. Esamina i campioni al microscopio e scatta fotografie per la documentazione.
6. Dosaggio immunoistochimico
- Decerare e disidratare accuratamente le sezioni di tessuto. Quindi, eseguire il recupero dell'antigene raffreddando le sezioni in una soluzione di citrato di sodio e bloccandole con siero bloccante per 20 minuti.
- Successivamente, esporre le fette all'anticorpo primario anti-occludina e incubarle per una notte a 4 °C. Successivamente, trattarli con anticorpi secondari per 30 minuti prima della controcolorazione con ematossilina16.
- Una volta che le fette si sono asciugate, osservatele e fotografatele al microscopio ottico.
7. Test ELISA
- 7.1 Tritare e omogeneizzare i frammenti di tessuto nel tampone di lisi utilizzando la sonicazione per garantire un'omogeneizzazione completa. Utilizzare il surnatante risultante per il rilevamento.
- Assegnazione di pozzetti per bianchi, campioni e repliche per gruppo. Determinare la concentrazione proteica leggendo l'assorbanza a 450 nm (valore OD) e conducendo un'analisi di regressione lineare16.
Risultati
Valutazione delle condizioni generali dei ratti modello di sacca ileale dopo l'insediamento
Dopo che l'operatore ha superato la curva di apprendimento chirurgico IPAA, i ratti hanno tollerato bene l'intervento chirurgico, con una durata chirurgica di 192,94 minuti ± 27,15 minuti, e si sono verificate meno complicanze postoperatorie. Durante il primo periodo postoperatorio, i ratti hanno sperimentato una diminuzione dell'assunzione con la dieta, ma il loro appetito preoperatorio è stato ripristinato entro 10-14 giorni dopo l'intervento chirurgico. L'attività postoperatoria precoce è leggermente diminuita e non c'erano secrezioni evidenti dagli occhi e dal naso. La perdita di peso prima e dopo l'intervento chirurgico è stata di 21,17 g ± 1,59 g. Il peso iniziale postoperatorio ha mostrato un trend decrescente, con una riduzione massima di 69,58 g ± 33,19 g. La crescita stabile è iniziata l'8,25 ± 2,53 giorni dopo l'intervento e il 31° giorno dopo l'intervento il peso ha superato il 9,35% ± il 4,7% del peso il giorno dopo l'intervento. I ratti sono stati in grado di defecare entro 24 ore dall'intervento chirurgico, con feci molli ma senza feci sanguinolente. La formazione di feci molli si è verificata dal 9° al 12° giorno dopo l'intervento.
Aumento compensatorio della sacca ileale
Il 35° giorno dopo l'intervento, la cavità addominale del ratto è stata aperta in anestesia, rivelando una grave adesione tra la sacca ileale e la cavità pelvica. Dopo aver accuratamente separato l'adesione tra la sacca e i tessuti circostanti, sono stati osservati un ingrossamento compensatorio della sacca ileale, un ispessimento della parete intestinale e una lieve dilatazione dell'intestino tenue distale (Figura 1). La lunghezza della sacca ileale era di 2,89 cm ± 0,28 cm al momento dell'intervento, mentre il 35° giorno dopo l'intervento misurava 3,86 cm ± 0,87 cm, mostrando una differenza statistica significativa di P = 0,000). Anche l'area della mucosa (cm2) della sacca ileale è risultata significativamente aumentata rispetto alla misurazione chirurgica (6,46 ± 0,85 vs. 17,02 ± 4,61, P = 0,000). Non c'era alcuna differenza significativa tra il gruppo IPAA e il gruppo della pouchite ileale (P > 0,05).
Valutazione delle condizioni generali e punteggio fecale di ratti con pouchite ileale
Il 31° giorno dopo l'intervento chirurgico, il DSS è stato somministrato al gruppo della pouchite ileale. All'inizio della somministrazione, sia il gruppo IPAA che il gruppo della pouchite ileale avevano lo stesso peso corporeo (352,00 g ± 30,03 g vs. 352,00 g ± 25,92 g, P = 1) ed erano generalmente in buone condizioni. Tuttavia, la quantità di cibo e acqua consumata nel gruppo della pouchite ileale è diminuita, con conseguente affaticamento mentale, capelli opachi, secrezione negli occhi e nel naso, diminuzione della mobilità e non sono stati osservati cambiamenti significativi nel gruppo IPAA. Al 35° giorno dopo l'intervento, il peso del gruppo pouchite ileale era significativamente inferiore a quello del gruppo IPAA (322,83 g ± 29,24 g vs. 364,83 g ± 30,13 g, P = 0,028) (Figura 2).
Il gruppo con pouchite ileale ha manifestato diarrea significativa il primo giorno dopo la somministrazione del DSS e il secondo giorno dopo la somministrazione del DSS aveva muco, pus e feci sanguinolente (Figura 3). Al 35° giorno dopo l'intervento, i punteggi delle feci11 del gruppo IPAA e del gruppo pouchite ileale erano rispettivamente (4,33 ± 0,82 vs. 2,17 ± 0,75, P = 0,001). I ratti del gruppo IPAA avevano un ano pulito e privo di inquinamento, mentre i ratti con pouchite ileale avevano gonfiore dell'ano accompagnato da muco, pus e feci sanguinolente.
Alterazioni istopatologiche della sacca ileale
Osservazione macroscopica di campioni di sacca ileale
Nel gruppo IPAA, la parete intestinale della sacca ileale si è ispessita e non è stata osservata alcuna erosione, ulcera o punto di sanguinamento. Nel gruppo della pouchite ileale, i vasi sanguigni nel mesentere della sacca di conservazione diventano più spessi e la mucosa della sacca ileale è ampiamente o localmente infiammata, con erosione visibile, ulcere e punti di sanguinamento, alcuni dei quali sono accompagnati da una significativa dilatazione distale dell'intestino tenue (Figura 4).
Osservazione microscopica del tessuto della sacca ileale
Nel gruppo di ratti IPAA, la punta di alcuni villi intestinali nel tessuto della sacca è diventata smussata, accompagnata da una piccola quantità di infiltrazione di neutrofili e, occasionalmente, è stata osservata una piccola quantità di essudazione sulla superficie della mucosa.
Al contrario, la disposizione dei villi intestinali nel tessuto della sacca ileale dei ratti nel gruppo della pouchite ileale era estremamente disordinata. Mancavano alcuni villi intestinali ed erano visibili un'estesa erosione e ulcere multiple a chiazze senza coinvolgere lo strato muscolare. Questo è stato accompagnato da un gran numero di neutrofili e infiltrazione di linfociti, eccessiva essudazione e infiammazione visibile della cripta. Il punteggio patologico del tessuto della sacca ileale nel gruppo della pouchite ileale era significativamente più alto di quello del gruppo IPAA, con una differenza statistica significativa osservata (8,50 ± 1,76 vs. 1,33 ± 0,52, P = 0,000) (Figura 5).
Livello di espressione della proteina funzionale della barriera intestinale occludina
L'occludina, un'importante proteina funzionale della barriera intestinale, è espressa sulla membrana cellulare del tessuto della tasca ileale sia nel gruppo IPAA che in quello della pouchite ileale dei ratti11. Tuttavia, il livello di espressione della proteina occludina nel gruppo della pouchite ileale era significativamente inferiore a quello del gruppo IPAA (0,25 ± 0,03 vs. 0,15 ± 0,02, P = 0,000) (Figura 6).
Rilevamento di fattori infiammatori nella sacca ileale
I livelli di espressione di IL-6, IL-17, TNF-α e INF-γ nel tessuto della sacca ileale dei ratti nel gruppo pouchite ileale erano significativamente più alti di quelli del gruppo IPAA (come determinato dal test ELISA16). Al contrario, l'IL-10 ha mostrato risultati opposti, con differenze statistiche osservate (P = 0,000) (Tabella 1).
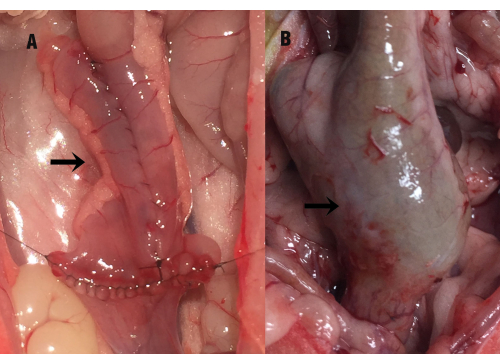
Figura 1: Lo stato della sacca ileale. La freccia indica la sacca ileale (A) al momento dell'intervento chirurgico e (B) l'allargamento compensatorio della sacca ileale il 35° giorno dopo l'intervento (durante la raccolta del campione). Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Andamento delle variazioni di peso corporeo nei ratti dopo l'intervento chirurgico con IPAA. La barra di errore è correlata alla deviazione standard, n = 6 in ogni gruppo. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Fotografia di feci di ratto. (A) Gruppo IPAA. (B) Gruppo della bustite ileale. Clicca qui per visualizzare una versione più grande di questa figura.
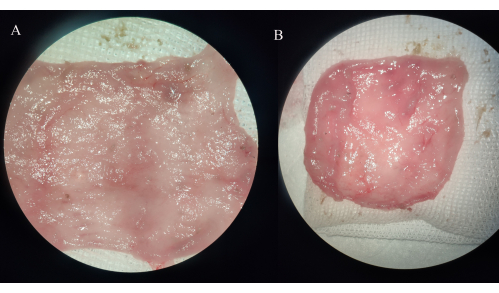
Figura 4: Osservazione macroscopica di campioni di sacca ileale. (A) Gruppo IPAA. (B) Gruppo della bustite ileale. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 5: Alterazioni patologiche del tessuto della sacca ileale di ratto. (A) Gruppo IPAA. (B) Gruppo della bustite ileale. Barre della scala: 60 μm. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 6: Rilevazione immunoistochimica dell'espressione della proteina occludina nel tessuto della sacca ileale di ratto. (A) Gruppo IPAA. (B) Gruppo della bustite ileale. Barre della scala: 60 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
| Gruppo | n | IL-6 | IL-10 | IL-17 | TNF-α | INF-γ |
| Gruppo IPAA | 6 | 2,60 ± 0,36 | 5,81 ± 0,66 | 17.48 ± 4.81 | 86.94 ± 24.06 | 4,08 ± 0,56 |
| Gruppo pouchite | 6 | 6,94 ± 1,18 | 2,77 ± 0,60 | 34,82 ± 2,41 | 213.00 ± 26.11 | 9.67 ± 1.70 |
| P | 0 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 |
Tabella 1: Livello di espressione dei fattori infiammatori nel tessuto della sacca ileale di ratto (pg/mL).
Discussione
La colite ulcerosa (CU) è un'infiammazione intestinale cronica caratterizzata da dolore epigastrico ricorrente, diarrea e feci sanguinolente mucose. Colpisce principalmente il retto e può coinvolgere il colon in progressione a vari livelli. La chirurgia svolge un ruolo cruciale nella gestione dell'UC 17,18,19. Da quando Parks et al.20 hanno introdotto la colectomia totale con una procedura di anastomosi anale ileale (IPAA) nel 1978 per rimuovere il tessuto alterato e ripristinare la continuità intestinale, questa operazione è diventata lo standard internazionale per il trattamento chirurgico della CU. I disturbi infiammatori della sacca sono le complicanze più comuni dopo l'intervento di IPAA.
A causa delle sfide affrontate nella conduzione di studi clinici sulla pouchite, i modelli animali sono stati utilizzati come esperimenti complementari per lo studio di farmaci e meccanismi correlati alla pouchite. Nel 1998, Lichtman et al.11 hanno sviluppato un modello di ratto che prevedeva la rimozione completa dell'intestino crasso e la riconnessione della sacca al retto. Questo modello ha mostrato segni di infiammazione, come infiltrazione di cellule mononucleate, essudazione luminale, ulcerazione della mucosa e infiammazione sierosa entro quattro settimane dall'intervento chirurgico. Il livello di infiammazione era correlato a un aumento della conta batterica nella sacca e si poteva osservare una distinta suscettibilità genetica dell'ospite. Nel 2002, Shebani et al.21 hanno costruito con successo un modello chirurgico di ratto IPAA tramite SDD, che ha efficacemente indotto la pouchite. Questo modello ha confermato l'efficacia dell'uso di animali per studiare la patogenesi della pouchite e ha fornito una solida piattaforma sperimentale per la ricerca di base sulla pouchite. Hanno anche identificato modelli simili di abbondante crescita batterica sia nei serbatoi umani che in quelli dei roditori, convalidando la sua utilità nello studio dello squilibrio batterico intestinale e nell'identificazione di potenziali agenti patogeni correlati alla pouchite.
Con una precedente esperienza nell'alimentazione dei topi e nella modellazione della chirurgia IPAA, è possibile comprimere la curva di apprendimento fino a una decina di soggetti. Una fase fondamentale di questo processo è la costruzione e l'anastomosi della sacca J. Dato che il tratto intestinale dei topi è relativamente sottile, 8-0 Per le suture è stata utilizzata la sutura. Suture di bloccaggio continue e un punto Connel sono stati impiegati separatamente per le suture della parete posteriore e della parete anteriore della sacca. Durante l'anastomosi della sacca e del canale anale, la creazione di una superficie inclinata può ridurre efficacemente la stenosi nel sito anastomotico prendendo come esempio il moncone rettale. Inizialmente, il fissaggio di due punti su ciascun lato del sito anastomotico, quindi la procedevolezza con suture di bloccaggio continue per suturare individualmente le pareti posteriore e anteriore, garantisce l'integrità dell'anastomosi e riduce i tempi chirurgici.
Anche la gestione postoperatoria svolge un ruolo fondamentale nel successo della modellazione. Un periodo di digiuno di 72 ore dopo l'intervento può ridurre efficacemente l'insorgenza di ostruzione intestinale. D'altra parte, una dieta liquida moderata precoce può garantire il fabbisogno nutrizionale e di liquidi dei topi. Dopo aver padroneggiato la curva di apprendimento, i chirurghi possono ottenere un tasso di successo più efficiente e costante nella creazione del modello.
Questo studio si è basato su queste basi e, attraverso l'esplorazione preliminare e il perfezionamento, ha stabilito con successo un modello di sacca ileale di ratto utilizzando la microchirurgia. Questo modello è stato quindi utilizzato per esaminare lo stato dell'infiammazione della sacca e gli indicatori della barriera intestinale. I risultati hanno dimostrato che i ratti mostravano sintomi notevoli come feci sanguinolente, diarrea e perdita di peso dopo essere stati esposti al DSS. Ciò ha portato a edema ed erosione della mucosa della sacca, infiammazione come indicato dal punteggio istopatologico e aumento dei livelli di fattori proinfiammatori, tra cui interleuchina-6 (IL-6), IL-17, fattore di necrosi tumorale-alfa (TNF-α) e interferone-gamma (INF-γ), insieme a livelli ridotti del fattore antinfiammatorio interleuchina-10 (IL-10). Inoltre, l'espressione proteica dell'occludina dell'indicatore della barriera intestinale è diminuita. Questi risultati sono in linea con gli studi precedenti11 e affermano il successo dell'istituzione del modello di pouchite di ratto, fornendo una solida piattaforma per la successiva ricerca di farmaci e meccanismi.
Divulgazioni
Nessuno.
Riconoscimenti
Nessuno
Materiali
| Name | Company | Catalog Number | Comments |
| Anhydrous ethanol | Tianjin Fengchuan Chemical Reagent Technology Co., Ltd | China | Hematoxin-eosin Staining |
| Dextran Sulfate Sodium | Yeasen | 60316ES76 | Used to induce pouch inflammation |
| Formaldehyde solution | Tianjin Zhiyuan Reagent Company | China | Hematoxin-eosin Staining |
| Gauze | Jiangxi Zhonggan Medical Equipment Company | China | Used for animal microsurgery |
| Hematoxylin | Beijing Zhongshan Jinqiao Company | China | Hematoxin-eosin Staining |
| Interferon γ Detection reagent kit | Cloud-clone | SEA049Ra | Detecting inflammatory factors |
| Interleukin-10 detection kit | Cloud-clone | SEA056Ra | Detecting inflammatory factors |
| Interleukin-17 detection kit | Cloud-clone | SEA063Ra | Detecting inflammatory factors |
| Interleukin-6 detection kit | Cloud-clone | SEA079Ra | Detecting inflammatory factors |
| Iodophor | Tangpai Medical Equipment Co., Ltd | China | Used for animal microsurgery |
| Microscopic manipulation instruments | Aesculap | Germany | Used for animal microsurgery |
| Occludin | abcam | ab216327 | Immunohistochemical testing |
| Sewing needle | Yangzhou Fuda Medical Equipment Co., Ltd | China | Used for animal microsurgery |
| tumor necrosis factor α Detection reagent kit | Cloud-clone | SEA133Ra | Detecting inflammatory factors |
| Two person binocular surgical microscope | OPTON | Germany | Used for animal microsurgery |
| Xylene | Tianjin Yingda Rare and Precious Reagent Factory | China | Hematoxin-eosin Staining |
Riferimenti
- Yang, M. L., Brar, M. S., Kennedy, E. D., De Buck Van Overstraeten, A. Laparoscopic versus transanal IPAA for ulcerative colitis: A patient-centered treatment trade-off study. Dis Colon Rectum. 67 (1), 107-113 (2024).
- Aktas, M. K., et al. Current status and surgical technique for restorative proctocolectomy with ileal pouch-anal anastomosis. Balkan Med J. 40 (4), 236-243 (2023).
- Zhao, L., et al. Microbiota DNA translocation into mesentery lymph nodes is associated with early development of pouchitis after ipaa for ulcerative colitis. Diseases of the Colon & Rectum. 66 (11), e1107-e1118 (2022).
- Ng, S. C., et al. Worldwide incidence and prevalence of inflammatory bowel disease in the 21st century: A systematic review of population-based studies. Lancet. 390 (10114), 2769-2778 (2017).
- Pardi, D. S., D'haens, G., Shen, B., Campbell, S., Gionchetti, P. Clinical guidelines for the management of pouchitis. Inflamm Bowel Dis. 15 (9), 1424-1431 (2009).
- Shen, B., et al. Treatment of pouchitis, Crohn's disease, cuffitis, and other inflammatory disorders of the pouch: Consensus guidelines from the international ileal pouch consortium. Lancet Gastroenterol Hepatol. 7 (1), 69-95 (2022).
- Dalal, R. L., Shen, B., Schwartz, D. A. Management of pouchitis and other common complications of the pouch. Inflamm Bowel Dis. 24 (5), 989-996 (2018).
- Li, K. Y., et al. A new rat model of pouchitis after proctocolectomy and ileal pouch-anal anastomosis using 2,4,6-trinitrobenzene sulfonic acid. J Gastrointest Surg. 25 (6), 1524-1533 (2021).
- Drzymala-Czyz, S., et al. Discrepancy between clinical and histological effects of dha supplementation in a rat model of pouchitis. Folia Histochem Cytobiol. 50 (1), 125-129 (2012).
- Santiago, P., Barnes, E. L., Raffals, L. E. Classification and management of disorders of the J pouch. Am J Gastroenterol. 118 (11), 1931-1939 (2023).
- Lichtman, S. N., Wang, J., Hummel, B., Lacey, S., Sartor, R. B. A rat model of ileal pouch-rectal anastomosis. Inflamm Bowel Dis. 4 (3), 187-195 (1998).
- Guarner, F. Inulin and oligofructose: Impact on intestinal diseases and disorders. Br J Nutr. 93, Suppl 1 S61-S65 (2005).
- Kim, C. J., et al. L-tryptophan exhibits therapeutic function in a porcine model of dextran sodium sulfate (DSS)-induced colitis. J Nutr Biochem. 21 (6), 468-475 (2010).
- Valatas, V., Bamias, G., Kolios, G. Experimental colitis models: Insights into the pathogenesis of inflammatory bowel disease and translational issues. Eur J Pharmacol. 759, 253-264 (2015).
- Letson, H. L., Morris, J., Biros, E., Dobson, G. P. Conventional and specific-pathogen free rats respond differently to anesthesia and surgical trauma. Sci Rep. 9 (1), 9399(2019).
- Gu, Y., et al. Saccharomyces boulardii, a yeast probiotic, inhibits gut motility through upregulating intestinal serotonin transporter and modulating gut microbiota. Pharmacol Res. 181, 106291(2022).
- Akiyama, S., et al. Endoscopic phenotype of the j pouch in patients with inflammatory bowel disease: A new classification for pouch outcomes. Clin Gastroenterol Hepatol. 20 (2), 293-302 (2022).
- Hata, K., et al. Pouchitis after ileal pouch-anal anastomosis in ulcerative colitis: Diagnosis, management, risk factors, and incidence. Dig Endosc. 29 (1), 26-34 (2017).
- Gallo, G., Kotze, P. G., Spinelli, A. Surgery in ulcerative colitis: When? How. Best Pract Res Clin Gastroenterol. 32-33, 71-78 (2018).
- Parks, A. Proctocolectomy without ileostomy for ulcerative colitis. BMJ. 2, 85-88 (1978).
- Shebani, K. O., et al. Pouchitis in a rat model of ileal J pouch-anal anastomosis. Inflamm Bowel Dis. 8 (1), 23-34 (2002).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon