Method Article
Um modelo de bolsite em ratos após proctocolectomia e anastomose ileal bolsa-anal usando sulfato de dextrano sódico
Neste Artigo
Resumo
Este protocolo descreve o método para estabelecer um modelo de bolsite em ratos. O modelo de bolsa ileal foi criado através da realização de cirurgia de anastomose ileal-bolsa anal (IPAA) usando técnicas microcirúrgicas. Após a cirurgia, o rato foi tratado com sulfato de dextrano sódico (DSS) a 4% por 4 dias.
Resumo
A colite ulcerativa () é uma doença crônica imunomediada que afeta todo o cólon e reto com um curso recidivante e remitente, causando morbidade ao longo da vida. Quando o tratamento médico é ineficaz, especialmente em casos de sangramento gastrointestinal maciço, perfuração, megacólon tóxico ou carcinogênese, a cirurgia se torna a última linha de defesa para curar a colite ulcerativa. A ressecção colorretal total e a anastomose ileal bolsa-anal (IPAA) oferecem a melhor chance de tratamento a longo prazo. A bolsite é a complicação pós-operatória mais comum e problemática. Nesta investigação, a microcirurgia é empregada para criar um modelo de bolsa ileal em ratos experimentais por meio de cirurgia IPAA. Posteriormente, um modelo de bolsite sustentado em ratos é estabelecido pela indução da inflamação da bolsa ileal com sulfato de dextrano sódico (DSS). O estabelecimento bem-sucedido da bolsite de ratos é validado por meio da análise do estado geral pós-operatório, peso, ingestão de alimentos e água, dados fecais, bem como patologia do tecido da bolsa, imuno-histoquímica e análise de fatores inflamatórios. Este modelo animal experimental de bolsite fornece uma base para estudar a patogênese e o tratamento da doença.
Introdução
A bolsite é uma inflamação inespecífica que afeta a bolsa ileal e é uma complicação prevalente após proctocolectomia total e anastomose ileal-bolsa anal (IPAA) em indivíduos com colite ulcerativa ()1,2,3. Essa condição tem uma taxa de ocorrência relativamente alta de até 50% e pode causar várias manifestações clínicas, incluindo diarreia, dor abdominal, perda de sangue fecal e febre. A causa exata da bolsite permanece indefinida, embora alguns pesquisadores acreditem que uma mudança na flora da bolsa possa desencadear a ativação imunológica e a inflamação subsequente 4,5,6,7.
Devido aos desafios associados à realização de ensaios clínicos sobre bolsite, os modelos animais podem servir como ferramentas valiosas para estudar drogas e mecanismos de bolsite. Há preocupações crescentes em relação à criação de bolsas ileais de ratos, com relatos indicando possível inflamação8. No entanto, as pesquisas nesse campo permanecem escassas devido à natureza intrincada do processo de fabricação, que carece de diretrizes claras 9,10. Em 1998, Lichtman foi o primeiro a estabelecer um modelo de bolsa ileal em ratos Lewis e ratos Sprague-Dawley (SD) realizando colectomia total11. Eles observaram infiltração de macrófagos, ulceração da mucosa e um aumento na flora bacteriana anaeróbica nos intestinos desses ratos, fornecendo uma base sólida para pesquisas futuras sobre a inflamação da bolsa ileal. Este modelo experimental de bolsite de rato imita de perto os sinais físicos e os mecanismos subjacentes observados na bolsite humana.
Os modelos de colite ulcerativa pré-clínica comumente aplicados incluem os modelos DSS e TNBS. O produto químico indutor do ácido 2,4,6-trinitrobenzeno sulfônico (TNBS) tipicamente simula a doença de Crohn12. O modelo DSS, respeitado por sua eficácia, perfil de segurança e acessibilidade, é frequentemente utilizado como uma ferramenta confiável para a indução da colite ulcerativa devido aos sintomas evidentes observados. Dada a colonização do tecido da bolsa, induzimos com sucesso um modelo de bolsite usando DSS13,14.
No presente estudo, a microcirurgia foi usada para criar com sucesso um modelo de bolsa ileal em ratos experimentais por meio de cirurgia IPAA. Posteriormente, um modelo de bolsite de rato sustentado foi estabelecido induzindo inflamação da bolsa ileal com DSS. A precisão durante a cirurgia é essencial para a formação bem-sucedida do modelo, e os cuidados pós-operatórios também são cruciais. Este modelo pode ser usado para investigar a patogênese da bolsite, avaliar potenciais agentes terapêuticos e aprofundar nossa compreensão dessa condição complexa. O estudo agiliza o procedimento de fabricação da bolsa ileal, reduzindo a duração da operação e aumentando a eficiência, estabelecendo assim uma base robusta para a pesquisa fundamental sobre distúrbios pós-cirúrgicos da bolsa.
Protocolo
Todos os experimentos com animais foram realizados de acordo com as políticas dos comitês de ética do Hospital Geral da Universidade Médica de Tianjin. Ratos Sprague-Dawley machos com idade entre 9 e 12 semanas, pesando aproximadamente 320-360 g, foram utilizados para este estudo. Os detalhes dos reagentes e equipamentos usados estão listados na Tabela de Materiais.
1. Seleção e manutenção de animais
- Selecione um animal saudável (peso corporal de ~ 220-240 g).
- Certifique-se de que eles atendam aos critérios do nível específico de livre de patógenos (FPS)15 e sejam criados de forma adaptativa por um mínimo de 2 semanas em um ambiente com ventilação adequada (8 a 12 trocas de ar por hora), temperatura confortável (20-25 °C), umidade apropriada (40%-70%), ruído mínimo (abaixo de 70 decibéis) e um ciclo de luz natural (12 h de luz e 12 h de escuridão).
- Durante este período, aloje-os em gaiolas limpas padrão a uma densidade de três a cinco por gaiola e troque a roupa de cama duas vezes por semana. Forneça acesso ad libitum a comida e água, bem como ração de manutenção padrão para ratos de laboratório.
2. Preparo pré-operatório
- Selecione um rato saudável com um peso corporal aproximado de 320 g a 360 g. Jejue o rato por 8-12 h antes da operação e forneça acesso a uma solução salina fisiológica e glicose a 5% na proporção de 1:1 para consumo voluntário.
- Preparar os instrumentos microcirúrgicos autoclavados (imersão pré-operatória em álcool por 1 h), um microscópio, uma mesa de dissecação de ratos, 8-0 sutura de alto peso molecular não absorvível, sutura não absorvível 4-0, gaze estéril, cotonetes estéreis, etc.
3. Estabelecimento do modelo de bolsa ileal de rato
- Injetar por via intraperitoneal uma solução de pentobarbital sódico a 1% na dose de 6 mL/kg e infiltração incisional de anestesia local com ropivacaína a 0,5% para anestesiar o rato. Mantenha o rato a uma temperatura confortável durante a anestesia com uma lâmpada elétrica.
- Realize a ressecção colorretal total seguindo os passos abaixo:
- Fixe o rato em decúbito dorsal em uma bancada anatômica seguindo um protocolo anestésico satisfatório. Confirme a profundidade da anestesia por meio de um beliscão no dedo do pé. Use uma máquina de cortar cabelo para eliminar os detritos de cabelo e aplique a solução de iodóforo duas vezes para esterilização do campo cirúrgico.
- Faça uma incisão na linha média, com aproximadamente 6 cm de comprimento, para dissecar através da pele, fáscia da linha branca e peritônio, proporcionando a entrada na cavidade abdominal. Use um afastador para expor a superfície peritoneal e cubra-a com gaze estéril bacteriostática embebida em solução salina.
- Isole o fluxo vascular do jejuno terminal, ligue sua origem usando um 8-0 fio de sutura e, posteriormente, cortá-lo. Coloque o coto cecal, localizado a 1-2 cm da válvula ileocecal, em repouso e, em seguida, corte-o.
- Inicie a ressecção do hemicólon direito, ligando o hemicólon direito e a veia cólica média de forma conservadora.
- Segregar ainda mais a artéria mesentérica inferior e isolar a artéria retal inferior. Continue o isolamento no reto até um intervalo equivalente a dois centímetros da borda anal. Ressecar obliquamente o reto distal em torno de 45 graus para evitar estenose pós-operatória.
- Execute a construção da bolsa J.
- Use um bisturi de micrótomo para separar a seção transversal do íleo terminal do intestino do mesentério, que deve medir cerca de 6-7 cm.
- Dobre o íleo terminal em forma de J para criar uma bolsa para o íleo. Realize a anastomose da parede posterior por meio de um ponto de intertravamento. Aumente a parede anterior usando um ponto de Connell modificado e mantenha um intestino apropriado para corresponder ao tamanho da seção transversal do coto retal distal.
- Reforce a bolsa em forma de J com 8-0 costura se necessário. O comprimento da bolsa J deve estar dentro da faixa de 2.5 cm a 3.5 cm.
- Realize a anastomose ileal-bolsa-anal, IPAA.
- Confirme a ausência de torção no mesentério e suture as paredes laterais da formiga da abertura da bolsa e a parede lateral do coto retal em intervalos com um 8-0 fio de sutura para tração.
- Por fim, aplique uma sutura de bloqueio contínua de camada completa nas paredes anterior e posterior.
- Verifique a ausência de sangramento ativo e limpe fisiologicamente a cavidade abdominal com solução salina normal. Feche sequencialmente a fáscia muscular abdominal e a pele com suturas 4-0.
- Realize o manejo pós-operatório.
- Administre cetoprofeno como analgesia pós-operatória (40 mg / kg, por via subcutânea) a todos os ratos após o fechamento abdominal. Certifique-se de que o rato seja aquecido com uma lâmpada elétrica até que ocorra a restauração.
- Restringir o consumo alimentar do animal por um período mínimo de 72 h no pós-operatório para reduzir o risco de obstrução intestinal. Permita o acesso a uma dieta de 5% de glicose ad libitum para repor rapidamente a energia e os fluidos corporais e ajuste a frequência de alimentação de acordo com os padrões de defecação.
- Uma semana após a cirurgia, comece com nutrição limitada e aumente gradualmente a quantidade consumida. Em seguida, forneça aos ratos ração regular para roedores consumirem livremente, mantendo um registro diário de sua ingestão alimentar, ingestão de água e peso corporal.
4. Estabelecimento de modelo de bolsite ileal de rato com DSS
- Realize o agrupamento experimental.
- Atribua aleatoriamente 12 ratos submetidos à ressecção colorretal total e cirurgia IPAA no grupo IPAA (Grupo A, n = 6) e no grupo bolsite (Grupo B, n = 6).
- Prepare uma solução de DSS a 4% adicionando 4 g de DSS a 100 mL de água pura, preparada na hora diariamente.
- Administre o grupo IPAA e o grupo bolsite com água pura ou DSS a 4% no 31º dia de pós-operatório ao 35º dia, respectivamente. Permita que os ratos bebam e comam livremente comida de rato durante os quatro dias consecutivos de administração.
- Efectue a recolha de amostras em bolsa.
- Na manhã do dia 35, após a operação, anestesiar os ratos com injeção intraperitoneal de solução de pentobarbital sódico a 1%, administrando uma dose de 6 mL/kg (seguindo protocolos aprovados institucionalmente).
- Corte a bolsa perpendicularmente do estoma da bolsa até a junção das bolsas de entrada e saída em cada grupo. Obtenha a amostra da bolsa.
- Abra a bolsa ao longo da linha de sutura da parede anterior e lave o canal intestinal com solução salina.
- Coloque um fragmento de tecido da bolsa em um tubo de microcentrífuga e refrigere-o imediatamente a -80 °C. Use esta parte para detecção ELISA de indicadores inflamatórios. Fixe a seção restante da bolsa com formaldeído a 10% para pontuação histopatológica e coloração imuno-histoquímica.
- Finalmente, eutanasiar o rato por embolia gasosa sob anestesia profunda (seguindo protocolos aprovados institucionalmente).
5. Análise histológica
- Depois de adquirir o tecido da bolsa do rato, mergulhe-o em paraformaldeído a 4% por 24 h. Posteriormente, prossiga com os protocolos de desidratação e incorporação. Corte o tecido processado para exame histológico16.
- Aplique coloração de hematoxilina e eosina para identificar diferenças histopatológicas entre os grupos. Examine as amostras microscopicamente e capture fotografias para documentação.
6. Ensaio imuno-histoquímico
- Desparafine e desidrate as seções de tecido com cuidado. Em seguida, realize a recuperação do antígeno resfriando as seções em solução de citrato de sódio e bloqueando-as com soro bloqueador por 20 min.
- Em seguida, expor as fatias ao anticorpo anti-oclusina primário e incubá-las durante a noite a 4 °C. Em seguida, trate-os com anticorpos secundários por 30 minutos antes da contracoloração da hematoxilina16.
- Depois que as fatias estiverem secas, observe-as e fotografe-as ao microscópio óptico.
7. Teste ELISA
- 7.1 Pique e homogeneize os fragmentos de tecido em tampão de lise usando sonicação para garantir uma homogeneização completa. Utilize o sobrenadante resultante para detecção.
- Aloque poços para brancos, amostras e réplicas por grupo. Determinar a concentração de proteínas lendo a absorvância a 450 nm (valor OD) e efectuando uma análise de regressão linear16.
Resultados
Avaliação do estado geral de ratos modelo bolsa ileal após o estabelecimento
Após o operador passar pela curva de aprendizado cirúrgico do IPAA, os ratos toleraram bem a cirurgia, com duração cirúrgica de 192,94 min ± 27,15 min, e ocorreram menos complicações pós-operatórias. Durante o período pós-operatório imediato, os ratos experimentaram uma diminuição na ingestão alimentar, mas seu apetite pré-operatório foi restaurado dentro de 10 dias a 14 dias após a cirurgia. A atividade pós-operatória precoce diminuiu ligeiramente e não havia secreções óbvias dos olhos e nariz. A perda de peso antes e após a cirurgia foi de 21,17 g ± 1,59 g. O peso pós-operatório inicial apresentou tendência decrescente, com redução máxima de 69,58 g ± 33,19 g. O crescimento estável iniciou-se no 8,25º dia ± 2,53 dias após a cirurgia, e no31º dia após a cirurgia, o peso ultrapassou 9,35% ± 4,7% do peso no dia seguinte à cirurgia. Os ratos foram capazes de defecar dentro de 24 horas após a cirurgia, com fezes moles, mas sem fezes com sangue. A formação de fezes moles ocorreu no9º ao 12º dia de pós-operatório.
Aumento compensatório da bolsa ileal
No35º dia de pós-operatório, a cavidade abdominal do rato foi aberta sob anestesia, revelando adesão severa entre a bolsa ileal e a cavidade pélvica. Após separar cuidadosamente a adesão entre a bolsa e os tecidos circundantes, observou-se aumento compensatório da bolsa ileal, espessamento da parede intestinal e leve dilatação do intestino delgado distal (Figura 1). O comprimento da bolsa ileal foi de 2,89 cm ± 0,28 cm no momento da cirurgia, enquanto no35º dia de pós-operatório mediu 3,86 cm ± 0,87 cm, mostrando uma diferença estatística significativa de P = 0,000). A área mucosa (cm2) da bolsa ileal também foi significativamente aumentada em comparação com a medida cirúrgica (6,46 ± 0,85 vs. 17,02 ± 4,61, P = 0,000). Não houve diferença significativa entre o grupo IPAA e o grupo bolsite ileal (P > 0,05).
Avaliação do estado geral e escore fecal de ratos com bolsite ileal
No31º dia após a cirurgia, o DSS foi administrado ao grupo bolsite ileal. No início da administração, tanto o grupo IPAA quanto o grupo bolsite ileal tinham peso corporal igual (352,00 g ± 30,03 g vs. 352,00 g ± 25,92 g, P = 1) e estavam geralmente em boas condições. No entanto, a quantidade de comida e água consumida no grupo bolsite ileal diminuiu, resultando em fadiga mental, cabelo sem brilho, secreção nos olhos e nariz, diminuição da mobilidade e nenhuma alteração significativa foi observada no grupo IPAA. No35º dia de pós-operatório, o peso do grupo bolsite ileal foi significativamente menor do que o do grupo IPAA (322,83 g ± 29,24 g vs. 364,83 g ± 30,13 g, P = 0,028) (Figura 2).
O grupo bolsite ileal apresentou diarreia significativa no primeiro dia após a administração de DSS e, no segundo dia após a administração de DSS, apresentou muco, pus e fezes com sangue (Figura 3). No35º dia de pós-operatório, os escores de fezes11 do grupo IPAA e do grupo bolsite ileal foram (4,33 ± 0,82 vs. 2,17 ± 0,75, P = 0,001), respectivamente. Os ratos do grupo IPAA tinham um ânus limpo e livre de poluição, enquanto os ratos com bolsite ileal tinham inchaço do ânus acompanhado de muco, pus e inserção de fezes com sangue.
Alterações histopatológicas da bolsa ileal
Observação macroscópica de espécimes de bolsa ileal
No grupo IPAA, a parede intestinal da bolsa ileal engrossou e nenhuma erosão, úlcera ou ponto de sangramento foi observado. No grupo bolsite ileal, os vasos sanguíneos no mesentério da bolsa de armazenamento tornam-se mais espessos e a mucosa da bolsa ileal é extensa ou localmente inflamada, com erosão visível, úlceras e pontos de sangramento, alguns dos quais acompanhados por dilatação distal significativa do intestino delgado (Figura 4).
Observação microscópica do tecido da bolsa ileal
No grupo de ratos IPAA, a ponta de algumas vilosidades intestinais no tecido da bolsa tornou-se romba, acompanhada por uma pequena quantidade de infiltração de neutrófilos e, ocasionalmente, uma pequena quantidade de exsudação foi observada na superfície da mucosa.
Em contraste, o arranjo das vilosidades intestinais no tecido da bolsa ileal de ratos no grupo de bolsite ileal foi extremamente desordenado. Algumas vilosidades intestinais estavam ausentes, e erosão extensa e múltiplas úlceras irregulares eram visíveis sem envolver a camada muscular. Isso foi acompanhado por um grande número de neutrófilos e infiltração de linfócitos, exsudação excessiva e inflamação visível da cripta. O escore patológico do tecido da bolsa ileal no grupo bolsite ileal foi significativamente maior do que no grupo IPAA, com diferença estatística significativa observada (8,50 ± 1,76 vs. 1,33 ± 0,52, P = 0,000) (Figura 5).
Nível de expressão da proteína funcional da barreira intestinal oclusina
A oclusina, uma importante proteína funcional da barreira intestinal, é expressa na membrana celular do tecido da bolsa ileal nos grupos IPAA e bolsite ileal de ratos11. No entanto, o nível de expressão da proteína oclusina no grupo bolsite ileal foi significativamente menor do que no grupo IPAA (0,25 ± 0,03 vs. 0,15 ± 0,02, P = 0,000) (Figura 6).
Detecção de fatores inflamatórios na bolsa ileal
Os níveis de expressão de IL-6, IL-17, TNF-α e INF-γ no tecido da bolsa ileal de ratos no grupo bolsite ileal foram significativamente maiores do que os do grupo IPAA (conforme determinado pelo teste ELISA16). Por outro lado, a IL-10 apresentou resultados opostos, com diferenças estatísticas observadas (P = 0,000) (Tabela 1).
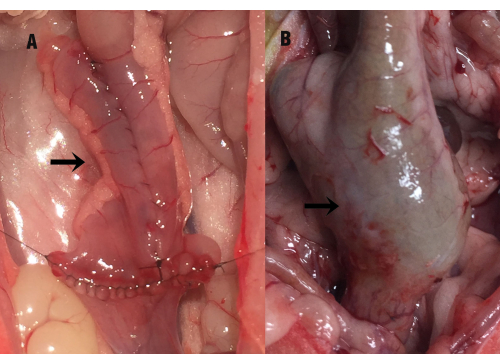
Figura 1: O estado da bolsa ileal. A seta indica a bolsa ileal (A) no momento da cirurgia e (B) o alargamento compensatório da bolsa ileal no35º dia de pós-operatório (durante a coleta da amostra). Clique aqui para ver uma versão maior desta figura.

Figura 2: Tendência das mudanças no peso corporal em ratos após a cirurgia de IPAA. A barra de erro está relacionada ao desvio padrão, n = 6 em cada grupo. Clique aqui para ver uma versão maior desta figura.

Figura 3: Fotografia de fezes de rato. (A) Grupo IPAA. (B) Grupo de bolsite ileal. Clique aqui para ver uma versão maior desta figura.
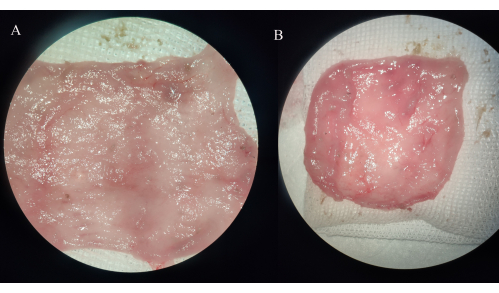
Figura 4: Observação macroscópica de espécimes de bolsa ileal. (A) Grupo IPAA. (B) Grupo de bolsite ileal. Clique aqui para ver uma versão maior desta figura.

Figura 5: Alterações patológicas do tecido da bolsa ileal de ratos. (A) Grupo IPAA. (B) Grupo de bolsite ileal. Barras de escala: 60 μm. Clique aqui para ver uma versão maior desta figura.

Figura 6: Detecção imuno-histoquímica da expressão da proteína oclusina no tecido da bolsa ileal de ratos. (A) Grupo IPAA. (B) Grupo de bolsite ileal. Barras de escala: 60 μm. Clique aqui para ver uma versão maior desta figura.
| Grupo | n | IL-6 | IL-10 | IL-17 | TNF-α | INF-γ |
| Grupo IPAA | 6 | 2,60 ± 0,36 | 5,81 ± 0,66 | 17.48 ± 4.81 | 86.94 ± 24.06 | 4,08 ± 0,56 |
| Grupo de bolsite | 6 | 6,94 ± 1,18 | 2,77 ± 0,60 | 34,82 ± 2,41 | 213.00 ± 26.11 | 9,67 ± 1,70 |
| P | 0 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 |
Tabela 1: Nível de expressão de fatores inflamatórios no tecido da bolsa ileal de ratos (pg/mL).
Discussão
A colite ulcerativa () é uma inflamação intestinal crônica caracterizada por dor epigástrica recorrente, diarreia e fezes com muco sanguinolento. Afeta principalmente o reto e pode envolver o cólon em progressão em graus variados. A cirurgia desempenha um papel crucial no manejo da colite ulcerativa 17,18,19. Desde que Parks et al.20 introduziram a colectomia total com um procedimento de anastomose ileal-bolsa anal (IPAA) em 1978 para remover tecido alterado e restaurar a continuidade intestinal, essa operação tornou-se o padrão internacional para o tratamento cirúrgico da colite ulcerativa. Distúrbios inflamatórios da bolsa são as complicações mais comuns após a cirurgia de IPAA.
Devido aos desafios enfrentados na realização de ensaios clínicos sobre bolsite, modelos animais têm sido utilizados como experimentos complementares para o estudo de drogas e mecanismos relacionados à bolsite. Em 1998, Lichtman et al.11 desenvolveram um modelo de rato envolvendo a remoção completa do intestino grosso e a reconexão da bolsa ao reto. Este modelo mostrou sinais de inflamação, como infiltração de células mononucleares, exsudação luminal, ulceração da mucosa e inflamação serosa dentro de quatro semanas após a cirurgia. O nível de inflamação foi correlacionado com um aumento da contagem bacteriana na bolsa, e suscetibilidade genética distinta do hospedeiro pode ser observada. Em 2002, Shebani et al.21 construíram com sucesso um modelo de rato cirúrgico IPAA via SDD, que efetivamente induziu bolsite. Este modelo confirmou a eficácia do uso de animais para estudar a patogênese da bolsite e forneceu uma plataforma experimental robusta para pesquisa básica sobre bolsite. Eles também identificaram padrões semelhantes de crescimento bacteriano abundante em reservatórios humanos e de roedores, validando sua utilidade na investigação do desequilíbrio bacteriano intestinal e na identificação de possíveis patógenos relacionados à bolsite.
Com experiência anterior em alimentação de camundongos e modelagem de cirurgia IPAA, é viável comprimir a curva de aprendizado para cerca de dez indivíduos. Uma etapa crítica neste processo é a construção e anastomose da bolsa J. Dado que o trato intestinal dos camundongos é relativamente delgado, 8-0 A sutura foi usada para as suturas. Suturas bloqueadas contínuas e um ponto de Connel foram empregados separadamente para as suturas da parede posterior e da parede anterior da bolsa. Durante a anastomose da bolsa e do canal anal, a criação de uma superfície inclinada pode efetivamente reduzir a estenose no local da anastomose, tomando o coto retal como exemplo. Inicialmente, fixar dois pontos de cada lado do local da anastomose e, em seguida, proceder com suturas contínuas bloqueadas para suturar as paredes posterior e anterior individualmente garante a integridade da anastomose e encurta o tempo cirúrgico.
O manejo pós-operatório também desempenha um papel fundamental na modelagem bem-sucedida. Um período de jejum de 72 horas no pós-operatório pode efetivamente reduzir a ocorrência de obstrução intestinal. Por outro lado, uma dieta líquida moderada precoce pode garantir as necessidades nutricionais e hídricas dos camundongos. Depois de dominar a curva de aprendizado, os cirurgiões podem alcançar uma taxa de sucesso mais eficiente e consistente no estabelecimento do modelo.
Este estudo foi construído sobre essa base e, por meio de exploração e refinamento preliminares, estabeleceu com sucesso um modelo de bolsa ileal de rato usando microcirurgia. Este modelo foi então utilizado para examinar o estado da inflamação da bolsa e os indicadores da barreira intestinal. Os resultados demonstraram que os ratos exibiram sintomas notáveis, como fezes com sangue, diarreia e perda de peso após serem expostos ao DSS. Isso levou a edema e erosão da mucosa da bolsa, inflamação conforme indicado pela pontuação histopatológica e aumento dos níveis de fatores pró-inflamatórios, incluindo interleucina-6 (IL-6), IL-17, fator de necrose tumoral alfa (TNF-α) e interferon-gama (INF-γ), juntamente com níveis diminuídos do fator anti-inflamatório interleucina-10 (IL-10). Além disso, a expressão proteica do indicador de barreira intestinal oclusina diminuiu. Esses achados se alinham com estudos anteriores11 e afirmam o estabelecimento bem-sucedido do modelo de bolsite de ratos, fornecendo uma plataforma sólida para pesquisas subsequentes de medicamentos e mecanismos.
Divulgações
Nenhum.
Agradecimentos
Nenhum
Materiais
| Name | Company | Catalog Number | Comments |
| Anhydrous ethanol | Tianjin Fengchuan Chemical Reagent Technology Co., Ltd | China | Hematoxin-eosin Staining |
| Dextran Sulfate Sodium | Yeasen | 60316ES76 | Used to induce pouch inflammation |
| Formaldehyde solution | Tianjin Zhiyuan Reagent Company | China | Hematoxin-eosin Staining |
| Gauze | Jiangxi Zhonggan Medical Equipment Company | China | Used for animal microsurgery |
| Hematoxylin | Beijing Zhongshan Jinqiao Company | China | Hematoxin-eosin Staining |
| Interferon γ Detection reagent kit | Cloud-clone | SEA049Ra | Detecting inflammatory factors |
| Interleukin-10 detection kit | Cloud-clone | SEA056Ra | Detecting inflammatory factors |
| Interleukin-17 detection kit | Cloud-clone | SEA063Ra | Detecting inflammatory factors |
| Interleukin-6 detection kit | Cloud-clone | SEA079Ra | Detecting inflammatory factors |
| Iodophor | Tangpai Medical Equipment Co., Ltd | China | Used for animal microsurgery |
| Microscopic manipulation instruments | Aesculap | Germany | Used for animal microsurgery |
| Occludin | abcam | ab216327 | Immunohistochemical testing |
| Sewing needle | Yangzhou Fuda Medical Equipment Co., Ltd | China | Used for animal microsurgery |
| tumor necrosis factor α Detection reagent kit | Cloud-clone | SEA133Ra | Detecting inflammatory factors |
| Two person binocular surgical microscope | OPTON | Germany | Used for animal microsurgery |
| Xylene | Tianjin Yingda Rare and Precious Reagent Factory | China | Hematoxin-eosin Staining |
Referências
- Yang, M. L., Brar, M. S., Kennedy, E. D., De Buck Van Overstraeten, A. Laparoscopic versus transanal IPAA for ulcerative colitis: A patient-centered treatment trade-off study. Dis Colon Rectum. 67 (1), 107-113 (2024).
- Aktas, M. K., et al. Current status and surgical technique for restorative proctocolectomy with ileal pouch-anal anastomosis. Balkan Med J. 40 (4), 236-243 (2023).
- Zhao, L., et al. Microbiota DNA translocation into mesentery lymph nodes is associated with early development of pouchitis after ipaa for ulcerative colitis. Diseases of the Colon & Rectum. 66 (11), e1107-e1118 (2022).
- Ng, S. C., et al. Worldwide incidence and prevalence of inflammatory bowel disease in the 21st century: A systematic review of population-based studies. Lancet. 390 (10114), 2769-2778 (2017).
- Pardi, D. S., D'haens, G., Shen, B., Campbell, S., Gionchetti, P. Clinical guidelines for the management of pouchitis. Inflamm Bowel Dis. 15 (9), 1424-1431 (2009).
- Shen, B., et al. Treatment of pouchitis, Crohn's disease, cuffitis, and other inflammatory disorders of the pouch: Consensus guidelines from the international ileal pouch consortium. Lancet Gastroenterol Hepatol. 7 (1), 69-95 (2022).
- Dalal, R. L., Shen, B., Schwartz, D. A. Management of pouchitis and other common complications of the pouch. Inflamm Bowel Dis. 24 (5), 989-996 (2018).
- Li, K. Y., et al. A new rat model of pouchitis after proctocolectomy and ileal pouch-anal anastomosis using 2,4,6-trinitrobenzene sulfonic acid. J Gastrointest Surg. 25 (6), 1524-1533 (2021).
- Drzymala-Czyz, S., et al. Discrepancy between clinical and histological effects of dha supplementation in a rat model of pouchitis. Folia Histochem Cytobiol. 50 (1), 125-129 (2012).
- Santiago, P., Barnes, E. L., Raffals, L. E. Classification and management of disorders of the J pouch. Am J Gastroenterol. 118 (11), 1931-1939 (2023).
- Lichtman, S. N., Wang, J., Hummel, B., Lacey, S., Sartor, R. B. A rat model of ileal pouch-rectal anastomosis. Inflamm Bowel Dis. 4 (3), 187-195 (1998).
- Guarner, F. Inulin and oligofructose: Impact on intestinal diseases and disorders. Br J Nutr. 93, Suppl 1 S61-S65 (2005).
- Kim, C. J., et al. L-tryptophan exhibits therapeutic function in a porcine model of dextran sodium sulfate (DSS)-induced colitis. J Nutr Biochem. 21 (6), 468-475 (2010).
- Valatas, V., Bamias, G., Kolios, G. Experimental colitis models: Insights into the pathogenesis of inflammatory bowel disease and translational issues. Eur J Pharmacol. 759, 253-264 (2015).
- Letson, H. L., Morris, J., Biros, E., Dobson, G. P. Conventional and specific-pathogen free rats respond differently to anesthesia and surgical trauma. Sci Rep. 9 (1), 9399(2019).
- Gu, Y., et al. Saccharomyces boulardii, a yeast probiotic, inhibits gut motility through upregulating intestinal serotonin transporter and modulating gut microbiota. Pharmacol Res. 181, 106291(2022).
- Akiyama, S., et al. Endoscopic phenotype of the j pouch in patients with inflammatory bowel disease: A new classification for pouch outcomes. Clin Gastroenterol Hepatol. 20 (2), 293-302 (2022).
- Hata, K., et al. Pouchitis after ileal pouch-anal anastomosis in ulcerative colitis: Diagnosis, management, risk factors, and incidence. Dig Endosc. 29 (1), 26-34 (2017).
- Gallo, G., Kotze, P. G., Spinelli, A. Surgery in ulcerative colitis: When? How. Best Pract Res Clin Gastroenterol. 32-33, 71-78 (2018).
- Parks, A. Proctocolectomy without ileostomy for ulcerative colitis. BMJ. 2, 85-88 (1978).
- Shebani, K. O., et al. Pouchitis in a rat model of ileal J pouch-anal anastomosis. Inflamm Bowel Dis. 8 (1), 23-34 (2002).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados