Method Article
Un modelo de pouchitis en ratas después de proctocolectomía y anastomosis anal con bolsa ileal y anastomosis con sulfato de dextrano sódico
En este artículo
Resumen
Este protocolo describe el método para establecer un modelo de pouchitis en ratas. El modelo de bolsa ileal se creó mediante la realización de una cirugía de anastomosis ileal-anal (IPAA) mediante técnicas microquirúrgicas. Después de la cirugía, la rata fue tratada con sulfato de dextrano sódico (DSS) al 4% durante 4 días.
Resumen
La colitis ulcerosa (CU) es una enfermedad crónica inmunomediada que afecta a todo el colon y el recto con un curso recurrente y remitente, causando morbilidad de por vida. Cuando el tratamiento médico es ineficaz, especialmente en casos de hemorragia gastrointestinal masiva, perforación, megacolon tóxico o carcinogénesis, la cirugía se convierte en la última línea de defensa para curar la colitis ulcerosa. La resección colorrectal total y la anastomosis anal con bolsa ileal (IPAA) ofrecen la mejor oportunidad para el tratamiento a largo plazo. La pouchitis es la complicación postoperatoria más común y problemática. En esta investigación, se emplea la microcirugía para crear un modelo de bolsa ileal en ratas experimentales mediante cirugía IPAA. Posteriormente, se establece un modelo sostenido de pouchitis en ratas mediante la inducción de la inflamación de la bolsa ileal con sulfato de dextrano sódico (DSS). El establecimiento exitoso de la pouchitis en ratas se valida mediante el análisis del estado general postoperatorio, el peso, la ingesta de alimentos y agua, los datos fecales, así como la patología del tejido de la bolsa, la inmunohistoquímica y el análisis de factores inflamatorios. Este modelo animal experimental de pouchitis proporciona una base para estudiar la patogénesis y el tratamiento de la afección.
Introducción
La pouchitis es una inflamación inespecífica que afecta a la bolsa ileal y es una complicación prevalente tras proctocolectomía total y anastomosis anal con bolsa ileal (IPAA) en individuos con colitis ulcerosa (CU)1,2,3. Esta afección tiene una tasa de incidencia relativamente alta de hasta el 50% y puede causar diversas manifestaciones clínicas, como diarrea, dolor abdominal, pérdida de sangre fecal y fiebre. La causa exacta de la pouchitis sigue siendo difícil de alcanzar, aunque algunos investigadores creen que un cambio en la flora de la pouchitis puede desencadenar la activación inmunitaria y la posterior inflamación 4,5,6,7.
Debido a los desafíos asociados con la realización de ensayos clínicos sobre la pouchitis, los modelos animales pueden servir como herramientas valiosas para estudiar los medicamentos y mecanismos de la pouchitis. Existe una creciente preocupación con respecto a la creación de bolsas ileales de rata, con informes que indican una posible inflamación8. Sin embargo, la investigación en este campo sigue siendo escasa debido a la naturaleza compleja del proceso de fabricación, que carece de directrices claras 9,10. En 1998, Lichtman fue el primero en establecer un modelo de bolsa ileal en ratas Lewis y ratas Sprague-Dawley (SD) mediante la realización de una colectomía total11. Observaron la infiltración de macrófagos, la ulceración de la mucosa y un aumento de la flora bacteriana anaeróbica dentro de los intestinos de estas ratas, lo que proporciona una base sólida para futuras investigaciones sobre la inflamación de la bolsa ileal. Este modelo experimental de pouchitis de rata imita de cerca los signos físicos y los mecanismos subyacentes observados en la pouchitis humana.
Los modelos de colitis ulcerosa preclínica comúnmente aplicados incluyen los modelos DSS y TNBS. El químico inductor ácido 2,4,6-trinitrobenceno sulfónico (TNBS) suele simular la enfermedad de Crohn12. El modelo DSS, respetado por su eficacia, perfil de seguridad y asequibilidad, se utiliza a menudo como una herramienta fiable para la inducción de la CU debido a los síntomas evidentes observados. Dada la colonización del tejido de la bolsa, inducimos con éxito un modelo de pouchitis utilizando DSS13,14.
En el presente estudio, se utilizó la microcirugía para crear con éxito un modelo de bolsa ileal en ratas experimentales mediante cirugía IPAA. Posteriormente, se estableció un modelo de pouchitis sostenida en rata mediante la inducción de inflamación de la bolsa ileal con DSS. La precisión durante la cirugía es esencial para la formación exitosa del modelo, y el cuidado postoperatorio también es crucial. Este modelo se puede utilizar para investigar la patogénesis de la pouchitis, evaluar posibles agentes terapéuticos y mejorar nuestra comprensión de esta compleja afección. El estudio simplifica el procedimiento de fabricación de la bolsa ileal, reduciendo la duración de la operación y aumentando la eficiencia, estableciendo así una base sólida para la investigación fundamental sobre los trastornos de la bolsa posquirúrgica.
Protocolo
Todos los experimentos con animales se realizaron de acuerdo con las políticas de los comités de ética del Hospital General de la Universidad Médica de Tianjin. Para este estudio se utilizaron ratas macho Sprague-Dawley de entre 9 y 12 semanas de edad, con un peso aproximado de 320-360 g. Los detalles de los reactivos y equipos utilizados se enumeran en la Tabla de Materiales.
1. Selección y mantenimiento de animales
- Seleccione un animal sano (peso corporal de ~220-240 g).
- Asegúrese de que cumplan con los criterios de nivel libre de patógenos específicos (SPF)15 y se críen de manera adaptativa durante un mínimo de 2 semanas en un entorno con ventilación adecuada (8 a 12 cambios de aire por hora), una temperatura agradable (20-25 °C), humedad adecuada (40%-70%), ruido mínimo (por debajo de 70 decibelios) y un ciclo de luz natural (12 h de luz y 12 h de oscuridad).
- Durante este período, colóquelos en jaulas limpias estándar a una densidad de tres a cinco por jaula y cambie la ropa de cama dos veces por semana. Proporcionar acceso ad libitum a alimentos y agua, así como a alimentos de mantenimiento estándar para ratas de laboratorio.
2. Preparación preoperatoria
- Seleccione una rata sana con un peso corporal aproximado de 320 g a 360 g. Ayunar la rata durante 8-12 h antes de la operación y proporcionar acceso a una solución de solución salina fisiológica y glucosa al 5% en una proporción de 1:1 para el consumo voluntario.
- Preparar los instrumentos microquirúrgicos esterilizados en autoclave (remojo preoperatorio en alcohol durante 1 h), un microscopio, una mesa de disección de ratas, 8-0 Sutura no absorbible de alto peso molecular, sutura no absorbible 4-0, gasas estériles, bastoncillos de algodón estériles, etc.
3. Establecimiento del modelo de bolsa ileal para ratas
- Inyectar por vía intraperitoneal una solución sódica de pentobarbital al 1% a una dosis de 6 mL/kg e infiltración incisional de anestesia local con ropivacaína al 0,5% para anestesiar a la rata. Mantenga a la rata a una temperatura agradable durante la anestesia con una lámpara eléctrica.
- Realice la resección colorrectal total siguiendo los siguientes pasos:
- Asegure a la rata en decúbito dorsal en un banco anatómico siguiendo un protocolo anestésico satisfactorio. Confirme la profundidad de la anestesia mediante un pellizco en el dedo del pie. Use cortadoras de afeitar para eliminar los restos de cabello y aplique la solución de yodóforo dos veces para la esterilización del campo quirúrgico.
- Realizar una incisión en la línea media, de aproximadamente 6 cm de largo, para diseccionar la piel, la fascia de la línea blanca y el peritoneo, proporcionando la entrada a la cavidad abdominal. Use un retractor para exponer la superficie peritoneal y cúbrala con una gasa estéril bacteriostática empapada en solución salina.
- Aislar el flujo vascular del yeyuno terminal, ligar su origen mediante un 8-0 hilo de sutura y, posteriormente, cortarlo. Coloque el muñón cecal, ubicado a 1-2 cm de la válvula ileocecal, en reposo y luego córtelo.
- Iniciar la resección del hemicolon derecho, ligando el hemicolon derecho y la vena del cólico medio de forma conservadora.
- Segregar aún más la arteria mesentérica inferior y aislar la arteria rectal inferior. Continúe el aislamiento por el recto hasta un intervalo que equivalga a dos centímetros desde el borde anal. Resecar oblicuamente el recto distal a unos 45 grados para evitar estenosis postoperatorias.
- Realice la construcción de la bolsa en J.
- Utilice un bisturí de micrótomo para separar la sección transversal del íleon terminal del intestino mesenterio, que debe medir unos 6-7 cm.
- Dobla el íleon terminal en forma de J para crear una bolsa para el íleon. Realizar la anastomosis de la pared posterior mediante un punto entrelazado. Aumente la pared anterior con un punto de Connell modificado y conserve un intestino adecuado para que coincida con el tamaño de la sección transversal del muñón rectal distal.
- Refuerce la bolsa en forma de J con 8-0 costuras si es necesario. La longitud de la bolsa J debe estar dentro del rango de 2,5 cm a 3,5 cm.
- Realizar anastomosis ileal-anal de bolsa, IPAA.
- Confirmar la ausencia de torsión en el mesenterio y suturar las paredes laterales de la abertura de la bolsa y la pared lateral del muñón rectal a intervalos con un 8-0 Hilo de sutura para tracción.
- En última instancia, aplique una sutura de bloqueo continuo de capa completa tanto en la pared anterior como en la posterior.
- Verificar la ausencia de sangrado activo y limpiar fisiológicamente la cavidad abdominal con solución salina normal. Cierre secuencialmente la fascia muscular abdominal y la piel con suturas 4-0.
- Realizar el manejo postoperatorio.
- Administrar ketoprofeno como analgesia postoperatoria (40 mg/kg, por vía subcutánea) a todas las ratas tras el cierre abdominal. Asegúrese de calentar la rata con una lámpara eléctrica hasta que se produzca la restauración.
- Restrinja el consumo de alimento del animal durante un período mínimo de 72 h después de la operación para reducir el riesgo de obstrucción intestinal. Permitir el acceso a una dieta de 5% de glucosa ad libitum para reponer rápidamente la energía y los líquidos corporales, y ajustar la frecuencia de alimentación según los patrones de defecación.
- Una semana después de la cirugía, comience con una nutrición limitada y aumente gradualmente la cantidad consumida. Luego, proporcione a las ratas alimento regular para roedores para que lo consuman libremente, mientras mantiene un registro diario de su ingesta dietética, ingesta de agua y peso corporal.
4. Establecimiento de un modelo de pouchitis ileal de rata con DSS
- Realizar la agrupación experimental.
- Asigne aleatoriamente a 12 ratas que se han sometido a una resección colorrectal total y cirugía de IPAA al grupo de IPAA (Grupo A, n = 6) y al grupo de pouchitis (Grupo B, n = 6).
- Prepare una solución de DSS al 4% añadiendo 4 g de DSS a 100 ml de agua pura, recién preparada diariamente.
- Administrar el grupo IPAA y el grupo de pouchitis con agua pura o DSS al 4% en el día 31 y 35 del postoperatorio, respectivamente. Permita que las ratas beban y coman libremente comida para ratas durante los cuatro días consecutivos de administración.
- Realice el muestreo de la bolsa.
- En la mañana del día 35, después de la operación, anestesiar a las ratas con una inyección intraperitoneal de solución sódica de pentobarbital al 1%, administrando una dosis de 6 mL/kg (siguiendo los protocolos aprobados institucionalmente).
- Corte la bolsa perpendicularmente desde el estoma de la bolsa hasta la unión de las bolsas de entrada y salida en cada grupo. Obtén el espécimen de la bolsa.
- Abra la bolsa a lo largo de la línea de sutura de la pared anterior y lave el canal intestinal con solución salina.
- Coloque un fragmento de tejido de bolsa en un tubo de microcentrífuga y refrigérelo rápidamente a -80 °C. Utilice esta parte para la detección ELISA de indicadores inflamatorios. Fije la sección restante de la bolsa con formaldehído al 10% para la puntuación histopatológica y la tinción inmunohistoquímica.
- Por último, eutanasiar a la rata mediante embolia gaseosa bajo anestesia profunda (siguiendo los protocolos aprobados institucionalmente).
5. Análisis histológico
- Después de adquirir el tejido de la bolsa de la rata, sumérjalo en paraformaldehído al 4% durante 24 h. Posteriormente, proceda con los protocolos de deshidratación e incrustación. Seccionar el tejido procesado para el examen histológico16.
- Aplique tinción con hematoxilina y eosina para identificar las diferencias histopatológicas entre los grupos. Examine las muestras microscópicamente y capture fotografías para su documentación.
6. Ensayo inmunohistoquímico
- Desparafinar y deshidratar las secciones de tejido con cuidado. Luego, realice la recuperación del antígeno enfriando las secciones en una solución de citrato de sodio y bloqueándolas con suero bloqueante durante 20 minutos.
- Posteriormente, exponer las rodajas al anticuerpo primario anti-ocludina e incubarlas durante la noche a 4 °C. Posteriormente, trátelos con anticuerpos secundarios durante 30 min antes de la contratinción de hematoxilina16.
- Una vez que las rodajas se hayan secado, obsérvalas y fotografíalas bajo un microscopio óptico.
7. Prueba ELISA
- 7.1 Picar y homogeneizar los fragmentos de tejido en tampón de lisis mediante sonicación para garantizar una homogeneización completa. Utilice el sobrenadante resultante para la detección.
- Asigne pozos para espacios en blanco, muestras y réplicas por grupo. Determine la concentración de proteínas mediante la lectura de la absorbancia a 450 nm (valor OD) y la realización de un análisis de regresión lineal16.
Resultados
Evaluación del estado general de las ratas modelo de bolsa ileal después del establecimiento
Después de que el operador superó la curva de aprendizaje quirúrgico IPAA, las ratas toleraron bien la cirugía, con una duración quirúrgica de 192,94 min ± 27,15 min, y se produjeron menos complicaciones postoperatorias. Durante el período postoperatorio temprano, las ratas experimentaron una disminución en la ingesta dietética, pero su apetito preoperatorio se restauró dentro de los 10 días a 14 días posteriores a la cirugía. La actividad postoperatoria temprana disminuyó ligeramente y no hubo secreciones evidentes de los ojos y la nariz. La pérdida de peso antes y después de la cirugía fue de 21,17 g ± 1,59 g. El peso postoperatorio inicial mostró una tendencia decreciente, con una reducción máxima de 69,58 g ± 33,19 g. El crecimiento estable comenzó a los 8,25 días ± 2,53 días después de la cirugía, y a los 31días después de la cirugía, el peso superó el 9,35% ± el 4,7% del peso del día después de la cirugía. Las ratas pudieron defecar dentro de las 24 horas posteriores a la cirugía, con heces blandas pero sin heces sanguinolentas. La formación de heces blandas se produjo entre el9º y el12º día después de la cirugía.
Aumento compensatorio de la bolsa ileal
A los 35días de la cirugía, la cavidad abdominal de la rata se abrió bajo anestesia, revelando una adherencia severa entre la bolsa ileal y la cavidad pélvica. Después de separar cuidadosamente la adherencia entre la bolsa y los tejidos circundantes, se observó un agrandamiento compensatorio de la bolsa ileal, un engrosamiento de la pared intestinal y una leve dilatación del intestino delgado distal (Figura 1). La longitud de la bolsa ileal fue de 2,89 cm ± 0,28 cm en el momento de la cirugía, mientras que a los 35días después de la cirugía midió 3,86 cm ± 0,87 cm, mostrando una diferencia estadística significativa de P = 0,000). El área mucosa (cm2) de la bolsa ileal también aumentó significativamente en comparación con la medición quirúrgica (6,46 ± 0,85 vs. 17,02 ± 4,61, p = 0,000). No hubo diferencias significativas entre el grupo de IPAA y el grupo de pouchitis ileal (P > 0,05).
Evaluación del estado general y puntuación fecal de ratas con pouchitis ileal
A los 31días después de la cirugía, se administró DSS al grupo de pouchitis ileal. Al inicio de la administración, tanto el grupo de IPAA como el grupo de pouchitis ileal tenían el mismo peso corporal (352,00 g ± 30,03 g vs. 352,00 g ± 25,92 g, P = 1) y en general se encontraban en buen estado. Sin embargo, la cantidad de alimentos y agua consumidos en el grupo de pouchitis ileal disminuyó, lo que resultó en fatiga mental, cabello sin brillo, secreción en los ojos y la nariz, disminución de la movilidad y no se observaron cambios significativos en el grupo de IPAA. A los 35días después de la cirugía, el peso del grupo de pouchitis ileal fue significativamente menor que el del grupo IPAA (322,83 g ± 29,24 g vs. 364,83 g ± 30,13 g, P = 0,028) (Figura 2).
El grupo de pouchitis ileal experimentó diarrea significativa el primer día después de la administración de DSS, y el segundo día después de la administración de DSS, presentaron moco, pus y heces con sangre (Figura 3). A los 35días después de la cirugía, las puntuaciones de heces11 del grupo IPAA y del grupo de pouchitis ileal fueron (4,33 ± 0,82 vs. 2,17 ± 0,75, p = 0,001), respectivamente. Las ratas del grupo IPAA tenían un ano limpio y libre de contaminación, mientras que las ratas con pouchitis ileal tenían hinchazón del ano acompañada de moco, pus y adhesión de heces con sangre.
Cambios histopatológicos de la bolsa ileal
Observación macroscópica de especímenes de bolsa ileal
En el grupo IPAA, la pared intestinal de la bolsa ileal se engrosó y no se observó erosión, úlcera o punto de sangrado. En el grupo de la bolsa ileal, los vasos sanguíneos del mesenterio de la bolsa de almacenamiento se vuelven más gruesos y la mucosa de la bolsa ileal se inflama extensa o localmente, con erosión, úlceras y puntos sangrantes visibles, algunos de los cuales se acompañan de una dilatación distal significativa del intestino delgado (Figura 4).
Observación microscópica del tejido de la bolsa ileal
En el grupo de ratas IPAA, la punta de algunas vellosidades intestinales en el tejido de la bolsa se volvió roma, acompañada de una pequeña cantidad de infiltración de neutrófilos y, ocasionalmente, se observó una pequeña cantidad de exudación en la superficie mucosa.
Por el contrario, la disposición de las vellosidades intestinales en el tejido de la bolsa ileal de las ratas del grupo de pouchitis ileal era extremadamente desordenada. Faltaban algunas vellosidades intestinales, y se apreciaba una erosión extensa y múltiples úlceras parcheadas sin comprometer la capa muscular. Esto se acompañó de un gran número de infiltraciones de neutrófilos y linfocitos, exudación excesiva e inflamación visible de las criptas. La puntuación patológica del tejido de la bolsa ileal en el grupo de pouchitis ileal fue significativamente mayor que la del grupo IPAA, observándose una diferencia estadísticamente significativa (8,50 ± 1,76 vs. 1,33 ± 0,52, p = 0,000) (Figura 5).
Nivel de expresión de la proteína funcional de barrera intestinal ocludina
La ocludina, una importante proteína funcional de la barrera intestinal, se expresa en la membrana celular del tejido de la bolsa ileal en los grupos de IPAA y pouchitis ileal de ratas11. Sin embargo, el nivel de expresión de la proteína ocludina en el grupo de pouchitis ileal fue significativamente menor que el del grupo IPAA (0,25 ± 0,03 vs. 0,15 ± 0,02, p = 0,000) (Figura 6).
Detección de factores inflamatorios en la bolsa ileal
Los niveles de expresión de IL-6, IL-17, TNF-α e INF-γ en el tejido de la bolsa ileal de las ratas en el grupo de pouchitis ileal fueron significativamente más altos que los del grupo IPAA (según lo determinado por la prueba ELISA16). Por el contrario, la IL-10 mostró resultados opuestos, observándose diferencias estadísticas (P = 0,000) (Tabla 1).
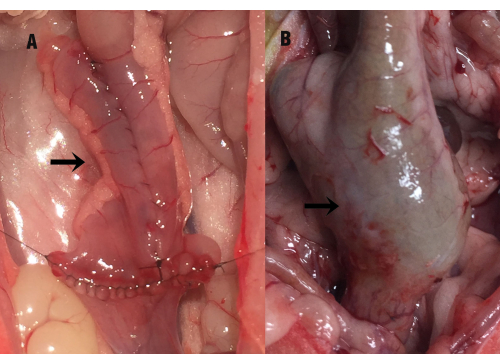
Figura 1: Estado de la bolsa ileal. La flecha indica la bolsa ileal (A) en el momento de la cirugía y (B) el agrandamiento compensatorio de la bolsa ileal a los 35días después de la cirugía (durante la recolección de la muestra). Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Tendencia de los cambios en el peso corporal en ratas después de la cirugía con IPAA. La barra de error está relacionada con la desviación estándar, n = 6 en cada grupo. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Fotografía de heces de rata. (A) Grupo IPAA. (B) Grupo de la pouchitis ileal. Haga clic aquí para ver una versión más grande de esta figura.
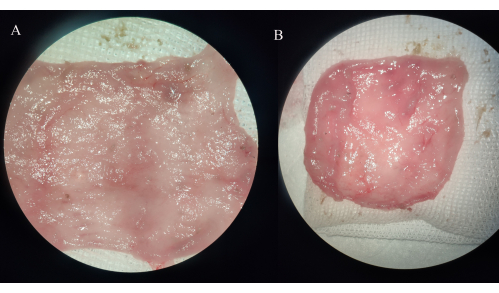
Figura 4: Observación macroscópica de especímenes de bolsa ileal. (A) Grupo IPAA. (B) Grupo de la pouchitis ileal. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Cambios patológicos en el tejido de la bolsa ileal de rata. (A) Grupo IPAA. (B) Grupo de la pouchitis ileal. Barras de escala: 60 μm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Detección inmunohistoquímica de la expresión de la proteína ocludina en el tejido de la bolsa ileal de rata. (A) Grupo IPAA. (B) Grupo de la pouchitis ileal. Barras de escala: 60 μm. Haga clic aquí para ver una versión más grande de esta figura.
| Grupo | n | IL-6 | IL-10 | IL-17 | TNF-α | INF-γ |
| Grupo IPAA | 6 | 2,60 ± 0,36 | 5,81 ± 0,66 | 17,48 ± 4,81 | 86,94 ± 24,06 | 4,08 ± 0,56 |
| Grupo de Pouchitis | 6 | 6,94 ± 1,18 | 2,77 ± 0,60 | 34,82 ± 2,41 | 213.00 ± 26.11 | 9,67 ± 1,70 |
| P | 0 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 |
Tabla 1: Nivel de expresión de factores inflamatorios en tejido de bolsa ileal de rata (pg/mL).
Discusión
La colitis ulcerosa (CU) es una inflamación intestinal crónica caracterizada por dolor epigástrico recurrente, diarrea y heces con sangre mucosa. Afecta principalmente al recto y puede afectar al colon en progresión en diversos grados. La cirugía juega un papel crucial en el manejo de la CU 17,18,19. Desde que Parks et al.20 introdujeron la colectomía total con un procedimiento de anastomosis anal con bolsa ileal (IPAA) en 1978 para eliminar el tejido alterado y restaurar la continuidad intestinal, esta operación se ha convertido en el estándar internacional para el tratamiento quirúrgico de la CU. Los trastornos inflamatorios de la bolsa son las complicaciones más comunes después de la cirugía de IPAA.
Debido a los desafíos a los que se enfrenta la realización de ensayos clínicos sobre la pouchitis, se han utilizado modelos animales como experimentos complementarios para estudiar los fármacos y los mecanismos relacionados con la pouchitis. En 1998, Lichtman et al.11 desarrollaron un modelo de rata que implicaba la extirpación completa del intestino grueso y la reconexión de la bolsa al recto. Este modelo mostró signos de inflamación, como infiltración de células mononucleares, exudación luminal, ulceración de la mucosa e inflamación serosa dentro de las cuatro semanas posteriores a la cirugía. El nivel de inflamación se correlacionó con un mayor recuento bacteriano en la bolsa, y se pudo observar una susceptibilidad genética distinta del huésped. En 2002, Shebani et al.21 construyeron con éxito un modelo de rata quirúrgica IPAA mediante SDD, que indujo eficazmente la pouchitis. Este modelo confirmó la eficacia del uso de animales para estudiar la patogénesis de la pouchitis y proporcionó una sólida plataforma experimental para la investigación básica sobre la pouchitis. También identificaron patrones similares de crecimiento bacteriano abundante tanto en reservorios humanos como en roedores, validando su utilidad en la investigación del desequilibrio bacteriano intestinal e identificando posibles patógenos relacionados con la pouchitis.
Con experiencia previa en alimentación de ratones y modelado de cirugía IPAA, es factible comprimir la curva de aprendizaje a alrededor de diez sujetos. Un paso crítico en este proceso es la construcción y anastomosis de la bolsa J. Dado que el tracto intestinal de los ratones es relativamente delgado, 8-0 Se utilizó sutura para las suturas. Se emplearon suturas de bloqueo continuo y un punto de Connel por separado para las suturas de la pared posterior y la pared anterior de la bolsa. Durante la anastomosis de la bolsa y del canal anal, la creación de una superficie inclinada puede reducir eficazmente la estenosis en el sitio anastomótico tomando como ejemplo el muñón rectal. Inicialmente, la fijación de dos puntos a cada lado del sitio anastomótico, luego proceder con suturas de bloqueo continuo para suturar las paredes posterior y anterior individualmente asegura la integridad de la anastomosis y acorta el tiempo quirúrgico.
El tratamiento postoperatorio también desempeña un papel fundamental en el éxito del modelado. Un período de ayuno de 72 horas después de la operación puede reducir eficazmente la aparición de obstrucción intestinal. Por otro lado, una dieta líquida moderada temprana puede asegurar los requerimientos nutricionales y de líquidos de los ratones. Después de dominar la curva de aprendizaje, los cirujanos pueden lograr una tasa de éxito más eficiente y consistente en el establecimiento del modelo.
Este estudio se ha basado en esta base y, a través de la exploración y el refinamiento preliminares, estableció con éxito un modelo de bolsa ileal de rata mediante microcirugía. Este modelo se utilizó para examinar el estado de la inflamación de la bolsa y los indicadores de la barrera intestinal. Los resultados demostraron que las ratas exhibieron síntomas notables como heces con sangre, diarrea y pérdida de peso después de ser expuestas al DSS. Esto condujo a edema y erosión de la mucosa de la bolsa, inflamación según lo indicado por la puntuación histopatológica y aumento de los niveles de factores proinflamatorios, incluyendo interleucina-6 (IL-6), IL-17, factor de necrosis tumoral alfa (TNF-α) e interferón-gamma (INF-γ), junto con niveles disminuidos del factor antiinflamatorio interleucina-10 (IL-10). Además, la expresión proteica del indicador de barrera intestinal ocludina disminuyó. Estos hallazgos se alinean con estudios previos11 y afirman el establecimiento exitoso del modelo de pouchitis en ratas, proporcionando una plataforma sólida para la investigación posterior de medicamentos y mecanismos.
Divulgaciones
Ninguno.
Agradecimientos
Ninguno
Materiales
| Name | Company | Catalog Number | Comments |
| Anhydrous ethanol | Tianjin Fengchuan Chemical Reagent Technology Co., Ltd | China | Hematoxin-eosin Staining |
| Dextran Sulfate Sodium | Yeasen | 60316ES76 | Used to induce pouch inflammation |
| Formaldehyde solution | Tianjin Zhiyuan Reagent Company | China | Hematoxin-eosin Staining |
| Gauze | Jiangxi Zhonggan Medical Equipment Company | China | Used for animal microsurgery |
| Hematoxylin | Beijing Zhongshan Jinqiao Company | China | Hematoxin-eosin Staining |
| Interferon γ Detection reagent kit | Cloud-clone | SEA049Ra | Detecting inflammatory factors |
| Interleukin-10 detection kit | Cloud-clone | SEA056Ra | Detecting inflammatory factors |
| Interleukin-17 detection kit | Cloud-clone | SEA063Ra | Detecting inflammatory factors |
| Interleukin-6 detection kit | Cloud-clone | SEA079Ra | Detecting inflammatory factors |
| Iodophor | Tangpai Medical Equipment Co., Ltd | China | Used for animal microsurgery |
| Microscopic manipulation instruments | Aesculap | Germany | Used for animal microsurgery |
| Occludin | abcam | ab216327 | Immunohistochemical testing |
| Sewing needle | Yangzhou Fuda Medical Equipment Co., Ltd | China | Used for animal microsurgery |
| tumor necrosis factor α Detection reagent kit | Cloud-clone | SEA133Ra | Detecting inflammatory factors |
| Two person binocular surgical microscope | OPTON | Germany | Used for animal microsurgery |
| Xylene | Tianjin Yingda Rare and Precious Reagent Factory | China | Hematoxin-eosin Staining |
Referencias
- Yang, M. L., Brar, M. S., Kennedy, E. D., De Buck Van Overstraeten, A. Laparoscopic versus transanal IPAA for ulcerative colitis: A patient-centered treatment trade-off study. Dis Colon Rectum. 67 (1), 107-113 (2024).
- Aktas, M. K., et al. Current status and surgical technique for restorative proctocolectomy with ileal pouch-anal anastomosis. Balkan Med J. 40 (4), 236-243 (2023).
- Zhao, L., et al. Microbiota DNA translocation into mesentery lymph nodes is associated with early development of pouchitis after ipaa for ulcerative colitis. Diseases of the Colon & Rectum. 66 (11), e1107-e1118 (2022).
- Ng, S. C., et al. Worldwide incidence and prevalence of inflammatory bowel disease in the 21st century: A systematic review of population-based studies. Lancet. 390 (10114), 2769-2778 (2017).
- Pardi, D. S., D'haens, G., Shen, B., Campbell, S., Gionchetti, P. Clinical guidelines for the management of pouchitis. Inflamm Bowel Dis. 15 (9), 1424-1431 (2009).
- Shen, B., et al. Treatment of pouchitis, Crohn's disease, cuffitis, and other inflammatory disorders of the pouch: Consensus guidelines from the international ileal pouch consortium. Lancet Gastroenterol Hepatol. 7 (1), 69-95 (2022).
- Dalal, R. L., Shen, B., Schwartz, D. A. Management of pouchitis and other common complications of the pouch. Inflamm Bowel Dis. 24 (5), 989-996 (2018).
- Li, K. Y., et al. A new rat model of pouchitis after proctocolectomy and ileal pouch-anal anastomosis using 2,4,6-trinitrobenzene sulfonic acid. J Gastrointest Surg. 25 (6), 1524-1533 (2021).
- Drzymala-Czyz, S., et al. Discrepancy between clinical and histological effects of dha supplementation in a rat model of pouchitis. Folia Histochem Cytobiol. 50 (1), 125-129 (2012).
- Santiago, P., Barnes, E. L., Raffals, L. E. Classification and management of disorders of the J pouch. Am J Gastroenterol. 118 (11), 1931-1939 (2023).
- Lichtman, S. N., Wang, J., Hummel, B., Lacey, S., Sartor, R. B. A rat model of ileal pouch-rectal anastomosis. Inflamm Bowel Dis. 4 (3), 187-195 (1998).
- Guarner, F. Inulin and oligofructose: Impact on intestinal diseases and disorders. Br J Nutr. 93, Suppl 1 S61-S65 (2005).
- Kim, C. J., et al. L-tryptophan exhibits therapeutic function in a porcine model of dextran sodium sulfate (DSS)-induced colitis. J Nutr Biochem. 21 (6), 468-475 (2010).
- Valatas, V., Bamias, G., Kolios, G. Experimental colitis models: Insights into the pathogenesis of inflammatory bowel disease and translational issues. Eur J Pharmacol. 759, 253-264 (2015).
- Letson, H. L., Morris, J., Biros, E., Dobson, G. P. Conventional and specific-pathogen free rats respond differently to anesthesia and surgical trauma. Sci Rep. 9 (1), 9399(2019).
- Gu, Y., et al. Saccharomyces boulardii, a yeast probiotic, inhibits gut motility through upregulating intestinal serotonin transporter and modulating gut microbiota. Pharmacol Res. 181, 106291(2022).
- Akiyama, S., et al. Endoscopic phenotype of the j pouch in patients with inflammatory bowel disease: A new classification for pouch outcomes. Clin Gastroenterol Hepatol. 20 (2), 293-302 (2022).
- Hata, K., et al. Pouchitis after ileal pouch-anal anastomosis in ulcerative colitis: Diagnosis, management, risk factors, and incidence. Dig Endosc. 29 (1), 26-34 (2017).
- Gallo, G., Kotze, P. G., Spinelli, A. Surgery in ulcerative colitis: When? How. Best Pract Res Clin Gastroenterol. 32-33, 71-78 (2018).
- Parks, A. Proctocolectomy without ileostomy for ulcerative colitis. BMJ. 2, 85-88 (1978).
- Shebani, K. O., et al. Pouchitis in a rat model of ileal J pouch-anal anastomosis. Inflamm Bowel Dis. 8 (1), 23-34 (2002).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados