Method Article
מודל חולדה של פאוצ'יטיס לאחר כריתת פרוקטוקולקטומיה ואנסטומוזה אנאלי של כיס איליאלי באמצעות דקסטרן סולפט נתרן
In This Article
Summary
פרוטוקול זה מתאר את השיטה להקמת מודל חולדה של pouchitis. מודל השקית האיליאלית נוצר על ידי ביצוע ניתוח אנסטומוזה אנאלי (IPAA) באמצעות טכניקות מיקרוכירורגיות. לאחר הניתוח, החולדה טופלה ב-4% דקסטרן סולפט נתרן (DSS) במשך 4 ימים.
Abstract
קוליטיס כיבית (UC) היא מחלה כרונית בתיווך מערכת החיסון הפוגעת בכל המעי הגס ופי הטבעת במסלול התקפי והפוגתי, וגורמת לתחלואה לכל החיים. כאשר הטיפול הרפואי אינו יעיל, במיוחד במקרים של דימום מסיבי במערכת העיכול, ניקוב, מגה-קולון רעיל או סרטן, ניתוח הופך לקו ההגנה האחרון לריפוי UC. כריתה כוללת של המעי הגס ואנסטומוזיס אנאלי (IPAA) מציעים את הסיכוי הטוב ביותר לטיפול ארוך טווח. פוצ'יטיס הוא הסיבוך הנפוץ והבעייתי ביותר לאחר הניתוח. במחקר זה, מיקרו-כירורגיה משמשת ליצירת מודל כיס איליאלי בחולדות ניסיוניות באמצעות ניתוח IPAA. לאחר מכן, מודל חולדה מתמשך של pouchitis נקבע על ידי גרימת דלקת של שקיק ileal עם נתרן dextran סולפט (DSS). ההקמה המוצלחת של פאוצ'יטיס חולדה מאומתת באמצעות ניתוח של מצב כללי לאחר הניתוח, משקל, צריכת מזון ומים, נתוני צואה, כמו גם פתולוגיה של רקמת כיס, אימונוהיסטוכימיה וניתוח גורמים דלקתיים. מודל ניסיוני זה של בעלי חיים של pouchitis מספק בסיס לחקר הפתוגנזה והטיפול במצב.
Introduction
פוצ'יטיס היא דלקת לא ספציפית המשפיעה על כיס האיליאלי והיא סיבוך שכיח לאחר כריתת פרוקטוקולקטומיה מלאה ואנסטומוזיס אנאלי של כיס איליאלי (IPAA) אצל אנשים עם קוליטיס כיבית (UC)1,2,3. מצב זה הוא בעל שיעור התרחשות גבוה יחסית של עד 50% ועלול לגרום לביטויים קליניים שונים, כולל שלשולים, כאבי בטן, איבוד דם בצואה וחום. הגורם המדויק לפוצ'יטיס נותר חמקמק, אם כי כמה חוקרים מאמינים כי שינוי בפלורה של השקית עשוי לעורר הפעלה חיסונית ולאחר מכן דלקת 4,5,6,7.
בשל האתגרים הקשורים בביצוע ניסויים קליניים על pouchitis, מודלים של בעלי חיים יכולים לשמש כלים יקרי ערך לחקר תרופות ומנגנונים של pouchitis. ישנם חששות גוברים לגבי יצירת שקיות חולדה, עם דיווחים המצביעים על דלקת אפשרית8. עם זאת, המחקר בתחום זה נותר דליל בשל אופיו המורכב של תהליך הייצור, אשר חסר הנחיות ברורות 9,10. בשנת 1998, ליכטמן היה הראשון שהקים מודל של פאוץ' איליאלי בחולדות לואיס וחולדות ספראג-דולי (SD) על ידי ביצוע כריתת קולקטומיה11 כוללת. הם הבחינו בחדירת מקרופאגים, כיב רירית ועלייה בפלורה חיידקית אנאירובית בתוך המעיים של חולדות אלה, מה שסיפק בסיס מוצק למחקר נוסף על דלקת כיסי איליאלית. מודל ניסיוני זה של פאוצ'יטיס חולדה מחקה באופן הדוק את הסימנים הפיזיים ואת המנגנונים הבסיסיים שנצפו בפוצ'יטיס אנושית.
מודלים נפוצים של קוליטיס כיבית פרה-קלינית כוללים את המודלים DSS ו-TNBS. הכימיקל המשרה 2,4,6-trinitrobenzene sulfonic acid (TNBS) מדמה בדרך כלל מחלת קרוהן12. מודל DSS, המכובד בשל יעילותו, פרופיל הבטיחות והמחיר המשתלם שלו, משמש לעתים קרובות ככלי אמין להשראת UC בשל הסימפטומים הברורים שנצפו. בהתחשב בהתיישבות של רקמת השקית, גרמנו בהצלחה מודל פאוצ'יטיס באמצעות DSS13,14.
במחקר הנוכחי, מיקרו-כירורגיה שימשה ליצירת מודל מוצלח של שקיק איליאלי בחולדות ניסיוניות באמצעות ניתוח IPAA. לאחר מכן, מודל מתמשך של פאוצ'יטיס חולדה נקבע על ידי גרימת דלקת של כיס איליאלי עם DSS. דיוק במהלך הניתוח חיוני ליצירת מודל מוצלח, וטיפול לאחר הניתוח הוא חיוני גם כן. מודל זה יכול לשמש כדי לחקור את הפתוגנזה של pouchitis, להעריך סוכנים טיפוליים פוטנציאליים, ולקדם את הבנתנו של מצב מורכב זה. המחקר מייעל את הליך ייצור השקיות, מקצר את משך הפעולה ומגביר את היעילות, ובכך מבסס בסיס איתן למחקר בסיסי בהפרעות שקיות לאחר ניתוח.
Protocol
כל הניסויים בבעלי חיים בוצעו בהתאם למדיניות של ועדות האתיקה של בית החולים הכללי של האוניברסיטה הרפואית בטיאן-ג'ין. במחקר זה נעשה שימוש בחולדות Sprague-Dawley זכרים בגילאי 9 עד 12 שבועות, במשקל של כ-320-360 גרם. פרטי הריאגנטים והציוד בהם נעשה שימוש מפורטים בטבלת החומרים.
1. בחירת בעלי חיים ותחזוקתם
- בחר חיה בריאה (משקל גוף של ~ 220-240 גרם).
- ודא שהם עומדים בקריטריונים של רמה ספציפית ללא פתוגן (SPF)15 ומגודלים באופן אדפטיבי למשך שבועיים לפחות בסביבה עם אוורור הולם (8 עד 12 החלפות אוויר בשעה), טמפרטורה נוחה (20-25 מעלות צלזיוס), לחות מתאימה (40%-70%), רעש מינימלי (מתחת ל-70 דציבלים) ומחזור אור טבעי (12 שעות אור ו-12 שעות חושך).
- במהלך תקופה זו, אכסנו אותם בכלובים נקיים סטנדרטיים בצפיפות של שלושה עד חמישה בכל כלוב, והחליפו את המצעים פעמיים בשבוע. לספק גישה למזון ולמים, כמו גם הזנת תחזוקה סטנדרטית לחולדות מעבדה.
2. הכנה טרום ניתוחית
- בחר חולדה בריאה עם משקל גוף משוער של 320 גרם עד 360 גרם. צמו את החולדה במשך 8-12 שעות לפני הניתוח וספקו גישה לתמיסה של מי מלח פיזיולוגיים ו-5% גלוקוז ביחס של 1:1 לצריכה רצונית.
- הכינו את המכשירים המיקרוכירורגיים האוטוקלאביים (השרייה לפני הניתוח באלכוהול למשך שעה), מיקרוסקופ, שולחן ניתוח חולדות, 8-0 תפר מולקולרי גבוה שאינו נספג, תפר 4-0 שאינו נספג, גזה סטרילית, צמר גפן סטרילי וכו '.
3. הקמת דגם כיס החולדה
- הזרקה תוך-צפקית של תמיסת נתרן פנטוברביטלית 1% במינון של 6 מ"ל/ק"ג וחתך בהרדמה מקומית עם 0.5% רופיוואקאין להרדמת החולדה. שמור על החולדה בטמפרטורה נוחה במהלך ההרדמה עם מנורה חשמלית.
- בצע כריתה כוללת של המעי הגס לפי השלבים הבאים:
- אבטחו את החולדה בשכיבה גבית על ספסל אנטומי בעקבות פרוטוקול הרדמה משביע רצון. יש לוודא את עומק ההרדמה באמצעות צביטת בוהן. השתמשו בקוצצי גילוח כדי לסלק לכלוך שיער, ומרחו פעמיים תמיסת יודופור לעיקור שדה כירורגי.
- בצעו חתך בקו האמצע, באורך של כ-6 ס"מ, כדי לנתח דרך העור, הפאשיה הלבנה והצפק, ולספק כניסה לחלל הבטן. השתמש retractor כדי לחשוף את משטח הצפק ולכסות אותו עם גזה סטרילית ספוגת מלוחים bacteriostatic.
- לבודד את זרימת כלי הדם של jejunum הטרמינל, ligate מקורו באמצעות 8-0 חוט התפר, ולאחר מכן לנתק אותו. הגדר את הגדם הצקאלי, הממוקם 1-2 ס"מ מהשסתום האילאוצקלי, במנוחה, ולאחר מכן נתק אותו.
- להתחיל כריתה של המעי הגס הימני, לקשור את ההמיקולון הימני ואת וריד המעי האמצעי באופן שמרני.
- הפרדה נוספת של העורק המזנטרי התחתון ובידוד העורק הרקטלי התחתון. המשיכו בבידוד במורד פי הטבעת עד למרווח השווה לשני סנטימטרים מפי הטבעת. יש לכרות באלכסון את פי הטבעת הדיסטלי בסביבות 45 מעלות כדי למנוע היצרות לאחר הניתוח.
- בצע בניית פאוץ' J.
- השתמש אזמל microtome כדי להפריד את החלק הרוחבי של ileum מסוף המעי mesentery, אשר צריך למדוד על 6-7 ס"מ.
- קפלו את האילאום הטרמינלי בצורה בצורת J כדי ליצור פאוץ' לאילאום. ביצוע אנסטומוזה של הקיר האחורי באמצעות תפר משתלב. הגדילו את הדופן הקדמית באמצעות תפר קונל שונה ושמרו על מעי מתאים שיתאים לגודל החתך של גדם פי הטבעת הדיסטלי.
- חזקו את השקית בצורת J עם 8-0 תפירה במידת הצורך. אורך שקית J צריך להיות בטווח של 2.5 ס"מ עד 3.5 ס"מ.
- לבצע anstomosis אנאלי כיס ileal, IPAA.
- לאשר את היעדר פיתול במזנטריה ולתפור את הדפנות הצדדיות של פתח השקית ואת הדופן הצידית של גדם פי הטבעת במרווחים עם 8-0 חוט תפירה למתיחה.
- בסופו של דבר, יש למרוח תפר נעילה רציף בשכבה מלאה הן על הדופן הקדמית והן על הדופן האחורית.
- ודא את היעדר הדימום הפעיל ונקה פיזיולוגית את חלל הבטן במי מלח רגילים. סוגרים ברצף את שרירי הבטן והעור עם 4-0 תפרים.
- בצע ניהול לאחר הניתוח.
- מתן קטופרופן כשיכוך כאבים לאחר הניתוח (40 מ"ג / ק"ג, תת עורית) לכל החולדות לאחר סגירת הבטן. ודאו שמחממים את החולדה באמצעות מנורה חשמלית עד לשיקום.
- להגביל את בעל החיים מצריכת מזון לתקופה מינימלית של 72 שעות לאחר הניתוח כדי להפחית את הסיכון של חסימת מעיים. לאפשר גישה לתזונה של 5% גלוקוז אד ליביטום, כדי לחדש במהירות אנרגיה ונוזלי גוף, ולהתאים את תדירות ההאכלה בהתאם לדפוסי עשיית צרכים.
- שבוע לאחר הניתוח יש להתחיל בתזונה מוגבלת ולהגדיל בהדרגה את הכמות הנצרכת. לאחר מכן, ספקו לחולדות מזון קבוע למכרסמים לצריכה חופשית, תוך שמירה על רישום יומי של צריכת התזונה שלהן, צריכת המים ומשקל הגוף.
4. הקמת מודל פאוצ'יטיס איליאלי חולדה עם DSS
- בצע את קיבוץ הניסויים.
- הקצו באופן אקראי 12 חולדות שעברו כריתה מלאה של המעי הגס וניתוח IPAA לקבוצת IPAA (קבוצה A, n = 6) ולקבוצת הפוצ'יטיס (קבוצה B, n = 6).
- הכן תמיסת DSS 4% על-ידי הוספת 4 גרם DSS ל-100 מ"ל מים טהורים, טריים המוכנים מדי יום.
- לנהל את קבוצת IPAA ואת קבוצת pouchitis עם מים טהורים או 4% DSS ביום שלאחר הניתוח 31 עד יום 35, בהתאמה. אפשרו לחולדות לשתות ולאכול מזון חולדות בחופשיות במהלך ארבעת הימים הרצופים של מתן התרופה.
- בצעו את דגימת השקית.
- בבוקר היום ה-35, לאחר הניתוח, מרדימים את החולדות בזריקה תוך-צפקית של 1% תמיסת נתרן פנטוברביטל, תוך מתן מינון של 6 מ"ל/ק"ג (בהתאם לפרוטוקולים שאושרו על ידי מוסדות).
- נתקו את השקית בניצב מהסטומה של השקית לצומת של שקיות הקלט והפלט בכל קבוצה. השג את דגימת השקית.
- פתחו את השקית לאורך קו התפרים של הדופן הקדמית ושטפו את תעלת המעי במי מלח.
- מניחים שבר של רקמת שקיק בצינור מיקרוצנטריפוגה ומיד מקררים אותו ב -80 ° C. השתמש בחלק זה לזיהוי ELISA של אינדיקטורים דלקתיים. תקן את החלק הנותר של השקית עם 10% פורמלדהיד לניקוד היסטופתולוגי וצביעה אימונוהיסטוכימית.
- לבסוף, הרדימו את החולדה על ידי תסחיף אוויר בהרדמה עמוקה (בהתאם לפרוטוקולים שאושרו במוסד).
5. ניתוח היסטולוגי
- לאחר רכישת רקמת כיס מהחולדה, לטבול אותו 4% paraformaldehyde במשך 24 שעות. לאחר מכן, המשך עם התייבשות ופרוטוקולי הטבעה. חתך את הרקמה המעובדת לבדיקה היסטולוגית16.
- החל המטוקסילין ו eosin צביעה כדי לזהות הבדלים היסטופתולוגיים בין קבוצות. בחנו את הדגימות במיקרוסקופ וצלמו תמונות לתיעוד.
6. בדיקה אימונוהיסטוכימית
- יש להתחמק ולייבש את חלקי הרקמה בזהירות. לאחר מכן, בצע שליפת אנטיגן על ידי קירור החלקים בתמיסת נתרן ציטראט וחסימתם בסרום חוסם למשך 20 דקות.
- לאחר מכן, לחשוף את הפרוסות נוגדן אנטי occludin העיקרי לדגור אותם במשך הלילה ב 4 ° C. לאחר מכן, טפל בהם עם נוגדנים משניים במשך 30 דקות לפני hematoxylin counterstaining16.
- לאחר שהפרוסות התייבשו, התבוננו וצלמו אותן תחת מיקרוסקופ אור.
7. מבחן ELISA
- 7.1 טחון והומוגניזציה של מקטעי הרקמה בחיץ ליזיס באמצעות סוניקציה כדי להבטיח הומוגניזציה יסודית. נצלו את הסופרנאטנט שנוצר לצורך זיהוי.
- הקצו בארות עבור ריקים, דגימות ושכפולים לכל קבוצה. קבע את ריכוז החלבון על ידי קריאת הספיגה ב 450 ננומטר (ערך OD) וביצוע ניתוח רגרסיה ליניארית16.
תוצאות
הערכת מצב כללית של חולדות מודל כיס איליאלי לאחר ההקמה
לאחר שהמפעיל עבר את עקומת הלמידה הכירורגית IPAA, החולדות סבלו את הניתוח היטב, עם משך ניתוח של 192.94 דקות ± 27.15 דקות, ופחות סיבוכים לאחר הניתוח התרחשו. במהלך התקופה המוקדמת שלאחר הניתוח, חולדות חוו ירידה בצריכה התזונתית, אך התיאבון שלהן לפני הניתוח חזר תוך 10 ימים עד 14 יום לאחר הניתוח. הפעילות המוקדמת לאחר הניתוח פחתה מעט, ולא היו הפרשות ברורות מהעיניים ומהאף. הירידה במשקל לפני ואחרי הניתוח הייתה 21.17 גרם ± 1.59 גרם. המשקל הראשוני לאחר הניתוח הראה מגמת ירידה, עם ירידה מקסימלית של 69.58 גרם ± 33.19 גרם. הצמיחה היציבה החלה ביום 8.25 ±-2.53 יום לאחר הניתוח, וביוםה-31 לאחר הניתוח, המשקל עלה על 9.35% ±-4.7% מהמשקל ביום שלאחר הניתוח. חולדות הצליחו לעשות את צרכיהן תוך 24 שעות לאחר הניתוח, עם צואה רופפת אך ללא צואה מדממת. היווצרות הצואה הרכה התרחשה ביום ה- 9 עד ה- 12 לאחר הניתוח.
עלייה מפצה בכיס איליאלי
ביוםה-35 לאחר הניתוח נפתח חלל הבטן של החולדה בהרדמה, והתגלה הידבקות קשה בין כיס החולדה לחלל האגן. לאחר הפרדה זהירה של ההיצמדות בין השקית לרקמות הסובבות אותה, נצפתה הגדלה מפצה של השקית האיליאלית, עיבוי דופן המעי והתרחבות קלה של המעי הדק הדיסטלי (איור 1). אורכו של הכיס היה 2.89 ס"מ ±-0.28 ס"מ בזמן הניתוח, ואילו ביוםה-35 לאחר הניתוח נמדדו 3.86 ס"מ ±-0.87 ס"מ, מה שמראה הבדל סטטיסטי מובהק של P =0.000). גם שטח הרירית (ס"מ2) של הכיס האילאלי הוגדל משמעותית בהשוואה למדידה הניתוחית (6.46 ± 0.85 לעומת 17.02 ± 4.61, P = 0.000). לא נמצא הבדל משמעותי בין קבוצת IPAA לבין קבוצת הפאוכיטיס האיליאלית (P > 0.05).
הערכת מצב כללית וציון צואה של חולדות עם פאוצ'יטיס איליאלי
ביוםה-31 לאחר הניתוח, DSS ניתן לקבוצת ה-ileal pouchitis. בתחילת הנטילה, הן קבוצת IPAA והן קבוצת הפאוכיטיס האיליאלית היו בעלות משקל גוף שווה (352.00 גרם ± 30.03 גרם לעומת 352.00 גרם ± 25.92 גרם, P = 1) והיו בדרך כלל במצב טוב. עם זאת, כמות המזון והמים שנצרכה בקבוצת הפאוכיטיס האיליאלית פחתה, וכתוצאה מכך עייפות נפשית, שיער לא מבריק, הפרשה בעיניים ובאף, ירידה בניידות, ולא נצפו שינויים משמעותיים בקבוצת IPAA. ביוםה-35 לאחר הניתוח, המשקל של קבוצת הפאוכיטיס האיליאלית היה נמוך משמעותית מזה של קבוצת IPAA (322.83 גרם ± 29.24 גרם לעומת 364.83 גרם ± 30.13 גרם, P = 0.028) (איור 2).
קבוצת הפאוכיטיס האיליאלית חוותה שלשול משמעותי ביום הראשון לאחר מתן DSS, וביום השני לאחר מתן DSS היו להם ריר, מוגלה וצואה דמית (איור 3). ביוםה-35 לאחר הניתוח, ציוני הצואה11 של קבוצת IPAA וקבוצת הפאוכיטיס האיליאלית היו (4.33 ± 0.82 לעומת 2.17 ± 0.75, P = 0.001), בהתאמה. לחולדות מקבוצת IPAA היה פי טבעת נקי ונקי מזיהום, בעוד שלחולדות האיליאל פוצ'יטיס הייתה נפיחות בפי הטבעת מלווה בליחה, מוגלה וחיבור צואה דמי.
שינויים היסטופתולוגיים של כיס איליאלי
תצפית מקרוסקופית של דגימות כיס איליאלי
בקבוצת IPAA התעבה דופן המעי של הכיס האיליאלי, ולא נצפתה שחיקה, כיב או נקודת דימום. בקבוצת הפאוכיטיס האיליאלית כלי הדם במזנטריה של שקית האחסון מתעבים, ורירית הכיס האיליאלי מודלקת באופן נרחב או מקומי, עם שחיקה נראית לעין, כיבים ונקודות דימום, שחלקן מלוות בהתרחבות מעי דק דיסטלית משמעותית (איור 4).
תצפית מיקרוסקופית ברקמת כיס איליאלי
בקבוצת החולדות IPAA, קצה של וילי מעיים כלשהו ברקמת השקית הפך קהה, מלווה בכמות קטנה של חדירת נויטרופילים, ומדי פעם, כמות קטנה של הפרשה נצפתה על פני הרירית.
לעומת זאת, סידור וילי המעי ברקמת הכיס האיליאלי של חולדות בקבוצת הפאוכיטיס האיליאלית היה מאוד לא מסודר. חלק מוילי המעי היו חסרים, ושחיקה נרחבת וכיבים טלאים מרובים נראו מבלי לערב את שכבת השריר. זה היה מלווה במספר רב של נויטרופילים וחדירת לימפוציטים, הפרשה מוגזמת, דלקת קריפטה גלויה. הציון הפתולוגי של רקמת הכיס האיליאלי בקבוצת הפאוכיטיס האיליאלית היה גבוה משמעותית מזה שבקבוצת IPAA, עם הבדל סטטיסטי מובהק שנצפה (8.50 ± 1.76 לעומת 1.33 ± 0.52, P = 0.000) (איור 5).
רמת ביטוי של מחסום המעי חלבון פונקציונלי occludin
אוקלודין, חלבון פונקציונלי חשוב של מחסום המעי, מתבטא בקרום התא של רקמת הכיס האיליאלי הן בקבוצות IPAA והן בקבוצות פאוצ'יטיס איליאליות של חולדות11. עם זאת, רמת הביטוי של חלבון אוקלודין בקבוצת הפאוכיטיס האיליאלית הייתה נמוכה משמעותית מזו שבקבוצת IPAA (0.25 ± 0.03 לעומת 0.15 ± 0.02, P = 0.000) (איור 6).
איתור גורמים דלקתיים בכיס איליאלי
רמות הביטוי של IL-6, IL-17, TNF-α ו-INF-γ ברקמת הכיס האיליאלי של חולדות בקבוצת הפאוכיטיס האיליאלית היו גבוהות משמעותית מאלה שבקבוצת IPAA (כפי שנקבע במבחן ELISA16). לעומת זאת, IL-10 הראה תוצאות הפוכות, עם הבדלים סטטיסטיים שנצפו (P = 0.000) (טבלה 1).
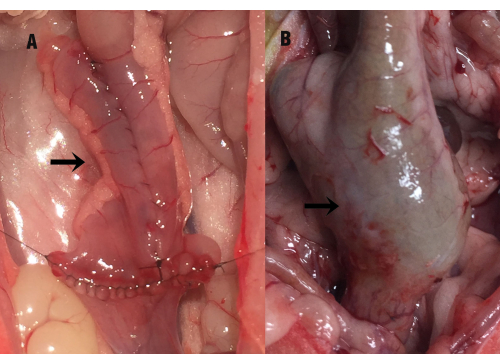
איור 1: מצב השקית האיליאלית. החץ מציין את הכיס האיליאלי (A) בזמן הניתוח ו-(B) את ההגדלה המפצה של הכיס ביוםה-35 לאחר הניתוח (במהלך איסוף הדגימות). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 2: מגמה של שינויים במשקל הגוף אצל חולדות לאחר ניתוח IPAA. סרגל השגיאה קשור לסטיית התקן, n = 6 בכל קבוצה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 3: תצלום של צואת חולדות. (A) קבוצת IPAA. (B) קבוצת Ileal pouchitis. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
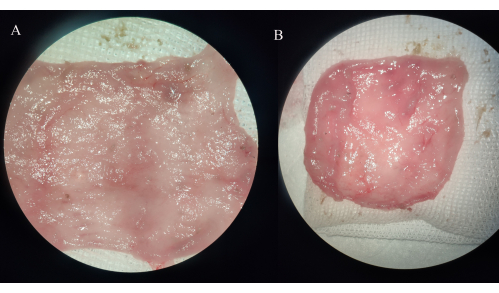
איור 4: תצפית מקרוסקופית של דגימות כיסי איליאלי. (A) קבוצת IPAA. (B) קבוצת Ileal pouchitis. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 5: שינויים פתולוגיים ברקמת כיס החולדה. (A) קבוצת IPAA. (B) קבוצת Ileal pouchitis. פסי קנה מידה: 60 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 6: זיהוי אימונוהיסטוכימי של ביטוי חלבון אוקלודין ברקמת כיס איליאלי של חולדה. (A) קבוצת IPAA. (B) קבוצת Ileal pouchitis. פסי קנה מידה: 60 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
| קבוצה | n | IL-6 | IL-10 | IL-17 | TNF-α | INF-γ |
| קבוצת IPAA | 6 | 2.60 ± 0.36 | 5.81 ± 0.66 | 17.48 ± 4.81 | 86.94 ± 24.06 | 4.08 ± 0.56 |
| קבוצת פוצ'יטיס | 6 | 6.94 ± 1.18 | 2.77 ± 0.60 | 34.82 ± 2.41 | 213.00 ± 26.11 | 9.67 ± 1.70 |
| P | 0 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 |
טבלה 1: רמת ביטוי של גורמים דלקתיים ברקמת כיס החולדה (pg/mL).
Discussion
קוליטיס כיבית (UC) היא דלקת מעיים כרונית המאופיינת בכאבים אפיגסטריים חוזרים, שלשולים וצואה דמית של ריר. זה משפיע בעיקר על פי הטבעת ועשוי לערב את המעי הגס המתקדם בדרגות שונות. ניתוח ממלא תפקיד מכריע בניהול UC 17,18,19. מאז פארקס et al.20 הציג colectomy מלא עם הליך anastomosis איליאלי פאוץ' אנאלי (IPAA) בשנת 1978 כדי להסיר רקמות שהשתנו ולשחזר את רצף המעי, ניתוח זה הפך לתקן הבינלאומי לטיפול כירורגי של UC. הפרעות דלקתיות בכיס הן הסיבוכים השכיחים ביותר לאחר ניתוח IPAA.
בשל האתגרים העומדים בפני ביצוע ניסויים קליניים על פוצ'יטיס, מודלים של בעלי חיים שימשו כניסויים משלימים לחקר תרופות ומנגנונים הקשורים לפוצ'יטיס. בשנת 1998 פיתחו ליכטמן ועמיתיו מודל חולדה הכולל הסרה מלאה של המעי הגס וחיבור מחדש של השקית לפי הטבעת. מודל זה הראה סימני דלקת, כגון חדירת תאים חד-גרעיניים, הפרשה לומינלית, כיב רירית ודלקת בסרוסל בתוך ארבעה שבועות לאחר הניתוח. רמת הדלקת נמצאה בקורלציה עם ספירת חיידקים מוגברת בכיס, וניתן היה להבחין ברגישות גנטית ברורה של המאכסן. בשנת 2002, Shebani et al.21 בנו בהצלחה מודל חולדה כירורגית IPAA באמצעות SDD, אשר גרם ביעילות pouchitis. מודל זה אישר את היעילות של שימוש בבעלי חיים לחקר הפתוגנזה של pouchitis וסיפק פלטפורמה ניסיונית חזקה למחקר בסיסי על pouchitis. הם גם זיהו דפוסים דומים של גידול חיידקים בשפע הן במאגרים אנושיים והן במאגרים של מכרסמים, ואימתו את יעילותו בחקירת חוסר איזון חיידקי במעיים ובזיהוי פתוגנים פוטנציאליים הקשורים לפוצ'יטיס.
עם ניסיון קודם בהזנת עכברים ומידול ניתוחי IPAA, דחיסת עקומת הלמידה לכעשרה נבדקים היא אפשרית. שלב קריטי בתהליך זה הוא הבנייה והאנסטומוזה של נרתיק J. בהתחשב בכך שמערכת העיכול של עכברים דקה יחסית, 8-0 התפרים שימשו לתפרים. תפרי נעילה רציפה ותפר קונל שימשו בנפרד לתפרי הקיר האחורי והקיר הקדמי של השקית. במהלך הכיס והאנסטומוזה של תעלת פי הטבעת, יצירת משטח משופע יכולה להפחית ביעילות את ההיצרות באתר האנסטומוטי על ידי לקיחת גדם פי הטבעת כדוגמה. בתחילה, אבטחת שני תפרים בכל צד של האתר האנסטומוטי, ולאחר מכן המשך עם תפרי נעילה רציפה כדי לתפור את הקירות האחוריים והקדמיים בנפרד מבטיח את שלמות האנסטומוזה ומקצר את זמן הניתוח.
ניהול לאחר הניתוח גם משחק תפקיד מרכזי מודלים מוצלחים. תקופת צום של 72 שעות לאחר הניתוח יכולה להפחית ביעילות את התרחשות חסימת המעיים. מצד שני, תזונה נוזלית מתונה מוקדמת יכולה להבטיח את הדרישות התזונתיות והנוזלים של העכברים. לאחר שליטה בעקומת הלמידה, מנתחים יכולים להשיג שיעור הצלחה יעיל ועקבי יותר בהקמת מודל.
מחקר זה התבסס על בסיס זה, ובאמצעות חקירה ראשונית ושכלול, ביסס בהצלחה מודל של שקיק עכברוש באמצעות מיקרו-כירורגיה. מודל זה שימש לאחר מכן כדי לבחון את המצב של דלקת פאוץ' ואינדיקטורים מחסום המעי. התוצאות הראו כי חולדות הציגו תסמינים בולטים כגון צואה דמית, שלשולים וירידה במשקל לאחר שנחשפו ל- DSS. זה הוביל לבצקת ושחיקה של רירית השקית, דלקת כפי שצוין על ידי ניקוד היסטופתולוגי, ורמות מוגברות של גורמים מעודדי דלקת, כולל אינטרלוקין-6 (IL-6), IL-17, גורם נמק גידולי-אלפא (TNF-α) ואינטרפרון-גמא (INF-γ), יחד עם רמות מופחתות של הגורם האנטי דלקתי אינטרלוקין-10 (IL-10). יתר על כן, ביטוי החלבון של אינדיקטור מחסום המעי אוקלודין ירד. ממצאים אלה עולים בקנה אחד עם מחקרים קודמים11 ומאשרים את ביסוססו המוצלח של מודל פאוצ'יטיס חולדה, המספק פלטפורמה מוצקה למחקר תרופות ומנגנונים עוקבים.
Disclosures
ללא.
Acknowledgements
ללא
Materials
| Name | Company | Catalog Number | Comments |
| Anhydrous ethanol | Tianjin Fengchuan Chemical Reagent Technology Co., Ltd | China | Hematoxin-eosin Staining |
| Dextran Sulfate Sodium | Yeasen | 60316ES76 | Used to induce pouch inflammation |
| Formaldehyde solution | Tianjin Zhiyuan Reagent Company | China | Hematoxin-eosin Staining |
| Gauze | Jiangxi Zhonggan Medical Equipment Company | China | Used for animal microsurgery |
| Hematoxylin | Beijing Zhongshan Jinqiao Company | China | Hematoxin-eosin Staining |
| Interferon γ Detection reagent kit | Cloud-clone | SEA049Ra | Detecting inflammatory factors |
| Interleukin-10 detection kit | Cloud-clone | SEA056Ra | Detecting inflammatory factors |
| Interleukin-17 detection kit | Cloud-clone | SEA063Ra | Detecting inflammatory factors |
| Interleukin-6 detection kit | Cloud-clone | SEA079Ra | Detecting inflammatory factors |
| Iodophor | Tangpai Medical Equipment Co., Ltd | China | Used for animal microsurgery |
| Microscopic manipulation instruments | Aesculap | Germany | Used for animal microsurgery |
| Occludin | abcam | ab216327 | Immunohistochemical testing |
| Sewing needle | Yangzhou Fuda Medical Equipment Co., Ltd | China | Used for animal microsurgery |
| tumor necrosis factor α Detection reagent kit | Cloud-clone | SEA133Ra | Detecting inflammatory factors |
| Two person binocular surgical microscope | OPTON | Germany | Used for animal microsurgery |
| Xylene | Tianjin Yingda Rare and Precious Reagent Factory | China | Hematoxin-eosin Staining |
References
- Yang, M. L., Brar, M. S., Kennedy, E. D., De Buck Van Overstraeten, A. Laparoscopic versus transanal IPAA for ulcerative colitis: A patient-centered treatment trade-off study. Dis Colon Rectum. 67 (1), 107-113 (2024).
- Aktas, M. K., et al. Current status and surgical technique for restorative proctocolectomy with ileal pouch-anal anastomosis. Balkan Med J. 40 (4), 236-243 (2023).
- Zhao, L., et al. Microbiota DNA translocation into mesentery lymph nodes is associated with early development of pouchitis after ipaa for ulcerative colitis. Diseases of the Colon & Rectum. 66 (11), e1107-e1118 (2022).
- Ng, S. C., et al. Worldwide incidence and prevalence of inflammatory bowel disease in the 21st century: A systematic review of population-based studies. Lancet. 390 (10114), 2769-2778 (2017).
- Pardi, D. S., D'haens, G., Shen, B., Campbell, S., Gionchetti, P. Clinical guidelines for the management of pouchitis. Inflamm Bowel Dis. 15 (9), 1424-1431 (2009).
- Shen, B., et al. Treatment of pouchitis, Crohn's disease, cuffitis, and other inflammatory disorders of the pouch: Consensus guidelines from the international ileal pouch consortium. Lancet Gastroenterol Hepatol. 7 (1), 69-95 (2022).
- Dalal, R. L., Shen, B., Schwartz, D. A. Management of pouchitis and other common complications of the pouch. Inflamm Bowel Dis. 24 (5), 989-996 (2018).
- Li, K. Y., et al. A new rat model of pouchitis after proctocolectomy and ileal pouch-anal anastomosis using 2,4,6-trinitrobenzene sulfonic acid. J Gastrointest Surg. 25 (6), 1524-1533 (2021).
- Drzymala-Czyz, S., et al. Discrepancy between clinical and histological effects of dha supplementation in a rat model of pouchitis. Folia Histochem Cytobiol. 50 (1), 125-129 (2012).
- Santiago, P., Barnes, E. L., Raffals, L. E. Classification and management of disorders of the J pouch. Am J Gastroenterol. 118 (11), 1931-1939 (2023).
- Lichtman, S. N., Wang, J., Hummel, B., Lacey, S., Sartor, R. B. A rat model of ileal pouch-rectal anastomosis. Inflamm Bowel Dis. 4 (3), 187-195 (1998).
- Guarner, F. Inulin and oligofructose: Impact on intestinal diseases and disorders. Br J Nutr. 93, Suppl 1 S61-S65 (2005).
- Kim, C. J., et al. L-tryptophan exhibits therapeutic function in a porcine model of dextran sodium sulfate (DSS)-induced colitis. J Nutr Biochem. 21 (6), 468-475 (2010).
- Valatas, V., Bamias, G., Kolios, G. Experimental colitis models: Insights into the pathogenesis of inflammatory bowel disease and translational issues. Eur J Pharmacol. 759, 253-264 (2015).
- Letson, H. L., Morris, J., Biros, E., Dobson, G. P. Conventional and specific-pathogen free rats respond differently to anesthesia and surgical trauma. Sci Rep. 9 (1), 9399(2019).
- Gu, Y., et al. Saccharomyces boulardii, a yeast probiotic, inhibits gut motility through upregulating intestinal serotonin transporter and modulating gut microbiota. Pharmacol Res. 181, 106291(2022).
- Akiyama, S., et al. Endoscopic phenotype of the j pouch in patients with inflammatory bowel disease: A new classification for pouch outcomes. Clin Gastroenterol Hepatol. 20 (2), 293-302 (2022).
- Hata, K., et al. Pouchitis after ileal pouch-anal anastomosis in ulcerative colitis: Diagnosis, management, risk factors, and incidence. Dig Endosc. 29 (1), 26-34 (2017).
- Gallo, G., Kotze, P. G., Spinelli, A. Surgery in ulcerative colitis: When? How. Best Pract Res Clin Gastroenterol. 32-33, 71-78 (2018).
- Parks, A. Proctocolectomy without ileostomy for ulcerative colitis. BMJ. 2, 85-88 (1978).
- Shebani, K. O., et al. Pouchitis in a rat model of ileal J pouch-anal anastomosis. Inflamm Bowel Dis. 8 (1), 23-34 (2002).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved