Method Article
Ein Rattenmodell der Pouchitis nach Proktokolektomie und ilealer Pouch-Analanastomose unter Verwendung von Dextransulfat-Natrium
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt die Methode zur Etablierung eines Rattenmodells für Pouchitis. Das Modell des Ileumbeutels wurde durch die Durchführung einer Ileumbeutel-Analanastomose (IPAA) mit mikrochirurgischen Techniken hergestellt. Nach der Operation wurde die Ratte 4 Tage lang mit 4% Dextransulfat-Natrium (DSS) behandelt.
Zusammenfassung
Colitis ulcerosa (UC) ist eine chronische immunvermittelte Erkrankung, die den gesamten Dickdarm und das Rektum mit einem schubförmigen und remittierenden Verlauf betrifft und eine lebenslange Morbidität verursacht. Wenn die medizinische Behandlung unwirksam ist, insbesondere bei massiven gastrointestinalen Blutungen, Perforationen, toxischem Megakolon oder Karzinogenese, wird eine Operation zur letzten Verteidigungslinie zur Heilung von UC. Die totale kolorektale Resektion und die ileale Pouch-Anal-Anastomose (IPAA) bieten die besten Chancen für eine langfristige Behandlung. Die Pouchitis ist die häufigste und lästigste postoperative Komplikation. In dieser Untersuchung wird die Mikrochirurgie eingesetzt, um ein Ileumbeutelmodell bei Versuchsratten mittels IPAA-Operation zu erzeugen. Anschließend wird ein anhaltendes Rattenmodell der Pouchitis etabliert, indem eine Entzündung des Ileumbeutels mit Dextransulfat-Natrium (DSS) induziert wird. Die erfolgreiche Etablierung der Rattenpouchitis wird durch die Analyse des postoperativen Allgemeinzustands, des Gewichts, der Nahrungs- und Wasseraufnahme, der Stuhldaten sowie der Pathologie des Pouch-Gewebes, der Immunhistochemie und der Analyse von Entzündungsfaktoren validiert. Dieses experimentelle Tiermodell der Pouchitis bietet eine Grundlage für die Untersuchung der Pathogenese und Behandlung der Erkrankung.
Einleitung
Pouchitis ist eine unspezifische Entzündung, die den Ileumbeutel betrifft und eine häufige Komplikation nach totaler Proktokolektomie und Ileumbeutel-Analanastomose (IPAA) bei Personen mit Colitis ulcerosa (UC) ist1,2,3. Diese Erkrankung hat eine relativ hohe Häufigkeit von bis zu 50% und kann verschiedene klinische Manifestationen verursachen, darunter Durchfall, Bauchschmerzen, fäkaler Blutverlust und Fieber. Die genaue Ursache der Pouchitis bleibt schwer fassbar, obwohl einige Forscher glauben, dass eine Verschiebung der Pouch-Flora eine Immunaktivierung und eine anschließende Entzündung auslösen kann 4,5,6,7.
Aufgrund der Herausforderungen, die mit der Durchführung klinischer Studien zu Pouchitis verbunden sind, können Tiermodelle als wertvolle Werkzeuge für die Untersuchung von Pouchitis-Medikamenten und -Mechanismen dienen. Es gibt wachsende Bedenken hinsichtlich der Bildung von Ileumbeuteln von Ratten, wobei Berichte auf eine mögliche Entzündung hinweisen8. Die Forschung auf diesem Gebiet ist jedoch aufgrund der Komplexität des Herstellungsprozesses, für den es keine klaren Richtlinien gibt, nach wie vor spärlich 9,10. Im Jahr 1998 war Lichtman der erste, der ein ileales Beutelmodell bei Lewis-Ratten und Sprague-Dawley-Ratten (SD) etablierte, indem er eine totale Kolektomie11 durchführte. Sie beobachteten eine Makrophageninfiltration, Schleimhautgeschwüre und eine Zunahme der anaeroben Bakterienflora im Darm dieser Ratten, was eine solide Grundlage für weitere Forschungen über Ileumbeutelentzündungen bildete. Dieses experimentelle Modell der Ratten-Pouchitis ahmt die physikalischen Anzeichen und zugrunde liegenden Mechanismen, die bei der menschlichen Pouchitis beobachtet werden, genau nach.
Zu den häufig verwendeten präklinischen Modellen für Colitis ulcerosa gehören die DSS- und TNBS-Modelle. Die induzierende Chemikalie 2,4,6-Trinitrobenzolsulfonsäure (TNBS) simuliert typischerweise Morbus Crohn12. Das DSS-Modell, das für seine Wirksamkeit, sein Sicherheitsprofil und seine Erschwinglichkeit geschätzt wird, wird aufgrund der beobachteten offensichtlichen Symptome häufig als zuverlässiges Werkzeug für die UC-Induktion verwendet. Aufgrund der Besiedlung des Pouchgewebes konnten wir erfolgreich ein Pouchitis-Modell mit DSS13,14 induzieren.
In der vorliegenden Studie wurde mittels Mikrochirurgie erfolgreich ein Ileumbeutelmodell bei Versuchsratten mittels IPAA-Operation erstellt. Anschließend wurde ein anhaltendes Ratten-Pouchitis-Modell etabliert, indem eine Entzündung des Ileumbeutels mit DSS induziert wurde. Genauigkeit während der Operation ist entscheidend für eine erfolgreiche Modellbildung, und auch die postoperative Versorgung ist von entscheidender Bedeutung. Dieses Modell kann verwendet werden, um die Pathogenese der Pouchitis zu untersuchen, potenzielle Therapeutika zu bewerten und unser Verständnis dieser komplexen Erkrankung zu verbessern. Die Studie rationalisiert das Herstellungsverfahren für Ileumbeutel, verkürzt die Operationsdauer und steigert die Effizienz, wodurch eine solide Grundlage für die Grundlagenforschung zu postoperativen Beutelerkrankungen geschaffen wird.
Protokoll
Alle Tierversuche wurden in Übereinstimmung mit den Richtlinien der Ethikkommissionen des Allgemeinen Krankenhauses der Medizinischen Universität Tianjin durchgeführt. Für diese Studie wurden männliche Sprague-Dawley-Ratten im Alter zwischen 9 und 12 Wochen mit einem Gewicht von etwa 320-360 g verwendet. Die Einzelheiten zu den verwendeten Reagenzien und Geräten sind in der Materialtabelle aufgeführt.
1. Auswahl und Pflege der Tiere
- Wählen Sie ein gesundes Tier (Körpergewicht von ~220-240 g).
- Stellen Sie sicher, dass sie die Kriterien eines spezifischen Pathogen-freien (LSF)15-Gehalts erfüllen und mindestens 2 Wochen lang adaptiv in einer Umgebung mit ausreichender Belüftung (8 bis 12 Luftwechsel pro Stunde), einer angenehmen Temperatur (20-25 °C), einer angemessenen Luftfeuchtigkeit (40 %-70 %), minimalem Lärm (unter 70 Dezibel) und einem natürlichen Lichtzyklus (12 Stunden Licht und 12 Stunden Dunkelheit) aufgezogen werden.
- Halten Sie sie während dieser Zeit in sauberen Standardkäfigen mit einer Dichte von drei bis fünf pro Käfig und wechseln Sie die Einstreu zweimal wöchentlich. Bieten Sie ad libitum Zugang zu Futter und Wasser sowie Standard-Erhaltungsfutter für Laborratten.
2. Präoperative Vorbereitung
- Wählen Sie eine gesunde Ratte mit einem ungefähren Körpergewicht von 320 g bis 360 g. Fasten Sie die Ratte 8-12 Stunden vor der Operation und verschaffen Sie ihnen Zugang zu einer Lösung aus physiologischer Kochsalzlösung und 5% Glukose im Verhältnis 1:1 für den freiwilligen Verzehr.
- Bereiten Sie die autoklavierten mikrochirurgischen Instrumente vor (präoperatives Einweichen in Alkohol für 1 h), ein Mikroskop, einen Präpariertisch für Ratten, 8-0 Nicht resorbierbares hochmolekulares Nahtmaterial, nicht resorbierbares 4-0-Nahtmaterial, sterile Gaze, sterile Wattestäbchen usw.
3. Etablierung des Modells der Ratten-Ileumbeutel
- Intraperitoneal injizieren Sie eine 1%ige Pentobarbital-Natriumlösung in einer Dosis von 6 ml/kg und inzisionale Infiltration einer Lokalanästhesie mit 0,5% Ropivacain, um die Ratte zu betäuben. Halten Sie die Ratte während der Narkose mit einer elektrischen Lampe auf einer angenehmen Temperatur.
- Führen Sie eine vollständige kolorektale Resektion mit den folgenden Schritten durch:
- Befestigen Sie die Ratte in dorsaler Liege auf einer anatomischen Bank nach einem zufriedenstellenden Anästhesieprotokoll. Bestätigen Sie die Tiefe der Anästhesie durch ein Zehenkneifen. Verwenden Sie einen Rasierschneider, um Haarreste zu entfernen, und tragen Sie die Jodophorlösung zweimal für die Sterilisation vor Ort auf.
- Machen Sie einen etwa 6 cm langen Schnitt in der Mittellinie, um die Haut, die Faszie der weißen Linie und das Bauchfell zu durchtrennen und den Zugang in die Bauchhöhle zu ermöglichen. Verwenden Sie einen Retraktor, um die Peritonealoberfläche freizulegen, und bedecken Sie sie mit bakteriostatischer, mit Kochsalzlösung getränkter steriler Gaze.
- Isolieren Sie den Gefäßfluss des terminalen Jejunums, ligieren Sie seinen Ursprung mit einem 8-0 Nähen Sie den Faden und durchtrennen Sie ihn anschließend. Setzen Sie den Blinddarmstumpf, der sich 1-2 cm von der Ileozökalklappe entfernt befindet, in Ruhe und durchtrennen Sie ihn.
- Beginnen Sie mit der Resektion des rechten Hemikolons, wobei das rechte Hemikolon und die mittlere Kolikvene konservativ ligiert werden.
- Segregieren Sie die Arteria mesenterica inferior weiter und isolieren Sie die Arteria rectalis inferior. Setzen Sie die Isolation entlang des Rektums bis zu einem Abstand von zwei Zentimetern vom Analrand fort. Das distale Rektum wird in einem Winkel von etwa 45 Grad schräg reseziert, um eine postoperative Stenose zu vermeiden.
- Führen Sie die J-Beutelkonstruktion durch.
- Trennen Sie mit einem Mikrotomskalpell den Querschnitt des terminalen Ileums vom Mesenterialdarm, der etwa 6-7 cm messen sollte.
- Falten Sie das terminale Ileum in einer J-förmigen Form, um einen Beutel für das Ileum zu erstellen. Führen Sie die Anastomose der hinteren Wand über einen ineinandergreifenden Stich durch. Augmentieren Sie die Vorderwand mit einem modifizierten Connell-Stich und behalten Sie einen geeigneten Darm bei, der der Querschnittsgröße des distalen Rektumstumpfes entspricht.
- Verstärken Sie den J-förmigen Beutel mit 8-0 Bei Bedarf nähen. Die Länge des J-Beutels sollte im Bereich von 2,5 cm bis 3,5 cm liegen.
- Führen Sie eine ileale Pouch-Analanastomose (IPAA) durch.
- Bestätigen Sie, dass das Mesenterium keine Torsion aufweist, und nähen Sie die Seitenwände der Beutelöffnung und die Seitenwand des Rektumstumpfes in Abständen mit einem 8-0 Nahtfaden für Traktion.
- Wenden Sie abschließend eine vollschichtige durchgehende Naht sowohl an der Vorder- als auch an der Hinterwand an.
- Vergewissern Sie sich, dass keine aktiven Blutungen vorhanden sind, und reinigen Sie die Bauchhöhle physiologisch mit normaler Kochsalzlösung. Verschließen Sie nacheinander die Bauchmuskulatur, die Faszie und die Haut mit 4-0-Nähten.
- Führen Sie ein postoperatives Management durch.
- Verabreichen Sie Ketoprofen als postoperative Analgesie (40 mg/kg, subkutan) an alle Ratten nach dem Verschluss des Bauches. Stellen Sie sicher, dass die Ratte mit einer elektrischen Lampe erwärmt wird, bis die Wiederherstellung erfolgt.
- Beschränken Sie das Tier für einen Zeitraum von mindestens 72 Stunden postoperativ auf den Verzehr von Lebensmitteln, um das Risiko eines Darmverschlusses zu verringern. Ermöglichen Sie den Zugang zu einer Ernährung mit 5% Glukose ad libitum, um Energie und Körperflüssigkeiten schnell wieder aufzufüllen, und passen Sie die Fütterungshäufigkeit an die Defäkationsmuster an.
- Beginnen Sie eine Woche nach der Operation mit einer begrenzten Ernährung und erhöhen Sie allmählich die verzehrte Menge. Geben Sie den Ratten dann regelmäßig Nagetierfutter, damit sie frei konsumieren können, während Sie täglich Aufzeichnungen über ihre Nahrungsaufnahme, Wasseraufnahme und ihr Körpergewicht führen.
4. Etablierung eines Modells der ilealen Pouchitis der Ratte mit DSS
- Führen Sie die experimentelle Gruppierung durch.
- 12 Ratten, die sich einer totalen kolorektalen Resektion und IPAA-Operation unterzogen haben, werden nach dem Zufallsprinzip in die IPAA-Gruppe (Gruppe A, n = 6) und die Pouchitis-Gruppe (Gruppe B, n = 6) eingeteilt.
- Bereiten Sie eine 4%ige DSS-Lösung vor, indem Sie 4 g DSS zu 100 ml reinem Wasser hinzufügen, das täglich frisch zubereitet wird.
- Verabreichen Sie die IPAA-Gruppe und die Pouchitis-Gruppe mit reinem Wasser oder 4 % DSS am postoperativen Tag 31 bzw. Tag 35. Lassen Sie Ratten während der vier aufeinanderfolgenden Tage der Verabreichung frei trinken und fressen.
- Führen Sie die Beutelprobenahme durch.
- Am Morgen des 35. Tages, nach der Operation, betäuben Sie die Ratten mit einer intraperitonealen Injektion von 1% iger Pentobarbital-Natriumlösung und verabreichen Sie eine Dosis von 6 ml/kg (gemäß den institutionell anerkannten Protokollen).
- Trennen Sie den Beutel senkrecht vom Stoma des Beutels bis zur Verbindung der Eingabe- und Ausgabebeutel in jeder Gruppe. Besorgen Sie sich das Beutelmuster.
- Öffnen Sie den Beutel entlang der Nahtlinie der Vorderwand und waschen Sie den Darmkanal mit Kochsalzlösung.
- Legen Sie ein Fragment des Beutelgewebes in ein Mikrozentrifugenröhrchen und kühlen Sie es umgehend bei -80 °C. Verwenden Sie diesen Teil für den ELISA-Nachweis von Entzündungsindikatoren. Fixieren Sie den verbleibenden Beutelabschnitt mit 10 % Formaldehyd für histopathologische Ritzungen und immunhistochemische Färbungen.
- Zum Schluss wird die Ratte durch eine Luftembolie unter tiefer Betäubung eingeschläfert (nach institutionell anerkannten Protokollen).
5. Histologische Analyse
- Nachdem Sie der Ratte Beutelgewebe entnommen haben, tauchen Sie es 24 Stunden lang in 4% Paraformaldehyd. Fahren Sie anschließend mit den Dehydratisierungs- und Einbettungsprotokollen fort. Schnitt des aufbereiteten Gewebes für die histologische Untersuchung16.
- Wenden Sie Hämatoxylin- und Eosin-Färbung an, um histopathologische Unterschiede zwischen den Gruppen zu identifizieren. Untersuchen Sie die Proben mikroskopisch und machen Sie Fotos für die Dokumentation.
6. Immunhistochemischer Assay
- Entwachse und dehydriere die Gewebeabschnitte vorsichtig. Führen Sie dann eine Antigen-Entnahme durch, indem Sie die Abschnitte in Natriumcitratlösung abkühlen und sie 20 Minuten lang mit blockierendem Serum blockieren.
- Anschließend werden die Scheiben dem primären Anti-Occludin-Antikörper ausgesetzt und über Nacht bei 4 °C inkubiert. Behandeln Sie sie anschließend 30 Minuten lang mit Sekundärantikörpern, bevor Sie eine Hämatoxylin-Gegenfärbungvornehmen 16.
- Sobald die Scheiben getrocknet sind, beobachten und fotografieren Sie sie unter einem Lichtmikroskop.
7. ELISA-Prüfung
- 7.1 Zerkleinern und homogenisieren Sie die Gewebefragmente im Lysepuffer mittels Ultraschall, um eine gründliche Homogenisierung zu gewährleisten. Verwenden Sie den resultierenden Überstand für die Detektion.
- Ordnen Sie Wells für Leerproben, Proben und Replikate pro Gruppe zu. Bestimmen Sie die Proteinkonzentration, indem Sie die Extinktion bei 450 nm (OD-Wert) ablesen und eine lineare Regressionsanalysedurchführen 16.
Ergebnisse
Allgemeine Zustandsbewertung von Ratten mit Ileumbeutelmodellen nach der Etablierung
Nachdem der Bediener die chirurgische Lernkurve der IPAA durchlaufen hatte, vertrugen die Ratten die Operation gut, mit einer Operationsdauer von 192,94 min ± 27,15 min, und es traten weniger postoperative Komplikationen auf. Während der frühen postoperativen Phase kam es bei Ratten zu einer Abnahme der Nahrungsaufnahme, aber ihr präoperativer Appetit wurde innerhalb von 10 Tagen bis 14 Tagen nach der Operation wiederhergestellt. Die frühe postoperative Aktivität nahm leicht ab, und es gab keine offensichtlichen Sekrete aus Augen und Nase. Der Gewichtsverlust vor und nach der Operation betrug 21,17 g ± 1,59 g. Das anfängliche postoperative Gewicht zeigte einen rückläufigen Trend, mit einer maximalen Reduktion von 69,58 g ± 33,19 g. Das stabile Wachstum begann am 8.25. Tag ± 2.53 Tag nach der Operation, und am 31. Tag nach der Operation überstieg das Gewicht 9,35 % ± 4,7 % des Gewichts am Tag nach der Operation. Die Ratten waren in der Lage, innerhalb von 24 Stunden nach der Operation ihren Stuhl zu verrichten, mit losem Stuhl, aber ohne blutigen Stuhl. Die Bildung von weichem Stuhl trat am 9. bis 12. Tag nach der Operation auf.
Kompensatorische Zunahme des Ileumbeutels
Am 35. Tag nach der Operation wurde die Bauchhöhle der Ratte unter Narkose geöffnet, wobei eine starke Adhäsion zwischen dem Ileumbeutel und der Beckenhöhle sichtbar wurde. Nach sorgfältiger Trennung der Adhäsion zwischen dem Beutel und dem umgebenden Gewebe wurde eine kompensatorische Vergrößerung des Ileumbeutels, eine Verdickung der Darmwand und eine leichte Erweiterung des distalen Dünndarms beobachtet (Abbildung 1). Die Länge des Ileumbeutels betrug zum Zeitpunkt der Operation 2,89 cm ± 0,28 cm, während er am 35. Tag nach der Operation 3,86 cm ± 0,87 cm betrug, was einen signifikanten statistischen Unterschied von P = 0,000 zeigt. Auch die Schleimhautfläche (cm 2) des Ileumbeutels war im Vergleich zur chirurgischen Messung signifikant vergrößert (6,46 ± 0,85 vs. 17,02 ± 4,61, P = 0,000). Es gab keinen signifikanten Unterschied zwischen der IPAA-Gruppe und der Gruppe mit ilealer Pouchitis (P > 0,05).
Bewertung des Allgemeinzustands und Kot-Score von Ratten mit ilealer Pouchitis
Am 31. Tag nach der Operation wurde der Gruppe mit ilealer Pouchitis DSS verabreicht. Zu Beginn der Verabreichung hatten sowohl die IPAA-Gruppe als auch die Ileumpouchitis-Gruppe das gleiche Körpergewicht (352,00 g ± 30,03 g vs. 352,00 g ± 25,92 g, P = 1) und waren im Allgemeinen in gutem Zustand. Die Menge an Nahrung und Wasser, die in der Gruppe mit ilealer Pouchitis konsumiert wurde, nahm jedoch ab, was zu geistiger Müdigkeit, glanzlosem Haar, Sekret in Augen und Nase, verminderter Beweglichkeit und in der IPAA-Gruppe zu keinen signifikanten Veränderungen führte. Am 35. Tag nach der Operation war das Gewicht der Gruppe mit ilealer Pouchitis signifikant niedriger als das der IPAA-Gruppe (322,83 g ± 29,24 g vs. 364,83 g ± 30,13 g, P = 0,028) (Abbildung 2).
Die Gruppe mit ilealer Pouchitis erlebte am ersten Tag nach der DSS-Verabreichung erheblichen Durchfall, und am zweiten Tag nach der DSS-Verabreichung hatten sie Schleim, Eiter und blutigen Stuhl (Abbildung 3). Am 35. Tag nach der Operation betrugen die Stuhlwerte11 der IPAA-Gruppe und der Ileumpouchitis-Gruppe (4,33 ± 0,82 vs. 2,17 ± 0,75, P = 0,001). Die Ratten der IPAA-Gruppe hatten einen sauberen und schadstofffreien Anus, während die Ratten mit ilealer Pouchitis eine Schwellung des Anus aufwiesen, begleitet von Schleim, Eiter und blutigem Stuhlansatz.
Histopathologische Veränderungen des Ileumbeutels
Makroskopische Betrachtung von Exemplaren aus Ileumbeuteln
In der IPAA-Gruppe verdickte sich die Darmwand des Ileumbeutels, und es wurde keine Erosion, kein Geschwür oder Blutungspunkt beobachtet. In der Gruppe der ilealen Pouchitis werden die Blutgefäße im Mesenterium des Vorratsbeutels dicker, und die Schleimhaut des Ileumbeutels ist großflächig oder lokal entzündet, mit sichtbarer Erosion, Geschwüren und Blutungspunkten, von denen einige von einer signifikanten distalen Dünndarmerweiterung begleitet werden (Abbildung 4).
Mikroskopische Betrachtung des ilealen Beutelgewebes
In der IPAA-Gruppe von Ratten wurde die Spitze einiger Darmzotten im Pouchgewebe stumpf, begleitet von einer kleinen Menge neutrophiler Infiltration, und gelegentlich wurde eine geringe Menge Exsudation auf der Schleimhautoberfläche beobachtet.
Im Gegensatz dazu war die Anordnung der Darmzotten im ilealen Pouchgewebe von Ratten in der Gruppe der ilealen Pouchitis extrem gestört. Einige Darmzotten fehlten, und es waren ausgedehnte Erosionen und mehrere fleckige Geschwüre sichtbar, ohne dass die Muskelschicht beteiligt war. Dies ging einher mit einer großen Anzahl von Neutrophilen und Lymphozyteninfiltrationen, übermäßiger Exsudation und sichtbarer Kryptenentzündung. Der pathologische Score des ilealen Pouchgewebes in der Gruppe mit ilealer Pouchitis war signifikant höher als in der IPAA-Gruppe, wobei ein signifikanter statistischer Unterschied beobachtet wurde (8,50 ± 1,76 vs. 1,33 ± 0,52, P = 0,000) (Abbildung 5).
Expressionsniveau des funktionellen Proteins der Darmbarriere Occludin
Occludin, ein wichtiges funktionelles Protein der Darmbarriere, wird sowohl in der IPAA- als auch in der Ileumpouchitis-Gruppe von Ratten auf der Zellmembran des ilealen Pouchgewebes exprimiert11. Das Expressionsniveau des Occludin-Proteins in der Gruppe mit ilealer Pouchitis war jedoch signifikant niedriger als in der IPAA-Gruppe (0,25 ± 0,03 vs. 0,15 ± 0,02, P = 0,000) (Abbildung 6).
Nachweis von Entzündungsfaktoren im Ileumbeutel
Die Expressionsniveaus von IL-6, IL-17, TNF-α und INF-γ im ilealen Pouchgewebe von Ratten in der Gruppe mit ilealer Pouchitis waren signifikant höher als in der IPAA-Gruppe (wie durch den ELISA-Testbestimmt 16). Umgekehrt zeigte IL-10 die gegenteiligen Ergebnisse, wobei statistische Unterschiede beobachtet wurden (P = 0,000) (Tabelle 1).
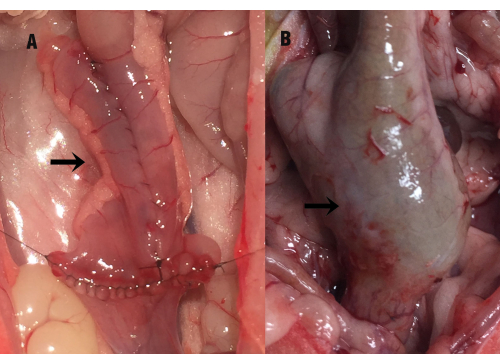
Abbildung 1: Der Zustand des Ileumbeutels. Der Pfeil zeigt den Ileumbeutel (A) zum Zeitpunkt der Operation und (B) die kompensatorische Vergrößerung des Ileumbeutels am 35. Tag nach der Operation (während der Probenentnahme). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Trend der Körpergewichtsveränderungen bei Ratten nach einer IPAA-Operation. Der Fehlerbalken bezieht sich auf die Standardabweichung, n = 6 in jeder Gruppe. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Foto des Kots von Ratten. (A) IPAA-Gruppe. (B) Gruppe der ilealen Pouchitis. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
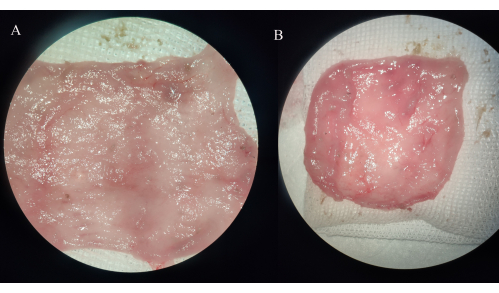
Abbildung 4: Makroskopische Betrachtung von Proben aus Ileumbeuteln. (A) IPAA-Gruppe. (B) Gruppe der ilealen Pouchitis. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Pathologische Veränderungen des ilealen Pouchgewebes der Ratte. (A) IPAA-Gruppe. (B) Gruppe der ilealen Pouchitis. Maßstabsstäbe: 60 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6: Immunhistochemischer Nachweis der Expression von Occludin-Proteinen in ilealem Pouchgewebe von Ratten. (A) IPAA-Gruppe. (B) Gruppe der ilealen Pouchitis. Maßstabsstäbe: 60 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Gruppe | n | IL-6 | IL-10 | IL-17 | TNF-α | INF-γ |
| IPAA-Gruppe | 6 | 2,60 ± 0,36 | 5,81 ± 0,66 | 17.48 ± 4.81 | 86,94 ± 24,06 | 4,08 ± 0,56 |
| Gruppe Pouchitis | 6 | 6,94 ± 1,18 | 2,77 ± 0,60 | 34,82 ± 2,41 | 213.00 ± 26.11 Uhr | 9,67 ± 1,70 |
| P | 0 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 |
Tabelle 1: Expressionsniveau von Entzündungsfaktoren im ilealen Pouchgewebe der Ratte (pg/ml).
Diskussion
Colitis ulcerosa (UC) ist eine chronische Darmentzündung, die durch wiederkehrende Magenschmerzen, Durchfall und blutigen Schleimstuhl gekennzeichnet ist. Sie betrifft in erster Linie den Enddarm und kann den fortschreitenden Dickdarm in unterschiedlichem Maße betreffen. Die Chirurgie spielt eine entscheidende Rolle bei der Behandlung von UC 17,18,19. Seit Parks et al.20 1978 die totale Kolektomie mit einem ilealen Pouch-Anal-Anastomosen-Verfahren (IPAA) einführten, um verändertes Gewebe zu entfernen und die Darmkontinuität wiederherzustellen, ist diese Operation zum internationalen Standard für die chirurgische Behandlung von UC geworden. Entzündliche Erkrankungen des Beutels sind die häufigsten Komplikationen nach einer IPAA-Operation.
Aufgrund der Herausforderungen bei der Durchführung klinischer Studien zu Pouchitis wurden Tiermodelle als ergänzende Experimente zur Untersuchung von Medikamenten und Mechanismen im Zusammenhang mit Pouchitis verwendet. Im Jahr 1998 entwickelten Lichtman et al.11 ein Rattenmodell, bei dem der Dickdarm vollständig entfernt und der Beutel wieder mit dem Rektum verbunden wurde. Dieses Modell zeigte innerhalb von vier Wochen nach der Operation Anzeichen einer Entzündung wie mononukleäre Zellinfiltration, luminale Exsudation, Schleimhautgeschwüre und seröse Entzündungen. Das Ausmaß der Entzündung korrelierte mit einer erhöhten Bakterienzahl im Beutel, und es konnte eine ausgeprägte genetische Anfälligkeit des Wirts beobachtet werden. Im Jahr 2002 konstruierten Shebani et al.21 erfolgreich ein chirurgisches IPAA-Rattenmodell mittels SDD, das effektiv eine Pouchitis induzierte. Dieses Modell bestätigte die Wirksamkeit des Einsatzes von Tieren zur Untersuchung der Pathogenese der Pouchitis und bot eine robuste experimentelle Plattform für die Grundlagenforschung zur Pouchitis. Sie identifizierten auch ähnliche Muster des reichlich vorhandenen Bakterienwachstums sowohl in menschlichen als auch in Nagetierreservoiren und bestätigten damit ihre Nützlichkeit bei der Untersuchung des bakteriellen Ungleichgewichts im Darm und der Identifizierung potenzieller Krankheitserreger im Zusammenhang mit Pouchitis.
Mit früheren Erfahrungen in der Mausfütterung und der IPAA-Chirurgiemodellierung ist es machbar, die Lernkurve auf etwa zehn Probanden zu komprimieren. Ein kritischer Schritt in diesem Prozess ist die Konstruktion und Anastomose des J-Beutels. Angesichts der Tatsache, dass der Darmtrakt von Mäusen relativ schlank ist, beträgt 8-0 Für die Nähte wurde Naht verwendet. Kontinuierliche Verriegelungsnähte und ein Connel-Stich wurden separat für die Nähte der Hinterwand und der Vorderwand des Beutels verwendet. Während der Anastomose des Beutels und des Analkanals kann die Schaffung einer geneigten Oberfläche die Stenose an der Anastomosenstelle am Beispiel des Rektumstumpfes wirksam reduzieren. Zunächst werden zwei Stiche auf jeder Seite der Anastomosenstelle gesichert, dann werden die hinteren und vorderen Wände einzeln mit kontinuierlichen Verriegelungsnähten vernäht, um die Integrität der Anastomose zu gewährleisten und die Operationszeit zu verkürzen.
Auch das postoperative Management spielt eine zentrale Rolle für eine erfolgreiche Modellierung. Eine 72-stündige Fastenperiode postoperativ kann das Auftreten von Darmverschlüssen effektiv reduzieren. Auf der anderen Seite kann eine frühe moderate flüssige Ernährung den Nährstoff- und Flüssigkeitsbedarf der Mäuse sicherstellen. Nach der Beherrschung der Lernkurve können Chirurgen eine effizientere und konsistentere Erfolgsquote bei der Modelletablierung erzielen.
Diese Studie hat auf dieser Grundlage aufgebaut und durch vorläufige Erkundung und Verfeinerung erfolgreich ein Modell für Ileumbeutel von Ratten mittels Mikrochirurgie etabliert. Dieses Modell wurde dann verwendet, um den Status der Pouch-Entzündung und die Indikatoren für die Darmbarriere zu untersuchen. Die Ergebnisse zeigten, dass Ratten bemerkenswerte Symptome wie blutigen Stuhl, Durchfall und Gewichtsverlust zeigten, nachdem sie DSS ausgesetzt waren. Dies führte zu Ödemen und Erosionen der Beutelschleimhaut, Entzündungen, die durch histopathologisches Scoring angezeigt wurden, und erhöhten Spiegeln von proinflammatorischen Faktoren, einschließlich Interleukin-6 (IL-6), IL-17, Tumornekrosefaktor-alpha (TNF-α) und Interferon-Gamma (INF-γ), zusammen mit verminderten Spiegeln des entzündungshemmenden Faktors Interleukin-10 (IL-10). Darüber hinaus nahm die Proteinexpression des Darmbarriereindikators Occludin ab. Diese Ergebnisse stimmen mit früheren Studienüberein 11 und bestätigen die erfolgreiche Etablierung des Ratten-Pouchitis-Modells und bieten eine solide Plattform für die nachfolgende Wirkstoff- und Mechanismusforschung.
Offenlegungen
Nichts.
Danksagungen
Nichts
Materialien
| Name | Company | Catalog Number | Comments |
| Anhydrous ethanol | Tianjin Fengchuan Chemical Reagent Technology Co., Ltd | China | Hematoxin-eosin Staining |
| Dextran Sulfate Sodium | Yeasen | 60316ES76 | Used to induce pouch inflammation |
| Formaldehyde solution | Tianjin Zhiyuan Reagent Company | China | Hematoxin-eosin Staining |
| Gauze | Jiangxi Zhonggan Medical Equipment Company | China | Used for animal microsurgery |
| Hematoxylin | Beijing Zhongshan Jinqiao Company | China | Hematoxin-eosin Staining |
| Interferon γ Detection reagent kit | Cloud-clone | SEA049Ra | Detecting inflammatory factors |
| Interleukin-10 detection kit | Cloud-clone | SEA056Ra | Detecting inflammatory factors |
| Interleukin-17 detection kit | Cloud-clone | SEA063Ra | Detecting inflammatory factors |
| Interleukin-6 detection kit | Cloud-clone | SEA079Ra | Detecting inflammatory factors |
| Iodophor | Tangpai Medical Equipment Co., Ltd | China | Used for animal microsurgery |
| Microscopic manipulation instruments | Aesculap | Germany | Used for animal microsurgery |
| Occludin | abcam | ab216327 | Immunohistochemical testing |
| Sewing needle | Yangzhou Fuda Medical Equipment Co., Ltd | China | Used for animal microsurgery |
| tumor necrosis factor α Detection reagent kit | Cloud-clone | SEA133Ra | Detecting inflammatory factors |
| Two person binocular surgical microscope | OPTON | Germany | Used for animal microsurgery |
| Xylene | Tianjin Yingda Rare and Precious Reagent Factory | China | Hematoxin-eosin Staining |
Referenzen
- Yang, M. L., Brar, M. S., Kennedy, E. D., De Buck Van Overstraeten, A. Laparoscopic versus transanal IPAA for ulcerative colitis: A patient-centered treatment trade-off study. Dis Colon Rectum. 67 (1), 107-113 (2024).
- Aktas, M. K., et al. Current status and surgical technique for restorative proctocolectomy with ileal pouch-anal anastomosis. Balkan Med J. 40 (4), 236-243 (2023).
- Zhao, L., et al. Microbiota DNA translocation into mesentery lymph nodes is associated with early development of pouchitis after ipaa for ulcerative colitis. Diseases of the Colon & Rectum. 66 (11), e1107-e1118 (2022).
- Ng, S. C., et al. Worldwide incidence and prevalence of inflammatory bowel disease in the 21st century: A systematic review of population-based studies. Lancet. 390 (10114), 2769-2778 (2017).
- Pardi, D. S., D'haens, G., Shen, B., Campbell, S., Gionchetti, P. Clinical guidelines for the management of pouchitis. Inflamm Bowel Dis. 15 (9), 1424-1431 (2009).
- Shen, B., et al. Treatment of pouchitis, Crohn's disease, cuffitis, and other inflammatory disorders of the pouch: Consensus guidelines from the international ileal pouch consortium. Lancet Gastroenterol Hepatol. 7 (1), 69-95 (2022).
- Dalal, R. L., Shen, B., Schwartz, D. A. Management of pouchitis and other common complications of the pouch. Inflamm Bowel Dis. 24 (5), 989-996 (2018).
- Li, K. Y., et al. A new rat model of pouchitis after proctocolectomy and ileal pouch-anal anastomosis using 2,4,6-trinitrobenzene sulfonic acid. J Gastrointest Surg. 25 (6), 1524-1533 (2021).
- Drzymala-Czyz, S., et al. Discrepancy between clinical and histological effects of dha supplementation in a rat model of pouchitis. Folia Histochem Cytobiol. 50 (1), 125-129 (2012).
- Santiago, P., Barnes, E. L., Raffals, L. E. Classification and management of disorders of the J pouch. Am J Gastroenterol. 118 (11), 1931-1939 (2023).
- Lichtman, S. N., Wang, J., Hummel, B., Lacey, S., Sartor, R. B. A rat model of ileal pouch-rectal anastomosis. Inflamm Bowel Dis. 4 (3), 187-195 (1998).
- Guarner, F. Inulin and oligofructose: Impact on intestinal diseases and disorders. Br J Nutr. 93, Suppl 1 S61-S65 (2005).
- Kim, C. J., et al. L-tryptophan exhibits therapeutic function in a porcine model of dextran sodium sulfate (DSS)-induced colitis. J Nutr Biochem. 21 (6), 468-475 (2010).
- Valatas, V., Bamias, G., Kolios, G. Experimental colitis models: Insights into the pathogenesis of inflammatory bowel disease and translational issues. Eur J Pharmacol. 759, 253-264 (2015).
- Letson, H. L., Morris, J., Biros, E., Dobson, G. P. Conventional and specific-pathogen free rats respond differently to anesthesia and surgical trauma. Sci Rep. 9 (1), 9399(2019).
- Gu, Y., et al. Saccharomyces boulardii, a yeast probiotic, inhibits gut motility through upregulating intestinal serotonin transporter and modulating gut microbiota. Pharmacol Res. 181, 106291(2022).
- Akiyama, S., et al. Endoscopic phenotype of the j pouch in patients with inflammatory bowel disease: A new classification for pouch outcomes. Clin Gastroenterol Hepatol. 20 (2), 293-302 (2022).
- Hata, K., et al. Pouchitis after ileal pouch-anal anastomosis in ulcerative colitis: Diagnosis, management, risk factors, and incidence. Dig Endosc. 29 (1), 26-34 (2017).
- Gallo, G., Kotze, P. G., Spinelli, A. Surgery in ulcerative colitis: When? How. Best Pract Res Clin Gastroenterol. 32-33, 71-78 (2018).
- Parks, A. Proctocolectomy without ileostomy for ulcerative colitis. BMJ. 2, 85-88 (1978).
- Shebani, K. O., et al. Pouchitis in a rat model of ileal J pouch-anal anastomosis. Inflamm Bowel Dis. 8 (1), 23-34 (2002).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten