Method Article
نموذج فأر لالتهاب الجيب بعد استئصال المستقيم والقولون ومفاغرة الجيب اللفائفي الشرجي باستخدام كبريتات ديكستران الصوديوم
In This Article
Summary
يصف هذا البروتوكول طريقة إنشاء نموذج الفئران من التهاب الجيب. تم إنشاء نموذج الجيب اللفائفي عن طريق إجراء جراحة مفاغرة الجيب اللفائفي الشرجي (IPAA) باستخدام تقنيات الجراحة المجهرية. بعد الجراحة ، عولج الجرذ بنسبة 4٪ من كبريتات ديكستران الصوديوم (DSS) لمدة 4 أيام.
Abstract
التهاب القولون التقرحي (UC) هو مرض مزمن بوساطة المناعة يصيب القولون والمستقيم بالكامل مع مسار انتكاسي وتحويل ، مما يسبب مراضة مدى الحياة. عندما يكون العلاج الطبي غير فعال ، خاصة في حالات النزيف المعدي المعوي الحاد أو الانثقاب أو تضخم القولون السام أو التسرطن ، تصبح الجراحة خط الدفاع الأخير لعلاج جامعة كاليفورنيا. يوفر الاستئصال الكلي للقولون والمستقيم ومفاغرة الجيب اللفائفي الشرجي (IPAA) أفضل فرصة للعلاج على المدى الطويل. التهاب الجيب هو أكثر مضاعفات ما بعد الجراحة شيوعا ومزعجة. في هذا التحقيق ، يتم استخدام الجراحة المجهرية لإنشاء نموذج الجيب اللفائفي في الفئران التجريبية عن طريق جراحة IPAA. بعد ذلك ، يتم إنشاء نموذج فئران مستدام من التهاب الجيب عن طريق إحداث التهاب في الجيب اللفائفي مع كبريتات ديكستران الصوديوم (DSS). يتم التحقق من صحة التأسيس الناجح لالتهاب جيب الفئران من خلال تحليل الحالة العامة بعد الجراحة ، والوزن ، وتناول الطعام والماء ، وبيانات البراز ، بالإضافة إلى أمراض أنسجة الحقيبة ، والكيمياء المناعية ، وتحليل العوامل الالتهابية. يوفر هذا النموذج الحيواني التجريبي لالتهاب الجيب أساسا لدراسة التسبب في المرض وعلاج الحالة.
Introduction
التهاب الجيب هو التهاب غير محدد يؤثر على الجيب اللفائفي وهو أحد المضاعفات السائدة بعد استئصال المستقيم والقولون الكلي ومفاغرة الجيب اللفائفي الشرجي (IPAA) لدى الأفراد المصابين بالتهاب القولون التقرحي (UC) 1،2،3. هذه الحالة لها معدل حدوث مرتفع نسبيا يصل إلى 50٪ ويمكن أن تسبب مظاهر سريرية مختلفة ، بما في ذلك الإسهال وآلام البطن وفقدان الدم البرازي والحمى. لا يزال السبب الدقيق لالتهاب الجيب بعيد المنال ، على الرغم من أن بعض الباحثين يعتقدون أن التحول في الأكياس النباتية قد يؤدي إلى تنشيط المناعة والالتهاب اللاحق4،5،6،7.
نظرا للتحديات المرتبطة بإجراء التجارب السريرية على التهاب الجيب ، يمكن أن تكون النماذج الحيوانية بمثابة أدوات قيمة لدراسة أدوية وآليات التهاب الجيب. هناك مخاوف متزايدة بشأن إنشاء أكياس لفائفية الفئران ، مع تقارير تشير إلى التهاب محتمل8. ومع ذلك ، لا تزال الأبحاث في هذا المجال قليلة بسبب الطبيعة المعقدة لعملية التصنيع ، والتي تفتقر إلى إرشادات واضحة 9,10. في عام 1998 ، كان ليشتمان أول من أنشأ نموذجا للكيس اللفائفي في فئران لويس وفئران سبراغ داولي (SD) عن طريق إجراء استئصال القولون الكلي11. لاحظوا تسلل البلاعم ، وتقرح الغشاء المخاطي ، وزيادة في النباتات البكتيرية اللاهوائية داخل أمعاء هذه الفئران ، مما يوفر أساسا متينا لمزيد من البحث حول التهاب الجيب اللفائفي. يحاكي هذا النموذج التجريبي لالتهاب جيب الفئران عن كثب العلامات الجسدية والآليات الأساسية التي لوحظت في التهاب الجيب البشري.
تشمل نماذج التهاب القولون التقرحي قبل السريري المطبقة بشكل شائع نماذج DSS و TNBS. عادة ما تحاكي المادة الكيميائية المحفزة 2،4،6-ثلاثي نيتروبنزين حمض السلفونيك (TNBS) مرض كرون12. غالبا ما يستخدم نموذج DSS ، الذي يحظى بالاحترام لفعاليته وملف تعريف السلامة والقدرة على تحمل التكاليف ، كأداة موثوقة لتحريض UC بسبب الأعراض الواضحة التي لوحظت. نظرا لاستعمار أنسجة الحقيبة ، نجحنا في إحداث نموذج التهاب الجيب باستخدام DSS13,14.
في هذه الدراسة ، تم استخدام الجراحة المجهرية لإنشاء نموذج الجيب اللفائفي بنجاح في الفئران التجريبية عن طريق جراحة IPAA. بعد ذلك ، تم إنشاء نموذج مستدام لالتهاب جيب الفئران عن طريق إحداث التهاب في الجيب اللفائفي مع DSS. الدقة أثناء الجراحة ضرورية لتشكيل النموذج بنجاح ، كما أن رعاية ما بعد الجراحة أمر بالغ الأهمية أيضا. يمكن استخدام هذا النموذج للتحقيق في التسبب في التهاب الجيب ، وتقييم العوامل العلاجية المحتملة ، وزيادة فهمنا لهذه الحالة المعقدة. تعمل الدراسة على تبسيط إجراءات تصنيع الأكياس اللفائفية ، مما يقلل من مدة التشغيل ويعزز الكفاءة ، وبالتالي إنشاء أساس قوي للبحث الأساسي في اضطرابات الحقيبة بعد الجراحة.
Protocol
تم إجراء جميع التجارب على وفقا لسياسات اللجان الأخلاقية للمستشفى العام بجامعة تيانجين الطبية. تم استخدام ذكور الفئران Sprague-Dawley الذين تتراوح أعمارهم بين 9 و 12 أسبوعا ، والتي تزن حوالي 320-360 جم ، لهذه الدراسة. يتم سرد تفاصيل الكواشف والمعدات المستخدمة في جدول المواد.
1. اختيار وصيانتها
- حدد صحيا (وزن الجسم ~ 220-240 جم).
- تأكد من أنها تفي بمعايير المستوى المحدد الخالي من مسببات الأمراض (SPF) 15 ويتم تربيتها بشكل تكيفي لمدة لا تقل عن أسبوعين في بيئة ذات تهوية كافية (من 8 إلى 12 تغييرا للهواء في الساعة) ، ودرجة حرارة مريحة (20-25 درجة مئوية) ، ورطوبة مناسبة (40٪ -70٪) ، والحد الأدنى من الضوضاء (أقل من 70 ديسيبل) ، ودورة الضوء الطبيعي (12 ساعة من الضوء و 12 ساعة من الظلام).
- خلال هذه الفترة ، ضعهم في أقفاص نظيفة قياسية بكثافة من ثلاثة إلى خمسة لكل قفص ، وقم بتغيير الفراش مرتين أسبوعيا. توفير إمكانية الوصول إلى الغذاء والماء ، بالإضافة إلى تغذية الصيانة القياسية لفئران المختبر.
2. التحضير قبل الجراحة
- حدد فأرا صحيا بوزن جسم تقريبي يتراوح من 320 جم إلى 360 جم. قم بصيام الفئران لمدة 8-12 ساعة قبل العملية وتوفير الوصول إلى محلول ملحي فسيولوجي و 5٪ جلوكوز بنسبة 1: 1 للاستهلاك الطوعي.
- تحضير الأدوات المجهرية المعقمة (نقع الكحول قبل الجراحة لمدة 1 ساعة) ، مجهر ، جدول تشريح الفئران ، 8-0 خياطة جزيئية عالية غير قابلة للامتصاص ، خياطة 4-0 غير قابلة للامتصاص ، شاش معقم ، مسحات قطنية معقمة ، إلخ.
3. إنشاء نموذج الحقيبة اللفائفية الفئران
- حقن محلول صوديوم بنتوباربيتال 1٪ داخل الصفاق بجرعة 6 مل / كجم وتسلل جراحي للتخدير الموضعي مع 0.5٪ روبيفاكايين لتخدير الفئران. الحفاظ على الفئران في درجة حرارة مريحة أثناء التخدير مع مصباح كهربائي.
- قم بإجراء استئصال القولون والمستقيم الكلي باتباع الخطوات التالية:
- قم بتأمين الجرذ في الاستلقاء الظهري على مقعد تشريحي بعد بروتوكول مخدر مرض. تأكد من عمق التخدير عن طريق قرصة إصبع القدم. استخدم كليبرز الحلاقة للتخلص من بقايا الشعر ، وقم بتطبيق محلول اليودوفور مرتين للتعقيم الميداني الجراحي.
- قم بعمل شق في خط الوسط ، بطول 6 سم تقريبا ، لتشريح الجلد ولفافة الخط الأبيض والبريتوني ، مما يوفر الدخول إلى تجويف البطن. استخدم ضامنا لفضح السطح البريتوني وتغطيته بشاش معقم مالح مبلل بالجراثيم.
- عزل تدفق الأوعية الدموية من الصائم الطرفية ، وربط أصله باستخدام 8-0 خيط خياطة ، وبعد ذلك قطعه. اضبط جذع cecal ، الذي يقع على بعد 1-2 سم من الصمام اللفائفي الأعور ، في حالة راحة ، ثم اقطعه.
- بدء استئصال نصف القولون الأيمن ، وربط نصف القولون الأيمن والوريد المغص الأوسط بشكل متحفظ.
- مزيد من فصل الشريان المساريقي السفلي وعزل الشريان المستقيمي السفلي. استمر في العزل أسفل المستقيم حتى فاصل زمني يعادل سنتيمترين من حافة الشرج. استئصال المستقيم البعيد بشكل غير مباشر عند حوالي 45 درجة لتجنب تضيق ما بعد الجراحة.
- أداء بناء الحقيبة J.
- استخدم مشرط ميكروتوم لفصل القسم العرضي من الدقاق الطرفي عن الأمعاء المساريقية ، والتي يجب أن تقيس حوالي 6-7 سم.
- قم بطي الدقاق الطرفي في شكل J لإنشاء كيس للدقاق. إجراء مفاغرة الجدار الخلفي عن طريق غرزة متشابكة. قم بزيادة الجدار الأمامي باستخدام غرزة كونيل المعدلة واحتفظ بأمعاء مناسبة لتتناسب مع حجم المقطع العرضي لجذع المستقيم البعيد.
- تعزيز الحقيبة على شكل حرف J مع 8-0 خياطة إذا لزم الأمر. يجب أن يتراوح طول الحقيبة J بين 2.5 سم و 3.5 سم.
- أداء مفاغرة الجيب اللفائفي الشرج ، IPAA.
- تأكد من عدم وجود التواء في المساريق وخياطة الجدران الجانبية للنمل في فتحة الحقيبة والجدار الجانبي لجذع المستقيم على فترات مع 8-0 خيط خياطة للجر.
- في النهاية ، ضع خياطة قفل مستمرة كاملة الطبقة على كل من الجدران الأمامية والخلفية.
- تحقق من عدم وجود نزيف نشط وتطهير تجويف البطن من الناحية الفسيولوجية بالمحلول الملحي الطبيعي. إغلاق بالتتابع اللفافة العضلية البطنية والجلد مع 4-0 الغرز.
- أداء إدارة ما بعد الجراحة.
- تطبيق كيتوبروفين كتسكين بعد العملية الجراحية (40 ملغ/ كغ، تحت الجلد) لجميع الفئران بعد إغلاق البطن. تأكد من تسخين الفئران باستخدام مصباح كهربائي حتى يحدث الترميم.
- تقييد من استهلاك الطعام لمدة لا تقل عن 72 ساعة بعد الجراحة للحد من خطر انسداد الأمعاء. اسمح بالوصول إلى نظام غذائي يحتوي على 5٪ من الجلوكوز لتجديد الطاقة وسوائل الجسم بسرعة ، وضبط وتيرة التغذية وفقا لأنماط التغوط.
- بعد أسبوع من الجراحة ، ابدأ بتغذية محدودة وقم بزيادة الكمية المستهلكة تدريجيا. بعد ذلك ، قم بتزويد الفئران بتغذية القوارض العادية للاستهلاك بحرية ، مع الاحتفاظ بسجل يومي لاستهلاكها الغذائي وكمية الماء ووزن الجسم.
4. إنشاء نموذج التهاب الجيب اللفائفي الفئران مع DSS
- إجراء التجميع التجريبي.
- قم بتعيين 12 فأرا بشكل عشوائي خضعوا لاستئصال القولون والمستقيم الكلي وجراحة IPAA في مجموعة IPAA (المجموعة A ، n = 6) ومجموعة التهاب الجيب (المجموعة B ، n = 6).
- قم بإعداد محلول DSS بنسبة 4٪ عن طريق إضافة 4 جم من DSS إلى 100 مل من الماء النقي ، يتم تحضيره طازجا يوميا.
- إدارة مجموعة IPAA ومجموعة التهاب الجيب بالماء النقي أو 4٪ DSS في اليوم 31 بعد الجراحة إلى اليوم 35 ، على التوالي. اسمح للفئران بشرب وأكل طعام الفئران بحرية خلال الأيام الأربعة المتتالية من تناولها.
- أداء أخذ عينات الحقيبة.
- في صباح اليوم 35 ، بعد العملية ، قم بتخدير الفئران بحقن داخل الصفاق من محلول صوديوم بنتوباربيتال 1٪ ، مع إعطاء جرعة 6 مل / كجم (وفقا للبروتوكولات المعتمدة مؤسسيا).
- اقطع الحقيبة بشكل عمودي من ثغرة الحقيبة إلى تقاطع أكياس الإدخال والإخراج في كل مجموعة. الحصول على عينة الحقيبة.
- افتح الحقيبة على طول خط خياطة الجدار الأمامي واغسل القناة المعوية بالمحلول الملحي.
- ضع جزءا من أنسجة الحقيبة في أنبوب طرد مركزي دقيق وقم بتبريده على الفور عند -80 درجة مئوية. استخدم هذا الجزء للكشف عن ELISA للمؤشرات الالتهابية. قم بإصلاح قسم الحقيبة المتبقي بنسبة 10٪ فورمالديهايد لتسجيل التشريح المرضي وتلطيخ المناعة الكيميائية.
- أخيرا ، القتل الرحيم للفأر عن طريق انسداد الهواء تحت التخدير العميق (باتباع البروتوكولات المعتمدة مؤسسيا).
5. التحليل النسيجي
- بعد الحصول على أنسجة الحقيبة من الفئران ، اغمرها في 4٪ بارافورمالدهيد لمدة 24 ساعة. بعد ذلك ، تابع بروتوكولات الجفاف والتضمين. قسم الأنسجة المعالجة للفحص النسيجي16.
- تطبيق تلطيخ الهيماتوكسيلين ويوزين لتحديد الاختلافات النسيجية المرضية عبر المجموعات. فحص العينات مجهريا والتقاط الصور الفوتوغرافية للتوثيق.
6. المقايسة المناعية الهيستوكيميائية
- إزالة الشمع وتجفيف أقسام الأنسجة بعناية. بعد ذلك ، قم بإجراء استرجاع المستضد عن طريق تبريد الأقسام في محلول سترات الصوديوم وسدها بمصل مانع لمدة 20 دقيقة.
- بعد ذلك ، قم بتعريض الشرائح للجسم المضاد الأساسي المضاد للإطباق واحتضانها طوال الليل عند 4 درجات مئوية. بعد ذلك ، عالجهم بالأجسام المضادة الثانوية لمدة 30 دقيقة قبل تلطيخ الهيماتوكسيلين16.
- بمجرد أن تجف الشرائح ، راقبها وصورها تحت المجهر الضوئي.
7. اختبار إليسا
- 7.1 فرم وتجانس شظايا الأنسجة في العازلة التحلل باستخدام صوتنة لضمان التجانس الشامل. استخدم المادة الطافية الناتجة للكشف.
- تخصيص الآبار للفراغات والعينات والنسخ المتماثلة لكل مجموعة. تحديد تركيز البروتين عن طريق قراءة الامتصاص عند 450 نانومتر (قيمة OD) وإجراء تحليل الانحدار الخطي16.
النتائج
تقييم الحالة العامة للفئران النموذجية للكيس اللفائفي بعد التأسيس
بعد أن اجتاز المشغل منحنى التعلم الجراحي IPAA ، تحملت الفئران الجراحة جيدا ، مع مدة جراحية تبلغ 192.94 دقيقة ± 27.15 دقيقة ، وحدثت مضاعفات أقل بعد الجراحة. خلال فترة ما بعد الجراحة المبكرة ، شهدت الفئران انخفاضا في المدخول الغذائي ، ولكن تم استعادة شهيتها قبل الجراحة في غضون 10 أيام إلى 14 يوما بعد الجراحة. انخفض النشاط المبكر بعد العملية الجراحية بشكل طفيف ، ولم تكن هناك إفرازات واضحة من العينين والأنف. كان فقدان الوزن قبل وبعد الجراحة 21.17 جم ± 1.59 جم. أظهر الوزن الأولي بعد العملية الجراحية اتجاها تنازليا ، مع انخفاض أقصى قدره 69.58 جم ± 33.19 جم. بدأ النمو المستقر في اليوم 8.25 ± 2.53 بعد الجراحة ، وبحلولاليوم 31 بعد الجراحة ، تجاوز الوزن 9.35٪ ± 4.7٪ من الوزن في اليوم التالي للجراحة. كانت الفئران قادرة على التبرز في غضون 24 ساعة بعد الجراحة ، مع براز رخو ولكن بدون براز دموي. حدث تكوين البراز اللينفي اليوم 9 إلى 12 بعد الجراحة.
زيادة تعويضية في الجيب اللفائفي
فياليوم 35 بعد الجراحة ، تم فتح تجويف البطن للفأر تحت التخدير ، مما كشف عن التصاق شديد بين الجيب اللفائفي وتجويف الحوض. بعد فصل الالتصاق بعناية بين الجيب والأنسجة المحيطة ، لوحظ تضخم تعويضي للكيس اللفائفي ، وسماكة جدار الأمعاء ، وتمدد خفيف للأمعاء الدقيقة البعيدة (الشكل 1). كان طول الجيب اللفائفي 2.89 سم ± 0.28 سم في وقت الجراحة ، بينمافي اليوم 35 بعد الجراحة ، كان قياسه 3.86 سم ± 0.87 سم ، مما يدل على فرق إحصائي كبير قدره P = 0.000). كما زادت المساحة المخاطية (سم2) من الجيب اللفائفي بشكل ملحوظ مقارنة بالقياس الجراحي (6.46 ± 0.85 مقابل 17.02 ± 4.61 ، P = 0.000). لم يكن هناك فرق كبير بين مجموعة IPAA ومجموعة التهاب الجيب اللفائفي (P > 0.05).
تقييم الحالة العامة ودرجة البراز للفئران المصابة بالتهاب الجيب اللفائفي
فياليوم 31 بعد الجراحة ، تم إعطاء DSS لمجموعة التهاب الجيب اللفائفي. في بداية الإدارة ، كان لكل من مجموعة IPAA ومجموعة التهاب الجيب اللفائفي وزن جسم متساو (352.00 جم ± 30.03 جم مقابل 352.00 جم ± 25.92 جم ، P = 1) وكانوا في حالة جيدة بشكل عام. ومع ذلك ، انخفضت كمية الطعام والماء المستهلكة في مجموعة التهاب الجيب اللفائفي ، مما أدى إلى التعب العقلي ، والشعر الباهت ، وإفراز العينين والأنف ، وانخفاض الحركة ، ولم تلاحظ أي تغييرات كبيرة في مجموعة IPAA. فياليوم 35 بعد الجراحة ، كان وزن مجموعة التهاب الجيب اللفائفي أقل بكثير من وزن مجموعة IPAA (322.83 جم ± 29.24 جم مقابل 364.83 جم ± 30.13 جم ، P = 0.028) (الشكل 2).
عانت مجموعة التهاب الجيب اللفائفي من إسهال كبير في اليوم الأول بعد إعطاء DSS ، وفي اليوم الثاني بعد إدارة DSS ، كان لديهم مخاط وصديد وبراز دموي (الشكل 3). فياليوم 35 بعد الجراحة ، كانت درجات البراز11 من مجموعة IPAA ومجموعة التهاب الجيب اللفائفي (4.33 ± 0.82 مقابل 2.17 ± 0.75 ، P = 0.001) ، على التوالي. كان لدى فئران مجموعة IPAA فتحة شرج نظيفة وخالية من التلوث ، بينما كان لدى فئران التهاب الجيب اللفائفي تورم في فتحة الشرج مصحوبا بالمخاط والقيح وملحق البراز الدموي.
التغيرات النسيجية المرضية للكيس اللفائفي
المراقبة العيانية لعينات الجيب اللفائفي
في مجموعة IPAA ، كان جدار الأمعاء في الحقيبة اللفائفية سميكا ، ولم يلاحظ أي تآكل أو قرحة أو نقطة نزيف. في مجموعة التهاب الجيب اللفائفي ، تصبح الأوعية الدموية في المساريق الكيسي المخزن أكثر سمكا ، ويكون الغشاء المخاطي للكيس اللفائفي ملتهبا على نطاق واسع أو محليا ، مع تآكل واضح ، وتقرحات ، ونقاط نزيف ، بعضها مصحوب بتمدد معوي صغير بعيد (الشكل 4).
المراقبة المجهرية لأنسجة الجيب اللفائفي
في مجموعة IPAA من الفئران ، أصبح طرف بعض الزغابات المعوية في أنسجة الحقيبة حادا ، مصحوبا بكمية صغيرة من تسلل العدلات ، وفي بعض الأحيان ، لوحظت كمية صغيرة من النضح على سطح الغشاء المخاطي.
في المقابل ، كان ترتيب الزغابات المعوية في أنسجة الجيب اللفائفي للفئران في مجموعة التهاب الجيب اللفائفي مضطربا للغاية. كانت بعض الزغابات المعوية مفقودة ، وكان التآكل الواسع والقرح المتعددة غير المكتملة مرئية دون إشراك طبقة العضلات. ورافق ذلك عدد كبير من العدلات وتسلل الخلايا اللمفاوية ، والنضح المفرط ، والتهاب القبو المرئي. كانت النتيجة المرضية لنسيج الجيب اللفائفي في مجموعة التهاب الجيب اللفائفي أعلى بكثير من تلك الموجودة في مجموعة IPAA ، مع ملاحظة فرق إحصائي كبير (8.50 ± 1.76 مقابل 1.33 ± 0.52 ، P = 0.000) (الشكل 5).
مستوى التعبير عن حاجز الأمعاء بروتين وظيفي occludin
يتم التعبير عن Occludin ، وهو بروتين وظيفي مهم للحاجز المعوي ، على غشاء الخلية لنسيج الجيب اللفائفي في كل من مجموعات IPAA والتهاب الجيب اللفائفي من الفئران11. ومع ذلك ، كان مستوى التعبير عن بروتين الأوكلودين في مجموعة التهاب الجيب اللفائفي أقل بكثير من ذلك في مجموعة IPAA (0.25 ± 0.03 مقابل 0.15 ± 0.02 ، P = 0.000) (الشكل 6).
الكشف عن العوامل الالتهابية في الجيب اللفائفي
كانت مستويات التعبير IL-6 و IL-17 و TNF-α و INF-γ في أنسجة الجيب اللفائفي للفئران في مجموعة التهاب الجيب اللفائفي أعلى بكثير من تلك الموجودة في مجموعة IPAA (كما هو محدد في اختبار ELISA16). على العكس من ذلك ، أظهر IL-10 نتائج معاكسة ، مع ملاحظة اختلافات إحصائية (P = 0.000) (الجدول 1).
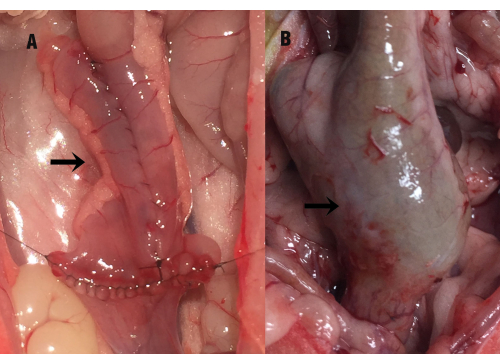
الشكل 1: حالة الجيب اللفائفي. يشير السهم إلى الجيب اللفائفي (A) في وقت الجراحة و (B) التوسيع التعويضي للكيس اللفائفيفي اليوم 35 بعد الجراحة (أثناء جمع العينات). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: اتجاه تغيرات وزن الجسم في الفئران بعد جراحة IPAA. يرتبط شريط الخطأ بالانحراف المعياري ، n = 6 في كل مجموعة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: صورة براز الفئران. (أ) مجموعة IPAA. ب: مجموعة التهاب الجيب اللفائفي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
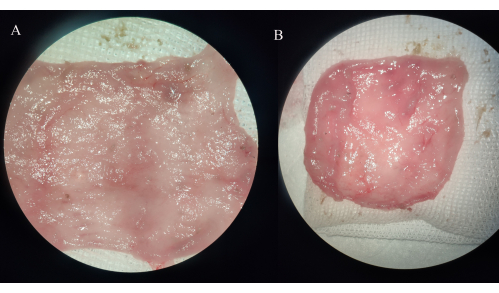
الشكل 4: الملاحظة العيانية لعينات الجيب اللفائفي. (أ) مجموعة IPAA. ب: مجموعة التهاب الجيب اللفائفي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: التغيرات المرضية لأنسجة الجيب اللفائفي للفئران. (أ) مجموعة IPAA. ب: مجموعة التهاب الجيب اللفائفي. قضبان المقياس: 60 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6: الكشف الكيميائي المناعي لتعبير بروتين الأوكلودين في أنسجة الجيب اللفائفي للفئران. (أ) مجموعة IPAA. ب: مجموعة التهاب الجيب اللفائفي. قضبان المقياس: 60 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| مجموعة | n | إيل-6 | IL-10 | إيل-17 | TNF-α | INF-γ |
| مجموعة IPAA | 6 | 2.60 ± 0.36 | 5.81 ± 0.66 | 17.48 ± 4.81 | 86.94 ± 24.06 | 4.08 ± 0.56 |
| مجموعة التهاب الجيب | 6 | 6.94 ± 1.18 | 2.77 ± 0.60 | 34.82 ± 2.41 | 213.00 ± 26.11 | 9.67 ± 1.70 |
| P | 0 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 |
الجدول 1: مستوى التعبير عن العوامل الالتهابية في أنسجة الجيب اللفائفي للفئران (pg / mL).
Discussion
التهاب القولون التقرحي (UC) هو التهاب معوي مزمن يتميز بألم شرسوفي متكرر وإسهال وبراز دموي مخاطي. يؤثر في المقام الأول على المستقيم وقد يشمل القولون المتقدم بدرجات متفاوتة. تلعب الجراحة دورا حاسما في إدارة UC17،18،19. منذ أن قدم Parks et al.20 استئصال القولون الكلي مع إجراء مفاغرة الجيب اللفائفي الشرجي (IPAA) في عام 1978 لإزالة الأنسجة المتغيرة واستعادة استمرارية الأمعاء ، أصبحت هذه العملية المعيار الدولي للعلاج الجراحي لجامعة كاليفورنيا. الاضطرابات الالتهابية في الحقيبة هي المضاعفات الأكثر شيوعا بعد جراحة IPAA.
نظرا للتحديات التي تواجه إجراء التجارب السريرية على التهاب الجيب ، تم استخدام النماذج الحيوانية كتجارب تكميلية لدراسة الأدوية والآليات المتعلقة بالتهاب الجيبة. في عام 1998 ، طور Lichtman et al.11 نموذجا للفئران يتضمن الإزالة الكاملة للأمعاء الغليظة وإعادة توصيل الحقيبة بالمستقيم. أظهر هذا النموذج علامات الالتهاب ، مثل تسلل الخلايا أحادية النواة ، ونضح اللمعية ، وتقرح الغشاء المخاطي ، والتهاب المصل في غضون أربعة أسابيع بعد الجراحة. ارتبط مستوى الالتهاب بزيادة عدد البكتيريا في الحقيبة ، ويمكن ملاحظة القابلية الوراثية المتميزة للمضيف. في عام 2002 ، نجح Shebani et al.21 في بناء نموذج فئران جراحي IPAA عبر SDD ، والذي تسبب بشكل فعال في التهاب الجيب. أكد هذا النموذج فعالية استخدام لدراسة التسبب في التهاب الجيب وقدم منصة تجريبية قوية للبحوث الأساسية حول التهاب الجيب. كما حددوا أنماطا مماثلة للنمو البكتيري الوفير في كل من الخزانات البشرية والقوارض ، مما يؤكد فائدتها في التحقيق في اختلال التوازن البكتيري المعوي وتحديد مسببات الأمراض المحتملة المتعلقة بالتهاب الجيب.
مع الخبرة السابقة في تغذية الفئران ونمذجة جراحة IPAA ، فإن ضغط منحنى التعلم إلى حوالي عشرة مواضيع أمر ممكن. الخطوة الحاسمة في هذه العملية هي بناء ومفاغرة الحقيبة J. بالنظر إلى أن الجهاز المعوي للفئران نحيف نسبيا ، 8-0 تم استخدام خياطة للغرز. تم استخدام خيوط القفل المستمر وغرز كونيل بشكل منفصل لخيوط الجدار الخلفي والجدار الأمامي للحقيبة. أثناء الجيب ومفاغرة القناة الشرجية ، يمكن أن يؤدي إنشاء سطح مائل إلى تقليل التضيق في موقع المفاغرة بشكل فعال عن طريق أخذ جذع المستقيم كمثال. في البداية ، يضمن تأمين غرزتين على كل جانب من موقع المفاغرة ، ثم المضي قدما في خيوط القفل المستمرة لخياطة الجدران الخلفية والأمامية بشكل فردي سلامة المفاغرة وتقصير وقت الجراحة.
تلعب إدارة ما بعد الجراحة أيضا دورا محوريا في النمذجة الناجحة. يمكن أن تقلل فترة الصيام لمدة 72 ساعة بعد الجراحة بشكل فعال من حدوث انسداد معوي. من ناحية أخرى ، يمكن أن يضمن النظام الغذائي السائل المعتدل المبكر المتطلبات الغذائية والسوائل للفئران. بعد إتقان منحنى التعلم ، يمكن للجراحين تحقيق معدل نجاح أكثر كفاءة واتساقا في إنشاء النموذج.
بنيت هذه الدراسة على هذا الأساس ، ومن خلال الاستكشاف الأولي والصقل ، نجحت في إنشاء نموذج الجيب اللفائفي للفئران باستخدام الجراحة المجهرية. ثم تم استخدام هذا النموذج لفحص حالة التهاب الحقيبة ومؤشرات الحاجز المعوي. أظهرت النتائج أن الفئران أظهرت أعراضا ملحوظة مثل البراز الدموي والإسهال وفقدان الوزن بعد تعرضها ل DSS. أدى ذلك إلى وذمة الغشاء المخاطي في الحقيبة وتآكلها ، والالتهاب كما هو موضح في التسجيل النسيجي المرضي ، وزيادة مستويات العوامل الالتهابية ، بما في ذلك إنترلوكين -6 (IL-6) ، IL-17 ، عامل نخر الورم ألفا (TNF-α) ، وإنترفيرون جاما (INF-γ) ، إلى جانب انخفاض مستويات العامل المضاد للالتهابات إنترلوكين -10 (IL-10). علاوة على ذلك ، انخفض تعبير البروتين لمؤشر حاجز الأمعاء occludin. تتوافق هذه النتائج مع الدراسات السابقة11 وتؤكد الإنشاء الناجح لنموذج التهاب جيب الفئران ، مما يوفر منصة صلبة لأبحاث الأدوية والآليات اللاحقة.
Disclosures
اي.
Acknowledgements
اي
Materials
| Name | Company | Catalog Number | Comments |
| Anhydrous ethanol | Tianjin Fengchuan Chemical Reagent Technology Co., Ltd | China | Hematoxin-eosin Staining |
| Dextran Sulfate Sodium | Yeasen | 60316ES76 | Used to induce pouch inflammation |
| Formaldehyde solution | Tianjin Zhiyuan Reagent Company | China | Hematoxin-eosin Staining |
| Gauze | Jiangxi Zhonggan Medical Equipment Company | China | Used for animal microsurgery |
| Hematoxylin | Beijing Zhongshan Jinqiao Company | China | Hematoxin-eosin Staining |
| Interferon γ Detection reagent kit | Cloud-clone | SEA049Ra | Detecting inflammatory factors |
| Interleukin-10 detection kit | Cloud-clone | SEA056Ra | Detecting inflammatory factors |
| Interleukin-17 detection kit | Cloud-clone | SEA063Ra | Detecting inflammatory factors |
| Interleukin-6 detection kit | Cloud-clone | SEA079Ra | Detecting inflammatory factors |
| Iodophor | Tangpai Medical Equipment Co., Ltd | China | Used for animal microsurgery |
| Microscopic manipulation instruments | Aesculap | Germany | Used for animal microsurgery |
| Occludin | abcam | ab216327 | Immunohistochemical testing |
| Sewing needle | Yangzhou Fuda Medical Equipment Co., Ltd | China | Used for animal microsurgery |
| tumor necrosis factor α Detection reagent kit | Cloud-clone | SEA133Ra | Detecting inflammatory factors |
| Two person binocular surgical microscope | OPTON | Germany | Used for animal microsurgery |
| Xylene | Tianjin Yingda Rare and Precious Reagent Factory | China | Hematoxin-eosin Staining |
References
- Yang, M. L., Brar, M. S., Kennedy, E. D., De Buck Van Overstraeten, A. Laparoscopic versus transanal IPAA for ulcerative colitis: A patient-centered treatment trade-off study. Dis Colon Rectum. 67 (1), 107-113 (2024).
- Aktas, M. K., et al. Current status and surgical technique for restorative proctocolectomy with ileal pouch-anal anastomosis. Balkan Med J. 40 (4), 236-243 (2023).
- Zhao, L., et al. Microbiota DNA translocation into mesentery lymph nodes is associated with early development of pouchitis after ipaa for ulcerative colitis. Diseases of the Colon & Rectum. 66 (11), e1107-e1118 (2022).
- Ng, S. C., et al. Worldwide incidence and prevalence of inflammatory bowel disease in the 21st century: A systematic review of population-based studies. Lancet. 390 (10114), 2769-2778 (2017).
- Pardi, D. S., D'haens, G., Shen, B., Campbell, S., Gionchetti, P. Clinical guidelines for the management of pouchitis. Inflamm Bowel Dis. 15 (9), 1424-1431 (2009).
- Shen, B., et al. Treatment of pouchitis, Crohn's disease, cuffitis, and other inflammatory disorders of the pouch: Consensus guidelines from the international ileal pouch consortium. Lancet Gastroenterol Hepatol. 7 (1), 69-95 (2022).
- Dalal, R. L., Shen, B., Schwartz, D. A. Management of pouchitis and other common complications of the pouch. Inflamm Bowel Dis. 24 (5), 989-996 (2018).
- Li, K. Y., et al. A new rat model of pouchitis after proctocolectomy and ileal pouch-anal anastomosis using 2,4,6-trinitrobenzene sulfonic acid. J Gastrointest Surg. 25 (6), 1524-1533 (2021).
- Drzymala-Czyz, S., et al. Discrepancy between clinical and histological effects of dha supplementation in a rat model of pouchitis. Folia Histochem Cytobiol. 50 (1), 125-129 (2012).
- Santiago, P., Barnes, E. L., Raffals, L. E. Classification and management of disorders of the J pouch. Am J Gastroenterol. 118 (11), 1931-1939 (2023).
- Lichtman, S. N., Wang, J., Hummel, B., Lacey, S., Sartor, R. B. A rat model of ileal pouch-rectal anastomosis. Inflamm Bowel Dis. 4 (3), 187-195 (1998).
- Guarner, F. Inulin and oligofructose: Impact on intestinal diseases and disorders. Br J Nutr. 93, Suppl 1 S61-S65 (2005).
- Kim, C. J., et al. L-tryptophan exhibits therapeutic function in a porcine model of dextran sodium sulfate (DSS)-induced colitis. J Nutr Biochem. 21 (6), 468-475 (2010).
- Valatas, V., Bamias, G., Kolios, G. Experimental colitis models: Insights into the pathogenesis of inflammatory bowel disease and translational issues. Eur J Pharmacol. 759, 253-264 (2015).
- Letson, H. L., Morris, J., Biros, E., Dobson, G. P. Conventional and specific-pathogen free rats respond differently to anesthesia and surgical trauma. Sci Rep. 9 (1), 9399(2019).
- Gu, Y., et al. Saccharomyces boulardii, a yeast probiotic, inhibits gut motility through upregulating intestinal serotonin transporter and modulating gut microbiota. Pharmacol Res. 181, 106291(2022).
- Akiyama, S., et al. Endoscopic phenotype of the j pouch in patients with inflammatory bowel disease: A new classification for pouch outcomes. Clin Gastroenterol Hepatol. 20 (2), 293-302 (2022).
- Hata, K., et al. Pouchitis after ileal pouch-anal anastomosis in ulcerative colitis: Diagnosis, management, risk factors, and incidence. Dig Endosc. 29 (1), 26-34 (2017).
- Gallo, G., Kotze, P. G., Spinelli, A. Surgery in ulcerative colitis: When? How. Best Pract Res Clin Gastroenterol. 32-33, 71-78 (2018).
- Parks, A. Proctocolectomy without ileostomy for ulcerative colitis. BMJ. 2, 85-88 (1978).
- Shebani, K. O., et al. Pouchitis in a rat model of ileal J pouch-anal anastomosis. Inflamm Bowel Dis. 8 (1), 23-34 (2002).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved