Method Article
Canlı Hücrelerde CRAF'ın 14-3-3 Proteinleri ile Etkileşimlerinin Ölçülmesi için Biyolüminesans Rezonans Enerji Transferi (BRET) Tabanlı Test
Bu Makalede
Özet
Bu protokol, canlı hücrelerde CRAF kinazın 14-3-3 proteinleri ile etkileşimlerini ölçmek için BRET tabanlı bir testi tanımlar. Protokol, hücrelerin hazırlanması, BRET emisyonlarının okunması ve veri analizi için adımların ana hatlarını çizmektedir. Tahlil optimizasyonu için uygun kontrollerin tanımlanması ve sorun gidermenin yer aldığı örnek bir sonuç da sunulmaktadır.
Özet
CRAF, RAS GTPazların birincil efektörüdür ve KRAS kaynaklı çeşitli kanserlerin tümör oluşumunda kritik bir rol oynar. Ek olarak, CRAF, gelişimsel RASopati, Noonan sendromuna neden olduğu gösterilen germ hattı mutasyonları için bir sıcak noktadır. Tüm RAF kinazlar, 14-3-3 düzenleyici proteinler için çoklu fosforilasyona bağlı bağlanma bölgeleri içerir. 14-3-3'ün bu bölgelere diferansiyel bağlanması, sinyalleşme koşulları altında plazma zarında aktif RAF dimerlerinin oluşumunda ve hareketsiz koşullar altında RAF otoinhibisyonunun sürdürülmesinde önemli roller oynar. Bu etkileşimlerin nasıl düzenlendiğini ve nasıl modüle edilebileceğini anlamak, RAF fonksiyonunu hedefleyen yeni terapötik yaklaşımları belirlemek için kritik öneme sahiptir. Burada, CRAF'ın canlı hücrelerde 14-3-3 proteinleri ile etkileşimlerini ölçmek için biyolüminesans rezonans enerji transferi (BRET) tabanlı bir testi anlatıyorum. Spesifik olarak, bu tahlil, bir Nano lusiferaz donörüne kaynaşmış CRAF ve bir Halo etiket alıcısına kaynaşmış 14-3-3'ün etkileşimlerini ölçer, burada RAF ve 14-3-3'ün etkileşimi, vericiden alıcıya enerji transferi ve BRET sinyalinin üretilmesi. Protokol ayrıca, bu sinyalin, yüksek afiniteli RAF yerleştirme bölgelerinin her birine 14-3-3 bağlanmasını önlediği gösterilen mutasyonlar tarafından bozulabileceğini göstermektedir. Bu protokol, BRET emisyonlarını okumak, veri analizi yapmak ve protein ekspresyon seviyelerini doğrulamak için ayrıntılı talimatlarla birlikte hücrelerin tohumlanması, transfekte edilmesi ve yeniden kaplanması prosedürlerini açıklar. Ek olarak, optimizasyon ve sorun giderme adımlarıyla birlikte örnek tahlil sonuçları sağlanır.
Giriş
RAF kinazlar (ARAF, BRAF ve CRAF), RAS, GTPazların doğrudan efektörleri ve pro-proliferatif / pro-hayatta kalma yanlısı RAF-MEK-ERK kinaz kaskadının başlatıcı üyeleridir. Son çalışmalar, CRAF ekspresyonunun küçük hücreli dışı akciğer kanseri ve pankreas duktal adenokarsinomu 1,2,3,4,5 dahil olmak üzere KRAS kaynaklı çeşitli kanserlerin tümörijenezinde anahtar bir rol oynadığını göstermiştir. Ayrıca, germline CRAF mutasyonları, RASopati'nin özellikle şiddetli bir formu olan Noonan sendromunaneden olur 6,7. CRAF regülasyonunu anlamak, hücrelerdeki işlevini hedefleyen başarılı terapötik yaklaşımlar geliştirmek için kritik öneme sahiptir.
Tüm RAF kinazlar, aktivitesini kontrol eden bir C-terminal katalitik (CAT) alanı ve bir N-terminal düzenleyici (REG) alanı olmak üzere iki fonksiyonel alana ayrılabilir (Şekil 1A)8. REG alanı, RAS bağlama alanını (RBD), sistein açısından zengin alanı (CRD) ve serin/treonin açısından zengin bir bölgeyi (S/T-zengin) kapsar. Özellikle, S/T açısından zengin bölge, fosforilasyona bağlı bir şekilde 14-3-3'e bağlanan N' bölgesini içerir (CRAF'ta S259; Şekil 1A) 8. CAT alanı, C' bölgesi olarak adlandırılan ikinci bir yüksek afiniteli 14-3-3 yerleştirme bölgesi ile birlikte kinaz alanını kapsar (CRAF'ta S621; Şekil 1A) 8. Dimerik 14-3-3 proteinlerinin CRD ile birlikte N' ve C' bölgelerine diferansiyel bağlanması, hem RAF aktivasyonunda hem de inhibisyonda kritik rol oynar 9,10,11,12,13. Normal sinyalleşme koşulları altında, RAF aktivasyonu, RAS tarafından plazma zarına alınmasıyla başlatılır ve BRAF-CRAF heterodimerinin baskın aktif form14,15 olduğu aktif dimerler oluşturmasına izin verir. Dimerik BRAF'ın kriyojenik elektron mikroskobu (Cryo-EM) yapıları ile birlikte BRAF ve CRAF ile yapılan biyokimyasal analizler, bir 14-3-3 dimerinin, her iki RAF protomerinin C' bölgesine aynı anda bağlanarak aktif RAF dimerlerini stabilize ettiğini göstermektedir (Şekil 1B)9,13,16,17. Tersine, çalışmalar, hareketsiz koşullar altında, RAF'ın, REG alanının CAT alanına bağlandığı veaktivitesini 12,18,19,20 inhibe ettiği sitozolik, otoinhibe edilmiş bir onay benimsediğini göstermiştir. Bu kapalı durum, REG alanındaki CRD ve N' bölgesine ve CAT alanındaki C' bölgesine bağlı bir 14-3-3 dimer ile stabilize edilir (Şekil 1B)10,13,21. BRAF'ta bu model, otoinhibe edilmiş BRAF monomerlerinin son Cryo-EM yapıları ve önceki biyokimyasal çalışmalarımız 10,12,13,21,22 tarafından desteklenmektedir. Bununla birlikte, 14-3-3'ün CRAF düzenlemesi23'te inhibe edici bir rol oynadığı gösterilirken, BRAF benzeri bir otoinhibe edilmiş durum, CRAF düzenlemesi12'de daha az rol oynayabilir; bu nedenle, 14-3-3 proteinlerinin CRAF aktivitesini düzenlediği mekanizmaları açıklığa kavuşturmak için daha fazla çalışmaya ihtiyaç vardır. RAF kinazların 14-3-3 aracılı regülasyonu, çok sayıda RAF fosforilasyonu ve fosforilasyon de-fosforilasyon olayı, çeşitli düzenleyici proteinlere bağlanma ve plazma zarı8 ile etkileşimler gerektirir. Bu nedenle, 14-3-3-RAF etkileşimlerinin fizyolojik olarak ilgili koşullar altında ve sağlam bir lipid çift tabakasının varlığında ölçülmesi kritik öneme sahiptir.
Bu sorunu ele almak için, NanoBRET (bundan sonra N-BRET olarak anılacaktır; kit detayları için Malzeme Tablosuna bakınız) teknolojisi, CRAF'ın canlı hücrelerdeki 14-3-3 proteinleri ile etkileşimlerini ölçmek için yakınlık tabanlı bir test geliştirmek üzere kullanılmıştır (Şekil 1C). Bu BRET tabanlı sistem, Halo618 enerji alıcı ligand22,24 ile etiketlemek için bir proteinin bir nanolusiferaz (Nano) donörü ve diğerinin bir Halo etiketi ile etiketlendiği iki ilgilenilen proteinin (POI) etkileşimlerini ölçer. İlgilenilen proteinlerin etkileşimi, vericiden alıcıya enerji transferi ile sonuçlanır ve bu da BRET sinyalini üretir (Şekil 1C). Son derece parlak Nano donör proteini (emisyon (em) 460 nm) ve Halo618 ligandı (em 618 nm), geleneksel BRET'e göre daha fazla spektral ayırma ve hassasiyet sağlar, bu da onu daha zayıf etkileşimleri incelemek ve bağlanmadaki ince değişiklikleri tespit etmek için ideal bir platform haline getirir24. Gerçekten de, daha önce RAF REG ve CAT alanlarının otoinhibitör etkileşimlerini ölçmek için N-BRET tabanlı bir test geliştirdik, bu da BRAF CRD'deki bir RASopati mutasyonları panelinin karakterizasyonu için gerekliydi ve bu alanın otoinhibisyonu sürdürmek ve yapısal BRAF aktivasyonunu önlemek için kritik önemini gösterdik12.
Burada açıklanan tahlil, bir N-terminal Nano etiketine (Nano-CRAF) kaynaşmış CRAF ve C-terminal Halo etiketine (14-3-3ζ-Halo) kaynaşmış 14-3-3'ün zeta izoformunun etkileşimlerini ölçer; Şekil 1C). Nano-CRAF'ın 14-3-3ζ-Halo ile etkileşimlerinin sağlam bir BRET sinyali ürettiğini ve bunun da 14-3-3'ün N' bölgesine (S259A) ve/veya C' bölgesine (S621A) bağlanmasını önleyen mutasyonlar tarafından bozulabileceğini gösteriyoruz. Aşağıdaki protokol, bu testi gerçekleştirmek, optimize etmek ve sorun gidermek için ayrıntılı adımlar sağlar.
Protokol
NOT: Bu test 293FT hücrelerde gerçekleştirilir. İnsan embriyonik böbrek hücrelerinden türetilen, iyi karakterize edilmiş ve kolayca transfekte edilebilir bir epitel hattı. Bu hücrelerin tek bir birleşik 10 cm'lik kültür kabı tipik olarak 20 oyuklu 6 oyuklu doku kültürü plakalarının tohumlanması için yeterli hücre sağlar. Adım 1-3, biyolojik bir güvenlik kabininde steril teknik kullanılarak gerçekleştirilmelidir.
1. Hücre tohumlama (1. Gün)
NOT: Bu adımda, hücreler doku kültürü kabından/kaplarından ayrılır, sayılır ve 2. adımda transfeksiyon için 6 oyuklu doku kültürü plakalarına ekilir (Şekil 2).
- Ortamı 10 cm'lik tabaktaki hücrelerden aspire edin. Hücreleri 5 mL fosfat tamponlu salin (PBS) ile yıkayın ve aspire edin.
- 1 mL tripsin-etilendiamintetraasetik asit (EDTA) ekleyin ve hücreleri tabaktan ayırmak için 37 ° C'de 3-5 dakika inkübe edin.
- Tripsini nötralize etmek için hücrelere 9 mL tam Dulbecco'nun modifiye kartal ortamını (DMEM) ekleyin ve homojen bir tek hücre süspansiyonu oluşturmak için tekrar tekrar yukarı ve aşağı pipetleyin.
- Hemen 20 μL hücreyi 1.7 mL'lik bir tüpe aktarın ve 20 μL tripan mavisi lekesi ile karıştırın. Otomatik bir hücre sayacı (Malzeme Tablosu) veya hemositometre kullanarak hücreleri sayın.
- Hücreleri tam DMEM ortamında 2 x 105 hücre / mL'ye seyreltin ve 6 oyuklu bir doku kültürü plakasının (4 x 105 hücre / oyuk) her bir oyuğuna 2 mL ekleyin. Hücreleri gece boyunca 37 ° C ve% 10 CO2'de inkübe edin.
NOT: 20x'ten daha az geçiş yapmış 293FT hücrelerin kullanılması önerilir. Daha önce, daha büyük geçiş sayılarına sahip hücrelerin kullanılmasının, BRET oranlarının azalmasına ve kuyudan kuyuya sinyal değişkenliğinin artmasına neden olabileceğini bulmuştük.
2. Hücre transfeksiyonu (2. Gün)
NOT: Burada hücreler, pCDNA3.1 boş vektörü ile birlikte pCMV5-NanoLuc-CRAF ve pCMV5-14-3-3ζ-Halo ekspresyon yapıları ile transfekte edilir (Şekil 2).
- Transfeksiyondan önce, N-BRET plazmitlerini 5 ng / μL'ye ve pCDNA3.1'i 100 ng / μL'ye seyreltin ve bir dizi steril 1.7 mL tüp numaralandırın.
- Her tüpe 5 ng pCMV5-NanoLuc-CRAF, 10 ng pCMV5-14-3-3ζ ve 200 ng PCDNA3.1 ile birlikte 100 μL transfeksiyon ortamı (ayrıntılar için Malzeme Tablosuna bakınız) ekleyin.
- 2 μL transfeksiyon reaktifi ekleyin (ayrıntılar için Malzeme Tablosuna bakın) ve karıştırmak için hafifçe girdaplayın. Tüm sıvının tüplerin dibinde toplandığından emin olmak için tüpleri bir mikrosantrifüjde kısa bir süre döndürün ve ardından yaklaşık 25 ° C'de 15 dakika inkübe edin.
- Transfeksiyon komplekslerini hücrelere damla damla ekleyin ve Halo ve Nano etiketli proteinlerin eksprese edilmesini sağlamak için 16-20 saat boyunca 37 °C /% 10 CO2'de inkübe edin.
NOT: Boş bir vektör (pCDNA3.1) taşıyıcı DNA'nın eklenmesi, N-BRET ekspresyon yapılarının yüksek transfeksiyon verimliliğini elde etmek için gereklidir. Boş vektör eklenememesi, 14-3-3ζ-Halo ve Nano-CRAF proteinlerinin ekspresyon seviyelerinin azalmasına neden olur ve daha önce tartışıldığı gibi zayıf ve tutarsız BRET oranlarına neden olur22.
3. Hücre yeniden kaplaması (3. Gün)
NOT: Bu adımda, hücreler 384 oyuklu bir plakaya ve Halo 618 ligandına (+ligand; Malzeme Tablosu) veya 4. adımda BRET emisyonlarını okumak için DMSO (+araç) eklenir. Kalan hücreler, Adım 5'te western blot analizi için taze 6 oyuklu kültür plakalarına aktarılır (Şekil 2).
- Aşağıdaki malzemeleri toplayın ve çalışma alanını aşağıda anlatıldığı gibi hazırlayın.
- 37 °C'lik bir su banyosu kullanarak, hem serumsuz Tahlil Ortamı hem de %10 FBS takviyeli Tahlil Ortamı ile birlikte önceden ısıtılmış tripsin-EDTA (ayrıntılar için Malzeme Tablosuna bakın).
- Ölçülecek numune sayısına bağlı olarak, üç set steril 1,7 mL tüp (Set 1-3) ve bir set steril 15 mL konik alt tüp ön etiketleyin. Döner kovalı bir santrifüjü 15 mL tüp ekleri ile donatın ve 4 °C'ye kadar önceden soğutun.
- Doku kültürü başlığına aşağıdaki öğeleri yerleştirin: reaktif rezervuarları, 384 oyuklu doku kültürü plakaları, 6 oyuklu doku kültürü plakaları, çok kanallı bir pipet ve uçlar, hücre sayma slaytları/odaları ve tripan mavisi lekesi (Malzeme Tablosu), 1,7 mL tüp Setleri 1-3 ile birlikte.
- Hücreleri aşağıda açıklandığı gibi toplayın ve sayın.
- Ortamı 6 oyuklu plakalardan aspire edin ve hücrelere 250 μL tripsin-EDTA ekleyin. 6 oyuklu plakaları, hücreler ayrılmaya başlayana kadar (3-5 dakika) 37 ° C'de inkübe edin.
- Tripsini nötralize etmek için her bir oyuğa 1 mL %10 FBS takviyeli tahlil ortamı ekleyin ve tek hücreli bir süspansiyon oluşturmak için kuvvetlice yukarı ve aşağı pipetleyin.
- 1 mL hücre süspansiyonunu önceden etiketlenmiş 15 mL'lik tüplere aktarın. 15 mL'lik tüplerin her birine 1 mL daha %10 FBS takviyeli tahlil ortamı ekleyin.
- Karıştırmak için tüpleri 5x ters çevirin ve hemen 20 μL hücre süspansiyonunu tüp Set 1'e aktarın.
- Önceden soğutulmuş salıncak kova santrifüjünde ~ 250 x g'da 5 dakika santrifüjleyin. Santrifüjleme aşaması sırasında, 20 μL tripan mavisi hücre boyasını tüp seti 1'deki hücrelerle karıştırın ve ardından otomatik bir hücre sayacı veya hemositometre kullanarak hücreleri sayın. 6-8 x 105 hücre / mL'lik bir verim tipiktir.
- 15 mL'lik tüpleri santrifüjden çıkarın ve ortamı hücre peletlerinden aspire edin. Hücre peletlerini serumsuz tahlil ortamında 2 x 105 hücre / mL'ye yeniden süspanse edin ve tek hücreli bir süspansiyon oluşturmak için kuvvetlice pipetleyin.
NOT: Serum içermeyen Tahlil Ortamının kullanımı, normal hücre sinyal yollarını susturmak için kullanılır.
- 384 oyuklu ve 6 oyuklu plakalardaki hücreleri aşağıda açıklandığı gibi yeniden plakalayın.
- Homojen bir hücre süspansiyonu sağlamak için 15 mL'lik tüpleri birkaç kez ters çevirin ve 500 μL'yi 1.7 mL'lik tüplere set 2 ve set 3'e aktarın.
- Set 2'ye 0,5 μL DMSO (+araç) ve tüp seti 3'e 0,5 μL Halo 618 ligandı (+ligand) ekleyin ve karıştırmak için pipetleyin.
- +Araç ve + ligand hücresi süspansiyonlarını reaktif rezervuarlarının ayrı kuyularına aktarın. Çok kanallı pipeti (Malzeme Tablosu) kullanarak, reaktif rezervuarlarından 40 μL + araç hücresi süspansiyonunu 384 oyuklu kültür plakasının dört katlı kuyularına aktarın. +ligand hücresi süspansiyonları için bu adımı tekrarlayın.
- Kalan hücreleri taze 6 oyuklu kültür plakalarına aktarın. 384 oyuklu ve 6 oyuklu plakaları gece boyunca 37 °C ve% 5 CO2'de inkübe edin.
4. BRET emisyonlarının okunması (4. Gün)
NOT: Bu adımda, nanolusiferaz substratı (ayrıntılar için Malzeme Tablosuna bakınız) 384 oyuklu kültür plakasındaki hücrelere eklenir ve N-BRET alıcısı (618 nm) ve donör (460 nm) emisyonları okunur (Şekil 2). Düzeltilmiş BRET oranları daha sonra hesaplanır.
- Serumsuz tahlil ortamını 37 °C'lik bir su banyosunda önceden ısıtın ve nanolusiferaz substratını 25 °C'de çözün. Nanolusiferaz substratını serum içermeyen tahlil ortamında 1:100 oranında seyreltin ve bir reaktif rezervuarına aktarın. 384 oyuklu plakanın her bir oyuğuna 10 μL artı %10-15 ekstra hacim eklemek için bu karışımdan yeterince hazırlayın.
- Çok kanallı bir pipet (Malzeme Tablosu) kullanarak, 10 μL substrat karışımını 384 oyuklu kültür plakasındaki hücreleri içeren oyukların her birine aktarın. Plakayı manuel olarak veya bir orbital çalkalayıcı kullanarak 1 dakika boyunca yavaşça döndürün.
- 384 kuyulu plakayı çok modlu plaka okuyucuya yerleştirin ve hücre içeren tüm kuyucuklar için 460 nm ve 618 nm emisyonları kaydedin.
NOT: Bu adım için kullanılan çok modlu plaka okuyucu için (ayrıntılar için Malzeme Tablosuna bakın), 6.5 sn okuma süresi ölçümü ile 0.1 mm'lik bir okuma yüksekliği kullanılmıştır, ancak diğer plaka okuyucular kullanılıyorsa daha fazla optimizasyon gerekebilir. - Aşağıdaki denklemi kullanarak +araç ve +ligand için ham BRET oranlarını miliBRET birimleri (mBU) cinsinden ayrı ayrı hesaplayın:
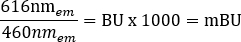
- +Araç BRET oranını +Ligand'ınkinden çıkararak düzeltilmiş BRET oranını hesaplayın (Ek Tablo 1).
NOT: Birden fazla deneyin sonuçlarını karşılaştırırken, düzeltilmiş BRET oranları bir araya getirilebilir ve Nano-CRAFWT ve 14-3-3ζ WT-Halo'dan oluşan Wildtype (WT) N-BRET çiftinin ortalamasına normalleştirilebilir (Ek Tablo 1).
5. Protein ekspresyon seviyelerinin doğrulanması (4. ve 5. günler)
NOT: Bu adımda, 6 oyuklu plakalardaki hücreler parçalanır ve Nano-CRAF ve 14-3-3ζ-Halo proteinlerinin protein ekspresyon seviyeleri, Halo ve Nano etiketlerine özgü antikorlar kullanılarak western blot analizi ile belirlenir. (Şekil 2).
- NP40 lizis tamponuna (Malzeme Tablosu) proteaz ve fosfataz inhibitörleri ekleyin ve numune başına 200 μL lizis tamponuna izin verin.
- Hücre içeren 6 oyuklu plakalardan ortamı aspire edin. Hücreleri bir kez 1 mL soğuk PBS ile yıkayın ve aspire edin.
- Her bir oyuğa 125 μL NP40 lizis tamponu ekleyin ve hücreleri parçalamak için 6 oyuklu plakaları 4 ° C'de sallanan bir platformda 15 dakika inkübe edin.
- Lizatları buz üzerinde 1.7 mL'lik tüplere aktarın ve 4 ° C'de 10 dakika boyunca 20.000 x g'da santrifüjleyin. Temizlenmiş lizatları tekrar buzun üzerine yerleştirin ve Bradford veya Biskinkoninik asit (BCA) tahlilleri gibi ticari olarak mevcut tahlilleri kullanarak protein konsantrasyonunu belirleyin.
- Uygun hacimde lizat ve NP40 lizis tamponunu taze 1.7 mL'lik tüplere toplam 100 μL hacme aktararak tüm numunelerdeki protein konsantrasyonunu normalleştirin.
- 5x protein numune tamponunu (Malzeme Tablosu) 1 dakika kaynatın ve her numuneye 25 μL ekleyin. Numuneleri 5-6 dakika kaynatın ve ardından tüm numunenin tüpün tabanında toplandığından emin olmak için tüpleri kısa bir süre santrifüjleyin.
- Çift protein jellerinin (Jel 1 ve Jel 2) her bir oyuğuna 25 μL numune yükleyin ve daha sonra proteinleri, daha önce tarif edildiği gibi standart western blotlama prosedürlerini kullanarak nitroselüloz veya PVDF membranlarına aktarın22.
- Membranları 30 dakika boyunca 25 ° C'de% 3 BSA-PBS'de bloke edin ve daha sonra membranları gece boyunca Halo antikoru (1: 1.000 seyreltme; Jel 1) ve nanolusiferaz veya CRAF antikoru (1:500 seyreltme; Jel 2) tris tamponlu salin içinde,% 0.2 Tween-20 (TBST; Malzeme Tablosu).
- Membranları 10 mL TBST'de 5 dakika boyunca 1x yıkayın ve daha sonra TBST'de 1: 10.000 oranında seyreltilmiş anti-fare HRP ikincil antikoru ile oda sıcaklığında 1 saat inkübe edin.
- Membranları 3x sallanan bir platformda 10 mL TBST'de 25 ° C'de her biri 5 dakika boyunca yıkayın. TBST'yi çıkarın ve ECL reaktifleri ve bir X-ışını film işlemcisi veya başka bir uygun görüntüleme sistemi kullanarak protein bantlarını görselleştirin.
Sonuçlar
Bu protokolde açıklandığı gibi gerçekleştirildiğinde (Şekil 2), Nano-CRAFWT ve 14-3-3ζ-Halo'nun etkileşimi, 50-60 mBU'luk düzeltilmiş BRET oranları üretmelidir (Şekil 3A; Ek Tablo 1). CRAF, N' bölgesi ve C' bölgesi olmak üzere iki fosforilasyona bağlı 14-3-3 yerleştirme bölgesi içerir (Şekil 1)8. Bu nedenle, CRAF: 14-3-3ζ bağlanmasını azaltmak için uygun kontroller, fosforilasyonu önleyen S259A ve S621A'yı ve sırayla 14-3-3'ün sırasıyla N' ve C' bölgelerinebağlanmasını içerir 25. Şekil 3A'da gösterildiği gibi, Nano-CRAFS259A , BRET sinyalini ~%45 ve Nano-CRAFS621A'yı ~%25 azaltırken, S259A/S621A (SS/AA) çift mutant, CRAF:14-3-3 BRET sinyalini neredeyse tamamen keser. Ek olarak, birden fazla bağımsız deneyin sonuçları, önce her deneyin sonuçlarını ortalama düzeltilmiş BRET oranına (Ek Tablo 1) normalleştirerek ve ardından her üç deneyden elde edilen veri noktalarını bir araya getirerek (Şekil 3B) karşılaştırılabilir. Etiketli proteinlerin nispi ekspresyon seviyeleri de western blot analizi ile doğrulanmalıdır (Şekil 3). Mutant proteinlerin ekspresyon seviyelerinin, mutant DNA vektörlerinin transfekte edilen miktarlarının buna göre ayarlanmasını gerektiren WT'den farklı olabileceğini unutmayın (Ek Tablo 1).
Ayrıca, özellikle alternatif bir plaka okuyucu, hücre hatları veya transfeksiyon reaktifleri kullanıldığında, bu protokolün optimizasyonunun gerekli olabileceğine dikkat edilmelidir. Şekil 4A , pCMV5-14-3-3ζ-Halo alıcı plazmidinin transfekte edilen miktarının arttırılmasının, pCMV5-NanoLuc-CRAF donör miktarını sabit tutarken, dozun bağlı olarak BRET sinyalini arttırdığı ve daha sonra 14-3-3-bağlayıcı eksik CRAFSS/AA mutantının varlığı ile azaltıldığı örnek bir optimizasyon deneyinin sonuçlarını göstermektedir. Bununla birlikte, alıcı-donör oranı çok yüksekse, Nano-CRAFWT'ye 14-3-3ζ-Halo bağlanması ile Nano-CRAFSS / AA negatif kontrolü arasındaki sinyal farkı azalacak, muhtemelen Nano-CRAFWT'nin bağlanma doygunluğunu yansıtacaktır. Ek olarak, düşük standart hata ile tekrarlanabilir değerler üreten bir BRET oranı elde edildiğinde, alıcı-donör oranında daha fazla artış gereksizdir. Gerçekten de, bu tahlillerin en büyük avantajlarından biri, proteinlerin fizyolojik ifade seviyelerindeki etkileşimlerini ölçme yeteneğidir. Yeni N-BRET tahlilleri geliştirirken, göz önünde bulundurulması gereken bir diğer önemli husus da etiket yerleşimidir. Şekil 4B , Halo etiketinin C-terminalinden 14-3-3ζ N-terminaline geçirilmesinin, Nano-CRAFWT ve Nano-CRAFSS/AA'ya 14-3-3ζ bağlanmasıyla oluşturulan düzeltilmiş BRET oranları üzerindeki etkisini göstermektedir. Bu amaçla, olası etiket konumlarının her biri için DNA ekspresyon yapıları oluşturulmalıdır (Şekil 4C) ve bunların hem WT çiftinin hem de bağlanma için bilinen bir negatif kontrolün BRET oranları üzerindeki etkileri değerlendirilmelidir.

Şekil 1: 14-3-3 proteinleri tarafından RAF regülasyonu. (A) Korunmuş 14-3-3 yerleştirme yerleri ile RAF kinaz alan yapısı şematik belirtilmiştir. (B) 14-3-3 proteinleri tarafından RAF düzenleme modelleri. (C) Bir C-terminal Halo etiket alıcısına kaynaşmış 14-3-3ζ ve bir N-terminal Nano vericiye kaynaşmış CRAF'ın etkileşimlerini ölçen N-BRET testi. Donörden alıcıya enerji transferi BRET sinyalini üretir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: CRAF:14-3-3 canlı hücre BRET tabanlı testi gerçekleştirmek için temel adımlar. Bu protokolde özetlenen beş ana adım gösterilmiştir: hücrelerin tohumlanması, transfekte edilmesi ve yeniden kaplanması, BRET sinyalini okuma ve Halo ve Nano etiketli proteinlerin ekspresyon seviyelerini doğrulama yöntemleri ile birlikte. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: CRAF:14-3-3 BRET bazlı test. 14-3-3ζ-Halo'nun Nano-CRAF -WT veya -S259A, -S621A ve -S259A/S621A (SS/AA) mutant formları ile etkileşimlerini karşılaştıran N-BRET testi, daha önce CRAF: 14-3-3 bağlanmasını bozduğu gösterilmiştir25. 14-3-3ζ-Halo (MW: 64 kDa.) ve Nano-CRAF varyantlarının (MW: 93 kDa.) ekspresyon seviyeleri western blot analizi ile incelendi. (A) Standart sapma (SD) ± tek bir deneyden dört tekrar kuyusundan düzeltilmiş BRET okumaları. (B) Üç bağımsız deneyden elde edilen düzeltilmiş BRET okumaları bir araya getirildi ve Nano-CRAFWT'ye (100'e ayarlandı) ± SD'ye normalleştirildi. İstatistiksel anlamlılık, Student t testi ile hesaplandı (iki kuyruklu, eşit varyans varsayarak). sayfa <0.0001. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
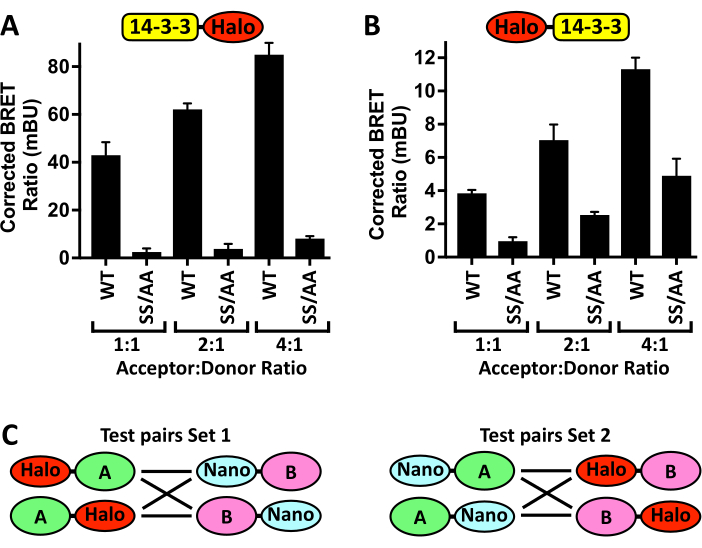
Şekil 4: Tahlil optimizasyon adımları. Artan miktarlarda (A) 14-3-3ζ-Halo veya (B) Halo-14-3-3ζ'nin sabit miktarda Nano-CRAF -WT veya -SS/AA (S259A/S621A) ile birlikte transfekte edilmesinin BRET sinyali ± SD üzerindeki etkileri. (C) Halo veya Nano etiketinin ilgilenilen her proteinin (A ve B) N-terminaline veya C-terminaline yerleştirilmesiyle oluşturulan tüm olası N-BRET çiftlerinin şeması. n = 4 olur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Tablo 1: CRAF:14-3-3 BRET tabanlı testten alınan örnek veriler. Belirtilen ifade yapıları, 2. günde (üst bölüm) hücrelere transfekte edildi. Ham, düzeltilmiş ve normalleştirilmiş BRET okumaları 4. günde ölçüldü ve hesaplandı (alt bölüm). Bu dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Önceki çalışmalar, 14-3-3 proteinlerinin RAF kinazların hem aktivasyonunda hem de inhibisyonunda kritik rol oynadığını göstermiştir. Bu bağlanma olaylarının nasıl düzenlendiğini ve bu etkileşimleri modüle etmenin RAF sinyalizasyonu ve RAF güdümlü onkogenez üzerindeki etkilerini anlamak, CRAF fonksiyonunu hedef alan yeni terapötik güvenlik açıklarını ortaya çıkarabilir. Bununla birlikte, Raf aktivasyon döngüsü, çok sayıda ilişkili protein, translasyon sonrası modifikasyonlar ve hücre altı lokalizasyonundakideğişiklikler 8 tarafından desteklenir ve bu nedenle bu koşulları tam olarak özetlemek için, RAF'ın düzenleyicileri ile etkileşimleri canlı hücre koşulları altında ölçülmelidir. Bu protokol, canlı hücrelerde 14-3-3ζ ve CRAF etkileşimlerini ölçmek için nanolusiferaz-Halo N-BRET çiftinin üstün sinyal-gürültü oranını ve spektral çözünürlüğünü kullanan yeni bir yakınlık tabanlı testi tanımlar.
Bu tahlil, fizyolojik olarak ilgili koşullar altında 14-3-3 ve CRAF'ın karmaşık etkileşimlerini incelemek için çok ihtiyaç duyulan bir platform sağlarken, dikkate alınması gereken bir dizi sınırlamaya sahiptir. İlk olarak, 14-3-3'ün hem RAF otoinhibisyonunda hem de dimerizasyonda rol oynadığı gösterilmiştir8, bu durumları ayırt etmek için ek kontroller ve deneysel yaklaşımlar dahil edilebilir. Örneğin, bu test, RAF otoinhibisyonundakideğişikliklerin doğrudan bir okumasını sağlayan daha önce geliştirilmiş N-BRET otoinhibisyon testi ile birlikte gerçekleştirilebilir 12,22. Ayrıca, CRAF'ın diğer RAF protomerleri15,26 ile dimerizasyonunu bozduğu gösterilen CRAF R401H mutasyonu gibi kontroller de bu fonksiyonların diseksiyonunda yararlı olabilir. Son olarak, Halo ve Nano etiketlerinin yerleşimi, CRAF: 14-3-3 etkileşimini ölçmek için optimize edilmiştir, ancak CRAF veya 14-3-3'ün diğer proteinlerle etkileşimlerinin sonuç olarak etkilenmediğini garanti edemez ve bu tahlil, CRAF: 14-3-3 bağlanmasının afinitesini, bu etkileşimlerin CRAF aktivitesi üzerindeki etkilerini veya bu etkileşimlerin meydana geldiği hücredeki konumu belirleyemez. Bu nedenle, in vitro bağlama testleri, CRAF kinaz testleri ve hücre altı lokalizasyon çalışmaları gibi diğer tamamlayıcı yaklaşımların da dahil edilmesi gerekebilir 12,27,28,29.
Bu testi veya aslında herhangi bir N-BRET bazlı testi gerçekleştirirken, dikkate alınması gereken bir dizi faktör vardır. Bu el yazmasında ve önceki çalışma22'de gösterildiği gibi, pCMV5-Halo (alıcı) ve pCMV5-Nanolusiferaz (verici) yapılarının doğru transfeksiyon oranı, POI'lerin bağlanmasını bozduğu bilinen bir mutant gibi uygun bir negatif kontrol ile birlikte, bu tahlilleri optimize etmek ve test etmek için kritik öneme sahiptir. Nano etiketli POI seviyelerini sabit tutarken Halo etiketli POI'nin ifadesini artırmak, BRET oranlarının artmasına neden olur. Bununla birlikte, bağlanma doygunluğa ulaştığında sinyal dengelenecek ve buna karşılık WT ile bağlanma bozukluğu olan POI'ler arasındaki delta azalacak ve bu da alıcı-verici optimizasyonu gerektirecektir. Tahlil optimizasyonundaki bir diğer kritik faktör, pCDNA3.1 gibi boş bir vektör taşıyıcı DNA'nın kullanılmasıdır. 200 ng pCDNA3.1'in dahil edilmesi. transfeksiyon karışımında, Halo ve Nano etiketli POI'lerin ekspresyon seviyelerini büyük ölçüde arttırır ve replikasyon kuyuları ile deneyler arasındaki değişkenliği azaltır22. Bununla birlikte, transfeksiyon verimliliğinin reaktifler ve hücre hatları arasında değişebileceği göz önüne alındığında, daha önce tarif edildiği gibi N-BRET çiftinin optimal ekspresyonunu elde etmek için taşıyıcı DNA miktarının da titre edilmesi gerekebilir22. BRET oranlarını büyük ölçüde etkileyen bir diğer faktör de etiket yerleşimidir. Gerçekten de, hangi POI'nin Halo etiketine karşı Nano etiketine kaynaştırıldığı ve bu etiketin proteinin N- veya C-terminaline yerleştirilip yerleştirilmediği, hem BRET oranının genliğini hem de negatif kontrollerin bu sinyali azaltma yeteneğini etkileyebilir. Bu nedenle, yeni tahliller geliştirirken olası N-BRET çiftlerinin her birini test etmek de önemlidir.
N-BRET tarafından konvansiyonel BRET'e göre elde edilen geliştirilmiş hassasiyet ve spektral çözünürlük, canlı hücrelerde daha zayıf etkileşimlere ve bağlanmadaki ince değişikliklerin ölçülmesine izin verir. Bununla birlikte, bu tahlillerin hücre sinyalleme olaylarını incelemek için faydası tam olarak anlaşılmamıştır. Özellikle, bu test muhtemelen 14-3-3'ün diğer RAF kinazları ARAF ve BRAF gibi diğer kinazlarla etkileşimini incelemek için uyarlanabilir ve RAS: RAF bağlanması ve RAF otoinhibisyonu 22,30'u incelemek için daha önce yayınlanmış N-BRET testleri ile birleştirildiğinde, canlı hücre koşulları altında RAF regülasyonunu ölçmek için bir araç kitinin temelini oluşturacaktır. Ek olarak, N-BRET, bir canlı hücre ilaç tarama platformu30 olarak umut vaat etmiştir ve bu nedenle bu test, inhibitörü 14-3-3 ve RAF etkileşimleri ile stabilize eden veya RAF aktivasyonunda yer alanları bozan bileşikleri tanımlamak için de kullanılabilir. Nanolusiferaz sinyalinin yüksek stabilitesi ve modern plaka okuyucuların alıcı ve verici emisyonlarını aynı anda tespit etme yeteneği göz önüne alındığında, bu tahlillerin, sinyal proteinlerinin etkileşimlerini gerçek zamanlı olarak ölçmek için uyarlanabileceği de takip edilecektir, bu da yukarı akış stimülasyonuna veya ilaç tedavilerine yanıt olarak bu etkileşimlerin dinamiklerini anlamak için kritik olacaktır.
Açıklamalar
Açıklanacak bir şey yok.
Teşekkürler
Bu proje kısmen Ulusal Kanser Enstitüsü, Ulusal Sağlık Enstitüleri'nden ZIA BC 010329 proje numarası altında federal fonlarla finanse edilmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| HaloTag® mouse monoclonal antibody | Promega | G9211 | Antibody for detecting HaloTag tagged proteins by immunoblot |
| NanoLuc® mouse monoclonal antibody | R&D Systems | MAB10026 | Antibody for detecting Nano-tagged proteins by immunoblot |
| CRAF mouse monoclonal antibody (E10) | Santa Crus Biotechnology | sc-7267 | Antibody directly detecting CRAF proteins by immunoblot |
| ECL anti-mouse HRP secondary antibody | Amersham | NA931-1ML | Secondary HRP conjugated mouse antibody (from sheep) |
| Reagents | |||
| X-tremeGENE™ 9 | Roche/Sigma | 6365809001 | |
| NanoBRET™ kit | Promega | N1661 | NanoBRET kit containing Halo 618 ligand and NanoGlo (nanoluciferase) substrate |
| DPBS, without Ca++ and Mg++ | Quality Biologicals | 114-057-101 | |
| Trypsin-EDTA (0.05%), phenol red | Life Technologies | 25300120 | |
| DMEM cell culture media | Life Technologies | 11995073 | High glucose, L-glutamine, phenol red, sodium pyruvate; without HEPES, suppliment media with 10% FBS, 2 mM L-glutamine and 100U penicillin-streptomycin |
| L-Glutamine (200 mM) | Life Technologies | 25030164 | |
| Penicillin-Streptomycin (10,000 U/mL) | Life Technologies | 15140163 | |
| Opti-MEM™ I reduced serum media | Gibco | 31985062 | For cell transfection |
| Opti-MEM reduced serum media, no phenol red | Gibco | 11058021 | For replating cells on Day 3. Supplement with 2 mM L-glutamine and 100U penicillin-streptomycin, along with 10% FBS (where indicated). |
| Invitrogen Trypan Blue Stain | Thermo Scientific | T10282 | |
| NP40 lysis buffer | N/A | N/A | 20 mM Tris (pH 8.0), 137mM NaCl, 10% glycerol, NP40 alternative (Milipore, Cat# 492016). Store at 4 degrees C.. Add the following protease and phosphatase immediately prior to use: 20 µM leupeptin, 0.5 mM sodium orthovanidate, 0.15 U/mL, 1mM PMSF. |
| 5x gel sample buffer | N/A | N/A | 240 mM Tris (pH 8.0), 9.5% SDS, 30% glycerol, 500mM DTT, 3mM bromophenol blue. Store at -20 degrees C. |
| Cell lines | |||
| 293FT cells (human) | Thermo Scientific | R70007 | |
| DNA vectors | |||
| pCMV5-Nano-CRAF WT and mutant | N/A | N/A | |
| pCMV5-14-3-3ζ-Halo | N/A | N/A | |
| Equipment | |||
| EnVision 2104 Multimode Plate Reader | PerkinElmer 2104 | 2104-0010 | 600LP NanoBRET & M460/50 nm NanoBRET emmisions filters, Luminescence 404 mirror, 6.5 mm measurement height and 0.1 s measurement time |
| Invitrogen Countess™ II Automated Cell Counter | Thermo Scientific | AMQAX1000 | |
| ThermoFisher E1-ClipTip™ Multichannel Pipettor | Thermo Scientific | 4672070 | |
| Software | |||
| GraphPad Prism (version 10.0.3) | GraphPad | www.graphpad.com | |
| Other | |||
| ThermoFisher ClipTip Multichannel pipette tips | Thermo Scientific | 94410153 | |
| Reagent Reservoir, 25 mL Divided, Sterile | Thomas Scientific | 1228K16 | |
| Perkin Elmer 384-well CulturPlate™ | PerkinElmer | 6007680 | White, polystyrene, tissue culture treated |
| Countess Cell Counting Chamber Slides | Thermo Scientific | C10228 |
Referanslar
- Blasco, R. B., et al. c-Raf, but not B-Raf, is essential for development of K-Ras oncogene-driven non-small cell lung carcinoma. Cancer Cell. 19, 652-663 (2011).
- Blasco, M. T., et al. Complete regression of advanced pancreatic ductal adenocarcinomas upon combined inhibition of EGFR and C-RAF. Cancer Cell. 35, 573-587 (2019).
- Karreth, F. A., Frese, K. K., DeNicola, G. M., Baccarini, M., Tuveson, D. A. C-Raf is required for the initiation of lung cancer by K-Ras(G12D). Cancer Discov. 1, 128-136 (2011).
- Lito, P., et al. Disruption of CRAF-mediated MEK activation is required for effective MEK inhibition in KRAS mutant tumors. Cancer Cell. 25, 697-710 (2014).
- Sanclemente, M., et al. c-RAF ablation induces regression of advanced Kras/Trp53 mutant lung adenocarcinomas by a mechanism independent of MAPK signaling. Cancer Cell. 33, 217-228 (2018).
- Razzaque, M. A., et al. Germline gain-of-function mutations in RAF1 cause Noonan syndrome. Nat Genet. 39, 1013-1017 (2007).
- Pandit, B., et al. Gain-of-function RAF1 mutations cause Noonan and LEOPARD syndromes with hypertrophic cardiomyopathy. Nat Genet. 39, 1007-1012 (2007).
- Terrell, E. M., Morrison, D. K. Ras-mediated activation of the Raf family kinases. Cold Spring Harb Perspect Med. 9 (1), 033746(2019).
- Kondo, Y., et al. Cryo-EM structure of a dimeric B-Raf:14-3-3 complex reveals asymmetry in the active sites of B-Raf kinases. Science. 366, 109-115 (2019).
- Park, E., et al. Architecture of autoinhibited and active BRAF-MEK1-14-3-3 complexes. Nature. 575 (7783), 545-550 (2019).
- Tzivion, G., Luo, Z., Avruch, J. A dimeric 14-3-3 protein is an essential cofactor for Raf kinase activity. Nature. 394, 88-92 (1998).
- Spencer-Smith, R., et al. RASopathy mutations provide functional insight into the BRAF cysteine-rich domain and reveal the importance of autoinhibition in BRAF regulation. Mol Cell. 82, 4262-4276 (2022).
- Martinez Fiesco, J. A., Durrant, D. E., Morrison, D. K., Zhang, P. Structural insights into the BRAF monomer-to-dimer transition mediated by RAS binding. Nat Commun. 13, 486(2022).
- Freeman, A. K., Ritt, D. A., Morrison, D. K. The importance of Raf dimerization in cell signaling. Small GTPases. 4, 180-185 (2013).
- Freeman, A. K., Ritt, D. A., Morrison, D. K. Effects of Raf dimerization and its inhibition on normal and disease-associated Raf signaling. Mol Cell. 49, 751-758 (2013).
- Rushworth, L. K., Hindley, A. D., O'Neill, E., Kolch, W. Regulation and role of Raf-1/B-Raf heterodimerization. Mol Cell Biol. 26, 2262-2272 (2006).
- Garnett, M. J., Rana, S., Paterson, H., Barford, D., Marais, R. Wild-type and mutant B-RAF activate C-RAF through distinct mechanisms involving heterodimerization. Mol Cell. 20, 963-969 (2005).
- Tran, N. H., Wu, X., Frost, J. A. B-Raf and Raf-1 are regulated by distinct autoregulatory mechanisms. J Biol Chem. 280, 16244-16253 (2005).
- Chong, H., Guan, K. L. Regulation of Raf through phosphorylation and N terminus-C terminus interaction. J Biol Chem. 278, 36269-36276 (2003).
- Cutler, R. E., Stephens, R. M., Saracino, M. R., Morrison, D. K. Autoregulation of the Raf-1 serine/threonine kinase. Proc Natl Acad Sci U S A. 95, 9214-9219 (1998).
- Park, E., et al. Cryo-EM structure of a RAS/RAF recruitment complex. Nat Commun. 14, 4580(2023).
- Spencer-Smith, R., Morrison, D. K. Protocol for measuring BRAF autoinhibition in live cells using a proximity-based NanoBRET assay. STAR Protoc. 4, 102461(2023).
- Clark, G. J., et al. 14-3-3 zeta negatively regulates raf-1 activity by interactions with the Raf-1 cysteine-rich domain. J Biol Chem. 272, 20990-20993 (1997).
- Machleidt, T., et al. NanoBRET--A novel BRET platform for the analysis of protein-protein interactions. ACS Chem Biol. 10, 1797-1804 (2015).
- Hekman, M., et al. Dynamic changes in C-Raf phosphorylation and 14-3-3 protein binding in response to growth factor stimulation: differential roles of 14-3-3 protein binding sites. J Biol Chem. 279, 14074-14086 (2004).
- Hatzivassiliou, G., et al. RAF inhibitors prime wild-type RAF to activate the MAPK pathway and enhance growth. Nature. 464, 431-435 (2010).
- Bondzi, C., Grant, S., Krystal, G. W. A novel assay for the measurement of Raf-1 kinase activity. Oncogene. 19, 5030-5033 (2000).
- Spencer-Smith, R., et al. Inhibition of RAS function through targeting an allosteric regulatory site. Nat Chem Biol. 13 (1), 62-68 (2016).
- Roy, S., et al. 14-3-3 facilitates Ras-dependent Raf-1 activation in vitro and in vivo. Mol Cell Biol. 18, 3947-3955 (1998).
- Durrant, D. E., et al. Development of a high-throughput NanoBRET screening platform to identify modulators of the RAS/RAF interaction. Mol Cancer Ther. 20, 1743-1754 (2021).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır