Method Article
Bioluminescence Resonance Energy Transfer (BRET) - בדיקה מבוססת למדידת אינטראקציות של CRAF עם 14-3-3 חלבונים בתאים חיים
In This Article
Summary
פרוטוקול זה מתאר בדיקה מבוססת BRET למדידת האינטראקציות של קינאז CRAF עם 14-3-3 חלבונים בתאים חיים. הפרוטוקול מתאר שלבים להכנת התאים, קריאת פליטות BRET וניתוח נתונים. מוצגת גם תוצאה לדוגמה עם זיהוי בקרות מתאימות ופתרון בעיות עבור מיטוב מבחן.
Abstract
CRAF הוא גורם משפיע עיקרי על RAS GTPases וממלא תפקיד קריטי בגידולים של מספר סוגי סרטן המונעים על ידי KRAS. בנוסף, CRAF הוא נקודה חמה למוטציות בקו הנבט, אשר הוכחו כגורמות לראסופתיה התפתחותית, תסמונת נונאן. כל הקינאזות של חיל האוויר המלכותי מכילות אתרי קישור מרובים תלויי זרחן עבור 14-3-3 חלבוני רגולציה. הקשירה הדיפרנציאלית של 14-3-3 לאתרים אלה ממלאת תפקיד חיוני ביצירת דימרים פעילים של חיל האוויר המלכותי בקרום הפלזמה בתנאי איתות ובשמירה על עיכוב עצמי של חיל האוויר המלכותי בתנאי שקט. הבנת האופן שבו אינטראקציות אלה מווסתות וכיצד ניתן לווסת אותן היא קריטית לזיהוי גישות טיפוליות חדשות המכוונות לתפקוד חיל האוויר המלכותי. במאמר זה אני מתאר בדיקה מבוססת העברת אנרגיית תהודה ביולומינסנטית (BRET) למדידת האינטראקציות של CRAF עם 14-3-3 חלבונים בתאים חיים. באופן ספציפי, בדיקה זו מודדת את האינטראקציות של CRAF שהתמזגו לתורם ננו לוציפראז ו-14-3-3 התמזגו למקבל תג Halo, כאשר האינטראקציה של RAF ו-14-3-3 גורמת להעברת אנרגיה מתורם למקבל וליצירת אות RET. הפרוטוקול מראה עוד כי אות זה יכול להיות משובש על ידי מוטציות שהוכחו כמונעות קשירה של 14-3-3 לכל אחד מאתרי העגינה של חיל האוויר המלכותי בעל זיקה גבוהה. פרוטוקול זה מתאר את הליכי הזריעה, ההדבקה והציפוי מחדש של התאים, יחד עם הוראות מפורטות לקריאת פליטות BRE, ביצוע ניתוח נתונים ואישור רמות ביטוי חלבונים. בנוסף, תוצאות בדיקה לדוגמה, יחד עם שלבי מיטוב ופתרון בעיות, מסופקים.
Introduction
קינאזות של חיל האוויר המלכותי (ARAF, BRAF ו-CRAF) הן המשפיעות הישירות של RAS GTPases והחברים היוזמים של מפל הקינאז RAF-MEK-ERK התומך בשגשוג/הישרדות. מחקרים אחרונים הראו כי ביטוי CRAF ממלא תפקיד מפתח בגידולים של מספר סוגי סרטן המונעים על ידי KRAS, כולל סרטן ריאות של תאים לא קטנים ואדנוקרצינומה של צינור הלבלב 1,2,3,4,5. יתר על כן, מוטציות CRAF נבט לגרום צורה חמורה במיוחד של RASopathy, תסמונת Noonan 6,7. הבנת ויסות CRAF היא קריטית לפיתוח גישות טיפוליות מוצלחות המכוונות לתפקודו בתאים.
ניתן לחלק את כל קינאזות חיל האוויר המלכותי לשני תחומים פונקציונליים, תחום C-terminal catalytic (CAT) ותחום N-terminal regulatory (REG), השולט בפעילותו (איור 1A)8. תחום REG כולל את תחום הקישור RAS (RBD), תחום עשיר בציסטאין (CRD) ואזור עשיר בסרין/תראונין (עשיר ב-S/T). יש לציין כי האזור העשיר ב-S/T מכיל את אתר N', הנקשר ל-14-3-3 באופן תלוי זרחן (S259 ב-CRAF; איור 1A) 8. תחום CAT כולל את תחום הקינאז, יחד עם אתר עגינה נוסף בעל זיקה גבוהה 14-3-3, המכונה אתר C (S621 ב-CRAF; איור 1A) 8. הקישור הדיפרנציאלי של חלבונים דימריים 14-3-3 לאתרי N' ו-C', יחד עם CRD, ממלא תפקידים קריטיים הן בהפעלת חיל האוויר המלכותי והן בעיכוב 9,10,11,12,13. בתנאי איתות רגילים, הפעלת RAF מתחילה על ידי גיוסו לקרום הפלזמה על ידי RAS, מה שמאפשר לו ליצור דימרים פעילים, כאשר ההטרודימר BRAF-CRAF הוא הצורה הפעילה השלטת14,15. בדיקות ביוכימיות עם BRAF ו-CRAF, יחד עם מבנים של מיקרוסקופ אלקטרונים קריוגני (Cryo-EM) של BRAF דימרי, מצביעים על כך שדימר 14-3-3 מייצב דימרים פעילים של חיל האוויר המלכותי על-ידי קשירה בו זמנית לאתר C של שני הפרוטומרים של חיל האוויר המלכותי (איור 1B)9,13,16,17. לעומת זאת, מחקרים הראו כי בתנאים שקטים, RAF מאמץ אישור ציטוסולי, מעוכב עצמי, שבו תחום REG נקשר לתחום CAT ומעכב את פעילותו 12,18,19,20. מצב סגור זה מיוצב על-ידי דימר 14-3-3 הקשור לאתר CRD ו-N' בתחום REG ולאתר C בתחום CAT (איור 1B)10,13,21. ב- BRAF, מודל זה נתמך על ידי מבני Cryo-EM עדכניים של מונומרים BRAF מעוכבים עצמיים ועל ידי המחקרים הביוכימיים הקודמים שלנו 10,12,13,21,22. עם זאת, בעוד 14-3-3 הוכח כממלא תפקיד מעכב בתקנה23 של CRAF, מצב מעכב עצמי דמוי BRAF עשוי לשחק תפקיד קטן יותר בתקנה12 של CRAF; לכן נדרשים מחקרים נוספים כדי להבהיר את המנגנונים שבאמצעותם 14-3-3 חלבונים מווסתים את פעילות CRAF. הוויסות בתיווך 14-3-3 של קינאזות RAF דורש שפע של אירועי זרחן ודה-זרחן של חיל האוויר המלכותי, קשירה לחלבוני בקרה שונים ואינטראקציות עם קרום הפלזמה8. לכן, קריטי שאינטראקציות 14-3-3-RAF יימדדו בתנאים פיזיולוגיים רלוונטיים ובנוכחות דו-שכבה שומנית שלמה.
כדי לטפל בבעיה זו, נעשה שימוש בטכנולוגיית NanoBRET (מכאן ואילך המכונה N-BRET; ראו טבלת חומרים לפירוט הערכה) כדי לפתח בדיקה מבוססת קרבה למדידת האינטראקציות של CRAF עם 14-3-3 חלבונים בתאים חיים (איור 1C). מערכת מבוססת BRET זו מודדת את האינטראקציות של שני חלבונים בעלי עניין (POI), כאשר חלבון אחד מתויג עם תורם ננולוציפראז (ננו) והשני עם תג Halo, לצורך תיוג עם ליגנד מקבל האנרגיה Halo61822,24. אינטראקציה בין החלבונים המעניינים גורמת להעברת אנרגיה מתורם למקבל, שבתורה מייצרת את אות ה-BRET (איור 1C). חלבון תורם ננו בהיר במיוחד (פליטה (em) 460 ננומטר) וליגנד Halo618 (em 618 ננומטר) מספקים הפרדה ספקטרלית ורגישות רבה יותר מאשר BTRE קונבנציונאלי, מה שהופך אותו לפלטפורמה אידיאלית לחקר אינטראקציות חלשות יותר וזיהוי שינויים עדינים בקשירה24. ואכן, פיתחנו בעבר בדיקה מבוססת N-BRET למדידת אינטראקציות אוטואינהיביטוריות של תחומי RAF REG ו- CAT, שהייתה חיונית לאפיון פאנל של מוטציות RASopathy ב- BRAF CRD והדגמנו את החשיבות הקריטית של תחום זה לשמירה על עיכוב עצמי ומניעת הפעלה מכוננת של BRAF12.
הבדיקה המתוארת כאן מודדת את האינטראקציות של CRAF, המאוחה לתג ננו N-terminal (Nano-CRAF), ואת איזופורם הזטה של 14-3-3 המאוחה לתג Halo מסוף C (14-3-3ζ-Halo; איור 1C). אנו מראים כי האינטראקציות של ננו-CRAF עם 14-3-3ζ-Halo מייצרות אות BRET חזק, אשר בתורו יכול להיות משובש על ידי מוטציות המונעות קישור 14-3-3 לאתר N' (S259A) ו / או לאתר C (S621A). הפרוטוקול הבא מספק שלבים מפורטים לביצוע, מיטוב ופתרון בעיות בבדיקה זו.
Protocol
הערה: בדיקה זו מבוצעת בתאים של 293FT. קו אפיתל מאופיין היטב וניתן להעברה בקלות הנגזר מתאי כליה עובריים אנושיים. צלחת תרבית אחת בקוטר 10 ס"מ של תאים אלה מספקת בדרך כלל מספיק תאים לזריעת 20 בארות של לוחות תרבית רקמה של 6 בארות. שלבים 1-3 חייבים להתבצע בטכניקה סטרילית בארון בטיחות ביולוגי.
1. זריעת תאים (יום 1)
הערה: בשלב הזה, התאים מנותקים מצלחת תרבית הרקמה, נספרים ונזרעים בצלחות תרבית רקמה של 6 בארות לצורך טרנספקציה בשלב 2 (איור 2).
- שאפו את המדיה מהתאים בצלחת בקוטר 10 ס"מ. לשטוף תאים עם 5 מ"ל של מלוחים חוצצים פוספט (PBS) ולשאוף.
- הוסף 1 מ"ל של חומצה טריפסין-אתילאנדיאמין טטראצטי (EDTA) ודגר במשך 3-5 דקות ב 37 ° C כדי לנתק תאים מהמנה.
- הוסף 9 מ"ל של מדיום הנשר המעובד של דולבקו (DMEM) לתאים כדי לנטרל טריפסין ופיפטה למעלה ולמטה שוב ושוב כדי ליצור תרחיף הומוגני של תא יחיד.
- מיד להעביר 20 μL של תאים צינור 1.7 מ"ל ומערבבים עם 20 μL של כתם כחול טריפאן. ספירת תאים באמצעות מונה תאים אוטומטי (רשימת חומרים) או המוציטומטר.
- לדלל תאים ל 2 x 105 תאים / מ"ל במדיה DMEM מלאה ולהוסיף 2 מ"ל לכל באר של צלחת תרבית רקמה 6 באר (4 x 105 תאים / באר). לדגור על תאים בטמפרטורה של 37°C ו-10%CO2 למשך הלילה.
הערה: מומלץ להשתמש בתאי 293FT שעברו פחות מפי 20. מצאנו בעבר כי שימוש בתאים עם מספרי מעבר גדולים יותר יכול לגרום ליחסי BRET מופחתים ולשונות אות גבוהה יותר.
2. טרנספקציה של תאים (יום 2)
הערה: כאן, התאים נגועים במבני הביטוי pCMV5-NanoLuc-CRAF ו-pCMV5-14-3-3ζ-Halo, יחד עם וקטור ריק pCDNA3.1 (איור 2).
- לפני ההדבקה, יש לדלל את פלסמידים N-BRET ל-5 ננוגרם/μL ו-pCDNA3.1 עד 100 ננוגרם/μL, ומספר קבוצה של צינורות סטריליים בנפח 1.7 מ"ל.
- הוסף 100 μL של אמצעי טרנספקציה (ראה טבלת חומרים לפרטים) לכל צינור, יחד עם 5 ng של pCMV5-NanoLuc-CRAF, 10 ng של pCMV5-14-3-3ζ ו- 200 ng של PCDNA3.1.
- מוסיפים 2 μL של מגיב טרנספקציה (ראו טבלת חומרים לפרטים) ומערבלים בעדינות כדי לערבב. סובבו את הצינורות לזמן קצר במיקרו-צנטריפוגה כדי להבטיח שכל הנוזלים נאספים בתחתית הצינורות ולאחר מכן דגרו בסביבות 25°C למשך 15 דקות.
- הוסף קומפלקסים של טרנספקציה לתאים ודגור ב-37°C/10%CO2 למשך 16-20 שעות כדי לאפשר לחלבונים המתויגים בהילה ובננו לבוא לידי ביטוי.
הערה: הוספת DNA נשא וקטור ריק (pCDNA3.1) חיונית להשגת יעילות טרנספקציה גבוהה של מבני הביטוי N-BRET. אי הוספת וקטור ריק גורמת לרמות ביטוי מופחתות של חלבוני 14-3-3ζ-Halo ו-Nano-CRAF וכתוצאה מכך ליחסי BRET חלשים ולא עקביים, כפי שנדון קודם לכן22.
3. ציפוי מחדש של תאים (יום 3)
הערה: בשלב זה, התאים מועברים ללוח של 384 בארות ולליגנד Halo 618 (+ליגנד; טבלת חומרים) או DMSO (+רכב) נוסף לקריאת פליטות BRET בשלב 4. התאים הנותרים מועברים ללוחות תרבית טריים בני 6 בארות לצורך ניתוח כתמים מערביים בשלב 5 (איור 2).
- אספו את החומרים הבאים והכינו את אזור העבודה כמתואר להלן.
- שימוש באמבט מים בטמפרטורה של 37°C, טריפסין-EDTA טרום-חם, יחד עם Assay Media ללא סרום ו-Assay Media עם תוספת FBS של 10% (ראו טבלת חומרים לפרטים).
- בהתבסס על מספר הדגימות שיש למדוד, תייגו מראש שלוש קבוצות של צינורות סטריליים של 1.7 מ"ל (סט 1-3), וסט אחד של צינורות תחתונים חרוטיים סטריליים של 15 מ"ל. ציידו צנטריפוגה עם דלי נדנדה עם תוספות צינור 15 מ"ל וקירור מראש ל -4 מעלות צלזיוס.
- הניחו את הפריטים הבאים במכסה המנוע של תרבית הרקמה: מאגרי ריאגנטים, לוחות תרבית רקמה 384 בארות, לוחות תרבית רקמה 6 בארות, פיפטה רב ערוצית וקצוות, שקופיות/תאים לספירת תאים וכתם כחול טריפאן (טבלת חומרים), יחד עם שפופרת 1.7 מ"ל סטים 1-3.
- קצור וספור את התאים כמתואר להלן.
- שאפו את המדיה מלוחות 6 בארות והוסיפו 250 μL של טריפסין-EDTA לתאים. לדגור על לוחות 6 בארות ב 37 ° C עד התאים מתחילים להתנתק (3-5 דקות).
- הוסף 1 מ"ל של 10% מדיית בדיקה בתוספת FBS לכל באר כדי לנטרל את הטריפסין והפיפטה למעלה ולמטה במרץ כדי ליצור תרחיף חד-תאי.
- העבר 1 מ"ל של תרחיף התא לצינורות 15 מ"ל המסומנים מראש. הוסף עוד 1 מ"ל של 10% מדיית בדיקה בתוספת FBS לכל אחד מצינורות 15 מ"ל.
- הפוך את הצינורות 5x כדי לערבב ומיד להעביר 20 μL של תרחיף התא לצינור סט 1.
- צנטריפוגה בצנטריפוגת דלי הנדנדה המקוררת מראש למשך 5 דקות ב~ 250 x גרם. במהלך שלב הצנטריפוגה, ערבבו 20 μL של כתם תאים כחול טריפאן עם התאים בצינור סט 1 ולאחר מכן ספרו את התאים באמצעות מונה תאים אוטומטי או המוציטומטר. תפוקה של 6-8 x 105 תאים/מ"ל אופיינית.
- הסר את צינורות 15 מ"ל מהצנטריפוגה ושאפו את המדיה מכדורי התא. השהה מחדש את כדורי התא ל 2 x 105 תאים/מ"ל במדיית בדיקה ללא סרום ופיפטה במרץ כדי ליצור תרחיף תא יחיד.
הערה: השימוש במדיית Assay נטולת סרום משמש להרגעת מסלולי איתות תאים רגילים.
- תאים חוזרים בלוחות 384 באר ו -6 בארות כמתואר להלן.
- הפוך את צינורות 15 מ"ל מספר פעמים כדי להבטיח תרחיף תאים הומוגני ולהעביר 500 μL ל 1.7 מ"ל צינורות להגדיר 2 ולהגדיר 3.
- הוסף 0.5 μL של DMSO (+רכב) לסט 2 ו- 0.5 μL של ליגנד Halo 618 (+ליגנד) לסט צינור 3 ופיפטה לערבוב.
- העבר את מתלי תאי +רכב ו +ליגנד לבארות נפרדות של מאגרים מגיבים. באמצעות פיפטה רב ערוצית (טבלה של חומרים), להעביר 40 μL של תרחיף תא הרכב + ממאגרי מגיב כדי לרבע בארות של צלחת תרבית 384 בארות. חזור על שלב זה עבור +ligand cell suspensions.
- מעבירים את התאים הנותרים לצלחות תרבית טריות בנות 6 בארות. דגרו על צלחות 384 בארות ו-6 בארות למשך הלילה בטמפרטורה של 37°C ו-5% CO2.
4. קריאת פליטות BRET (יום 4)
הערה: בשלב זה, מצע הננולוציפרז (ראו טבלת חומרים לפרטים) מתווסף לתאים בלוח התרבית של 384 בארות, וקולט N-BRET (618 ננומטר) והתורם (460 ננומטר) נקראים (איור 2). לאחר מכן מחושבים יחסי BRET המתוקנים.
- מדיית בדיקה ללא סרום חם מראש באמבט מים בטמפרטורה של 37°C והפשירו את מצע הננולוציפרז בטמפרטורה של 25°C. לדלל את מצע nanoluciferase 1:100 במדיה בדיקה ללא סרום ולהעביר למאגר מגיב. הכינו מספיק מתערובת זו להוספת 10 μL לכל באר של צלחת 384 בארות, בתוספת 10%-15% נפח נוסף.
- באמצעות פיפטה רב-ערוצית (טבלת חומרים), מעבירים 10 מיקרוליטר מתערובת המצע לכל אחת מהבארות המכילות תאים בלוח התרבית בן 384 הקידוחים. סובבו את הצלחת בעדינות למשך דקה אחת, ידנית או באמצעות שייקר מסלולי.
- הכנס את לוח 384 הקידוחים לקורא הלוחות הרב-מצבי ורשום את פליטות 460 ננומטר ו- 618 ננומטר עבור כל הבארות המכילות תאים.
הערה: עבור קורא הלוחות הרב-מצבי המשמש לשלב זה (ראה טבלת חומרים לקבלת פרטים), נעשה שימוש בגובה קריאה של 6.5 מ"מ, עם מדידת זמן קריאה של 0.1 שניות, אולם ייתכן שיהיה צורך במיטוב נוסף אם משתמשים בקוראי לוחות אחרים. - חשב את יחסי BRET הגולמיים עבור +vehicle ו- +ligand ביחידות מילי-BRET (mBU) בנפרד, באמצעות המשוואה הבאה:
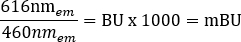
- חשב את יחס ה- BRET המתוקן על ידי הפחתת יחס +BRET רכב מזה של +ליגנד (טבלה משלימה 1).
הערה: כאשר משווים את התוצאות של ניסויים מרובים, ניתן לאגד ולנרמל את יחסי BRET המתוקנים לממוצע של זוג Wildtype (WT) N-BRET, המורכב מ-Nano-CRAF WT ו- 14-3-3ζWT-Halo (טבלה משלימה 1).
5. אישור רמות ביטוי חלבון (ימים 4 ו-5)
הערה: בשלב זה התאים בלוחות 6 הקידוחים עוברים ליזה ורמות ביטוי החלבונים של חלבוני Nano-CRAF ו-14-3-3ζ-Halo נקבעות על ידי ניתוח כתמים מערביים באמצעות נוגדנים ספציפיים לתגי Halo ו-Nano. (איור 2).
- הוסף מעכבי פרוטאז ופוספטאז למאגר הליזיס NP40 (טבלה של חומרים), המאפשר 200 מיקרוליטר של חיץ ליזיס לדגימה.
- שאפו מדיה מלוחות 6 בארות המכילים תאים. לשטוף את התאים פעם אחת עם 1 מ"ל של PBS קר ולשאוף.
- הוסף 125 μL של חיץ ליזיס NP40 לכל באר ודגר על לוחות 6 בארות ב 4 ° C על פלטפורמת נדנדה במשך 15 דקות כדי lyse את התאים.
- מעבירים ליזטים לצינורות של 1.7 מ"ל על קרח וצנטריפוגה בטמפרטורה של 20,000 x גרם למשך 10 דקות ב-4°C. הניחו את הליזטים שסולקו בחזרה על קרח וקבעו את ריכוז החלבונים באמצעות בדיקות זמינות מסחריות, כגון בדיקות ברדפורד או חומצה ביכנכונינית (BCA).
- נרמל את ריכוז החלבון בכל הדגימות על ידי העברת נפח מתאים של ליזט וחיץ ליזיס NP40 לצינורות טריים של 1.7 מ"ל לנפח כולל של 100 μL.
- מרתיחים מאגר דגימת חלבון 5x (טבלה של חומרים) למשך דקה אחת ומוסיפים 25 μL לכל דגימה. מרתיחים דגימות במשך 5-6 דקות ולאחר מכן פולס צנטריפוגה את הצינורות לזמן קצר כדי להבטיח שכל הדגימה נאספת בבסיס הצינור.
- טען 25 μL של דגימה לתוך כל באר של ג'ל חלבון כפול (ג'ל 1 וג'ל 2) ולאחר מכן להעביר חלבונים לממברנות ניטרוצלולוז או PVDF באמצעות הליכי הכתמה מערביים סטנדרטיים, כפי שתואר קודם לכן22.
- לחסום ממברנות ב-3% BSA-PBS ב-25°C למשך 30 דקות ולאחר מכן לדגור על קרומים למשך הלילה עם נוגדן Halo (דילול 1:1,000; ג'ל 1) או nanoluciferase או נוגדן CRAF (דילול 1:500; ג'ל 2) במי מלח חוצצים בתריס, בתוספת 0.2% Tween-20 (TBST; טבלת חומרים).
- יש לשטוף את הממברנות פעם אחת למשך 5 דקות ב-10 מ"ל TBST ולאחר מכן לדגור בטמפרטורת החדר למשך שעה אחת עם נוגדן משני HRP נגד עכבר, מדולל בקנ"מ 1:10,000 ב-TBST.
- יש לשטוף את הממברנות 3x על משטח נדנדה ב-10 מ"ל TBST ב-25°C למשך 5 דקות כל אחת. הסר TBST והצג באופן חזותי רצועות חלבון באמצעות ריאגנטים ECL ומעבד סרטי רנטגן או מערכת הדמיה מתאימה אחרת.
תוצאות
כאשר היא מבוצעת כמתואר בפרוטוקול זה (איור 2), האינטראקציה של Nano-CRAFWT ו-14-3-3ζ-Halo אמורה לייצר יחסי BRET מתוקנים של 50-60 mBU (איור 3A; טבלה משלימה 1). CRAF מכיל שני אתרי עגינה תלויי זרחן 14-3-3, אתר N' ואתר C (איור 1)8. לכן, בקרות מתאימות להפחתת קשירת CRAF:14-3-3ζ כוללות את S259A ו-S621A, המונעות זרחון, ובתורם 14-3-3 קשירה, לאתרים N' ו-C', בהתאמה25. כפי שניתן לראות באיור 3A, Nano-CRAFS259A מפחית את אות ה-BRET ב~45% ואת אות ה-Nano-CRAFS621A ב~25%, בעוד שהמוטציה הכפולה S259A/S621A (SS/AA) מבטלת כמעט לחלוטין את אות ה-BRET CRAF:14-3-3. נוסף על כך, ניתן להשוות את התוצאות של ניסויים עצמאיים מרובים על-ידי נרמול התוצאות של כל ניסוי ליחס BRET המתוקן הממוצע (טבלה משלימה 1), ולאחר מכן איגום יחד של נקודות הנתונים מכל שלושת הניסויים (איור 3B). רמות הביטוי היחסיות של החלבונים המתויגים צריכות להיות מאושרות גם על-ידי ניתוח כתמים מערביים (איור 3). שימו לב שרמות הביטוי של חלבונים מוטנטיים עשויות להיות שונות מאלו של WT, מה שדורש להתאים את הכמויות המועתקות של וקטורי דנ"א מוטנטיים בהתאם (טבלה משלימה 1).
כמו כן יש לציין כי אופטימיזציה של פרוטוקול זה עשוי להידרש, במיוחד בעת שימוש בקורא לוחות חלופי, שורות תאים, או ריאגנטים transfection. איור 4A מראה את התוצאות של ניסוי אופטימיזציה לדוגמה, שבו הגדלת הכמות המועברת של פלסמיד מקבל pCMV5-14-3-3ζ-Halo, תוך שמירה על כמות קבועה של תורם pCMV5-NanoLuc-CRAF, מינון תלוי באות BRET, אשר לאחר מכן מופחת על-ידי נוכחות של מוטנט CRAFSS/AA חסר 14-3-קשירה. עם זאת, אם יחס המקבל לתורם גבוה מדי, ההבדל באות בין קישור 14-3-3ζ-Halo לבקרת Nano-CRAFWT לעומת הבקרה השלילית Nano-CRAFSS/AA יופחת, ככל הנראה הרוויה הקשורה של Nano-CRAFWT. בנוסף, ברגע שמושג יחס BRET המייצר ערכים הניתנים לשחזור עם שגיאת תקן נמוכה, אין צורך בעלייה נוספת ביחס המקבל לתורם. ואכן, אחד היתרונות העיקריים של בדיקות אלה הוא היכולת למדוד את האינטראקציות של חלבונים ברמות ביטוי פיזיולוגיות. בעת פיתוח מבחני N-BRET חדשים, שיקול חשוב נוסף הוא מיקום התגים. איור 4B מראה את ההשפעה של החלפת תג Halo ממסוף C למסוף N של 14-3-3ζ על יחסי BRET מתוקנים שנוצרו על-ידי קשירה של 14-3-3ζל-Nano-CRAF WT ו-Nano-CRAFSS/AA. לשם כך יש ליצור מבני ביטוי דנ"א עבור כל אחד ממיקומי התגים האפשריים (איור 4C), ולהעריך את השפעתם על יחסי BRET הן של זוג WT והן של בקרה שלילית ידועה לקשירה.

איור 1: ויסות RAF על-ידי 14-3-3 חלבונים. (A) מבנה תחום קינאז של חיל האוויר המלכותי סכמטי עם 14-3-3 אתרי עגינה שמורים. (B) מודלים של ויסות RAF על ידי 14-3-3 חלבונים. (C) בדיקת N-BRET המודדת את האינטראקציות של 14-3-3ζ מאוחה למקבל תג Halo מסוף C ו- CRAF המאוחה לתורם ננו N-terminal. העברת אנרגיה של התורם למקבל מייצרת את אות ה- BRET. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 2: שלבי מפתח לביצוע הבדיקה מבוססת ה-Bret של התא החי CRAF:14-3-3. מוצגים חמשת השלבים העיקריים המתוארים בפרוטוקול זה, כולל: זריעה, הדבקה וציפוי מחדש של התאים, יחד עם שיטות לקריאת אות BRET ולאישור רמות הביטוי של החלבונים המתויגים בהילה ובננו. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 3: CRAF:14-3-3 בדיקה מבוססת BRET. בדיקת N-BRET המשווה את האינטראקציות של 14-3-3ζ-Halo עם Nano-CRAF -WT, או עם צורות מוטנטיות -S259A, -S621A ו-S259A/S621A (SS/AA), שהוצגו בעבר כפוגעות בקשירת CRAF:14-3-325. רמות הביטוי של גרסאות 14-3-3ζ-Halo (MW: 64 kDa.) וגרסאות Nano-CRAF (MW: 93 kDa.) נבדקו על ידי ניתוח כתמים מערביים. (A) קריאות BRET מתוקנות מארבע בארות משוכפלות מניסוי יחיד ± סטיית תקן (SD). (B) קריאות BRET מתוקנות משלושה ניסויים עצמאיים אוחדו ונורמלו ל-Nano-CRAFWT (מוגדר ל-100) ±-SD. מובהקות סטטיסטית חושבה על ידי מבחן t של סטודנט (דו-זנב, בהנחה של שונות שווה). עמ<0.0001. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
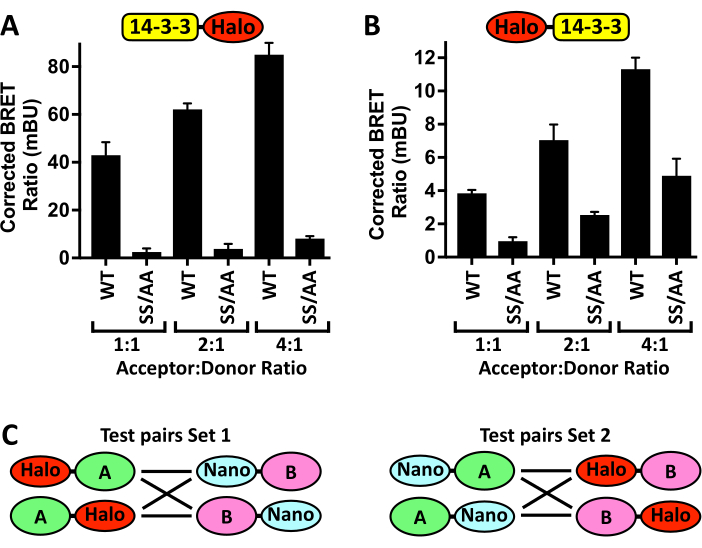
איור 4: שלבי מיטוב מבחן. ההשפעות של העברה משותפת של כמויות הולכות וגדלות של (A) 14-3-3ζ-Halo או (B) Halo-14-3-3ζ עם כמות קבועה של Nano-CRAF -WT או -SS/AA (S259A/S621A) על אות BRET ± SD. (C) סכמה של כל זוגות N-BRET אפשריים שנוצרו על ידי הצבת התג Halo או Nano על N-terminus או C-terminus של כל חלבון מעניין (A ו- B). n = 4. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
טבלה משלימה 1: נתונים לדוגמה מהבדיקה מבוססת CRAF:14-3-3 BRET. מבני הביטוי שצוינו הועתקו לתוך התאים ביום 2 (החלק העליון). קריאות ה-BRET הגולמיות, המתוקנות והמנורמלות נמדדו וחושבו ביום 4 (החלק התחתון). אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
מחקרים קודמים הראו כי 14-3-3 חלבונים ממלאים תפקידים קריטיים הן בהפעלה והן בעיכוב של קינאזות RAF. הבנת האופן שבו אירועים קושרים אלה מוסדרים וההשפעות של אפנון אינטראקציות אלה על איתות RAF ואונקוגנזה מונעת על ידי חיל האוויר המלכותי עשויה לחשוף פגיעויות טיפוליות חדשות המכוונות לתפקוד CRAF. עם זאת, מחזור ההפעלה של חיל האוויר המלכותי נתמך על ידי שפע של חלבונים קשורים, שינויים לאחר תרגום, ושינויים בלוקליזציה תת-תאית8, ולכן כדי לשחזר תנאים אלה במלואם, יש למדוד את האינטראקציות של חיל האוויר המלכותי עם הרגולטורים שלו בתנאי תאים חיים. פרוטוקול זה מתאר בדיקה חדשנית מבוססת קרבה המשתמשת ביחס האות לרעש המעולה וברזולוציה הספקטרלית של זוג ננולוציפראז-Halo N-BRET למדידת האינטראקציות של 14-3-3ζ ו-CRAF בתאים חיים.
בעוד שבדיקה זו מספקת פלטפורמה נחוצה מאוד לחקר האינטראקציות המורכבות של 14-3-3 ו- CRAF בתנאים רלוונטיים מבחינה פיזיולוגית, יש לה מספר מגבלות שיש לקחת בחשבון. ראשית, בהתחשב בכך שהוכח כי 14-3-3 ממלא תפקידים הן בעיכוב העצמי של חיל האוויר המלכותי והן בדימריזציה8, ניתן לשלב בקרות נוספות וגישות ניסיוניות כדי להבחין בין מצבים אלה. לדוגמה, ניתן לבצע בדיקה זו בשילוב עם בדיקת העיכוב האוטומטי N-BRET שפותחה בעבר, המספקת קריאה ישירה של שינויים בעיכוב העצמי של חיל האוויר המלכותי12,22. יתר על כן, בקרות כגון מוטציית CRAF R401H, שהוכחה כמשבשת את הדימריזציה של CRAF עם פרוטומרים אחרים של חיל האוויר המלכותי 15,26, עשויות גם הן להיות שימושיות בניתוח פונקציות אלה. לבסוף, המיקום של תגי Halo ו-Nano ממוטב למדידת האינטראקציה CRAF:14-3-3, אך אינו יכול להבטיח שהאינטראקציות של CRAF או 14-3-3 עם חלבונים אחרים לא יושפעו כתוצאה מכך, וגם בדיקה זו אינה יכולה לקבוע את הזיקה של קשירת CRAF:14-3-3, את ההשפעות של אינטראקציות אלה על פעילות CRAF, או את המיקום בתא שבו אינטראקציות אלה מתרחשות. לכן, ייתכן שיהיה צורך לשלב גם גישות משלימות אחרות, כגון מבחני קשירה חוץ גופית, מבחני קינאז CRAF ומחקרי לוקליזציה תת-תאיים 12,27,28,29.
בעת ביצוע בדיקה זו, או למעשה כל בדיקה מבוססת N-BRET, ישנם מספר גורמים שיש לקחת בחשבון. כפי שניתן לראות בכתב יד זה, ובעבודה קודמת22, יחס הטרנספקציה הנכון של מבני pCMV5-Halo (מקבל) ומבני pCMV5-Nanoluciferase (תורם), יחד עם בקרה שלילית מתאימה, כגון מוטציה הידועה כמשבשת את הקישור של נקודות העניין, הוא קריטי לאופטימיזציה ולבדיקה של בדיקות אלה. הגדלת הביטוי של נקודת העניין המתויגת של Halo, תוך שמירה על רמות נקודות עניין מתויגות של ננו קבועות, מביאה להגדלת יחסי BET. עם זאת, ברגע שהקשירה רוויה, האות יתאזן ובתורה הדלתא בין WT לבין נקודות עניין לקויות קשירה תפחת, מה שיחייב אופטימיזציה של מקבל-תורם. גורם קריטי נוסף באופטימיזציה של בדיקות הוא השימוש בדנ"א נשא וקטורי ריק, כגון pCDNA3.1. הכללת 200 ng של pCDNA3.1. בתמהיל הטרנספקציה מגדיל מאוד את רמות הביטוי של נקודות העניין המתויגות בהילה ובננו ומקטין את השונות בין בארות משוכפלות לניסויים22. עם זאת, בהתחשב בכך שיעילות הטרנספקציה יכולה להשתנות בין ריאגנטים לקווי תאים, ייתכן שיהיה צורך גם בכמות הדנ"א המוביל כדי להשיג ביטוי אופטימלי של זוג N-BRE, כפי שתואר קודם לכן22. גורם נוסף המשפיע מאוד על יחסי BRET הוא מיקום התגים. ואכן, איזה POI מאוחה לתג Halo לעומת תג Nano והאם תג זה ממוקם על N- או C- terminus של החלבון יכול להשפיע הן על המשרעת של יחס BRET והן על היכולת של בקרות שליליות להפחית אות זה. לכן, חשוב גם לבדוק כל אחד מזוגות N-BRET האפשריים בעת פיתוח בדיקות חדשות.
הרגישות והרזולוציה הספקטרלית המשופרות שהושגו על ידי N-BRET על פני BRET קונבנציונלי מאפשרות אינטראקציות חלשות יותר ושינויים עדינים בקשירה שיימדדו בתאים חיים. עם זאת, התועלת של בדיקות אלה לחקר אירועי איתות סלולרי לא מומשה במלואה. יש לציין כי בדיקה זו עשויה להיות מותאמת לחקר האינטראקציה של 14-3-3 עם קינאזות אחרות, כגון קינאזות אחרות של חיל האוויר המלכותי ARAF ו- BRAF, ובשילוב עם מבחני N-BRET שפורסמו בעבר לחקר קשירת RAS:RAF ועיכוב עצמי22,30 של חיל האוויר המלכותי, יהוו את הבסיס לערכת כלים למדידת ויסות RAF בתנאי תאים חיים. בנוסף, N-BRET הראתה הבטחה כפלטפורמה לסינון תרופות תאים חיים30, ולכן בדיקה זו עשויה להיות שימושית גם לזיהוי תרכובות המייצבות את המעכב עם אינטראקציות של 14-3-3 ו- RAF או משבשות את המעורבים בהפעלת RAF. בהתחשב ביציבות הגבוהה של אות ננולוציפראז וביכולתם של קוראי לוחות מודרניים לזהות בו זמנית פליטות של מקבלים ותורמים, המסקנה היא שניתן להתאים את הבדיקות הללו למדידת האינטראקציות של חלבוני איתות בזמן אמת, דבר שיהיה קריטי להבנת הדינמיקה של אינטראקציות אלה בתגובה לגירוי במעלה הזרם או לטיפולים תרופתיים.
Disclosures
אין מה לחשוף.
Acknowledgements
פרויקט זה מומן בחלקו במימון פדרלי מהמכון הלאומי לסרטן, המכונים הלאומיים לבריאות, תחת מספר הפרויקט ZIA BC 010329.
Materials
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| HaloTag® mouse monoclonal antibody | Promega | G9211 | Antibody for detecting HaloTag tagged proteins by immunoblot |
| NanoLuc® mouse monoclonal antibody | R&D Systems | MAB10026 | Antibody for detecting Nano-tagged proteins by immunoblot |
| CRAF mouse monoclonal antibody (E10) | Santa Crus Biotechnology | sc-7267 | Antibody directly detecting CRAF proteins by immunoblot |
| ECL anti-mouse HRP secondary antibody | Amersham | NA931-1ML | Secondary HRP conjugated mouse antibody (from sheep) |
| Reagents | |||
| X-tremeGENE™ 9 | Roche/Sigma | 6365809001 | |
| NanoBRET™ kit | Promega | N1661 | NanoBRET kit containing Halo 618 ligand and NanoGlo (nanoluciferase) substrate |
| DPBS, without Ca++ and Mg++ | Quality Biologicals | 114-057-101 | |
| Trypsin-EDTA (0.05%), phenol red | Life Technologies | 25300120 | |
| DMEM cell culture media | Life Technologies | 11995073 | High glucose, L-glutamine, phenol red, sodium pyruvate; without HEPES, suppliment media with 10% FBS, 2 mM L-glutamine and 100U penicillin-streptomycin |
| L-Glutamine (200 mM) | Life Technologies | 25030164 | |
| Penicillin-Streptomycin (10,000 U/mL) | Life Technologies | 15140163 | |
| Opti-MEM™ I reduced serum media | Gibco | 31985062 | For cell transfection |
| Opti-MEM reduced serum media, no phenol red | Gibco | 11058021 | For replating cells on Day 3. Supplement with 2 mM L-glutamine and 100U penicillin-streptomycin, along with 10% FBS (where indicated). |
| Invitrogen Trypan Blue Stain | Thermo Scientific | T10282 | |
| NP40 lysis buffer | N/A | N/A | 20 mM Tris (pH 8.0), 137mM NaCl, 10% glycerol, NP40 alternative (Milipore, Cat# 492016). Store at 4 degrees C.. Add the following protease and phosphatase immediately prior to use: 20 µM leupeptin, 0.5 mM sodium orthovanidate, 0.15 U/mL, 1mM PMSF. |
| 5x gel sample buffer | N/A | N/A | 240 mM Tris (pH 8.0), 9.5% SDS, 30% glycerol, 500mM DTT, 3mM bromophenol blue. Store at -20 degrees C. |
| Cell lines | |||
| 293FT cells (human) | Thermo Scientific | R70007 | |
| DNA vectors | |||
| pCMV5-Nano-CRAF WT and mutant | N/A | N/A | |
| pCMV5-14-3-3ζ-Halo | N/A | N/A | |
| Equipment | |||
| EnVision 2104 Multimode Plate Reader | PerkinElmer 2104 | 2104-0010 | 600LP NanoBRET & M460/50 nm NanoBRET emmisions filters, Luminescence 404 mirror, 6.5 mm measurement height and 0.1 s measurement time |
| Invitrogen Countess™ II Automated Cell Counter | Thermo Scientific | AMQAX1000 | |
| ThermoFisher E1-ClipTip™ Multichannel Pipettor | Thermo Scientific | 4672070 | |
| Software | |||
| GraphPad Prism (version 10.0.3) | GraphPad | www.graphpad.com | |
| Other | |||
| ThermoFisher ClipTip Multichannel pipette tips | Thermo Scientific | 94410153 | |
| Reagent Reservoir, 25 mL Divided, Sterile | Thomas Scientific | 1228K16 | |
| Perkin Elmer 384-well CulturPlate™ | PerkinElmer | 6007680 | White, polystyrene, tissue culture treated |
| Countess Cell Counting Chamber Slides | Thermo Scientific | C10228 |
References
- Blasco, R. B., et al. c-Raf, but not B-Raf, is essential for development of K-Ras oncogene-driven non-small cell lung carcinoma. Cancer Cell. 19, 652-663 (2011).
- Blasco, M. T., et al. Complete regression of advanced pancreatic ductal adenocarcinomas upon combined inhibition of EGFR and C-RAF. Cancer Cell. 35, 573-587 (2019).
- Karreth, F. A., Frese, K. K., DeNicola, G. M., Baccarini, M., Tuveson, D. A. C-Raf is required for the initiation of lung cancer by K-Ras(G12D). Cancer Discov. 1, 128-136 (2011).
- Lito, P., et al. Disruption of CRAF-mediated MEK activation is required for effective MEK inhibition in KRAS mutant tumors. Cancer Cell. 25, 697-710 (2014).
- Sanclemente, M., et al. c-RAF ablation induces regression of advanced Kras/Trp53 mutant lung adenocarcinomas by a mechanism independent of MAPK signaling. Cancer Cell. 33, 217-228 (2018).
- Razzaque, M. A., et al. Germline gain-of-function mutations in RAF1 cause Noonan syndrome. Nat Genet. 39, 1013-1017 (2007).
- Pandit, B., et al. Gain-of-function RAF1 mutations cause Noonan and LEOPARD syndromes with hypertrophic cardiomyopathy. Nat Genet. 39, 1007-1012 (2007).
- Terrell, E. M., Morrison, D. K. Ras-mediated activation of the Raf family kinases. Cold Spring Harb Perspect Med. 9 (1), 033746(2019).
- Kondo, Y., et al. Cryo-EM structure of a dimeric B-Raf:14-3-3 complex reveals asymmetry in the active sites of B-Raf kinases. Science. 366, 109-115 (2019).
- Park, E., et al. Architecture of autoinhibited and active BRAF-MEK1-14-3-3 complexes. Nature. 575 (7783), 545-550 (2019).
- Tzivion, G., Luo, Z., Avruch, J. A dimeric 14-3-3 protein is an essential cofactor for Raf kinase activity. Nature. 394, 88-92 (1998).
- Spencer-Smith, R., et al. RASopathy mutations provide functional insight into the BRAF cysteine-rich domain and reveal the importance of autoinhibition in BRAF regulation. Mol Cell. 82, 4262-4276 (2022).
- Martinez Fiesco, J. A., Durrant, D. E., Morrison, D. K., Zhang, P. Structural insights into the BRAF monomer-to-dimer transition mediated by RAS binding. Nat Commun. 13, 486(2022).
- Freeman, A. K., Ritt, D. A., Morrison, D. K. The importance of Raf dimerization in cell signaling. Small GTPases. 4, 180-185 (2013).
- Freeman, A. K., Ritt, D. A., Morrison, D. K. Effects of Raf dimerization and its inhibition on normal and disease-associated Raf signaling. Mol Cell. 49, 751-758 (2013).
- Rushworth, L. K., Hindley, A. D., O'Neill, E., Kolch, W. Regulation and role of Raf-1/B-Raf heterodimerization. Mol Cell Biol. 26, 2262-2272 (2006).
- Garnett, M. J., Rana, S., Paterson, H., Barford, D., Marais, R. Wild-type and mutant B-RAF activate C-RAF through distinct mechanisms involving heterodimerization. Mol Cell. 20, 963-969 (2005).
- Tran, N. H., Wu, X., Frost, J. A. B-Raf and Raf-1 are regulated by distinct autoregulatory mechanisms. J Biol Chem. 280, 16244-16253 (2005).
- Chong, H., Guan, K. L. Regulation of Raf through phosphorylation and N terminus-C terminus interaction. J Biol Chem. 278, 36269-36276 (2003).
- Cutler, R. E., Stephens, R. M., Saracino, M. R., Morrison, D. K. Autoregulation of the Raf-1 serine/threonine kinase. Proc Natl Acad Sci U S A. 95, 9214-9219 (1998).
- Park, E., et al. Cryo-EM structure of a RAS/RAF recruitment complex. Nat Commun. 14, 4580(2023).
- Spencer-Smith, R., Morrison, D. K. Protocol for measuring BRAF autoinhibition in live cells using a proximity-based NanoBRET assay. STAR Protoc. 4, 102461(2023).
- Clark, G. J., et al. 14-3-3 zeta negatively regulates raf-1 activity by interactions with the Raf-1 cysteine-rich domain. J Biol Chem. 272, 20990-20993 (1997).
- Machleidt, T., et al. NanoBRET--A novel BRET platform for the analysis of protein-protein interactions. ACS Chem Biol. 10, 1797-1804 (2015).
- Hekman, M., et al. Dynamic changes in C-Raf phosphorylation and 14-3-3 protein binding in response to growth factor stimulation: differential roles of 14-3-3 protein binding sites. J Biol Chem. 279, 14074-14086 (2004).
- Hatzivassiliou, G., et al. RAF inhibitors prime wild-type RAF to activate the MAPK pathway and enhance growth. Nature. 464, 431-435 (2010).
- Bondzi, C., Grant, S., Krystal, G. W. A novel assay for the measurement of Raf-1 kinase activity. Oncogene. 19, 5030-5033 (2000).
- Spencer-Smith, R., et al. Inhibition of RAS function through targeting an allosteric regulatory site. Nat Chem Biol. 13 (1), 62-68 (2016).
- Roy, S., et al. 14-3-3 facilitates Ras-dependent Raf-1 activation in vitro and in vivo. Mol Cell Biol. 18, 3947-3955 (1998).
- Durrant, D. E., et al. Development of a high-throughput NanoBRET screening platform to identify modulators of the RAS/RAF interaction. Mol Cancer Ther. 20, 1743-1754 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved