Method Article
Pseudomonas syringae pv'ye Stoma Yanıtlarının Doğrudan Gözlemi ve Otomatik Ölçümü. domates DC3000 içinde Arabidopsis thaliana
Bu Makalede
Özet
Burada, Arabidopsis thaliana'da bakteri istilasına karşı stoma yanıtlarının doğrudan gözlemlenmesi ve otomatik ölçümü için basit bir yöntem sunuyoruz. Bu yöntem, cihaz tarafından yakalanan yaprak görüntüleri için tasarlanmış bir görüntü analizi boru hattı ile birlikte taşınabilir bir stoma görüntüleme cihazından yararlanır.
Özet
Stomalar, bitki yaprağı epidermisinde bulunan mikroskobik gözeneklerdir. Stoma açıklığının düzenlenmesi sadece fotosentez ve transpirasyonel su kaybı için karbondioksit alımını dengelemek için değil, aynı zamanda bakteri istilasını kısıtlamak için de çok önemlidir. Bitkiler mikropların tanınması üzerine stomaları kapatırken, Pseudomonas syringae pv gibi patojenik bakteriler. domates DC3000 (Pto), yaprağın iç kısmına erişmek için kapalı stomaları yeniden açın. Bakteri istilasına stoma tepkilerini değerlendirmek için yapılan geleneksel tahlillerde, yaprak epidermal kabukları, yaprak diskleri veya müstakil yapraklar bakteri süspansiyonu üzerinde yüzdürülür ve daha sonra stomalar mikroskop altında gözlemlenir ve ardından stoma açıklığının manuel ölçümü yapılır. Bununla birlikte, bu tahliller zahmetlidir ve bitkiye bağlı bir yaprakta doğal bakteri istilasına stoma tepkilerini yansıtmayabilir. Son zamanlarda, bir yaprağı bitkiden ayırmadan sıkıştırarak stomaları gözlemleyebilen taşınabilir bir görüntüleme cihazı ve cihaz tarafından yakalanan yaprak görüntülerinden stoma açıklığını otomatik olarak ölçmek için tasarlanmış derin öğrenme tabanlı bir görüntü analizi boru hattı geliştirildi. Burada, bu teknik ilerlemelere dayanarak, Arabidopsis thaliana'da bakteri istilasına stoma yanıtlarını değerlendirmek için yeni bir yöntem tanıtıldı. Bu yöntem üç basit adımdan oluşur: doğal enfeksiyon süreçlerini taklit eden Pto'nun sprey aşılanması, taşınabilir görüntüleme cihazı kullanılarak Pto aşılanmış bitkinin bir yaprağındaki stomaların doğrudan gözlemlenmesi ve görüntü analizi boru hattı ile stoma açıklığının otomatik ölçümü. Bu yöntem, doğal bitki-bakteri etkileşimini yakından taklit eden koşullar altında Pto istilası sırasında stoma kapanmasını ve yeniden açılmasını göstermek için başarıyla kullanılmıştır.
Giriş
Stomalar, yaprakların yüzeyinde ve bitkilerin diğer hava kısımlarında bir çift koruyucu hücre ile çevrili mikroskobik gözeneklerdir. Sürekli değişen ortamlarda, stoma açıklığının düzenlenmesi, bitkilerin terleme yoluyla su kaybı pahasına fotosentez için gerekli olan karbondioksit alımını kontrol etmeleri için çok önemlidir. Bu nedenle, stoma açıklığının nicelleştirilmesi, bitki çevresel adaptasyonunu anlamada etkili olmuştur. Bununla birlikte, stoma açıklığının ölçülmesi, mikroskopla yakalanan bir yaprak görüntüsündeki stoma gözeneklerini tespit etmek ve ölçmek için insan emeği gerektirdiğinden, doğası gereği zaman alıcı ve zahmetlidir. Bu sınırlamaları aşmak için, stoma biyolojisini incelemek için yaygın olarak kullanılan bir model bitki olan Arabidopsis thaliana'da stoma açıklığının ölçülmesini kolaylaştırmak için çeşitli yöntemler geliştirilmiştir 1,2,3,4,5,6. Örneğin, stoma iletkenliğinin bir ölçüsü olarak terleme hızını ölçmek için bir porometre kullanılabilir. Bununla birlikte, bu yöntem, stoma iletkenliğini belirleyen stoma sayısı ve açıklığı hakkında doğrudan bilgi sağlamaz. Bazı çalışmalar, bir floresan aktin işaretleyicisi, bir floresan boya veya hücre duvarı otofloresansı 1,2,3,4,5 kullanarak stoma gözeneklerini vurgulayan konfokal mikroskopi tekniklerini kullanmıştır. Bu yaklaşımlar stomaların tespitini kolaylaştırırken, hem konfokal mikroskopi tesisi işletme hem de mikroskopi örnekleri hazırlama maliyeti rutin uygulamaya engel olabilir. Sai ve arkadaşları tarafından yapılan çığır açan bir çalışmada, A. thaliana epidermal peelinglerinin parlak alan mikroskobik görüntülerinden stoma açıklığını otomatik olarak ölçmek için derin bir sinir ağı modeli geliştirilmiştir6. Yine de bu yenilik, araştırmacıları mikroskobik gözlem için epidermal bir peeling hazırlama görevinden muaf tutmaz. Son zamanlarda, A. thaliana'nın bir yaprağını sıkıştırarak stomaları gözlemleyebilen taşınabilir bir görüntüleme cihazı ve cihaz tarafından yakalanan yaprak görüntülerinden stoma açıklığını otomatik olarak ölçen derin öğrenme tabanlı bir görüntü analizi boru hattı geliştirilerek bu engel aşıldı7.
Stomalar, bakteriyel patojenlere karşı bitkinin doğuştan gelen bağışıklığına katkıda bulunur. Bu bağışıklık tepkisinin anahtarı, bakteriyel patojenlerin çoğaldığı ve hastalıklara neden olduğu mikroskobik gözeneklerden yaprak iç kısmına bakteri girişini kısıtlayan stoma kapanmasıdır8. Stoma kapanması, genellikle bir mikrop sınıfında ortak olan immünojenik moleküller olan mikropla ilişkili moleküler paternlerin (MAMP'ler), plazma membran lokalize patern tanıma reseptörleri (PRR'ler) tarafından tanınması üzerine indüklenir9. FLG22 olarak bilinen bakteriyel flagellinin 22 amino asitlik epitopu, PRR FLS210 tarafından tanınması yoluyla stoma kapanmasını indükleyen tipik bir MAMP'dir. Karşı önlem olarak, Pseudomonas syringae pv gibi bakteriyel patojenler. domates DC3000 (Pto) ve Xanthomonas campestris pv. Vezikatoria, stomaları yeniden açmak için virülans mekanizmaları geliştirmiştir 9,11,12. Bakteriyel patojenlere karşı bu stoma tepkileri, geleneksel olarak, yaprak epidermal kabuklarının, yaprak disklerinin veya ayrılmış yaprakların bakteriyel süspansiyon üzerinde yüzdürüldüğü ve daha sonra stomaların mikroskop altında gözlemlendiği ve ardından stoma açıklığının manuel olarak ölçüldüğü deneylerde analiz edilmiştir. Bununla birlikte, bu tahliller zahmetlidir ve bitkiye bağlı bir yaprakta meydana gelen doğal bakteri istilasına karşı stoma tepkilerini yansıtmayabilir.
Burada, doğal bitki-bakteri etkileşimini yakından taklit eden koşullar altında Pto invazyonu sırasında stoma kapanmasını ve yeniden açılmasını araştırmak için basit bir yöntem sunulmaktadır. Bu yöntem, stoma açıklığının otomatik ölçümü için görüntü analiz boru hattı ile birlikte Pto ile aşılanmış bitkiye bağlı bir yaprak üzerinde A. thaliana stomalarının doğrudan gözlemlenmesi için taşınabilir görüntüleme cihazından yararlanır.
Protokol
1. Büyüyen bitkiler
- Dormansi kırılması için, A. thaliana (Col-0) tohumlarını deiyonize suda tekrar süspanse edin ve karanlıkta 4 gün boyunca 4 ° C'de inkübe edin.
- Tohumları toprağa ekin ve beyaz floresan ışıkla donatılmış bir odada büyütün. Aşağıdaki büyüme koşullarını koruyun: 22 °C sıcaklık, 10 saat boyunca 6.000 lux (yaklaşık 100 μmol/m2/s) ışık yoğunluğu ve %60 bağıl nem.
- Gerektiğinde bitkileri sıvı gübre ile sulayın. Aşılamadan 1 hafta ila 2 gün önce sulamadan kaçının ve aşılamadan 1 gün önce iyice sulayın.
2. Bakteri aşısının hazırlanması
- 50 μg/mL rifampisin ile katılaşmış King's B (KB) ortamında (20 g Tripton, 1.5 gK2HPO4 ve 1 L için 15 g Gliserol, %1.5 Agar) gliserol stoğundan Pto'yu çizgi haline getirin ve 28 °C'de 2 gün inkübe edin.
- Tek bir koloniyi 50 μg/mL rifampisin ile 5 mL KB sıvı ortama aşılayın ve geç logaritmik büyüme fazına kadar 200 rpm'de çalkalayarak 28 °C'de inkübe edin.
- Kültürü 2 dakika boyunca 6.000 x g'da santrifüjleyin, süpernatanı atın ve peleti 1 mL steril suda yeniden süspanse edin. Bu adımı bir kez daha tekrarlayın.
- Süpernatanı çıkarın, peleti 1 mL stoma açma tamponunda (25 mM MES-KOH pH 6.15, 10 mM KCl) yeniden süspanse edin ve OD600'ü ölçün.
- Süspansiyonu% 0.04 silikon yüzey aktif madde içeren stoma açma tamponu ile OD600 0.2'ye seyreltin.
3. Bakterilerin sprey aşılanması
- Aşılamadan 1 gün öncesinden deneyin sonuna kadar, bitkileri yaklaşık 10.000 lux (yaklaşık 170 μmol/m2/s) ışık yoğunluğuna maruz bırakın.
- Çoğu stomanın açık olduğundan emin olmak için, bitkileri sprey aşılamadan önce en az 3 saat boyunca ışığın altında şeffaf bir kapakla kapalı bir tepside tutun.
- Kapağı çıkarın ve yaprakların abaksiyal tarafına tek bir kapta üç bitki başına 2,5 mL bakteri süspansiyonu püskürtmek için bir airbrush kullanın.
- Aşılanmış bitkileri, yaklaşık% 85'lik bir bağıl nemi korumak için şeffaf bir kapakla kaplı bir tepside inkübe edin.
- Bölüm 4'te açıklanan yöntemi kullanarak sprey aşılamadan 1 saat ve 3 saat sonra stoma görüntüleri elde edin.
4. Taşınabilir görüntüleme cihazı kullanılarak stomaların doğrudan gözlemlenmesi
NOT: Taşınabilir stoma görüntüleme cihazı bir LED ışık ve bir kamera modülü ile donatılmıştır ve yaklaşık 0,5 μm/piksel çözünürlüğe sahip 2.592 × 1.944 (yükseklik × genişlik; piksel) görüntü alabilir.
- Taşınabilir stoma görüntüleme cihazını, görüntü alma yazılımı ile donatılmış bir kişisel bilgisayara (PC) bağlayın.
- Aşılanmış yapraklardaki su damlacıklarını bir parça kağıtla nazikçe ama tamamen çıkarın.
- Cihazın üst kapağını açın, kanadı sahneye yerleştirin ve üst kapağı kapatın (Şekil 1).
- Ayar vidasını manipüle ederek görüntünün odağını ayarlayın, ardından PC ekranındaki Resmi Kaydet düğmesine tıklayın. Görüntü anında elde edilecektir. Tipik olarak, odaklanmış bir görüntü yaklaşık 10 analiz edilebilir stoma içerir. Sağlam sonuçlar elde etmek için, üç farklı bitkinin altı yaprağından stoma görüntüleri elde edin (bitki başına iki yaprak).
5. Stoma açıklığının manuel ölçümü
NOT: ImageJ yazılımı şu adresten indirilebilir: https://imagej.nih.gov/ij/download.html
- ImageJ'de bir görüntü dosyası açın.
- ROI Yöneticisi'ni Analiz > Araçları > seçerek ROI yöneticisini açın.
- Bir stomanın genişliğine karşılık gelen bir çizgi çizmek için Düz Çizgi seçim aracını kullanın (Şekil 2) ve ROI Yöneticisi'nde Ekle'ye tıklayarak ROI'yi kaydedin.
- Aynı stomanın uzunluğuna karşılık gelen bir çizgi çizin (Şekil 2A) ve ROI'yi adım 5.3'te açıklandığı gibi kaydedin.
- Genişliği ve uzunluğu ölçmek için ROI Yöneticisi'nde Ölç'e tıklayın.
- Stoma açıklığını (oranını) elde etmek için genişliği uzunluğa bölün. Sağlam miktar tayini için, her tedavi ve zaman noktası için 60 veya daha fazla stoma kullanın. Analiz için prematüre veya belirsiz stomaları seçmeyin (Şekil 2B, C).
6. Stoma açıklığının otomatik ölçümü
NOT: Görüntü analizi işlem hattı, bir bulut Python programlama dili yürütülebilir ortamı olan Google Colaboratory'de çalışır. Kullanıcıların, çalışan bir Google Drive, Google Chrome tarayıcısı ve ön koşul olarak sabit bir internet bağlantısı olan geçerli bir Google hesabına sahip olması gerekir.
- Zenodo'dan (https://doi-org.remotexs.ntu.edu.sg/10.5281/zenodo.8062528) Google Colaboratory not defterini indirin ve not defterini açın.
- Dosya > Drive'da bir kopyasını kaydet'i seçerek not defterinin Google Drive'da yerel bir kopyasını oluşturun. Yeni bir sekme göründükten sonra, özgün not defterinin sekmesini güvenli bir şekilde kapatın.
- Gerekli kitaplıkları içe aktarmak için hücre bloklarını açmadan not defterindeki Ortam Kurulumu bölümünün altındaki Yürüt düğmesine bir kez basın.
- Google Drive'da analiz için kullanılan üç klasör (ör. example_result, inference_results ve model) oluşturmak için Dizin Ayarları bölümünü yürütün.
NOT: Bu durumda, example_result, inference_results ve model adlı klasörler üst dizin olarak kullanılır ve sırasıyla çıkarım sonuçlarını ve eğitilen modelleri depolar. Bu not defteri, temsili bir yordam olarak dizin oluşturmanın bir örneğini gösterir. Adı değiştirmek için pardir, infdir veya modeldir yolunu yeniden yazın. - Görüntülerin Hazırlanması bölümüne göre, elde edilen görüntüleri, son grafik oluşturma için işleme veya örneğe (örneğin, mock_1h_XXXXXX.jpg) göre görüntü başlıklarında gruplandırılmış example_result'ye taşıyın. Örnek görüntüler Zenodo'dan (https://doi-org.remotexs.ntu.edu.sg/10.5281/zenodo.8062528) edinilebilir.
- Zenodo'dan (https://doi-org.remotexs.ntu.edu.sg/10.5281/zenodo.8062528) eğitilen modellerin ONNX dosyalarını indirmek ve bunları model dizininin altına yerleştirmek için Eğitilen Modelleri İndir bölümünü gerçekleştirin.
- Tek tek görüntülerden stoma açıklığını ölçmek için Stoma Açıklığının Çıkarımı ve Ölçümü bölümünü çalıştırın. Üst üste bindirilmiş çıkarıma sahip sonuç görüntüleri ve example_result.csv adlı csv dosyası inference_results dizinine aktarılır.
- inference_results dizinine aktarılan stoma açıklık oranı hakkında bir grafik oluşturmak için Grafik Oluşturma bölümünü yürütün.
Sonuçlar
Pto'nun sprey aşılanmasını takiben, aşılanmış bitkilere bağlı yapraklardaki stomalar, taşınabilir stoma görüntüleme cihazı tarafından doğrudan gözlemlendi. Manuel ve otomatik ölçümler kullanılarak, yaklaşık 60 stomanın genişlik / uzunluk oranları alınarak stoma açıklığını hesaplamak için aynı yaprak görüntüleri kullanıldı. Manuel ve otomatik ölçümler, aşılamadan (hpi) 1 saat sonra sahte aşılanmış bitkilere kıyasla Pto aşılanmış bitkilerde stoma açıklığında sürekli bir azalma olduğunu göstermiştir (Şekil 3A, B), bu da A thaliana bitkilerinin Pto istilasına yanıt olarak stomaları kapattığını göstermektedir. 3 hpi'de, Pto ile aşılanmış bitkilerde ve sahte aşılanmış bitkilerde stoma açıklığı hemen hemen aynıydı (Şekil 3C, D), Pto tarafından stomaların yeniden açılmasını anımsatıyordu. Dikkat çekici bir şekilde, stoma açıklığının otomatik ölçümünün bir görüntüyü işlemesi yalnızca yaklaşık 5 saniye sürdü (Tablo 1), bu da manuel ölçüme kıyasla ölçüm süresini %95'ten fazla azalttı. Bu nedenle, bu protokol, A. thaliana'nın bakteriyel patojene dinamik stoma tepkilerini izlemek için operasyonel olarak basit ve emek tasarrufu sağlayan bir araç sunar.

Şekil 1: Taşınabilir görüntüleme cihazı. Taşınabilir görüntüleme cihazını sahneye yerleştirilmiş bir kanatla (solda) ve üst kapağı kapalıyken (sağda) gösteren resimler. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
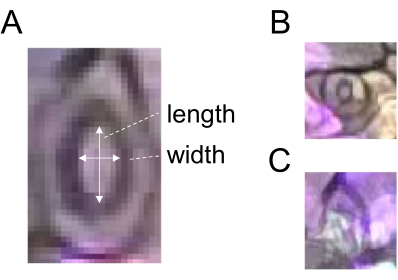
Şekil 2: Stoma açıklığı ölçümünün şematik diyagramı. (A) Stoma açıklığı, beyaz oklarla gösterildiği gibi, bir stomanın genişliğinin uzunluğuna oranı hesaplanarak belirlenir. (B) Prematüre ve (C) belirsiz stomalar ölçümden çıkarılmalıdır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Bozulmamış bir bütün bitkide Pto'ya stoma tepkileri. A. thaliana bitkileri mock veya Pto ile sprey aşılandı ve aşılanan bitkilere bağlı yapraklardaki stomalar portatif stoma görüntüleme cihazı ile (A,B) 1 hpi ve (C,D) 3 hpi'de doğrudan gözlendi. Stoma açıklığı (oranı) (A,C) manuel ve (B,D) otomatik ölçümlerle hesaplandı. P değerleri iki kuyruklu t-testi ile hesaplandı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| İşlem süresi (s) | ||
| Yöntem | Demek | SD |
| El ile | 130.1 | 48.8 |
| Otomatik | 4.7 | 0.8 |
Tablo 1: Görüntü başına stoma açıklığının manuel ve otomatik ölçümleri için işlem süresi. İşlem süresinin ortalamaları ve standart sapmaları (SD), dokuz temsili görüntünün ölçümlerinden hesaplandı.
Tartışmalar
Önceki çalışmalar, bakteri istilalarınastoma tepkilerini araştırmak için epidermal kabuklar, yaprak diskleri veya müstakil yapraklar kullandı 9,11,12. Buna karşılık, bu çalışmada önerilen yöntem, Pto'nun sprey aşılanmasından sonra bitkiye bağlı bir yaprak üzerindeki stomaları doğrudan gözlemlemek için taşınabilir stoma görüntüleme cihazından yararlanır ve bakteri istilasının doğal koşullarını taklit eder. Ayrıca bu yöntem, yaprak ayırma, yaprak diski eksizyonu ve epidermal soyulma gibi tahribatlı numune hazırlama işlemlerini içermediğinden, bu numune hazırlama işlemleriyle ilişkili yaralanma ve su kaybı önlenebilir. Yaralanma ve su kaybı kaçınılmaz olarak stoma hareketlerini etkileyen fitohormonlar jasmonat ve absisik asit gibi bitki kaynaklı sinyaller ürettiğinden, bu etkiler hafife alınmamalıdır13,14.
Taşınabilir stoma görüntüleme cihazının optimum kullanımı için birkaç kılavuz vardır. İlk olarak, yaprak yüzeylerinden su damlacıklarını tamamen çıkarmak, optimum netlik ve odaklanma görüntüleri elde etmek için çok önemlidir. İkinci olarak, odakta ince ayar yapmak için ayar vidasını manipüle ederek aynı yaprak alanlarından birden fazla görüntü almanız önerilir. Bu uygulamanın, yaprak alanı başına analiz edilebilir stoma sayısını artırması ve böylece potansiyel örnekleme yanlılıklarını azaltması beklenmektedir. Son olarak, cihazla bir yaprağı sıkıştırırken, yaprağa zarar vermemek için dikkatli kullanım gerekir. Bu kritiktir çünkü yaralanma, stoma kapanmasını ortaya çıkaran ipuçlarından biridir14.
Stoma açıklığı, otomatik ölçümde manuel ölçüme göre daha değişken olma eğilimindeydi (Şekil 3). Bunun birkaç olası nedeni vardır. Daha önce, görüntü analiz boru hattı tarafından çıkarılan stoma gözeneklerinin genellikle stoma gözeneklerini çevreleyen hücre duvarlarını ve/veya koruyucu hücrelerin gölgeleriniiçerdiği bildirilmişti 7, insan gözüyle manuel ölçümde durum böyle değildir. Alışılmadık şekillere sahip stomalar, manuel ve otomatik ölçümler arasındaki varyasyonu da etkileyebilir, ancak stoma algılama modeli bu tür stomaları analizden çıkarmak için eğitilmiştir7. Otomatik ölçümde stoma açıklığı için birkaç stomaya sıfır değer verildi, ancak bilinmeyen nedenlerle manuel ölçümde hiç değer verilmedi. Bu sorunları gidermek için modellerin gelecekteki güncellemeleri gerekli olabilir. Bununla birlikte, otomatik stoma açıklığı ölçümü esasen manuel ölçümle eşleştiğinden, görüntü analizi boru hattının mevcut sürümü pratik kullanımdadır.
Bu çalışmada tarif edilen A. thaliana'daki stoma açıklığının doğrudan gözlemlenmesi ve otomatik ölçümü, stomaların bitki çevresel adaptasyonundaki rolünü aydınlatmaya yönelik çeşitli uygulamalar için umut vaat etmektedir. Örneğin, sunulan yöntem, MAMP'ler ve mikrobiyal patojenler gibi biyotik streslerin yanı sıra kuraklık gibi abiyotik streslere maruz kaldıktan sonra bozulmamış bir bütün bitki sistemindeki stoma açıklığının hızlı bir şekilde ölçülmesi için geniş çapta uygulanabilir olmalıdır. Bunu desteklemek için, önceki bir çalışma, stoma açılmasını indükleyen mantar toksini fusikosin veya stoma kapanmasını indükleyen stres hormonu absisik asit ile tedavi edilen "yaprak disklerin" stoma açıklığını doğru bir şekilde ölçmek için görüntü analizi boru hattını başarıyla uyguladı7. Ayrıca, prensip olarak, taşınabilir görüntüleme cihazı, bitkiye bağlı tek bir özdeş yaprak üzerinde stoma açıklığının uzun süreli zaman seyri analizine izin verir. Bu, bitki-mikrop etkileşimlerinin yeni yönlerine ışık tutabilir, çünkü çoğu çalışma, etkileşimin ilk birkaç saati boyunca bakteriyel patojenlere karşı stoma tepkilerine odaklanmıştır 9,10,11. Çeşitli çevresel koşullar altında bakteri istilasına stoma tepkilerini araştırmak için sunulan yöntemi kullanmak ve değiştirmek de ilginç olacaktır. Bu, özellikle stoma hareketlerini ve bakteriyel patojenlerin hastalık gelişimini etkileyen sıcaklık, nem ve toprak suyu mevcudiyeti gibi çevresel faktörlerin etkilerini anlamakla ilgilidir 8,15. Sonuç olarak, sunulan yöntemin, şimdiye kadar ulaşılamayan deneysel ortamlar altında bitki-mikrop etkileşimleri içinde ve ötesinde stoma fonksiyonları üzerine araştırmaları hızlandırması öngörülmektedir.
Açıklamalar
Yazarların beyan edecek herhangi bir çıkar çatışması yoktur.
Teşekkürler
Verimli tartışmalar için 'Bitki-mikrop holobiontunun montajı yoluyla bitki adaptif özelliklerinin birlikte yaratılması' araştırma projesinin tüm üyelerine teşekkür ederiz. Bu çalışma, Dönüştürücü Araştırma Alanları için Yardım Hibesi (21H05151 ve 21H05149'dan A.M.'ye ve 21H05152'den YT'ye) ve Zorlu Keşif Araştırmaları için Yardım Hibesi (22K19178'den A.M.'ye) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Agar | Nakarai tesque | 01028-85 | |
| Airbrush kits | ANEST IWATA | MX2900 | Accessory kits for SPRINT JET |
| Biotron | Nippon Medical & Chemical Instruments | LPH-411S | Plant Growth Chamber with white fluorescent light |
| Glycerol | Wako | 072-00626 | |
| Half tray | Sakata | 72000113 | A set of tray and lid |
| Hyponex | Hyponex | No catalogue number available | Dilute the solution of Hyponex at a ratio of 1:2000 in deionized water for watering plants |
| Image J | Natinal Institute of Health | Download at https://imagej.nih.gov/ij/download.html | Used for manual measurement of stomatal aperture |
| K2HPO4 | Wako | 164-04295 | |
| KCl | Wako | 163-03545 | |
| KOH | Wako | 168-21815 | For MES-KOH |
| MES | Wako | 343-01621 | For MES-KOH |
| Portable stomatal imaging device | Phytometrics | Order at https://www.phytometrics.jp/ | Takagi et al.(2023) doi: 10.1093/pcp/pcad018. |
| Rifampicin | Wako | 185-01003 | Dissolve in DMSO |
| Silwet-L77 | Bio medical science | BMS-SL7755 | silicone surfactant used in spray inoculation |
| SPRINT JET | ANEST IWATA | IS-800 | Airbrush used for spray inoculation |
| SuperMix A | Sakata seed | 72000083 | Mix with Vermiculite G20 in equal proportions for preparing soil |
| Tryptone | Nakarai tesque | 35640-95 | |
| Vermiculite G20 | Nittai | No catalogue number available | Mix with Super Mix A in equal proportions for preparing soil |
| White fluorescent light | NEC | FHF32EX-N-HX-S | Used for Biotron |
Referanslar
- Shimono, M., Higaki, T., Kaku, H., Shibuya, N., Hasezawa, S., Day, B. Quantitative evaluation of stomatal cytoskeletal patterns during the activation of immune signaling in Arabidopsis thaliana. PLoS One. 11, e0159291 (2016).
- Bourdais, G., et al. The use of quantitative imaging to investigate regulators of membrane trafficking in Arabidopsis stomatal closure. Traffic. 20 (2), 168-180 (2019).
- Higaki, T., Kutsuna, N., Hasezawa, S. CARTA-based semi-automatic detection of stomatal regions on an Arabidopsis cotyledon surface. Plant Morphology. 26 (1), 9-12 (2014).
- Eisele, J. F., Fäßler, F., Bürgel, F., Chaban, C. A. A rapid and simple method for microscopy-based stomata analyses. PLoS One. 11, e0164576 (2016).
- Chitraker, R., Melotto, M. Assessing stomatal response to live bacterial cells using whole leaf imaging. Journal of Visualized Experiments. 44, 2185 (2010).
- Sai, N., et al. StomaAI: an efficient and user-friendly tool for measurement of stomatal pores and density using deep computer vision. New Phytologist. 238 (2), 904-915 (2023).
- Takagi, M., et al. Image-based quantification of Arabidopsis thaliana stomatal aperture from leaf images. Plant and Cell Physiology. pcad018, (2023).
- Melotto, M., Zhang, L., Oblessuc, P. R., He, S. Y. Stomatal defense a decade later. Plant Physiology. 174 (2), 561-571 (2017).
- Melotto, M., Underwood, W., Koczan, J., Nomura, K., He, S. Y. Plant stomata function in innate immunity against bacterial invasion. Cell. 126 (5), 969-980 (2006).
- Zeng, W., He, S. A prominent role of the flagellin receptor FLAGELLIN-SENSING2 in mediating stomatal response to Pseudomonas syringae pv tomato DC3000 in Arabidopsis. Plant Physiology. 153 (3), 1188-1198 (2010).
- Zheng, X. Y., et al. Coronatine promotes Pseudomonas syringae virulence in plants by activating a signaling cascade that inhibits salicylic acid accumulation. Cell Host and Microbe. 11 (6), 587-596 (2012).
- Raffeiner, M., et al. The Xanthomonas type-III effector XopS stabilizes CaWRKY40a to regulate defense responses and stomatal immunity in pepper (Capsicum annuum). The Plant Cell. 34 (5), 1684-1708 (2022).
- Munemasa, S., Hauser, F., Park, J., Waadt, R., Brandt, B., Schroeder, J. I. Mechanisms of abscisic acid-mediated control of stomatal aperture. Current Opinion in Plant Biology. 28, 154-162 (2015).
- Förster, S., et al. Wounding-induced stomatal closure requires jasmonate-mediated activation of GORK K+ channels by a Ca2+ sensor-kinase CBL1-CIPK5 complex. Developmental Cell. 48 (1), 87-99 (2018).
- Cheng, Y. T., Zhang, L., He, S. Y. Plant-microbe interactions facing environmental challenge. Cell Host and Microbe. 26 (2), 183-192 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır