Method Article
Observation directe et mesure automatisée des réponses stomatiques à Pseudomonas syringae pv. tomate DC3000 chez Arabidopsis thaliana
Dans cet article
Résumé
Ici, nous présentons une méthode simple d’observation directe et de mesure automatisée des réponses stomatiques à l’invasion bactérienne chez Arabidopsis thaliana. Cette méthode exploite un dispositif d’imagerie stomatique portable, ainsi qu’un pipeline d’analyse d’images conçu pour les images de feuilles capturées par l’appareil.
Résumé
Les stomates sont des pores microscopiques présents dans l’épiderme des feuilles de la plante. La régulation de l’ouverture des stomates est essentielle non seulement pour équilibrer l’absorption de dioxyde de carbone pour la photosynthèse et la perte d’eau par transpiration, mais aussi pour limiter l’invasion bactérienne. Alors que les plantes ferment les stomates lors de la reconnaissance de microbes, les bactéries pathogènes, telles que Pseudomonas syringae pv. tomate DC3000 (PDF), rouvrez les stomates fermés pour accéder à l’intérieur de la feuille. Dans les essais conventionnels d’évaluation des réponses stomatiques à l’invasion bactérienne, les pelures épidermiques des feuilles, les disques foliaires ou les feuilles détachées sont flottés sur une suspension bactérienne, puis les stomates sont observés au microscope suivi d’une mesure manuelle de l’ouverture des stomates. Cependant, ces tests sont lourds et peuvent ne pas refléter les réponses stomatiques à l’invasion bactérienne naturelle dans une feuille attachée à la plante. Récemment, un appareil d’imagerie portable a été développé qui peut observer les stomates en pinçant une feuille sans la détacher de la plante, ainsi qu’un pipeline d’analyse d’images basé sur l’apprentissage profond conçu pour mesurer automatiquement l’ouverture des stomates à partir d’images de feuilles capturées par l’appareil. Ici, en s’appuyant sur ces avancées techniques, une nouvelle méthode pour évaluer les réponses stomatiques à l’invasion bactérienne chez Arabidopsis thaliana est introduite. Cette méthode se compose de trois étapes simples : l’inoculation par pulvérisation de la PTO imitant les processus naturels d’infection, l’observation directe des stomates sur une feuille de la plante inoculée à la PTO à l’aide de l’appareil d’imagerie portable et la mesure automatisée de l’ouverture des stomates par le pipeline d’analyse d’images. Cette méthode a été utilisée avec succès pour démontrer la fermeture et la réouverture des stomates lors de l’invasion de la PTO dans des conditions qui imitent étroitement l’interaction naturelle plante-bactérie.
Introduction
Les stomates sont des pores microscopiques entourés d’une paire de cellules de garde à la surface des feuilles et d’autres parties aériennes des plantes. Dans des environnements en constante évolution, la régulation de l’ouverture stomatique est essentielle pour que les plantes contrôlent l’absorption de dioxyde de carbone nécessaire à la photosynthèse au détriment de la perte d’eau par transpiration. Ainsi, la quantification de l’ouverture des stomates a été déterminante pour comprendre l’adaptation environnementale des plantes. Cependant, la quantification de l’ouverture stomatique est intrinsèquement longue et fastidieuse car elle nécessite un travail humain pour repérer et mesurer les pores stomatiques dans une image de feuille capturée au microscope. Pour contourner ces limites, diverses méthodes ont été développées pour faciliter la quantification de l’ouverture stomatique chez Arabidopsis thaliana, une plante modèle largement utilisée pour étudier la biologie stomatique 1,2,3,4,5,6. Par exemple, un poromètre peut être utilisé pour mesurer le taux de transpiration comme mesure de la conductance stomatique. Cependant, cette méthode ne fournit pas d’informations directes sur le nombre et l’ouverture des stomates qui déterminent la conductance stomatique. Certaines études ont utilisé des techniques de microscopie confocale mettant en évidence les pores stomatiques à l’aide d’un marqueur d’actine fluorescent, d’un colorant fluorescent ou d’une autofluorescence de la paroi cellulaire 1,2,3,4,5. Bien que ces approches facilitent la détection des stomates, le coût d’exploitation d’une installation de microscopie confocale et de la préparation des échantillons de microscopie peut constituer un obstacle à l’application de routine. Dans le cadre d’un travail novateur de Sai et al., un modèle de réseau neuronal profond a été développé pour mesurer automatiquement l’ouverture des stomates à partir d’images microscopiques en fond clair de peelings épidermiques d’A. thaliana 6. Pourtant, cette innovation ne dispense pas les chercheurs de préparer un peeling épidermique pour l’observation microscopique. Récemment, cet obstacle a été surmonté en développant un appareil d’imagerie portable capable d’observer les stomates en pinçant une feuille d’A. thaliana, ainsi qu’un pipeline d’analyse d’images basé sur l’apprentissage profond qui mesure automatiquement l’ouverture des stomates à partir des images de feuilles capturées par l’appareil7.
Les stomates contribuent à l’immunité innée des plantes contre les bactéries pathogènes. La clé de cette réponse immunitaire est la fermeture stomatique qui limite l’entrée des bactéries par le pore microscopique à l’intérieur des feuilles, où les bactéries pathogènes prolifèrent et provoquent des maladies8. La fermeture stomatique est induite lors de la reconnaissance de modèles moléculaires associés aux microbes (MAMP), des molécules immunogènes souvent communes à une classe de microbes, par des récepteurs de reconnaissance de formes (PRR) localisés par la membrane plasmique9. Un épitope de 22 acides aminés de la flagelline bactérienne connu sous le nom de flg22 est un MAMP typique qui induit la fermeture stomatique grâce à sa reconnaissance par le PRR FLS210. En contre-mesure, des bactéries pathogènes telles que Pseudomonas syringae pv. tomate DC3000 (Pto) et Xanthomonas campestris pv. Les vésicatories ont développé des mécanismes de virulence pour rouvrir les stomates 9,11,12. Ces réponses stomatiques aux agents pathogènes bactériens ont été analysées de manière conventionnelle dans des essais dans lesquels des pelures épidermiques de feuilles, des disques foliaires ou des feuilles détachées sont flottés sur une suspension bactérienne, puis les stomates sont observés au microscope suivis d’une mesure manuelle de l’ouverture stomatique. Cependant, ces tests sont lourds et peuvent ne pas refléter les réponses stomatiques à l’invasion bactérienne naturelle qui se produisent dans une feuille attachée à la plante.
Ici, une méthode simple est présentée pour étudier la fermeture et la réouverture des stomates lors de l’invasion de la PTO dans des conditions qui imitent étroitement l’interaction naturelle plante-bactérie. Cette méthode exploite le dispositif d’imagerie portable pour l’observation directe des stomates d’A. thaliana sur une feuille attachée à la plante inoculée avec la Pto, ainsi que le pipeline d’analyse d’images pour la mesure automatisée de l’ouverture des stomates.
Protocole
1. Cultiver des plantes
- Pour sortir de la dormance, remettre les graines d’A. thaliana (Col-0) en suspension dans de l’eau désionisée et les incuber à 4 °C pendant 4 jours dans l’obscurité.
- Semez les graines sur le sol et cultivez-les dans une chambre équipée d’une lumière fluorescente blanche. Maintenir les conditions de croissance suivantes : température de 22 °C, intensité lumineuse de 6 000 lux (environ 100 μmol/m2/s) pendant 10 h et humidité relative de 60 %.
- Au besoin, arrosez les plantes avec un engrais liquide. S’abstenir d’arroser de 1 semaine à 2 jours avant l’inoculation et arroser bien 1 jour avant l’inoculation.
2. Préparation de l’inoculum bactérien
- Laisser des traces de PTO à partir de glycérol sur du milieu King’s B (KB) solidifié (20 g de tryptone, 1,5 g de K2HPO4 et 15 g de glycérol pour 1 L, 1,5 % de gélose) avec 50 μg/mL de rifampicine et incuber à 28 °C pendant 2 jours.
- Inoculer une seule colonie à 5 mL de milieu liquide KB avec 50 μg/mL de rifampicine et incuber à 28 °C en agitant à 200 tr/min jusqu’à la fin de la phase de croissance logarithmique.
- Centrifuger la culture à 6 000 x g pendant 2 min, jeter le surnageant et remettre la pastille en suspension dans 1 mL d’eau stérile. Répétez cette étape une fois de plus.
- Retirer le surnageant, remettre la pastille en suspension dans 1 mL de tampon d’ouverture de stomates (25 mM MES-KOH pH 6,15, 10 mM KCl) et mesurer la DO600.
- Diluer la suspension àOD 600 0,2 avec un tampon d’ouverture de stomates contenant 0,04 % de tensioactif de silicone.
3. Inoculation par pulvérisation des bactéries
- De 1 jour avant l’inoculation jusqu’à la fin de l’expérience, exposer les plantes à une intensité lumineuse d’environ 10 000 lux (environ 170 μmol/m2/s).
- Pour vous assurer que la plupart des stomates sont ouverts, gardez les plantes sur un plateau recouvert d’un couvercle transparent sous la lumière pendant au moins 3 heures avant l’inoculation par pulvérisation.
- Retirez le couvercle et utilisez un aérographe pour pulvériser le côté abaxial des feuilles avec 2,5 ml de suspension bactérienne par trois plantes dans un seul pot.
- Incuber les plantes inoculées sur un plateau recouvert d’un couvercle transparent pour maintenir une humidité relative d’environ 85%.
- Obtenir des images des stomates 1 h et 3 h après l’inoculation par pulvérisation en utilisant la méthode décrite dans la section 4.
4. Observation directe des stomates à l’aide de l’appareil d’imagerie portable
REMARQUE : L’appareil d’imagerie stomatique portable est équipé d’une lumière LED et d’un module de caméra et peut acquérir 2 592 × 1 944 (hauteur × largeur ; pixels) images avec une résolution d’environ 0,5 μm/pixel.
- Connectez l’appareil d’imagerie stomatique portable à un ordinateur personnel (PC) équipé d’un logiciel d’acquisition d’images.
- Retirez délicatement mais complètement les gouttelettes d’eau des feuilles inoculées avec un morceau de papier.
- Ouvrez le capot supérieur de l’appareil, placez la feuille sur la platine et fermez le capot supérieur (Figure 1).
- Ajustez la mise au point de l’image en manipulant la vis de réglage, puis cliquez sur le bouton Enregistrer l’image sur l’écran du PC. L’image sera acquise instantanément. En règle générale, une image focalisée contient environ 10 stomates analysables. Pour obtenir des résultats robustes, acquérir des images stomatiques de six feuilles de trois plantes différentes (deux feuilles par plante).
5. Mesure manuelle de l’ouverture des stomates
REMARQUE : Le logiciel ImageJ peut être téléchargé à l’adresse https://imagej.nih.gov/ij/download.html
- Ouvrez un fichier image dans l’ImageJ.
- Ouvrez le gestionnaire de retour sur investissement en sélectionnant Analyser les outils > > Gestionnaire de retour sur investissement.
- Utilisez l’outil de sélection en ligne droite pour tracer une ligne correspondant à la largeur d’une stomie (Figure 2) et enregistrez le retour sur investissement en cliquant sur Ajouter dans le gestionnaire de retour sur investissement.
- Tracez une ligne correspondant à la longueur de la même stomie (figure 2A) et enregistrez le retour sur investissement comme décrit à l’étape 5.3.
- Cliquez sur Mesurer dans le gestionnaire de retour sur investissement pour mesurer la largeur et la longueur.
- Divisez la largeur par la longueur pour obtenir l’ouverture stomatique (rapport). Pour une quantification robuste, utilisez 60 stomates ou plus pour chaque traitement et chaque point temporel. Ne choisissez pas de stomates prématurés ou obscurs pour l’analyse (Figure 2B, C).
6. Mesure automatisée de l’ouverture des stomates
REMARQUE : Le pipeline d’analyse d’images s’exécute dans Google Colaboratory, un environnement exécutable du langage de programmation Python dans le cloud. Les utilisateurs doivent disposer d’un compte Google valide avec un Google Drive fonctionnel, un navigateur Google Chrome et une connexion Internet stable comme condition préalable.
- Téléchargez le bloc-notes Google Colaboratory à partir de Zenodo (https://doi-org.remotexs.ntu.edu.sg/10.5281/zenodo.8062528) et ouvrez-le.
- Effectuez une copie locale du bloc-notes dans Google Drive en sélectionnant Fichier > Enregistrer une copie dans Drive. Une fois qu’un nouvel onglet s’affiche, fermez en toute sécurité l’onglet du bloc-notes d’origine.
- Appuyez une fois sur le bouton Exécuter sous la section Configuration de l’environnement dans le bloc-notes sans déplier les blocs de cellules pour importer les bibliothèques requises.
- Exécutez la section Paramètres du répertoire pour créer trois dossiers utilisés pour l’analyse (par exemple, example_result, inference_results et modèle) dans Google Drive.
REMARQUE : Dans ce cas, les dossiers nommés example_result, inference_results et model sont utilisés comme répertoire parental, stockant respectivement les résultats d’inférence et les modèles entraînés. Ce bloc-notes montre un exemple de construction d’annuaire en tant que procédure représentative. Pour modifier le nom, réécrivez le chemin pardir, infdir ou modeldir . - Selon la section Préparation des images , déplacez les images acquises vers example_result, regroupées dans des titres d’images par traitement ou par échantillon (par exemple, mock_1h_XXXXXX.jpg) pour la génération finale du graphique. Des exemples d’images sont disponibles auprès de Zenodo (https://doi-org.remotexs.ntu.edu.sg/10.5281/zenodo.8062528).
- Effectuez la partie Télécharger les modèles entraînés pour télécharger les fichiers ONNX des modèles entraînés à partir de Zenodo (https://doi-org.remotexs.ntu.edu.sg/10.5281/zenodo.8062528) et placez-les dans le répertoire du modèle .
- Exécutez la partie Inférence et mesure de l’ouverture stomatique pour quantifier l’ouverture stomatique à partir d’images individuelles. Les images résultantes avec l’inférence superposée et le fichier csv nommé example_result.csv seront exportées vers le répertoire inference_results.
- Exécutez la section Génération de graphes pour créer un graphique sur le rapport d’ouverture des stomates, exporté vers le répertoire inference_results .
Résultats
Après l’inoculation de la PTO par pulvérisation, les stomates sur les feuilles attachées aux plantes inoculées ont été directement observés par le dispositif d’imagerie stomatique portable. À l’aide de mesures manuelles et automatisées, les mêmes images de feuilles ont été utilisées pour calculer l’ouverture stomatique en prenant des rapports largeur/longueur d’environ 60 stomates. Les mesures manuelles et automatisées ont systématiquement indiqué une diminution de l’ouverture stomatique chez les plantes inoculées par Pto par rapport aux plantes inoculées par simulation 1 heure après l’inoculation (hpi) (Figure 3A,B), indiquant que les plantes A thaliana ferment les stomates en réponse à l’invasion de la Pto. À 3 hpi, l’ouverture stomatique chez les plantes inoculées par Pto et les plantes inoculées par simulation était pratiquement la même (Figure 3C, D), rappelant la réouverture des stomates par Pto. Remarquablement, la mesure automatisée de l’ouverture des stomates n’a pris qu’environ 5 s pour traiter une image (tableau 1), réduisant le temps de mesure de plus de 95 % par rapport à la mesure manuelle. Ainsi, ce protocole offre un moyen simple et économique de suivre les réponses stomatiques dynamiques d’A. thaliana à l’agent pathogène bactérien.

Figure 1 : appareil d’imagerie portable. Images représentant l’appareil d’imagerie portable avec un feuillet placé sur la scène (à gauche) et avec le capot supérieur fermé (à droite). Veuillez cliquer ici pour voir une version agrandie de cette figure.
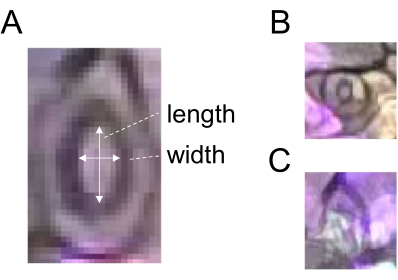
Figure 2 : Schéma de principe de la mesure de l’ouverture des stomates. (A) L’ouverture stomatique est déterminée en calculant le rapport entre la largeur et la longueur d’une stomie, comme indiqué par des flèches blanches. (B) Les stomates prématurés et (C) obscurs doivent être exclus de la mesure. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Réponses stomatiques à la Pto dans une plante entière intacte. Les plantes d’A. thaliana ont été inoculées par pulvérisation avec du faux ou de la Pto, et les stomates sur les feuilles attachées aux plantes inoculées ont été directement observés à (A,B) 1 hpi et (C,D) 3 hpi par le dispositif d’imagerie stomatique portable. L’ouverture stomatique (rapport) a été calculée par des mesures manuelles (A,C) et (B,D) automatisées. Les valeurs p ont été calculées par un test t bilatéral. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Délai(s) de traitement | ||
| Méthode | Méchant | SD |
| Manuelle | 130.1 | 48.8 |
| Automatisé | 4.7 | 0.8 |
Tableau 1 : Temps de traitement pour les mesures manuelles et automatisées de l’ouverture des stomates par image. Les moyennes et les écarts-types (ET) du temps de traitement ont été calculés à partir des mesures de neuf images représentatives.
Discussion
Des études antérieures ont utilisé des pelures épidermiques, des disques de feuilles ou des feuilles détachées pour étudier les réponses stomatiques aux invasions bactériennes 9,11,12. En revanche, la méthode proposée dans cette étude utilise le dispositif d’imagerie stomatique portable pour observer directement les stomates sur une feuille attachée à la plante après l’inoculation par pulvérisation de Pto, imitant les conditions naturelles d’invasion bactérienne. De plus, comme cette méthode n’implique pas de processus destructifs de préparation d’échantillons tels que le détachement des feuilles, l’excision du disque foliaire et le pelage épidermique, les blessures et la perte d’eau associées à ces processus de préparation des échantillons peuvent être évitées. Ces effets ne doivent pas être pris à la légère, car les blessures et la perte d’eau produisent inévitablement des signaux d’origine végétale tels que les phytohormones jasmonate et acide abscissique qui affectent les mouvements des stomates13,14.
Il existe plusieurs directives pour l’utilisation optimale de l’appareil d’imagerie stomatique portable. Tout d’abord, il est primordial d’éliminer soigneusement les gouttelettes d’eau de la surface des feuilles pour obtenir des images d’une clarté et d’une mise au point optimales. Deuxièmement, il est recommandé de prendre plusieurs images à partir de zones de feuilles identiques en manipulant la vis de réglage pour affiner la mise au point. Cette pratique devrait augmenter le nombre de stomates analysables par surface foliaire, atténuant ainsi les biais d’échantillonnage potentiels. Enfin, lors du pincement d’une feuille avec l’appareil, une manipulation prudente est nécessaire pour éviter d’endommager la feuille. Ceci est essentiel car la blessure est l’un des signaux qui provoquent la fermeture stomatique14.
L’ouverture stomatique avait tendance à être plus variable dans la mesure automatisée que dans la mesure manuelle (Figure 3). Il y a plusieurs raisons possibles à cela. Il a été précédemment rapporté que les pores stomatiques déduits par le pipeline d’analyse d’images incluent souvent des parois cellulaires et/ou des ombres de cellules de garde entourant le pore stomatique7, ce qui n’est pas le cas dans la mesure manuelle par l’œil humain. Les stomates de forme inhabituelle peuvent également affecter la variation entre les mesures manuelles et automatisées, bien que le modèle de détection des stomates ait été entraîné pour exclure ces stomates de l’analyse7. Quelques stomates ont reçu des valeurs nulles pour l’ouverture des stomates dans la mesure automatisée, mais aucune dans la mesure manuelle pour des raisons inconnues. Des mises à jour futures des modèles pourraient être nécessaires pour résoudre ces problèmes. Néanmoins, comme la mesure automatisée de l’ouverture des stomates correspondait essentiellement à la mesure manuelle, la version actuelle du pipeline d’analyse d’images est d’une utilité pratique.
L’observation directe et la mesure automatisée de l’ouverture des stomates chez A. thaliana décrites dans cette étude sont prometteuses pour diverses applications visant à élucider le rôle des stomates dans l’adaptation environnementale des plantes. Par exemple, la méthode présentée devrait être largement applicable pour quantifier rapidement l’ouverture stomatique dans un système végétal entier intact après une exposition à des stress biotiques tels que les MAMP et les agents pathogènes microbiens ainsi qu’à des stress abiotiques tels que la sécheresse. À l’appui de cela, une étude antérieure a appliqué avec succès le pipeline d’analyse d’images pour quantifier avec précision l’ouverture stomatique des « disques foliaires » traités avec la toxine fongique fusicoccine qui induit l’ouverture stomatique ou l’hormone du stress, l’acide abscissique qui induit la fermeture des stomates7. De plus, en principe, l’appareil d’imagerie portable permet une analyse à long terme de l’ouverture stomatique sur une seule feuille identique attachée à la plante. Cela pourrait faire la lumière sur de nouveaux aspects des interactions plantes-microbes, car la plupart des études se sont concentrées sur les réponses stomatiques aux agents pathogènes bactériens pendant les premières heures de l’interaction 9,10,11. Il sera également intéressant d’utiliser et de modifier la méthode présentée pour explorer les réponses stomatiques à l’invasion bactérienne dans diverses conditions environnementales. Ceci est particulièrement pertinent pour comprendre les impacts des facteurs environnementaux tels que la température, l’humidité et la disponibilité de l’eau du sol qui affectent les mouvements des stomates et le développement de maladies par des bactéries pathogènes 8,15. En conclusion, la méthode présentée sera envisagée pour accélérer la recherche sur les fonctions stomatiques dans et au-delà des interactions plantes-microbes dans des contextes expérimentaux jusqu’ici inaccessibles.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à déclarer.
Remerciements
Nous remercions tous les membres du projet de recherche, « Co-création de traits adaptatifs végétaux via l’assemblage d’holobiontes plantes-microbes », pour leurs discussions fructueuses. Ce travail a été soutenu par la subvention pour les domaines de recherche transformatrice (21H05151 et 21H05149 à A.M. et 21H05152 à Y.T.) et la subvention pour la recherche exploratoire stimulante (22K19178 à A. M.).
matériels
| Name | Company | Catalog Number | Comments |
| Agar | Nakarai tesque | 01028-85 | |
| Airbrush kits | ANEST IWATA | MX2900 | Accessory kits for SPRINT JET |
| Biotron | Nippon Medical & Chemical Instruments | LPH-411S | Plant Growth Chamber with white fluorescent light |
| Glycerol | Wako | 072-00626 | |
| Half tray | Sakata | 72000113 | A set of tray and lid |
| Hyponex | Hyponex | No catalogue number available | Dilute the solution of Hyponex at a ratio of 1:2000 in deionized water for watering plants |
| Image J | Natinal Institute of Health | Download at https://imagej.nih.gov/ij/download.html | Used for manual measurement of stomatal aperture |
| K2HPO4 | Wako | 164-04295 | |
| KCl | Wako | 163-03545 | |
| KOH | Wako | 168-21815 | For MES-KOH |
| MES | Wako | 343-01621 | For MES-KOH |
| Portable stomatal imaging device | Phytometrics | Order at https://www.phytometrics.jp/ | Takagi et al.(2023) doi: 10.1093/pcp/pcad018. |
| Rifampicin | Wako | 185-01003 | Dissolve in DMSO |
| Silwet-L77 | Bio medical science | BMS-SL7755 | silicone surfactant used in spray inoculation |
| SPRINT JET | ANEST IWATA | IS-800 | Airbrush used for spray inoculation |
| SuperMix A | Sakata seed | 72000083 | Mix with Vermiculite G20 in equal proportions for preparing soil |
| Tryptone | Nakarai tesque | 35640-95 | |
| Vermiculite G20 | Nittai | No catalogue number available | Mix with Super Mix A in equal proportions for preparing soil |
| White fluorescent light | NEC | FHF32EX-N-HX-S | Used for Biotron |
Références
- Shimono, M., Higaki, T., Kaku, H., Shibuya, N., Hasezawa, S., Day, B. Quantitative evaluation of stomatal cytoskeletal patterns during the activation of immune signaling in Arabidopsis thaliana. PLoS One. 11, e0159291 (2016).
- Bourdais, G., et al. The use of quantitative imaging to investigate regulators of membrane trafficking in Arabidopsis stomatal closure. Traffic. 20 (2), 168-180 (2019).
- Higaki, T., Kutsuna, N., Hasezawa, S. CARTA-based semi-automatic detection of stomatal regions on an Arabidopsis cotyledon surface. Plant Morphology. 26 (1), 9-12 (2014).
- Eisele, J. F., Fäßler, F., Bürgel, F., Chaban, C. A. A rapid and simple method for microscopy-based stomata analyses. PLoS One. 11, e0164576 (2016).
- Chitraker, R., Melotto, M. Assessing stomatal response to live bacterial cells using whole leaf imaging. Journal of Visualized Experiments. 44, 2185 (2010).
- Sai, N., et al. StomaAI: an efficient and user-friendly tool for measurement of stomatal pores and density using deep computer vision. New Phytologist. 238 (2), 904-915 (2023).
- Takagi, M., et al. Image-based quantification of Arabidopsis thaliana stomatal aperture from leaf images. Plant and Cell Physiology. pcad018, (2023).
- Melotto, M., Zhang, L., Oblessuc, P. R., He, S. Y. Stomatal defense a decade later. Plant Physiology. 174 (2), 561-571 (2017).
- Melotto, M., Underwood, W., Koczan, J., Nomura, K., He, S. Y. Plant stomata function in innate immunity against bacterial invasion. Cell. 126 (5), 969-980 (2006).
- Zeng, W., He, S. A prominent role of the flagellin receptor FLAGELLIN-SENSING2 in mediating stomatal response to Pseudomonas syringae pv tomato DC3000 in Arabidopsis. Plant Physiology. 153 (3), 1188-1198 (2010).
- Zheng, X. Y., et al. Coronatine promotes Pseudomonas syringae virulence in plants by activating a signaling cascade that inhibits salicylic acid accumulation. Cell Host and Microbe. 11 (6), 587-596 (2012).
- Raffeiner, M., et al. The Xanthomonas type-III effector XopS stabilizes CaWRKY40a to regulate defense responses and stomatal immunity in pepper (Capsicum annuum). The Plant Cell. 34 (5), 1684-1708 (2022).
- Munemasa, S., Hauser, F., Park, J., Waadt, R., Brandt, B., Schroeder, J. I. Mechanisms of abscisic acid-mediated control of stomatal aperture. Current Opinion in Plant Biology. 28, 154-162 (2015).
- Förster, S., et al. Wounding-induced stomatal closure requires jasmonate-mediated activation of GORK K+ channels by a Ca2+ sensor-kinase CBL1-CIPK5 complex. Developmental Cell. 48 (1), 87-99 (2018).
- Cheng, Y. T., Zhang, L., He, S. Y. Plant-microbe interactions facing environmental challenge. Cell Host and Microbe. 26 (2), 183-192 (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon