Method Article
Observación directa y medición automatizada de las respuestas estomáticas a Pseudomonas syringae pv. tomate DC3000 en Arabidopsis thaliana
En este artículo
Resumen
Aquí, presentamos un método simple para la observación directa y la medición automatizada de las respuestas estomáticas a la invasión bacteriana en Arabidopsis thaliana. Este método aprovecha un dispositivo portátil de imágenes estomáticas, junto con una canalización de análisis de imágenes diseñada para imágenes foliares capturadas por el dispositivo.
Resumen
Los estomas son poros microscópicos que se encuentran en la epidermis de las hojas de las plantas. La regulación de la apertura estomática es fundamental no solo para equilibrar la absorción de dióxido de carbono para la fotosíntesis y la pérdida transpiracional de agua, sino también para restringir la invasión bacteriana. Mientras que las plantas cierran los estomas al reconocer los microbios, las bacterias patógenas, como Pseudomonas syringae pv. tomate DC3000 (Pto), vuelva a abrir los estomas cerrados para acceder al interior de la hoja. En los ensayos convencionales para evaluar las respuestas de los estomas a la invasión bacteriana, las cáscaras epidérmicas de las hojas, los discos de las hojas o las hojas desprendidas flotan en suspensión bacteriana, y luego los estomas se observan bajo un microscopio seguido de una medición manual de la apertura de los estomas. Sin embargo, estos ensayos son engorrosos y es posible que no reflejen las respuestas estomáticas a la invasión bacteriana natural en una hoja adherida a la planta. Recientemente, se desarrolló un dispositivo de imagen portátil que puede observar los estomas pellizcando una hoja sin separarla de la planta, junto con una tubería de análisis de imágenes basada en el aprendizaje profundo diseñada para medir automáticamente la apertura de los estomas a partir de imágenes de hojas capturadas por el dispositivo. Aquí, sobre la base de estos avances técnicos, se presenta un nuevo método para evaluar las respuestas estomáticas a la invasión bacteriana en Arabidopsis thaliana . Este método consta de tres sencillos pasos: inoculación por pulverización de Pto imitando los procesos naturales de infección, observación directa de los estomas en una hoja de la planta inoculada con Pto utilizando el dispositivo portátil de obtención de imágenes y medición automatizada de la apertura estomática mediante la tubería de análisis de imágenes. Este método se utilizó con éxito para demostrar el cierre y la reapertura de los estomas durante la invasión de la toma de fuerza en condiciones que imitan de cerca la interacción natural planta-bacteria.
Introducción
Los estomas son poros microscópicos rodeados por un par de células protectoras en la superficie de las hojas y otras partes aéreas de las plantas. En entornos en constante cambio, la regulación de la apertura estomática es fundamental para que las plantas controlen la absorción de dióxido de carbono necesaria para la fotosíntesis a expensas de la pérdida de agua a través de la transpiración. Por lo tanto, la cuantificación de la apertura estomática ha sido fundamental para comprender la adaptación ambiental de las plantas. Sin embargo, cuantificar la apertura estomática es inherentemente lento y engorroso, ya que requiere trabajo humano para detectar y medir los poros de los estomas en una imagen de hoja capturada por un microscopio. Para sortear estas limitaciones, se han desarrollado diversos métodos para facilitar la cuantificación de la apertura estomática en Arabidopsis thaliana, una planta modelo ampliamente utilizada para estudiar la biología estomática 1,2,3,4,5,6. Por ejemplo, se puede utilizar un porómetro para medir la tasa de transpiración como medida de la conductancia estomática. Sin embargo, este método no proporciona información directa sobre el número y la apertura de los estomas que determinan la conductancia estomática. Algunos estudios han utilizado técnicas de microscopía confocal que resaltan los poros de los estomas utilizando un marcador de actina fluorescente, un colorante fluorescente o autofluorescencia de la pared celular 1,2,3,4,5. Si bien estos enfoques facilitan la detección de estomas, el costo de operar una instalación de microscopía confocal y preparar muestras de microscopía puede ser un obstáculo para la aplicación rutinaria. En un trabajo pionero de Sai et al., se desarrolló un modelo de red neuronal profunda para medir automáticamente la apertura estomática a partir de imágenes microscópicas de campo claro de exfoliaciones epidérmicas de A. thaliana 6. Sin embargo, esta innovación no exime a los investigadores de la tarea de preparar un peeling epidérmico para su observación microscópica. Recientemente, este obstáculo se superó mediante el desarrollo de un dispositivo de imagen portátil que puede observar los estomas pellizcando una hoja de A. thaliana, junto con una tubería de análisis de imágenes basada en el aprendizaje profundo que mide automáticamente la apertura de los estomas a partir de imágenes de hojas capturadas por el dispositivo7.
Los estomas contribuyen a la inmunidad innata de las plantas contra los patógenos bacterianos. La clave de esta respuesta inmune es el cierre estomatológico que restringe la entrada bacteriana a través del poro microscópico hacia el interior de la hoja, donde los patógenos bacterianos proliferan y causan enfermedades8. El cierre de los estomas se induce tras el reconocimiento de patrones moleculares asociados a microbios (MAMP), moléculas inmunogénicas que a menudo son comunes a una clase de microbios, por parte de los receptores de reconocimiento de patrones localizados en la membrana plasmática (PRR)9. Un epítopo de 22 aminoácidos de la flagelina bacteriana conocido como flg22 es un MAMP típico que induce el cierre de los estomas a través de su reconocimiento por el PRR FLS210. Como contramedida, los patógenos bacterianos como Pseudomonas syringae pv. tomate DC3000 (Pto) y Xanthomonas campestris pv. Las vesicatorias han desarrollado mecanismos de virulencia para reabrir los estomas 9,11,12. Estas respuestas estomáticas a patógenos bacterianos se han analizado convencionalmente en ensayos en los que las cáscaras epidérmicas de las hojas, los discos de las hojas o las hojas desprendidas flotan en suspensión bacteriana, y luego los estamatas se observan bajo un microscopio seguido de una medición manual de la apertura de los estomas. Sin embargo, estos ensayos son engorrosos y pueden no reflejar las respuestas estomáticas a la invasión bacteriana natural que se produce en una hoja adherida a la planta.
Aquí, se presenta un método simple para investigar el cierre y la reapertura de los estomas durante la invasión de la toma de fuerza bajo la condición que imita de cerca la interacción natural planta-bacteria. Este método aprovecha el dispositivo de imagen portátil para la observación directa de los estomas de A. thaliana en una hoja adherida a la planta inoculada con Pto, junto con la tubería de análisis de imágenes para la medición automatizada de la apertura de los estomas.
Protocolo
1. Cultivo de plantas
- Para romper la latencia, resuspender las semillas de A. thaliana (Col-0) en agua desionizada e incubarlas a 4 °C durante 4 días en la oscuridad.
- Siembre las semillas en el suelo y crezca en una cámara equipada con luz fluorescente blanca. Mantener las siguientes condiciones de crecimiento: temperatura de 22 °C, intensidad lumínica de 6.000 lux (aprox. 100 μmol/m2/s) durante 10 h y humedad relativa del 60%.
- Cuando sea necesario, riegue las plantas con un fertilizante líquido. Abstenerse de regar de 1 semana a 2 días antes de la inoculación y regar bien 1 día antes de la inoculación.
2. Preparación del inóculo bacteriano
- Estrías de Pto a partir de caldo de glicerol en medio solidificado King's B (KB) (20 g de triptona, 1,5 g de K2HPO4 y 15 g de glicerol para 1 L, agar al 1,5%) con 50 μg/ml de rifampicina e incubar a 28 °C durante 2 días.
- Inocular una sola colonia a 5 mL de medio líquido KB con 50 μg/mL de rifampicina e incubar a 28 °C con agitación a 200 rpm hasta la fase de crecimiento logarítmico tardío.
- Centrifugar el cultivo a 6.000 x g durante 2 min, desechar el sobrenadante y resuspender el pellet en 1 mL de agua estéril. Repita este paso una vez más.
- Retire el sobrenadante, vuelva a suspender el gránulo en 1 ml de tampón de apertura de los estomas (25 mM MES-KOH pH 6,15, 10 mM KCl) y mida el OD600.
- Diluir la suspensión a DO600 0,2 con tampón de apertura de los estomas, que contiene un 0,04 % de tensioactivo de silicona.
3. Inoculación por pulverización de bacterias
- Desde 1 día antes de la inoculación hasta el final del experimento, exponga las plantas a una intensidad de luz de unos 10.000 lux (aprox. 170 μmol/m2/s).
- Para asegurarse de que la mayoría de los estomas estén abiertos, mantenga las plantas en una bandeja cubierta con una tapa transparente bajo la luz durante al menos 3 horas antes de la inoculación por pulverización.
- Retire la tapa y use un aerógrafo para rociar el lado abaxial de las hojas con 2,5 ml de suspensión bacteriana por cada tres plantas en una sola maceta.
- Incubar las plantas inoculadas en una bandeja cubierta con una tapa transparente para mantener una humedad relativa de alrededor del 85%.
- Adquirir imágenes de los estomas a la 1 h y 3 h después de la inoculación por pulverización utilizando el método descrito en la sección 4.
4. Observación directa de los estomas mediante el dispositivo portátil de imagen
NOTA: El dispositivo portátil de imágenes estomáticas está equipado con una luz LED y un módulo de cámara y puede adquirir imágenes de 2.592 × 1.944 (altura × anchura; píxeles) con una resolución de aproximadamente 0,5 μm/píxel.
- Conecte el dispositivo portátil de imágenes estomáticas a una computadora personal (PC) equipada con software de adquisición de imágenes.
- Retire suave pero completamente las gotas de agua de las hojas inoculadas con un trozo de papel.
- Abra la cubierta superior del dispositivo, coloque la hoja en la platina y cierre la cubierta superior (Figura 1).
- Ajuste el enfoque de la imagen manipulando el tornillo de ajuste y, a continuación, haga clic en el botón Guardar imagen en la pantalla del PC. La imagen se adquirirá al instante. Por lo general, una imagen enfocada contiene aproximadamente 10 estomas analizables. Para obtener resultados robustos, adquiera imágenes estomáticas de seis hojas de tres plantas diferentes (dos hojas por planta).
5. Medición manual de la apertura estomática
NOTA: El software ImageJ se puede descargar en https://imagej.nih.gov/ij/download.html
- Abra un archivo de imagen en ImageJ.
- Abra el administrador de ROI seleccionando Analizar herramientas de > > Administrador de ROI.
- Utilice la herramienta de selección Línea recta para dibujar una línea correspondiente a la anchura de un estoma (Figura 2) y registre el ROI haciendo clic en Agregar en el Administrador de ROI.
- Dibuje una línea correspondiente a la longitud del mismo estoma (Figura 2A) y registre el ROI como se describe en el paso 5.3.
- Haga clic en Medir en el Administrador de ROI para medir el ancho y el largo.
- Divida el ancho por el largo para obtener la apertura estomática (proporción). Para una cuantificación robusta, use 60 o más estomas para cada tratamiento y punto de tiempo. No elija estomas prematuros u oscuros para el análisis (Figura 2B, C).
6. Medición automatizada de la apertura estomática
NOTA: La canalización de análisis de imágenes se ejecuta en Google Colaboratory, un entorno ejecutable de lenguaje de programación Python en la nube. Los usuarios deben tener una cuenta de Google válida con un Google Drive, un navegador Google Chrome que funcione y una conexión a Internet estable como requisito previo.
- Descargue el cuaderno de Google Colaboratory de Zenodo (https://doi-org.remotexs.ntu.edu.sg/10.5281/zenodo.8062528) y ábralo.
- Para realizar una copia local del bloc de notas en Google Drive, selecciona Archivo > Guardar una copia en Drive. Después de que aparezca una nueva pestaña, cierre de forma segura la pestaña del bloc de notas original.
- Presione el botón Ejecutar una vez debajo de la sección Configuración del entorno en el cuaderno sin desplegar los bloques de celdas para importar las bibliotecas requeridas.
- Ejecute la sección Configuración del directorio para crear tres carpetas utilizadas para el análisis (por ejemplo, example_result, inference_results y modelo) en Google Drive.
NOTA: En este caso, las carpetas denominadas example_result, inference_results y model se utilizan como directorio principal, almacenando los resultados de la inferencia y los modelos entrenados, respectivamente. En este cuaderno se muestra un ejemplo de construcción de directorios como procedimiento representativo. Para cambiar el nombre, vuelva a escribir la ruta pardir, infdir o modeldir . - De acuerdo con la sección Preparación de las imágenes , mueva las imágenes adquiridas a example_result, agrupadas en títulos de imágenes por tratamiento o muestra (por ejemplo, mock_1h_XXXXXX.jpg) para la generación final de gráficos. Las imágenes de muestra están disponibles en Zenodo (https://doi-org.remotexs.ntu.edu.sg/10.5281/zenodo.8062528).
- Realice la parte Descargar modelos entrenados para descargar los archivos ONNX de los modelos entrenados de Zenodo (https://doi-org.remotexs.ntu.edu.sg/10.5281/zenodo.8062528) y colóquelos en el directorio del modelo .
- Ejecute la parte Inferencia y medición de la apertura estomática para cuantificar la apertura estomática a partir de imágenes individuales. Las imágenes resultantes con inferencia superpuesta y el archivo csv denominado example_result.csv se exportarán al directorio inference_results.
- Ejecute la sección Generación de grafos para crear un gráfico sobre la relación de apertura estomática, exportado al directorio inference_results .
Resultados
Después de la inoculación por aspersión de Pto, los estomas en las hojas adheridas a las plantas inoculadas fueron observados directamente por el dispositivo portátil de imágenes estomáticas. Utilizando mediciones manuales y automatizadas, se utilizaron las mismas imágenes de las hojas para calcular la apertura de los estomas tomando proporciones de ancho a largo de aproximadamente 60 estomas. Las mediciones manuales y automatizadas indicaron consistentemente una disminución en la apertura estomática en las plantas inoculadas con Pto en comparación con las plantas inoculadas simuladamente 1 hora después de la inoculación (hpi) (Figura 3A, B), lo que indica que las plantas de A thaliana cierran los estomas en respuesta a la invasión de Pto . A 3 hpi, la apertura estomática en las plantas inoculadas con Pto y en las plantas simuladas inoculadas fue prácticamente la misma (Figura 3C, D), lo que recuerda a la reapertura de los estomas por Pto. Sorprendentemente, la medición automatizada de la apertura estomática tardó solo aproximadamente 5 segundos en procesar una imagen (Tabla 1), lo que redujo el tiempo de medición en más del 95% en comparación con la medición manual. Por lo tanto, este protocolo ofrece un medio operacionalmente simple y que ahorra mano de obra para rastrear las respuestas dinámicas de los estomas de A. thaliana al patógeno bacteriano.

Figura 1: Dispositivo portátil de imágenes. Imágenes que muestran el dispositivo de imagen portátil con una hoja colocada en el escenario (izquierda) y con la cubierta superior cerrada (derecha). Haga clic aquí para ver una versión más grande de esta figura.
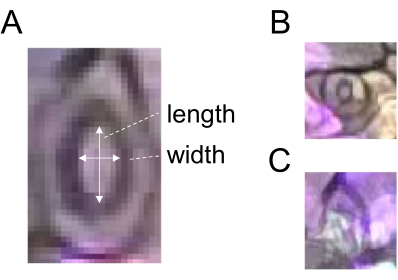
Figura 2: Diagrama esquemático de la medición de la apertura estomática. (A) La apertura estomática se determina calculando la relación entre la anchura y la longitud de un estoma, como se indica con flechas blancas. (B) Los estomas prematuros y (C) oscuros deben excluirse de la medición. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Respuestas estomáticas al Pto en una planta entera intacta. Las plantas de A. thaliana fueron inoculadas por aspersión con Pto o Pto, y los estomas en las hojas adheridas a las plantas inoculadas se observaron directamente a (A,B) 1 hpi y (C,D) 3 hpi por el dispositivo portátil de imágenes estomáticas. La apertura estomática (relación) se calculó mediante mediciones manuales (A,C) y (B,D) automatizadas. Los valores de p se calcularon mediante una prueba t de dos colas. Haga clic aquí para ver una versión más grande de esta figura.
| Tiempo(s) de procesamiento | ||
| Método | Significar | SD |
| Manual | 130.1 | 48.8 |
| Automatizado | 4.7 | 0.8 |
Tabla 1: Tiempo de procesamiento para mediciones manuales y automatizadas de la apertura estomática por imagen. Se calcularon medias y desviaciones estándar (DE) del tiempo de procesamiento a partir de las mediciones de nueve imágenes representativas.
Discusión
Estudios previos utilizaron cáscaras epidérmicas, discos foliares u hojas desprendidas para investigar las respuestas estomáticas a las invasiones bacterianas 9,11,12. Por el contrario, el método propuesto en este estudio aprovecha el dispositivo portátil de imágenes estomáticas para observar directamente los estomas en una hoja adherida a la planta después de la inoculación por aspersión de Pto, imitando las condiciones naturales de invasión bacteriana. Además, debido a que este método no implica procesos destructivos de preparación de muestras, como el desprendimiento de hojas, la escisión del disco de hojas y la descamación epidérmica, se pueden evitar las heridas y la pérdida de agua asociadas con estos procesos de preparación de muestras. Estos efectos no deben tomarse a la ligera, ya que las heridas y la pérdida de agua producen inevitablemente señales derivadas de las plantas, como las fitohormonas jasmonato y ácido abscísico, que afectan a los movimientos estomatológicos13,14.
Existen varias pautas para el uso óptimo del dispositivo portátil de imágenes estomáticas. En primer lugar, eliminar a fondo las gotas de agua de la superficie de las hojas es primordial para obtener imágenes de claridad y enfoque óptimos. En segundo lugar, se recomienda tomar varias imágenes de áreas foliares idénticas manipulando el tornillo de ajuste para ajustar el enfoque. Se espera que esta práctica aumente el número de estomas analizables por área foliar, mitigando así los posibles sesgos de muestreo. Por último, al pellizcar una hoja con el dispositivo, se requiere un manejo cuidadoso para evitar dañar la hoja. Esto es crítico porque la herida es una de las señales que provocan el cierre de los estomas14.
La apertura estomática tendió a ser más variable en la medición automatizada que en la manual (Figura 3). Hay varias razones posibles para esto. Anteriormente se informó que los poros estomáticas inferidos por la tubería de análisis de imágenes a menudo incluyen paredes celulares y/o sombras de células protectoras que rodean el poro estomatológico7, lo que no es el caso de la medición manual por ojos humanos. Los estomas con formas inusuales también pueden afectar la variación entre las mediciones manuales y automatizadas, aunque el modelo de detección de estomas fue entrenado para excluir dichos estomas del análisis7. A unos pocos estomas se les dio un valor de cero para la apertura estomática en la medición automatizada, pero ninguno en la medición manual por razones desconocidas. Es posible que sea necesario actualizar los modelos en el futuro para abordar estos problemas. Sin embargo, dado que la medición automatizada de la apertura estomática coincidió esencialmente con la medición manual, la versión actual de la canalización de análisis de imágenes es de uso práctico.
La observación directa y la medición automatizada de la apertura estomática en A. thaliana descritas en este estudio son prometedoras para diversas aplicaciones para dilucidar el papel de los estomas en la adaptación ambiental de las plantas. Por ejemplo, el método presentado debería ser ampliamente aplicable para cuantificar rápidamente la apertura estomática en un sistema intacto de toda la planta después de la exposición a estreses bióticos como MAMP y patógenos microbianos, así como a estreses abióticos como la sequía. En apoyo de esto, un estudio anterior aplicó con éxito la línea de análisis de imágenes para cuantificar con precisión la apertura estomática de los "discos foliares" tratados con la toxina fúngica fusicoccina que induce la apertura de los estomas o la hormona del estrés ácido abscísico que induce el cierre de los estomas7. Además, en principio, el dispositivo de imagen portátil permite el análisis a largo plazo de la evolución temporal de la abertura estomática en una sola hoja idéntica adherida a la planta. Esto podría arrojar luz sobre nuevos aspectos de las interacciones planta-microbio, ya que la mayoría de los estudios se han centrado en las respuestas estomáticas a patógenos bacterianos durante las primeras horas de la interacción 9,10,11. También será interesante emplear y modificar el método presentado para explorar las respuestas estomáticas a la invasión bacteriana bajo diversas condiciones ambientales. Esto es particularmente relevante para comprender los impactos de los factores ambientales como la temperatura, la humedad y la disponibilidad de agua en el suelo que afectan los movimientos de los estomas y el desarrollo de enfermedades por patógenos bacterianos 8,15. En conclusión, se prevé que el método presentado acelere la investigación sobre las funciones estomáticas dentro y fuera de las interacciones planta-microbio en entornos experimentales hasta ahora inalcanzables.
Divulgaciones
Los autores no tienen conflictos de intereses que declarar.
Agradecimientos
Agradecemos a todos los miembros del proyecto de investigación, 'Co-creación de rasgos adaptativos de plantas a través del ensamblaje de holobiontes planta-microbio', por las fructíferas discusiones. Este trabajo fue apoyado por Grant-in-Aid for Transformative Research Areas (21H05151 y 21H05149 a A.M. y 21H05152 a Y.T.) y Grant-in-Aid for Challenging Exploratory Research (22K19178 a A. M.).
Materiales
| Name | Company | Catalog Number | Comments |
| Agar | Nakarai tesque | 01028-85 | |
| Airbrush kits | ANEST IWATA | MX2900 | Accessory kits for SPRINT JET |
| Biotron | Nippon Medical & Chemical Instruments | LPH-411S | Plant Growth Chamber with white fluorescent light |
| Glycerol | Wako | 072-00626 | |
| Half tray | Sakata | 72000113 | A set of tray and lid |
| Hyponex | Hyponex | No catalogue number available | Dilute the solution of Hyponex at a ratio of 1:2000 in deionized water for watering plants |
| Image J | Natinal Institute of Health | Download at https://imagej.nih.gov/ij/download.html | Used for manual measurement of stomatal aperture |
| K2HPO4 | Wako | 164-04295 | |
| KCl | Wako | 163-03545 | |
| KOH | Wako | 168-21815 | For MES-KOH |
| MES | Wako | 343-01621 | For MES-KOH |
| Portable stomatal imaging device | Phytometrics | Order at https://www.phytometrics.jp/ | Takagi et al.(2023) doi: 10.1093/pcp/pcad018. |
| Rifampicin | Wako | 185-01003 | Dissolve in DMSO |
| Silwet-L77 | Bio medical science | BMS-SL7755 | silicone surfactant used in spray inoculation |
| SPRINT JET | ANEST IWATA | IS-800 | Airbrush used for spray inoculation |
| SuperMix A | Sakata seed | 72000083 | Mix with Vermiculite G20 in equal proportions for preparing soil |
| Tryptone | Nakarai tesque | 35640-95 | |
| Vermiculite G20 | Nittai | No catalogue number available | Mix with Super Mix A in equal proportions for preparing soil |
| White fluorescent light | NEC | FHF32EX-N-HX-S | Used for Biotron |
Referencias
- Shimono, M., Higaki, T., Kaku, H., Shibuya, N., Hasezawa, S., Day, B. Quantitative evaluation of stomatal cytoskeletal patterns during the activation of immune signaling in Arabidopsis thaliana. PLoS One. 11, e0159291 (2016).
- Bourdais, G., et al. The use of quantitative imaging to investigate regulators of membrane trafficking in Arabidopsis stomatal closure. Traffic. 20 (2), 168-180 (2019).
- Higaki, T., Kutsuna, N., Hasezawa, S. CARTA-based semi-automatic detection of stomatal regions on an Arabidopsis cotyledon surface. Plant Morphology. 26 (1), 9-12 (2014).
- Eisele, J. F., Fäßler, F., Bürgel, F., Chaban, C. A. A rapid and simple method for microscopy-based stomata analyses. PLoS One. 11, e0164576 (2016).
- Chitraker, R., Melotto, M. Assessing stomatal response to live bacterial cells using whole leaf imaging. Journal of Visualized Experiments. 44, 2185 (2010).
- Sai, N., et al. StomaAI: an efficient and user-friendly tool for measurement of stomatal pores and density using deep computer vision. New Phytologist. 238 (2), 904-915 (2023).
- Takagi, M., et al. Image-based quantification of Arabidopsis thaliana stomatal aperture from leaf images. Plant and Cell Physiology. pcad018, (2023).
- Melotto, M., Zhang, L., Oblessuc, P. R., He, S. Y. Stomatal defense a decade later. Plant Physiology. 174 (2), 561-571 (2017).
- Melotto, M., Underwood, W., Koczan, J., Nomura, K., He, S. Y. Plant stomata function in innate immunity against bacterial invasion. Cell. 126 (5), 969-980 (2006).
- Zeng, W., He, S. A prominent role of the flagellin receptor FLAGELLIN-SENSING2 in mediating stomatal response to Pseudomonas syringae pv tomato DC3000 in Arabidopsis. Plant Physiology. 153 (3), 1188-1198 (2010).
- Zheng, X. Y., et al. Coronatine promotes Pseudomonas syringae virulence in plants by activating a signaling cascade that inhibits salicylic acid accumulation. Cell Host and Microbe. 11 (6), 587-596 (2012).
- Raffeiner, M., et al. The Xanthomonas type-III effector XopS stabilizes CaWRKY40a to regulate defense responses and stomatal immunity in pepper (Capsicum annuum). The Plant Cell. 34 (5), 1684-1708 (2022).
- Munemasa, S., Hauser, F., Park, J., Waadt, R., Brandt, B., Schroeder, J. I. Mechanisms of abscisic acid-mediated control of stomatal aperture. Current Opinion in Plant Biology. 28, 154-162 (2015).
- Förster, S., et al. Wounding-induced stomatal closure requires jasmonate-mediated activation of GORK K+ channels by a Ca2+ sensor-kinase CBL1-CIPK5 complex. Developmental Cell. 48 (1), 87-99 (2018).
- Cheng, Y. T., Zhang, L., He, S. Y. Plant-microbe interactions facing environmental challenge. Cell Host and Microbe. 26 (2), 183-192 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados