Method Article
直接观察和自动测量对丁香假单胞菌 pv 的气孔反应。番茄拟南芥中的DC3000
摘要
在这里,我们提出了一种简单的方法,用于直接观察和自动测量 拟南芥对细菌入侵的气孔反应。该方法利用便携式气孔成像设备,以及专为设备捕获的叶片图像而设计的图像分析管道。
摘要
气孔是在植物叶片表皮中发现的微小孔隙。气孔的调节不仅对于平衡光合作用和蒸腾水分损失的二氧化碳吸收至关重要,而且对于限制细菌入侵也至关重要。当植物在识别微生物时关闭气孔,致病细菌,如 丁香假单胞菌 pv。 番茄 DC3000 (Pto),重新打开闭合的气孔以进入叶片内部。在评估气孔对细菌入侵反应的常规测定中,将叶表皮皮、叶盘或分离的叶漂浮在细菌悬浮液上,然后在显微镜下观察气孔,然后手动测量气孔孔径。然而,这些测定很麻烦,可能无法反映附着在植物上的叶子对自然细菌入侵的气孔反应。最近,开发了一种便携式成像设备,可以通过捏住叶子而不将其从植物上分离来观察气孔,以及基于深度学习的图像分析管道,旨在从设备捕获的叶子图像中自动测量气孔孔径。在这里,在这些技术进步的基础上,介绍了一种评估 拟南芥 细菌入侵的气孔反应的新方法。该方法包括三个简单的步骤:模拟自然感染过程的 Pto 喷雾接种,使用便携式成像设备直接观察 Pto接种植物叶子上的气孔,以及通过图像分析管道自动测量气孔径。该方法成功地用于在 Pto 侵袭期间在密切模拟天然植物-细菌相互作用的条件下气孔关闭和重新开放。
引言
气孔是植物叶子和其他地上部分表面被一对保卫细胞包围的微观孔隙。在不断变化的环境中,气孔的调节是植物控制光合作用所需的二氧化碳吸收的核心,而代价是通过蒸腾作用流失水分。因此,气孔孔径的量化有助于了解植物的环境适应性。然而,量化气孔本质上是耗时和繁琐的,因为它需要人工来发现和测量显微镜捕获的叶片图像中的气孔。为了规避这些限制,已经开发了各种方法来促进拟南芥气孔的量化,拟南芥是一种广泛用于研究气孔生物学的模式植物1,2,3,4,5,6。例如,孔径计可用于测量蒸腾速率,作为气孔导度的指标。然而,该方法不能提供关于确定气孔导率的气孔数和孔径的直接信息。一些研究使用共聚焦显微镜技术,使用荧光肌动蛋白标记物、荧光染料或细胞壁自发荧光1、2、3、4、5 突出气孔。虽然这些方法有助于气孔的检测,但操作共聚焦显微镜设施和制备显微镜样品的成本可能会成为常规应用的障碍。在Sai等人的一项开创性工作中,开发了一种深度神经网络模型,用于从拟南芥表皮剥离的明场显微图像中自动测量气孔孔径6。然而,这项创新并没有免除研究人员为显微镜观察准备表皮剥离的任务。最近,通过开发一种便携式成像设备克服了这一障碍,该设备可以通过捏住拟南芥的叶子来观察气孔,以及基于深度学习的图像分析管道,该管道可以从设备捕获的叶子图像中自动测量气孔孔径7。
气孔有助于植物对细菌病原体的先天免疫力。这种免疫反应的关键是气孔闭合,它限制细菌通过微观孔进入叶片内部,细菌病原体在那里增殖并引起疾病8.通过质膜定位模式识别受体 (PRR) 识别微生物相关分子模式 (MAMP) 时,诱导气孔闭合,MAMP 是一类微生物通常共有的免疫原性分子9。细菌鞭毛蛋白的 22 个氨基酸表位称为 flg22,是一种典型的 MAMP,它通过被 PRR FLS210 识别来诱导气孔闭合。作为对策,细菌病原体如丁香假单胞菌pv。番茄DC3000 (Pto) 和 Xanthomonas campestris pv.囊泡已经进化出毒力机制来重新打开气孔 9,11,12。这些对细菌病原体的气孔反应已在测定中进行了常规分析,其中叶表皮皮、叶盘或分离的叶子漂浮在细菌悬浮液上,然后在显微镜下观察气孔,然后手动测量气孔孔径。然而,这些测定很麻烦,可能无法反映附着在植物上的叶子中发生的对自然细菌入侵的气孔反应。
在这里,提出了一种简单的方法,用于在密切模拟自然植物-细菌相互作用的条件下研究 Pto 入侵期间的气孔关闭和重新开放。该方法利用便携式成像设备直接观察附着在接种Pto的植物上的叶片上的拟南芥气孔,以及用于自动测量气孔孔径的图像分析管道。
研究方案
1. 种植植物
- 为了打破休眠,将 拟南芥 (Col-0)种子重悬于去离子水中,并在4°C下在黑暗中孵育4天。
- 将种子播种在土壤上,并在装有白色荧光灯的房间中生长。保持以下生长条件:温度为22°C,光强度为6,000勒克斯(约100μmol /m 2 / s)10小时,相对湿度为60%。
- 需要时,用液体肥料给植物浇水。接种前 1 周至 2 天不要浇水,接种前 1 天浇水。
2.制备细菌接种物
- 在凝固的King's B(KB)培养基(20g胰蛋白胨,1.5gK2HPO4和15g甘油的1L,1.5%琼脂)上从甘油储备中提取条纹Pto与50μg/ mL利福平,并在28°C下孵育2天。
- 将单个菌落接种至含有50μg/ mL利福平的5mLKB液体培养基中,并在28°C下以200rpm振荡孵育至对数生长后期。
- 以 6,000 x g 离心培养物 2 分钟,弃去上清液,并将沉淀重悬于 1 mL 无菌水中。再次重复此步骤。
- 除去上清液,将沉淀重悬于1mL气孔开口缓冲液(25mM MES-KOH pH 6.15,10mM KCl)中,并测量OD600。
- 用含有0.04%有机硅表面活性剂的气孔开口缓冲液将悬浮液稀释至OD600 0.2。
3.喷雾接种细菌
- 从接种前1天到实验结束,将植物暴露在约10,000勒克斯(约170μmol/m2/s)的光照强度下。
- 为确保大多数气孔是开放的,在喷雾接种之前,将植物放在覆盖有透明盖子的托盘上至少3小时。
- 取下盖子,用喷枪在单个花盆上每三株植物喷洒 2.5 mL 细菌悬浮液的叶子背面。
- 将接种的植物在覆盖有透明盖子的托盘上孵育,以保持约85%的相对湿度。
- 使用第 4 节中描述的方法在喷雾接种后 1 小时和 3 小时获取气孔图像。
4.使用便携式成像设备直接观察气孔
注意:便携式气孔成像设备配备 LED 灯和摄像头模块,可以采集 2,592 × 1,944(高×宽;像素)图像,分辨率约为 0.5 μm/像素。
- 将便携式气孔成像设备连接到配备图像采集软件的个人计算机 (PC)。
- 用一张纸轻轻但完全去除接种叶子上的水滴。
- 打开设备的顶盖,将叶子放在载物台上,然后关闭顶盖(图 1)。
- 通过操作调节螺钉调整图像的焦距,然后单击 保存 图像 PC屏幕上的按钮。图像将立即被获取。通常,聚焦图像包含大约 10 个可分析的气孔。为了获得可靠的结果,从三种不同植物的六片叶子(每株植物两片叶子)获取气孔图像。
5.气孔孔径的手动测量
注意:ImageJ 软件可在 https://imagej.nih.gov/ij/download.html 下载
- 在 ImageJ 中打开图像文件。
- 通过选择 “分析>工具”>“ROI 管理器”打开 ROI 管理器。
- 使用直线选择工具绘制一条与造口宽度相对应的线(图 2),并通过单击 ROI 管理器中的添加来注册 ROI。
- 画一条对应于相同造口长度的线(图2A)并按照步骤5.3中的描述记录ROI。
- 单击 ROI 管理器中的测量以测量宽度和长度。
- 将宽度除以长度,得到气孔孔径(比率)。为了进行稳健的定量,每个治疗和时间点使用 60 个或更多气孔。不要选择过早或模糊的气孔进行分析(图2B,C)。
6. 气孔孔径自动测量
注意:图像分析管道在 Google Colaboratory 中运行,这是一个云 Python 编程语言可执行环境。用户必须拥有有效的 Google 帐户,并且必须拥有有效的 Google Drive、Google Chrome 浏览器和稳定的互联网连接作为先决条件。
- 从 Zenodo (https://doi-org.remotexs.ntu.edu.sg/10.5281/zenodo.8062528) 下载 Google Colaboratory 笔记本,然后打开笔记本。
- 通过选择 “文件”>“在云端硬盘中保存副本”,将笔记本本地复制到 Google 云端硬盘。出现新选项卡后,安全地关闭原始笔记本的选项卡。
- 按一下笔记本中“环境设置”部分下方的“执行”按钮,而无需展开单元块以导入所需的库。
- 执行 “目录设置 ”部分,在 Google 云端硬盘中创建三个用于分析的文件夹(例如 example_result、inference_results 和 model)。
注意:在本例中,名为 example_result、inference_results 和 model 的文件夹用作父目录,分别存储推理结果和训练模型。此笔记本显示了作为代表过程的目录构造示例。若要更改名称,请重写 pardir、 infdir 或 modeldir 路径。 - 根据 “图像的准备 ”部分,将采集的图像移动到 example_result,按处理或样本(例如,mock_1h_XXXXXX.jpg)分组在图像标题中,以生成最终的图形。示例图像可从 Zenodo (https://doi-org.remotexs.ntu.edu.sg/10.5281/zenodo.8062528) 获得。
- 执行下载 训练模型 部分,从 Zenodo (https://doi-org.remotexs.ntu.edu.sg/10.5281/zenodo.8062528) 下载训练模型的 ONNX 文件,并将其放在模型 目录下。
- 运行气 孔孔径的推断和测量 部分,从单个图像量化气孔径。具有叠加推理的结果图像和名为 example_result.csv 的 csv 文件将导出到 inference_results 目录。
- 执行 “图形生成 ”部分以创建有关气孔孔径比的图形,并导出到 inference_results 目录。
结果
喷洒接种Pto后,通过便携式气孔成像设备直接观察附着在接种植物上的叶子上的气孔。使用手动和自动测量,使用相同的叶片图像通过获取大约 60 个气孔的宽度与长度之比来计算气孔孔径。手动和自动测量一致表明,在接种后 1 小时 (hpi) 时,与模拟接种的植物相比,Pto 接种植物的气孔孔径减小(图 3A,B),表明拟南芥植物在响应 Pto 入侵时关闭气孔。在3 hpi时,Pto接种的植物和模拟接种的植物的气孔孔径几乎相同(图3C,D),让人想起Pto重新开放的气孔。值得注意的是,气孔孔径的自动测量仅需约5秒即可处理一张图像(表1),与手动测量相比,测量时间缩短了95%以上。因此,该协议提供了一种操作简单且省力的方法来跟踪拟南芥对细菌病原体的动态气孔反应。

图 1:便携式成像设备。 描绘便携式成像设备的图片,舞台上有一片叶子(左),顶盖关闭(右)。 请点击这里查看此图的较大版本.
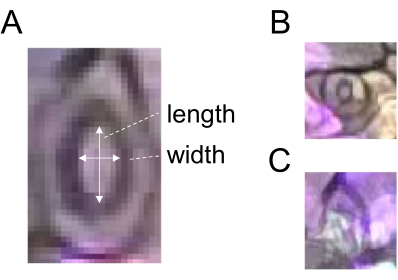
图2:气孔孔径测量示意图。 (A) 气孔孔径是通过计算造口的宽度与长度之比来确定的,如白色箭头所示。(B) 早产和 (C) 模糊的气孔应排除在测量之外。 请点击这里查看此图的较大版本.

图3:完整整株植物中气孔对Pto的反应。 用模拟或Pto喷洒接种拟南芥植株,通过便携式气孔成像装置在(A,B)1 hpi和(C,D)3 hpi直接观察附着在接种植株上的叶片上的气孔。气孔孔径(比率)通过(A,C)手动和(B,D)自动测量计算。P 值通过双尾 t 检验计算。请点击这里查看此图的较大版本.
| 处理时间 (s) | ||
| 方法 | 意味 着 | 标清 |
| 手动 | 130.1 | 48.8 |
| 自动化 | 4.7 | 0.8 |
表 1:手动和自动测量每张图像气孔径的处理时间。 处理时间的平均值和标准差 (SD) 是根据 9 张代表性图像的测量值计算得出的。
讨论
以前的研究使用表皮剥离、叶盘或分离的叶子来研究气孔对细菌入侵的反应 9,11,12。相比之下,本研究提出的方法利用便携式气孔成像设备直接观察喷洒接种Pto后附着在植物上的叶子上的气孔,模拟细菌入侵的自然条件。此外,由于该方法不涉及破坏性的样品制备过程,例如叶片脱落、叶盘切除和表皮剥离,因此可以避免与这些样品制备过程相关的伤口和水分损失。这些影响不应掉以轻心,因为受伤和水分流失不可避免地会产生植物衍生的信号,例如影响气孔运动的植物激素茉莉酸酯和脱落酸13,14。
对于便携式气孔成像设备的最佳使用,有几项指南。首先,彻底去除叶片表面的水滴对于获得最佳清晰度和焦点的图像至关重要。其次,建议通过操纵调节螺钉来微调焦距,从相同的叶片区域拍摄多张图像。预计这种做法将增加每个叶面积的可分析气孔数量,从而减轻潜在的采样偏差。最后,用设备捏叶子时,需要小心处理,以免损坏叶子。这很关键,因为受伤是引起气孔闭合的线索之一14.
与手动测量相比,自动测量中的气孔孔径往往变化更大(图3)。这有几个可能的原因。先前有报道称,通过图像分析管道推断的气孔通常包括气孔7周围的细胞壁和/或保卫细胞的阴影,这在人眼手动测量中并非如此。具有异常形状的气孔也可能影响手动和自动测量之间的变化,尽管气孔检测模型经过训练以从分析中排除此类气孔7。在自动测量中,一些气孔的气孔孔径值为零,但在手动测量中则没有,原因不明。为了解决这些问题,未来可能需要对模型进行更新。然而,由于自动气孔孔径测量与手动测量基本匹配,因此当前版本的图像分析管道具有实际用途。
本研究中描述的对拟南芥气孔径的直接观察和自动测量有望为阐明气孔在植物环境适应中的作用提供各种应用。例如,所提出的方法应广泛适用于在暴露于生物胁迫(如MAMPs和微生物病原体)以及非生物胁迫(如干旱)后快速量化完整整个植物系统中的气孔孔径。为了支持这一点,之前的一项研究成功地应用了图像分析管道来准确量化用诱导气孔张开的真菌毒素梭菌素或诱导气孔闭合的应激激素脱落酸处理的“叶盘”的气孔孔径7。此外,原则上,便携式成像设备允许对附着在植物上的单个相同叶子上的气孔进行长期时程分析。这可能会揭示植物-微生物相互作用的新方面,因为大多数研究都集中在相互作用的最初几个小时内对细菌病原体的气孔反应9,10,11。使用和修改所提出的方法来探索各种环境条件下对细菌入侵的气孔反应也将很有趣。这对于了解环境因素(如温度、湿度和土壤水分可用性)的影响特别相关,这些因素会影响细菌病原体的气孔运动和疾病发展 8,15。总之,所提出的方法将被设想为在迄今为止无法实现的实验环境中加速植物-微生物相互作用内外的气孔功能研究。
披露声明
作者没有利益冲突需要声明。
致谢
我们感谢研究项目“通过组装植物-微生物全息生物共同创造植物适应性状”的所有成员进行了富有成效的讨论。这项工作得到了变革性研究领域的补助金(21H05151 和 21H05149 到 A.M. 和 21H05152 到 Y.T.)和挑战性探索性研究的补助金(22K19178 到 A.M.)的支持。
材料
| Name | Company | Catalog Number | Comments |
| Agar | Nakarai tesque | 01028-85 | |
| Airbrush kits | ANEST IWATA | MX2900 | Accessory kits for SPRINT JET |
| Biotron | Nippon Medical & Chemical Instruments | LPH-411S | Plant Growth Chamber with white fluorescent light |
| Glycerol | Wako | 072-00626 | |
| Half tray | Sakata | 72000113 | A set of tray and lid |
| Hyponex | Hyponex | No catalogue number available | Dilute the solution of Hyponex at a ratio of 1:2000 in deionized water for watering plants |
| Image J | Natinal Institute of Health | Download at https://imagej.nih.gov/ij/download.html | Used for manual measurement of stomatal aperture |
| K2HPO4 | Wako | 164-04295 | |
| KCl | Wako | 163-03545 | |
| KOH | Wako | 168-21815 | For MES-KOH |
| MES | Wako | 343-01621 | For MES-KOH |
| Portable stomatal imaging device | Phytometrics | Order at https://www.phytometrics.jp/ | Takagi et al.(2023) doi: 10.1093/pcp/pcad018. |
| Rifampicin | Wako | 185-01003 | Dissolve in DMSO |
| Silwet-L77 | Bio medical science | BMS-SL7755 | silicone surfactant used in spray inoculation |
| SPRINT JET | ANEST IWATA | IS-800 | Airbrush used for spray inoculation |
| SuperMix A | Sakata seed | 72000083 | Mix with Vermiculite G20 in equal proportions for preparing soil |
| Tryptone | Nakarai tesque | 35640-95 | |
| Vermiculite G20 | Nittai | No catalogue number available | Mix with Super Mix A in equal proportions for preparing soil |
| White fluorescent light | NEC | FHF32EX-N-HX-S | Used for Biotron |
参考文献
- Shimono, M., Higaki, T., Kaku, H., Shibuya, N., Hasezawa, S., Day, B. Quantitative evaluation of stomatal cytoskeletal patterns during the activation of immune signaling in Arabidopsis thaliana. PLoS One. 11, e0159291 (2016).
- Bourdais, G., et al. The use of quantitative imaging to investigate regulators of membrane trafficking in Arabidopsis stomatal closure. Traffic. 20 (2), 168-180 (2019).
- Higaki, T., Kutsuna, N., Hasezawa, S. CARTA-based semi-automatic detection of stomatal regions on an Arabidopsis cotyledon surface. Plant Morphology. 26 (1), 9-12 (2014).
- Eisele, J. F., Fäßler, F., Bürgel, F., Chaban, C. A. A rapid and simple method for microscopy-based stomata analyses. PLoS One. 11, e0164576 (2016).
- Chitraker, R., Melotto, M. Assessing stomatal response to live bacterial cells using whole leaf imaging. Journal of Visualized Experiments. 44, 2185 (2010).
- Sai, N., et al. StomaAI: an efficient and user-friendly tool for measurement of stomatal pores and density using deep computer vision. New Phytologist. 238 (2), 904-915 (2023).
- Takagi, M., et al. Image-based quantification of Arabidopsis thaliana stomatal aperture from leaf images. Plant and Cell Physiology. pcad018, (2023).
- Melotto, M., Zhang, L., Oblessuc, P. R., He, S. Y. Stomatal defense a decade later. Plant Physiology. 174 (2), 561-571 (2017).
- Melotto, M., Underwood, W., Koczan, J., Nomura, K., He, S. Y. Plant stomata function in innate immunity against bacterial invasion. Cell. 126 (5), 969-980 (2006).
- Zeng, W., He, S. A prominent role of the flagellin receptor FLAGELLIN-SENSING2 in mediating stomatal response to Pseudomonas syringae pv tomato DC3000 in Arabidopsis. Plant Physiology. 153 (3), 1188-1198 (2010).
- Zheng, X. Y., et al. Coronatine promotes Pseudomonas syringae virulence in plants by activating a signaling cascade that inhibits salicylic acid accumulation. Cell Host and Microbe. 11 (6), 587-596 (2012).
- Raffeiner, M., et al. The Xanthomonas type-III effector XopS stabilizes CaWRKY40a to regulate defense responses and stomatal immunity in pepper (Capsicum annuum). The Plant Cell. 34 (5), 1684-1708 (2022).
- Munemasa, S., Hauser, F., Park, J., Waadt, R., Brandt, B., Schroeder, J. I. Mechanisms of abscisic acid-mediated control of stomatal aperture. Current Opinion in Plant Biology. 28, 154-162 (2015).
- Förster, S., et al. Wounding-induced stomatal closure requires jasmonate-mediated activation of GORK K+ channels by a Ca2+ sensor-kinase CBL1-CIPK5 complex. Developmental Cell. 48 (1), 87-99 (2018).
- Cheng, Y. T., Zhang, L., He, S. Y. Plant-microbe interactions facing environmental challenge. Cell Host and Microbe. 26 (2), 183-192 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
ISSN 2689-3649
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。
我们使用 cookie 来增强您在我们网站上的体验。
继续使用我们的网站或单击“继续”,即表示您同意接受我们的 cookie。